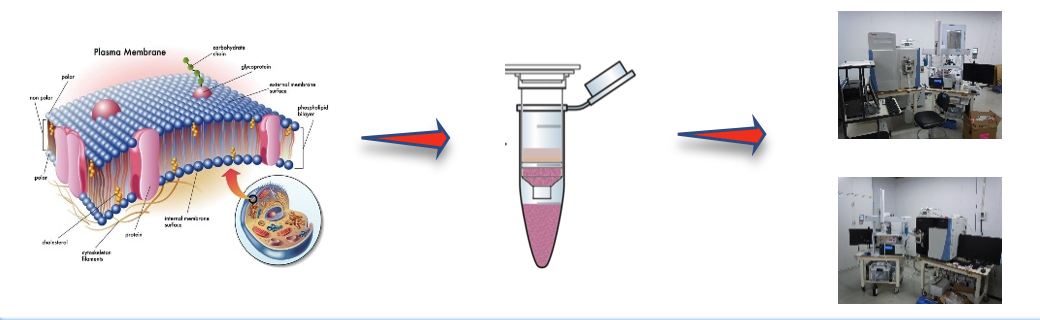
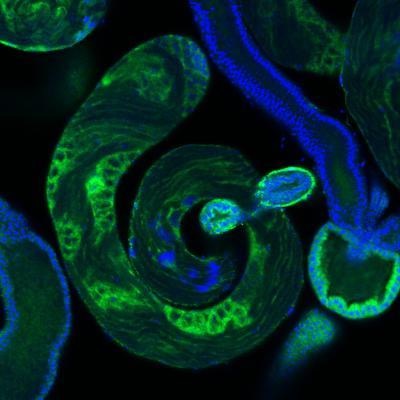
MIT で既存の分子とのクロストークを回避するタンパク質ペアを構築。 設計 されたシグナル伝達経路は、合成生物学回路を構築するための新しい戦略を 提供する
 生細胞内では多くの重要なメッセージがタンパク質間の相互作用を介して伝達されている。これらのシグナルを正確に中継するためには、各タンパク質が特定のパートナーとのみ相互作用し類似のタンパク質との望ましくないクロストークを回避する必要がある。
MIT の新研究では、これらタンパク質間のクロストークを細胞がどのように防いでいるかを明らかにし、また、細胞がシグナル伝達に使用していない膨大な数のタンパク質相互作用が残っていることを示した。 これは、合成生物学者が細胞の既存のシグナル伝達経路に干渉することなく、疾患の診断などのアプリケーション応用可能な新しいタンパク質の組み合わせを選び出せることを意味している。「ハイスループットアプローチを使用すると、特定の相互作用の多くの直交バージョンを生成でき、そのタンパク質複合体のさまざまな独立バージョンをいくつ構築できるかを確認できる」と、MIT の大学院生であり、 この論文の著者の Conor McClune 氏は述べた。2019 年 10 月 23 日に Nature でオンラインで公開されたこの論文は、シグナル伝達タンパク質の新しいペアを作成し、特定の植物ホルモンに遭遇すると黄色の蛍光を発する大腸菌細胞を操作することで、それらがどのように 新しいシグナルを新しい出力にリンクするために使用できるか実証した。 この論文は、「直交シグナル伝達経路を設計することで配列空間の疎な占有を明らかにする。(Engineering Orthogonal Signaling Pathways Reveals the Sparse Occupancy Of Sequence Space.)」と題されている。MIT の生物学教授である Michael Laub 博士(写真)はこの研究の上級著者だ。 その他著者として、Aurora Alvarez-Buylla 氏
生細胞内では多くの重要なメッセージがタンパク質間の相互作用を介して伝達されている。これらのシグナルを正確に中継するためには、各タンパク質が特定のパートナーとのみ相互作用し類似のタンパク質との望ましくないクロストークを回避する必要がある。
MIT の新研究では、これらタンパク質間のクロストークを細胞がどのように防いでいるかを明らかにし、また、細胞がシグナル伝達に使用していない膨大な数のタンパク質相互作用が残っていることを示した。 これは、合成生物学者が細胞の既存のシグナル伝達経路に干渉することなく、疾患の診断などのアプリケーション応用可能な新しいタンパク質の組み合わせを選び出せることを意味している。「ハイスループットアプローチを使用すると、特定の相互作用の多くの直交バージョンを生成でき、そのタンパク質複合体のさまざまな独立バージョンをいくつ構築できるかを確認できる」と、MIT の大学院生であり、 この論文の著者の Conor McClune 氏は述べた。2019 年 10 月 23 日に Nature でオンラインで公開されたこの論文は、シグナル伝達タンパク質の新しいペアを作成し、特定の植物ホルモンに遭遇すると黄色の蛍光を発する大腸菌細胞を操作することで、それらがどのように 新しいシグナルを新しい出力にリンクするために使用できるか実証した。 この論文は、「直交シグナル伝達経路を設計することで配列空間の疎な占有を明らかにする。(Engineering Orthogonal Signaling Pathways Reveals the Sparse Occupancy Of Sequence Space.)」と題されている。MIT の生物学教授である Michael Laub 博士(写真)はこの研究の上級著者だ。 その他著者として、Aurora Alvarez-Buylla 氏
血液因子(GDF11)が、食事療法によるカロリー制限の利点を模倣し、神経新生と血管リモデリングを刺激することを高齢のマウスモデルで解明。
 老化は人体のすべての機能、特に脳機能に影響を与えるプロセスだが、ライフスタイルの変化(運動、カロリー摂取の制限など)により老化を遅らせることができる。パスツール研究所とCNRS(フランス国立科学研究センター)の研究者は、血液中の分子 GDF11(図)のこれまで知られていなかった特性を解明した。 マウスモデルで GDF11 が、食事療法によるカロリー制限の利点(心血管疾患を減らし、癌を防ぎ、脳の神経発生を高める)を模倣できることを解明した。
この研究の結果は、2019年10月22日にAging Cell誌に掲載された。このオープンアクセスの論文は、「全身GDF11がアディポネクチンの分泌を刺激し高齢マウスのカロリー制限様表現型を誘導(Systemic GDF11 Stimulates the Secretion of Adiponectin and Induces a Calorie Restriction-Like Phenotype in Aged Mice.)」と題されている。今日、長期に健康な脳を維持することは可能だ。 過去30年間、断続的な絶食などの特定の食事制限がいくつかの種の認知能力を改善し、平均寿命を延ばすことができると一般に認められてきた。 また、カロリー制限(栄養の質を維持しながら20%から30%のカロリー摂取量を減らすこと)が心血管疾患や癌のリスクを減らし、脳内の新しいニューロンの生産を増加させることも証明されている。マウスモデルを使用した以前の研究では、研究者は、老齢マウスに若いマウスの血液を注入すると、脳の血管が若返り、その結果、脳の血流が改善し、神経新生と認知が増加することを観察した。知覚記憶ユニット(パスツール研究所/ CNRS)の研究者は、カロリー制限と若い血液の補充が臓器の若返りに効果的であることから、特定のメカニズムが共通している可能性が
老化は人体のすべての機能、特に脳機能に影響を与えるプロセスだが、ライフスタイルの変化(運動、カロリー摂取の制限など)により老化を遅らせることができる。パスツール研究所とCNRS(フランス国立科学研究センター)の研究者は、血液中の分子 GDF11(図)のこれまで知られていなかった特性を解明した。 マウスモデルで GDF11 が、食事療法によるカロリー制限の利点(心血管疾患を減らし、癌を防ぎ、脳の神経発生を高める)を模倣できることを解明した。
この研究の結果は、2019年10月22日にAging Cell誌に掲載された。このオープンアクセスの論文は、「全身GDF11がアディポネクチンの分泌を刺激し高齢マウスのカロリー制限様表現型を誘導(Systemic GDF11 Stimulates the Secretion of Adiponectin and Induces a Calorie Restriction-Like Phenotype in Aged Mice.)」と題されている。今日、長期に健康な脳を維持することは可能だ。 過去30年間、断続的な絶食などの特定の食事制限がいくつかの種の認知能力を改善し、平均寿命を延ばすことができると一般に認められてきた。 また、カロリー制限(栄養の質を維持しながら20%から30%のカロリー摂取量を減らすこと)が心血管疾患や癌のリスクを減らし、脳内の新しいニューロンの生産を増加させることも証明されている。マウスモデルを使用した以前の研究では、研究者は、老齢マウスに若いマウスの血液を注入すると、脳の血管が若返り、その結果、脳の血流が改善し、神経新生と認知が増加することを観察した。知覚記憶ユニット(パスツール研究所/ CNRS)の研究者は、カロリー制限と若い血液の補充が臓器の若返りに効果的であることから、特定のメカニズムが共通している可能性が
癌の早期発見を目指す英米の5つの機関による大西洋横断コラボレーション(ACED)が78億円を調達
 癌を早期に発見するための根本的な新しい戦略と技術の開発は、大西洋横断研究アライアンスの大胆な野望であり、癌の早期発見のための国際同盟(Alliance for Cancer Early Detection:ACED)は、Cancer Research UKとのパートナーにより2019年10月21日に発足が発表された。今後5年間で78億円以上の資金が提供される。早期発見は、より多くの人が癌に打ち勝つために不可欠だ。癌が早期に発見され治療されると、患者が病気を生き残るチャンスが劇的に向上する。 早期癌と前癌状態の生物学を理解することで、医師は病気を早期に発見し、必要に応じて効果的に治療する正確な方法を見つけることができる。
そもそも癌の発生を止めることができる「正確な予防」さえ可能になるかもしない。 英国の統計は、達成可能な生存率の大きな改善を強調している。 6種類の異なる癌の5年生存率は、腫瘍が小さくなり限局性を維持するステージ1で診断された場合、癌が大きくなり周囲の組織や他の臓器に侵入し始めるステージ4で診断された場合の生存率と比較して3倍以上高くなる。早期発見技術の進歩は、後期段階の診断を減らし、早期の治療可能な段階で診断される人々の割合を増やすのに役立ち、より多くの患者の将来を確保できる。Cancer Research UKは、英国と米国の科学者チームとの共同研究により、この未開拓の研究分野を開始するための大胆な野望を設定している。 癌の早期発見のための国際同盟 (ACED) は、Cancer Research UK、スタンフォード大学カナリアセンター、 ケンブリッジ大学、オレゴンヘルスアンドサイエンス(OHSU)ナイトキャンサー研究所、ユニバーシティカレッジロンドン(UCL)、マンチェスター大学で構成されている。
腸癌、乳癌、子宮頸癌などの既存のスクリーニン
癌を早期に発見するための根本的な新しい戦略と技術の開発は、大西洋横断研究アライアンスの大胆な野望であり、癌の早期発見のための国際同盟(Alliance for Cancer Early Detection:ACED)は、Cancer Research UKとのパートナーにより2019年10月21日に発足が発表された。今後5年間で78億円以上の資金が提供される。早期発見は、より多くの人が癌に打ち勝つために不可欠だ。癌が早期に発見され治療されると、患者が病気を生き残るチャンスが劇的に向上する。 早期癌と前癌状態の生物学を理解することで、医師は病気を早期に発見し、必要に応じて効果的に治療する正確な方法を見つけることができる。
そもそも癌の発生を止めることができる「正確な予防」さえ可能になるかもしない。 英国の統計は、達成可能な生存率の大きな改善を強調している。 6種類の異なる癌の5年生存率は、腫瘍が小さくなり限局性を維持するステージ1で診断された場合、癌が大きくなり周囲の組織や他の臓器に侵入し始めるステージ4で診断された場合の生存率と比較して3倍以上高くなる。早期発見技術の進歩は、後期段階の診断を減らし、早期の治療可能な段階で診断される人々の割合を増やすのに役立ち、より多くの患者の将来を確保できる。Cancer Research UKは、英国と米国の科学者チームとの共同研究により、この未開拓の研究分野を開始するための大胆な野望を設定している。 癌の早期発見のための国際同盟 (ACED) は、Cancer Research UK、スタンフォード大学カナリアセンター、 ケンブリッジ大学、オレゴンヘルスアンドサイエンス(OHSU)ナイトキャンサー研究所、ユニバーシティカレッジロンドン(UCL)、マンチェスター大学で構成されている。
腸癌、乳癌、子宮頸癌などの既存のスクリーニン
ASHG2019 :マウスでCas9による標的外変異誘発を定量化。ガイドRNAのデザイン次第で標的外変異誘発を大幅に制限可能と報告。
 カナダのトロントにある病気の子供のための病院(SickKids)のフェノゲノミクスセンター科学技術開発部長の Lauryl Nutter博士(写真)を含む研究者らは、CRISPR酵素Cas9の使用を改善し、実験マウスの標的外変異誘発の可能性を減らすための新しい方法を見つけた。
研究者の遺伝子編集に関連する共通の懸念である精度を改善するための新戦略に役立つこの調査結果は、ヒューストンで開催された米国人類遺伝学会2019年次総会(ASHG2019)で2019年10月18日に発表された。
このプレゼンテーションは「全ゲノムシーケンスでCas9の標的外変異誘発を遺伝的浮動環境に入れる(Whole Genome Sequencing Puts Cas9 Off-Target Mutagenesis into the Context Of Genetic Drift.)」と題されている。Nutter博士と複数機関のノックアウトマウスフェノタイピングプロジェクト(KOMP2)の共同研究者は、Cas9と遺伝子編集を定期的に使用して、特定の突然変異を持つ実験用マウスの系統を作り出している。 この研究では、マウス系統での標的外変異誘発の可能性(遺伝子編集プロセスによって導入された意図しない遺伝子変異)にしばしば遭遇する。「我々は標的外変異誘発について、どの程度心配する必要があるのか知りたいと思っていた。」とNutter 博士は述べた。 マウスでの問題の程度を実証することにより、研究室で研究されているヒト細胞株でよりよく評価できるとともに、Cas9ベースの遺伝子編集の精度を改善する新しい方法を生み出したいと考えた。これらの質問に答えるために、Nutter博士のチームは、Cas9とガイドRNAを使用してマウスの胚で58のゲノム編集実験を行い、異なる遺伝子に特定の標的変異を誘発し、それを子
カナダのトロントにある病気の子供のための病院(SickKids)のフェノゲノミクスセンター科学技術開発部長の Lauryl Nutter博士(写真)を含む研究者らは、CRISPR酵素Cas9の使用を改善し、実験マウスの標的外変異誘発の可能性を減らすための新しい方法を見つけた。
研究者の遺伝子編集に関連する共通の懸念である精度を改善するための新戦略に役立つこの調査結果は、ヒューストンで開催された米国人類遺伝学会2019年次総会(ASHG2019)で2019年10月18日に発表された。
このプレゼンテーションは「全ゲノムシーケンスでCas9の標的外変異誘発を遺伝的浮動環境に入れる(Whole Genome Sequencing Puts Cas9 Off-Target Mutagenesis into the Context Of Genetic Drift.)」と題されている。Nutter博士と複数機関のノックアウトマウスフェノタイピングプロジェクト(KOMP2)の共同研究者は、Cas9と遺伝子編集を定期的に使用して、特定の突然変異を持つ実験用マウスの系統を作り出している。 この研究では、マウス系統での標的外変異誘発の可能性(遺伝子編集プロセスによって導入された意図しない遺伝子変異)にしばしば遭遇する。「我々は標的外変異誘発について、どの程度心配する必要があるのか知りたいと思っていた。」とNutter 博士は述べた。 マウスでの問題の程度を実証することにより、研究室で研究されているヒト細胞株でよりよく評価できるとともに、Cas9ベースの遺伝子編集の精度を改善する新しい方法を生み出したいと考えた。これらの質問に答えるために、Nutter博士のチームは、Cas9とガイドRNAを使用してマウスの胚で58のゲノム編集実験を行い、異なる遺伝子に特定の標的変異を誘発し、それを子
アルツハイマー病に関与したヒト遺伝子(MAPT)が組み込まれたマウスモデルが開発される
 ミネソタ大学の研究者は、アルツハイマー病などの疾患の治療法の研究で、マウス版のアルツハイマー病関連MAPT遺伝子がヒト版の遺伝子に完全に置き換えられたマウスの系統を開発した。 完全な遺伝子置換モデルとしてこの新しい動物モデルは、MAPT遺伝子はヒトと同じように機能し、研究者は遺伝子治療をより正確に開発および評価できるようになる。
この研究は、10月16日にテキサス州ヒューストンで開催された米国人類遺伝学会(ASHG)2019年次総会(10月15〜19日)で発表された。 発表の要旨は、「マウスへのヒト遺伝学の移動:完全なヒト遺伝子置換モデル(Moving Human Genetics into the Mouse: Full Human Gene-Replacement Models.)」と題されている。「研究者は、研究対象のマウスや他の動物モデルの遺伝子の動物バージョンを見つけて操作することで、ヒト遺伝子を長い間研究してきた」とミネソタ大学の准教授であるMichael Koob 博士は説明した。
「しかし、マウスはヒトとは異なる遺伝子を持っている。遺伝子の機能が同じであっても、その配列は異なる」とKoob博士は語った。 このため、動物モデルの研究には通常、多くの試行錯誤が伴い、研究者は、遺伝的変化が観察された変化につながる理由と方法について推測する必要がある。さらに、ヒトにおける遺伝子のヒトバージョンの役割について結論を導き出すこと、そして治療法を開発することはこの知識に基づいて構築することは困難であり、間違いを起こしやすく、研究結果は必ずしもそのまま通用しない。完全な遺伝子置換モデルへのアプローチを開発する中でKoob博士と同僚は、アルツハイマー病で重要な役割を果たすことが知られているが、その関与がよく理解されていない遺伝子であるMAPTに焦点を合わせることにし
ミネソタ大学の研究者は、アルツハイマー病などの疾患の治療法の研究で、マウス版のアルツハイマー病関連MAPT遺伝子がヒト版の遺伝子に完全に置き換えられたマウスの系統を開発した。 完全な遺伝子置換モデルとしてこの新しい動物モデルは、MAPT遺伝子はヒトと同じように機能し、研究者は遺伝子治療をより正確に開発および評価できるようになる。
この研究は、10月16日にテキサス州ヒューストンで開催された米国人類遺伝学会(ASHG)2019年次総会(10月15〜19日)で発表された。 発表の要旨は、「マウスへのヒト遺伝学の移動:完全なヒト遺伝子置換モデル(Moving Human Genetics into the Mouse: Full Human Gene-Replacement Models.)」と題されている。「研究者は、研究対象のマウスや他の動物モデルの遺伝子の動物バージョンを見つけて操作することで、ヒト遺伝子を長い間研究してきた」とミネソタ大学の准教授であるMichael Koob 博士は説明した。
「しかし、マウスはヒトとは異なる遺伝子を持っている。遺伝子の機能が同じであっても、その配列は異なる」とKoob博士は語った。 このため、動物モデルの研究には通常、多くの試行錯誤が伴い、研究者は、遺伝的変化が観察された変化につながる理由と方法について推測する必要がある。さらに、ヒトにおける遺伝子のヒトバージョンの役割について結論を導き出すこと、そして治療法を開発することはこの知識に基づいて構築することは困難であり、間違いを起こしやすく、研究結果は必ずしもそのまま通用しない。完全な遺伝子置換モデルへのアプローチを開発する中でKoob博士と同僚は、アルツハイマー病で重要な役割を果たすことが知られているが、その関与がよく理解されていない遺伝子であるMAPTに焦点を合わせることにし
5万年前の遺伝子の復活により、マラリア原虫がゴリラからヒトへ寄生したことが明らかに
 最も致命的であるマラリア原虫がゴリラからヒトにジャンプする一連の出来事が発見された。 英国のウェルカムサンガー研究所とフランスのモンペリエ大学の研究者は、熱帯熱マラリア原虫の祖先によって取得された約50,000年前の遺伝子配列を再構築し、ヒト赤血球に感染する能力を与えた。PLOS Biologyで2019年10月15日に公開されたこの論文は、「先祖伝来のRH5侵略リガンドの復活が、ヒトの熱帯熱マラリアの起源の分子的説明を提供する。」と題されている。
最も致命的であるマラリア原虫がゴリラからヒトにジャンプする一連の出来事が発見された。 英国のウェルカムサンガー研究所とフランスのモンペリエ大学の研究者は、熱帯熱マラリア原虫の祖先によって取得された約50,000年前の遺伝子配列を再構築し、ヒト赤血球に感染する能力を与えた。研究者らは、このrh5遺伝子が限られた時間で寄生虫がゴリラとヒトの両方に感染することを可能にし、分子レベルでジャンプがどのように行われたかを発見した。 この研究チームはまた、熱帯熱マラリア原虫をヒトに制限する特定のDNA突然変異を特定した。PLOS Biologyで2019年10月15日に公開されたこの研究は、最も致命的な感染症の1つがどのようにヒトに感染するようになったかについて信憑性のある説明を提供し、病原体が1つの種からどのように飛び出すことができるかを理解するために重要と言える。 この論文は、「先祖伝来のRH5侵略リガンドの復活が、ヒトの熱帯熱マラリアの起源の分子的説明を提供する。(Resurrection of the Ancestral RH5 Invasion Ligand Provides a Molecular Explanation for the Origin of P. Falciparum Malaria In Humans.)」と題
最も致命的であるマラリア原虫がゴリラからヒトにジャンプする一連の出来事が発見された。 英国のウェルカムサンガー研究所とフランスのモンペリエ大学の研究者は、熱帯熱マラリア原虫の祖先によって取得された約50,000年前の遺伝子配列を再構築し、ヒト赤血球に感染する能力を与えた。PLOS Biologyで2019年10月15日に公開されたこの論文は、「先祖伝来のRH5侵略リガンドの復活が、ヒトの熱帯熱マラリアの起源の分子的説明を提供する。」と題されている。
最も致命的であるマラリア原虫がゴリラからヒトにジャンプする一連の出来事が発見された。 英国のウェルカムサンガー研究所とフランスのモンペリエ大学の研究者は、熱帯熱マラリア原虫の祖先によって取得された約50,000年前の遺伝子配列を再構築し、ヒト赤血球に感染する能力を与えた。研究者らは、このrh5遺伝子が限られた時間で寄生虫がゴリラとヒトの両方に感染することを可能にし、分子レベルでジャンプがどのように行われたかを発見した。 この研究チームはまた、熱帯熱マラリア原虫をヒトに制限する特定のDNA突然変異を特定した。PLOS Biologyで2019年10月15日に公開されたこの研究は、最も致命的な感染症の1つがどのようにヒトに感染するようになったかについて信憑性のある説明を提供し、病原体が1つの種からどのように飛び出すことができるかを理解するために重要と言える。 この論文は、「先祖伝来のRH5侵略リガンドの復活が、ヒトの熱帯熱マラリアの起源の分子的説明を提供する。(Resurrection of the Ancestral RH5 Invasion Ligand Provides a Molecular Explanation for the Origin of P. Falciparum Malaria In Humans.)」と題
睡眠時無呼吸は糖尿病性黄斑浮腫の危険因子となり得る
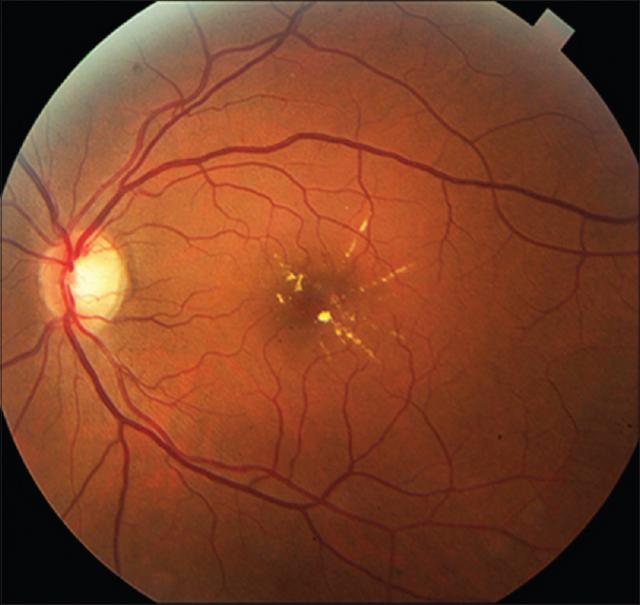 台湾のChang Gung Memorial Hospitalによる新研究は、重度の睡眠時無呼吸が、失明や失明を引き起こす可能性のある糖尿病の合併症である糖尿病性黄斑浮腫を発症する危険因子であることを示している。 糖尿病性黄斑浮腫も、重度の睡眠時無呼吸の患者では治療がより困難であった。 初期の研究では2つの状態の関連性が弱いことが示されていたが、睡眠時無呼吸は基礎疾患を悪化させるという証拠が増えている。
この研究者らは、サンフランシスコで10月12〜15日に開催された第123回米国眼科学会でこの研究成果を発表した。糖尿病の人が血糖値をうまくコントロールできないと、目の後ろの小さな血管が損傷する可能性がある。この状態は糖尿病性網膜症と呼ばれ、米国では失明の主な原因になっている。時には、小さな膨らみが血管から突出し、網膜に液体や血液が漏れることがある。この液体は網膜の領域に腫れや浮腫を引き起こし、はっきりと見ることができる。睡眠時無呼吸は、呼吸が繰り返し停止および開始し、睡眠を妨害し、血中酸素濃度を低下させる睡眠障害である。酸素の低下は、血管を傷つける役割を果たす可能性のある体の多くの変化を解き放つようだ。睡眠時無呼吸の人は、高血圧、心臓発作、脳卒中、2型糖尿病を発症するリスクがある。さて目はどうだろうか?
台湾のChang Gung Memorial Hospitalの研究者らは、睡眠時無呼吸は、インスリン抵抗性を高め、炎症を高め、血圧を上げることにより、糖尿病性網膜症の発症と悪化の一因になると考えている。主任研究者のJuifan Chiang博士および同僚は、8年間にわたって糖尿病性網膜症と診断されたすべての患者のデータを調べた。 研究者は、重度の睡眠時無呼吸の割合が、糖尿病性黄斑浮腫のない患者と比較して、糖尿病性黄斑浮腫のある患者で有意に高いことを発見した(80
台湾のChang Gung Memorial Hospitalによる新研究は、重度の睡眠時無呼吸が、失明や失明を引き起こす可能性のある糖尿病の合併症である糖尿病性黄斑浮腫を発症する危険因子であることを示している。 糖尿病性黄斑浮腫も、重度の睡眠時無呼吸の患者では治療がより困難であった。 初期の研究では2つの状態の関連性が弱いことが示されていたが、睡眠時無呼吸は基礎疾患を悪化させるという証拠が増えている。
この研究者らは、サンフランシスコで10月12〜15日に開催された第123回米国眼科学会でこの研究成果を発表した。糖尿病の人が血糖値をうまくコントロールできないと、目の後ろの小さな血管が損傷する可能性がある。この状態は糖尿病性網膜症と呼ばれ、米国では失明の主な原因になっている。時には、小さな膨らみが血管から突出し、網膜に液体や血液が漏れることがある。この液体は網膜の領域に腫れや浮腫を引き起こし、はっきりと見ることができる。睡眠時無呼吸は、呼吸が繰り返し停止および開始し、睡眠を妨害し、血中酸素濃度を低下させる睡眠障害である。酸素の低下は、血管を傷つける役割を果たす可能性のある体の多くの変化を解き放つようだ。睡眠時無呼吸の人は、高血圧、心臓発作、脳卒中、2型糖尿病を発症するリスクがある。さて目はどうだろうか?
台湾のChang Gung Memorial Hospitalの研究者らは、睡眠時無呼吸は、インスリン抵抗性を高め、炎症を高め、血圧を上げることにより、糖尿病性網膜症の発症と悪化の一因になると考えている。主任研究者のJuifan Chiang博士および同僚は、8年間にわたって糖尿病性網膜症と診断されたすべての患者のデータを調べた。 研究者は、重度の睡眠時無呼吸の割合が、糖尿病性黄斑浮腫のない患者と比較して、糖尿病性黄斑浮腫のある患者で有意に高いことを発見した(80
脳の特定領域の深部脳刺激(DBS)が治療抵抗性の鬱病患者に長期間強力な抗鬱効果をもたらした
 脳下帯状回(SCC)と呼ばれる脳の領域への深部脳刺激(DBS)により、 他の治療に反応しなかった最も重度の鬱病患者である治療抵抗性鬱病の患者に長期間強力な抗鬱効果をもたらしたことがAmerican Journal of Psychiatryの2019年10月4日号にオンラインで公開された。この論文は「治療抵抗性うつ病に対する脳梁下帯状回深部脳刺激の長期転帰(Long-Term Outcomes of Subcallosal Cingulate Deep Brain Stimulation for Treatment-Resistant Depression.)」と題されている。
この研究は、エモリー大学の神経学・脳神経外科・精神医学・神経科学の教授であり、ナッシュファミリーアドバンストサーキットセンターの設立ディレクターであるHelen S. Mayberg博士(写真)が率いている。ニューヨーク市マウントシナイのアイカーン医科大学の治療学は、研究チームによって実施された以前の研究を検証し、これらの患者のDBSを改良および最適化するための追加研究の基礎を築いた。本態性振戦、パーキンソン病、てんかん、強迫性障害を治療するために米国食品医薬品局から承認されている脳深部刺激は、神経刺激装置(「脳ペースメーカー」と呼ばれることもある)の配置を伴う神経外科的処置だ。 高周波の電気インパルスを脳の奥深くに埋め込まれた電極を通して各障害の症状の原因となる特定の脳領域に送る。Mayberg博士は、2005年に治療抵抗性鬱病患者を対象に、Brodmann エリア25として知られる脳梁下帯状回白質のDBSの最初の試験を主導し、臨床的有益性があることを実証した。 その後の小規模な非盲検試験でも同様に良好な結果が得られたが、これらの有望な非盲検結果にもかかわらず、指定された6ヶ月で統計的に有
脳下帯状回(SCC)と呼ばれる脳の領域への深部脳刺激(DBS)により、 他の治療に反応しなかった最も重度の鬱病患者である治療抵抗性鬱病の患者に長期間強力な抗鬱効果をもたらしたことがAmerican Journal of Psychiatryの2019年10月4日号にオンラインで公開された。この論文は「治療抵抗性うつ病に対する脳梁下帯状回深部脳刺激の長期転帰(Long-Term Outcomes of Subcallosal Cingulate Deep Brain Stimulation for Treatment-Resistant Depression.)」と題されている。
この研究は、エモリー大学の神経学・脳神経外科・精神医学・神経科学の教授であり、ナッシュファミリーアドバンストサーキットセンターの設立ディレクターであるHelen S. Mayberg博士(写真)が率いている。ニューヨーク市マウントシナイのアイカーン医科大学の治療学は、研究チームによって実施された以前の研究を検証し、これらの患者のDBSを改良および最適化するための追加研究の基礎を築いた。本態性振戦、パーキンソン病、てんかん、強迫性障害を治療するために米国食品医薬品局から承認されている脳深部刺激は、神経刺激装置(「脳ペースメーカー」と呼ばれることもある)の配置を伴う神経外科的処置だ。 高周波の電気インパルスを脳の奥深くに埋め込まれた電極を通して各障害の症状の原因となる特定の脳領域に送る。Mayberg博士は、2005年に治療抵抗性鬱病患者を対象に、Brodmann エリア25として知られる脳梁下帯状回白質のDBSの最初の試験を主導し、臨床的有益性があることを実証した。 その後の小規模な非盲検試験でも同様に良好な結果が得られたが、これらの有望な非盲検結果にもかかわらず、指定された6ヶ月で統計的に有
英国、UK BioBankに蓄積された50万人のボランティアの全ゲノム配列解析プロジェクトを始動。世界中の優れた学生や科学者の移民を奨励するため、規則が変更された。
 生命を脅かす病気との闘いにおける画期的プロジェクトが、英国で2019年9月11日に始動した。 2億ポンド(約264億円)の全ゲノム配列決定プロジェクトが形成され、英国ストックポートに本拠地を置くUK Biobankで約50万人のボランティアの遺伝子コードを調べ配列決定する。UK Biobankは製薬会社や専門機関とパートナーシップを形成している。
英国のBoris Johnson 首相は次のように述べている。「英国には、国際的な協力と発見の中心に自らを置くという誇りのある歴史がある。 60年以上前、我々は国際的な研究者チームによってケンブリッジでDNAの発見に至ったが、今日はさらに進んでいる。 現在、我々は世界中の専門家を集めて、英国で世界最大の遺伝学研究プロジェクトに取り組み、生命にかかわる病気の治療を改善し、最終的には命を救おうとしている。 この種の突破には、英国で勉強や働くために世界中から集まる最も光り輝く最高の人材に開かれていなければ不可能だ。 だからこそ、留学生が潜在的な可能性を解き放ち、英国でのキャリアを開始するための新ルートを発表する。」ゲノミクス研究は、真に予測可能で、よりパーソナライズされたヘルスケアシステムを作成する可能性があり、英国はこの分野の研究が提供する機会を掴みたいと望んでいる。そのため、政府は2024年までに500万件のDNA分析を行うことを約束した。新しいプロジェクトは、遺伝子研究を通じて健康を改善し、癌、心臓病、糖尿病、関節炎、認知症を含む広範囲の重篤で生命を脅かす病気の予防、診断、治療を改善することを目指している。
Andrea Leadsom 英国商務長官は、次のように述べている。 「本資金支援は、科学的努力と進歩の最前線に留まるという英国の決意を反映しており、これまでに実施された世界で最も野心的な遺伝子配列決定プログラムの1つだ。
生命を脅かす病気との闘いにおける画期的プロジェクトが、英国で2019年9月11日に始動した。 2億ポンド(約264億円)の全ゲノム配列決定プロジェクトが形成され、英国ストックポートに本拠地を置くUK Biobankで約50万人のボランティアの遺伝子コードを調べ配列決定する。UK Biobankは製薬会社や専門機関とパートナーシップを形成している。
英国のBoris Johnson 首相は次のように述べている。「英国には、国際的な協力と発見の中心に自らを置くという誇りのある歴史がある。 60年以上前、我々は国際的な研究者チームによってケンブリッジでDNAの発見に至ったが、今日はさらに進んでいる。 現在、我々は世界中の専門家を集めて、英国で世界最大の遺伝学研究プロジェクトに取り組み、生命にかかわる病気の治療を改善し、最終的には命を救おうとしている。 この種の突破には、英国で勉強や働くために世界中から集まる最も光り輝く最高の人材に開かれていなければ不可能だ。 だからこそ、留学生が潜在的な可能性を解き放ち、英国でのキャリアを開始するための新ルートを発表する。」ゲノミクス研究は、真に予測可能で、よりパーソナライズされたヘルスケアシステムを作成する可能性があり、英国はこの分野の研究が提供する機会を掴みたいと望んでいる。そのため、政府は2024年までに500万件のDNA分析を行うことを約束した。新しいプロジェクトは、遺伝子研究を通じて健康を改善し、癌、心臓病、糖尿病、関節炎、認知症を含む広範囲の重篤で生命を脅かす病気の予防、診断、治療を改善することを目指している。
Andrea Leadsom 英国商務長官は、次のように述べている。 「本資金支援は、科学的努力と進歩の最前線に留まるという英国の決意を反映しており、これまでに実施された世界で最も野心的な遺伝子配列決定プログラムの1つだ。
幼児の稀で致命的な障害であるクラッベ病の原因が特定された。薬物療法の実証試験は疾患マウスモデルに効果を示した。
 セントルイスのワシントン大学医学部の研究者らは、通常3歳前後で発作、発達退行、および死をもたらす小児の致命的な遺伝子障害「クラッベ病」に至る正確な生化学的パスウェイについて、数十年にわたる謎を解決したようだ。このクラッベ病のヒト疾患マウスモデルを用い、この研究者らは可能な治療戦略を見つけ出した。
2019年9月16日にPNASでオンラインで公開されたこの論文は、「クラッベ病における酸性セラミダーゼの遺伝的アブレーションによりサイコシン仮説が確認され、新しい治療標的が特定された。(Genetic Ablation of Acid Ceramidase In Krabbe Disease Confirms the Psychosine Hypothesis and Identifies a New Therapeutic Target.)」と題されている。クラッベ病としても知られる乳児球状細胞白質ジストロフィーの患者は、神経ワイヤーの軸索を絶縁する保護被覆を徐々に失う。この稀な状態(出生100,000人に約1人に影響を及ぼす)は、通常1歳前に診断され、急速に進行する。 研究者らは、サイコシンと呼ばれる有毒化合物の蓄積がこの障害で神経の絶縁が破壊される原因であると長い間疑っていた。 遺伝性疾患の患者は、サイコシンの分解に関与する重要なタンパク質を欠いている。 しかし、クラッベ病のサイコシン源はとらえどころのないものであり、問題を解決することは不可能だ。「幼児期のクラッベ病は常に致命的だ。」と、ワシントン大学医学部の教授である上級著者のMark S. Sands 博士は述べた。 「これは、1世紀以上前に発見された神経変性疾患だが、効果的な治療法はまだない。ほぼ50年間、サイコシンの仮説は正しいと想定されてきた。 しかし、我々はそれを証明することができなかった。」驚くべきこと
セントルイスのワシントン大学医学部の研究者らは、通常3歳前後で発作、発達退行、および死をもたらす小児の致命的な遺伝子障害「クラッベ病」に至る正確な生化学的パスウェイについて、数十年にわたる謎を解決したようだ。このクラッベ病のヒト疾患マウスモデルを用い、この研究者らは可能な治療戦略を見つけ出した。
2019年9月16日にPNASでオンラインで公開されたこの論文は、「クラッベ病における酸性セラミダーゼの遺伝的アブレーションによりサイコシン仮説が確認され、新しい治療標的が特定された。(Genetic Ablation of Acid Ceramidase In Krabbe Disease Confirms the Psychosine Hypothesis and Identifies a New Therapeutic Target.)」と題されている。クラッベ病としても知られる乳児球状細胞白質ジストロフィーの患者は、神経ワイヤーの軸索を絶縁する保護被覆を徐々に失う。この稀な状態(出生100,000人に約1人に影響を及ぼす)は、通常1歳前に診断され、急速に進行する。 研究者らは、サイコシンと呼ばれる有毒化合物の蓄積がこの障害で神経の絶縁が破壊される原因であると長い間疑っていた。 遺伝性疾患の患者は、サイコシンの分解に関与する重要なタンパク質を欠いている。 しかし、クラッベ病のサイコシン源はとらえどころのないものであり、問題を解決することは不可能だ。「幼児期のクラッベ病は常に致命的だ。」と、ワシントン大学医学部の教授である上級著者のMark S. Sands 博士は述べた。 「これは、1世紀以上前に発見された神経変性疾患だが、効果的な治療法はまだない。ほぼ50年間、サイコシンの仮説は正しいと想定されてきた。 しかし、我々はそれを証明することができなかった。」驚くべきこと
左利きに関連した4つの遺伝子領域が特定された
 新たな研究により、一般集団の左利きに関連するゲノム領域が初めて特定され、その影響が脳の構造と関連付けられた。 この研究は、これらの遺伝的違いを、言語に関連する脳の領域間のつながりと関連付けるものだ。遺伝子が利き手の決定に部分的な役割を担っていることはすでに知られていた。双子の研究では、利き手の変化の25%は遺伝子に起因すると推定されている。しかし、これらの遺伝子は一般集団では確立されていなかった。
このオックスフォード大学の医学研究評議会とウェルカム財団から資金提供を受けた研究者が率いる新しい研究は、2019年9月5日に Brain誌でオンラインで公開された。 この研究では、38,332人の左利きを含むUK Biobankの約40万人のゲノムを分析することによって、左利きに関連する遺伝的変異のいくつかを特定した。 このオープンアクセスの論文は、「利き手、言語領域および神経精神病:脳画像と遺伝学からの洞察(Handedness, Language Areas, and Neuropsychiatric Diseases: Insights from Brain Imaging and Genetics)」と題されている。特定された4つの遺伝的領域のうち、3つは脳の発達と構造に関与するタンパク質に関連していた。 特に、これらのタンパク質は、細胞骨格と呼ばれる細胞内の足場の一部である微小管に関連しており、細胞骨格の構築と機能を体内で誘導する。 参加者の約10,000人からの詳細な脳画像を使用して、これらの遺伝的影響が言語関連領域を結合する脳の細胞骨格を含む白質領域の脳構造の違いに関連していることを発見した。
研究の筆頭著者であるオックスフォード大学医学研究評議会のフェローであるAkira Wiberg 博士は、次のように述べている。「人々の約90%は右利きであり、これは
新たな研究により、一般集団の左利きに関連するゲノム領域が初めて特定され、その影響が脳の構造と関連付けられた。 この研究は、これらの遺伝的違いを、言語に関連する脳の領域間のつながりと関連付けるものだ。遺伝子が利き手の決定に部分的な役割を担っていることはすでに知られていた。双子の研究では、利き手の変化の25%は遺伝子に起因すると推定されている。しかし、これらの遺伝子は一般集団では確立されていなかった。
このオックスフォード大学の医学研究評議会とウェルカム財団から資金提供を受けた研究者が率いる新しい研究は、2019年9月5日に Brain誌でオンラインで公開された。 この研究では、38,332人の左利きを含むUK Biobankの約40万人のゲノムを分析することによって、左利きに関連する遺伝的変異のいくつかを特定した。 このオープンアクセスの論文は、「利き手、言語領域および神経精神病:脳画像と遺伝学からの洞察(Handedness, Language Areas, and Neuropsychiatric Diseases: Insights from Brain Imaging and Genetics)」と題されている。特定された4つの遺伝的領域のうち、3つは脳の発達と構造に関与するタンパク質に関連していた。 特に、これらのタンパク質は、細胞骨格と呼ばれる細胞内の足場の一部である微小管に関連しており、細胞骨格の構築と機能を体内で誘導する。 参加者の約10,000人からの詳細な脳画像を使用して、これらの遺伝的影響が言語関連領域を結合する脳の細胞骨格を含む白質領域の脳構造の違いに関連していることを発見した。
研究の筆頭著者であるオックスフォード大学医学研究評議会のフェローであるAkira Wiberg 博士は、次のように述べている。「人々の約90%は右利きであり、これは
テロメラーゼの新たな役割が明らかに。テロメラーゼは正常細胞の細胞死の直前に一過性誘導され、より緩やかな細胞死をもたらす。
 メリーランド大学(UMD)と国立衛生研究所の新しい研究により、酵素テロメラーゼの新しい役割が明らかになった。 これまで正常組織におけるテロメラーゼの唯一の既知の役割は、胚細胞、精子細胞、成体幹細胞、免疫細胞など、定期的に分裂する特定の細胞を保護することとされていた。 科学者は、無制限の細胞分裂を促進する癌性腫瘍を除き、他のすべての細胞ではテロメラーゼがオフになっていると考えていた。
新しい研究では、老化プロセスの重要な時点で、テロメラーゼが正常な成体細胞で再活性化することが分かった。 細胞死の直前、テロメラーゼのバーストは老化ストレスから細胞を緩衝してプロセスを遅くし、癌につながる可能性のあるDNA損傷を減らす。 この研究は、2019年9月2日に全米科学アカデミーの論文集に掲載された。このオープンアクセスの論文は、「テロメラーゼ発現の一時的な誘導が老化を仲介し、初代線維芽細胞の腫瘍形成を減少させる(Transient Induction of Telomerase Expression Mediates Senescence and Reduces Tumorigenesis in Primary Fibroblasts.)」と題されている。「この研究は、正常細胞におけるテロメラーゼ機能の現在の理解を再構築するものだ。」と、この研究の主著者でありUMDの細胞生物学および分子遺伝学の准教授であるKan Cao博士は述べた。 「我々の研究は、腫瘍形成の促進を超えて成人細胞にテロメラーゼの役割があることを初めて示した。細胞のライフサイクルの重要なポイントでのテロメラーゼの活性化の調節は重要な機能を果たしていると言える。」テロメラーゼは、染色体を損傷から保護する細胞の染色体の末端にある特殊なDNAタンパク質構造であるテロメア(画像の明るく表示された部分)の短縮を防いでいる。
メリーランド大学(UMD)と国立衛生研究所の新しい研究により、酵素テロメラーゼの新しい役割が明らかになった。 これまで正常組織におけるテロメラーゼの唯一の既知の役割は、胚細胞、精子細胞、成体幹細胞、免疫細胞など、定期的に分裂する特定の細胞を保護することとされていた。 科学者は、無制限の細胞分裂を促進する癌性腫瘍を除き、他のすべての細胞ではテロメラーゼがオフになっていると考えていた。
新しい研究では、老化プロセスの重要な時点で、テロメラーゼが正常な成体細胞で再活性化することが分かった。 細胞死の直前、テロメラーゼのバーストは老化ストレスから細胞を緩衝してプロセスを遅くし、癌につながる可能性のあるDNA損傷を減らす。 この研究は、2019年9月2日に全米科学アカデミーの論文集に掲載された。このオープンアクセスの論文は、「テロメラーゼ発現の一時的な誘導が老化を仲介し、初代線維芽細胞の腫瘍形成を減少させる(Transient Induction of Telomerase Expression Mediates Senescence and Reduces Tumorigenesis in Primary Fibroblasts.)」と題されている。「この研究は、正常細胞におけるテロメラーゼ機能の現在の理解を再構築するものだ。」と、この研究の主著者でありUMDの細胞生物学および分子遺伝学の准教授であるKan Cao博士は述べた。 「我々の研究は、腫瘍形成の促進を超えて成人細胞にテロメラーゼの役割があることを初めて示した。細胞のライフサイクルの重要なポイントでのテロメラーゼの活性化の調節は重要な機能を果たしていると言える。」テロメラーゼは、染色体を損傷から保護する細胞の染色体の末端にある特殊なDNAタンパク質構造であるテロメア(画像の明るく表示された部分)の短縮を防いでいる。
ニーマン・ピック病A型の有望な遺伝子置換療法が米オハイオ州で前進
 最近オハイオ州立大学医学部に移ったKrystof Bankiewicz MD, PhD(写真)が率いる研究は、ニーマン・ピックA型疾患の遺伝子置換療法が非ヒト霊長類で安全に使用でき、マウスで治療効果があることを示している。これらの研究成果は、ジャーナルScience Translational Medicineで2019年8月21日にオンラインで公開された。 この論文は、「ニーマン・ピック病A型に対するアデノ随伴ウイルスベクター血清型9ベースの遺伝子治療(Adeno-Associated Viral Vector Serotype 9–Based Gene Therapy for Niemann-Pick Disease Type A.)」と題されている。
Bankiewicz 博士は、オハイオ州立大学に脳神経外科の教授として移籍する以前、カリフォルニア大学サンフランシスコ校で、ニューヨーク、マサチューセッツ、スペインの研究者と共同で、このトランスレーショナル遺伝子治療研究を実施していた。ニーマン・ピック病A型(NPD-A)は、神経変性と早期死を特徴とするリソソーム蓄積症である。 スフィンゴミエリンをセラミドに加水分解する酵素酸性スフィンゴミエリナーゼ(ASM)をコードする遺伝子の機能喪失変異が原因だ。 この病気では、細胞内の脂肪を代謝する身体の能力が影響を受け、これらの細胞が誤作動し、最終的には死に至る。 この遺伝性疾患は、脳、神経、肝臓、脾臓、骨髄、肺に影響を及ぼす可能性がある。 ニーマン・ピック病の3つの主なタイプは、A型、B型、C型に分類される。経験する徴候と症状は、状態のタイプと重症度によって異なる。
A型の乳児の中には、生後数ヶ月以内に徴候や症状を示すものがある。 B型の人は何年も兆候を示さず、成人期まで生き残る可能性が高くなる。 C型の人は、成人にな
最近オハイオ州立大学医学部に移ったKrystof Bankiewicz MD, PhD(写真)が率いる研究は、ニーマン・ピックA型疾患の遺伝子置換療法が非ヒト霊長類で安全に使用でき、マウスで治療効果があることを示している。これらの研究成果は、ジャーナルScience Translational Medicineで2019年8月21日にオンラインで公開された。 この論文は、「ニーマン・ピック病A型に対するアデノ随伴ウイルスベクター血清型9ベースの遺伝子治療(Adeno-Associated Viral Vector Serotype 9–Based Gene Therapy for Niemann-Pick Disease Type A.)」と題されている。
Bankiewicz 博士は、オハイオ州立大学に脳神経外科の教授として移籍する以前、カリフォルニア大学サンフランシスコ校で、ニューヨーク、マサチューセッツ、スペインの研究者と共同で、このトランスレーショナル遺伝子治療研究を実施していた。ニーマン・ピック病A型(NPD-A)は、神経変性と早期死を特徴とするリソソーム蓄積症である。 スフィンゴミエリンをセラミドに加水分解する酵素酸性スフィンゴミエリナーゼ(ASM)をコードする遺伝子の機能喪失変異が原因だ。 この病気では、細胞内の脂肪を代謝する身体の能力が影響を受け、これらの細胞が誤作動し、最終的には死に至る。 この遺伝性疾患は、脳、神経、肝臓、脾臓、骨髄、肺に影響を及ぼす可能性がある。 ニーマン・ピック病の3つの主なタイプは、A型、B型、C型に分類される。経験する徴候と症状は、状態のタイプと重症度によって異なる。
A型の乳児の中には、生後数ヶ月以内に徴候や症状を示すものがある。 B型の人は何年も兆候を示さず、成人期まで生き残る可能性が高くなる。 C型の人は、成人にな
ロックフェラーの科学者により、ハエの小さな精巣から新しい遺伝子がどの ように発生するか洞察が引き出された
 性別の戦いでは、遺伝的観点から、男性は革新的な側面を持っているように見える。精巣は精子の単なる工場以上のものであることが発見された。精巣は、種の進化の原料である新しい遺伝子の出現のホットスポットとしても機能している。ロックフェラー大学のチームは、ミバエを使用し、精子の発育中に自然のイノベーションの試みがどのように機能するかについて重要な洞察を得た。
eLifeで2019年8月16日にオンラインで公開された研究では、単一細胞レベルのDNA変異の存在と、そのような変化から生じる新しい遺伝子の活性をマッピングした。この論文は、「精巣単一細胞RNA-SeqがショウジョウバエのDe Novo遺伝子転写と生殖細胞変異バイアスのダイナミクスを明らかにする(Testis Single-Cell RNA-Seq Reveals the Dynamics of De Novo Gene Transcription and Germline Mutational Bias in Drosophila.)」と題されている。「我々の研究は、生物の適応と進化を可能にし最終的に地球上の生命の多様性に貢献するプロセスに関する前例のない視点を提供する」と研究を率いたロックフェラーの助教授Li Zhao博士は述べた。近年、ハエからヒトまでの動物の研究により、精巣に由来する多くの若い遺伝子が発見された。これらの発見および他の発見は、遺伝子の進化のために、精巣が体の最も生産的な部位、すなわち男性または女性の間でランク付けされることを示唆している。しかし、この遺伝子変種の大量生産には重大なリスクが伴う。たとえば、ヒトの場合、父親の精子は、正常な発育の過程で母親の卵子よりも2〜3倍多くの新しい突然変異を獲得し、その精子は遺伝的な誤りに悩まされる。場合によって、そのような間違いは、父親の子孫を傷つけたりすること
性別の戦いでは、遺伝的観点から、男性は革新的な側面を持っているように見える。精巣は精子の単なる工場以上のものであることが発見された。精巣は、種の進化の原料である新しい遺伝子の出現のホットスポットとしても機能している。ロックフェラー大学のチームは、ミバエを使用し、精子の発育中に自然のイノベーションの試みがどのように機能するかについて重要な洞察を得た。
eLifeで2019年8月16日にオンラインで公開された研究では、単一細胞レベルのDNA変異の存在と、そのような変化から生じる新しい遺伝子の活性をマッピングした。この論文は、「精巣単一細胞RNA-SeqがショウジョウバエのDe Novo遺伝子転写と生殖細胞変異バイアスのダイナミクスを明らかにする(Testis Single-Cell RNA-Seq Reveals the Dynamics of De Novo Gene Transcription and Germline Mutational Bias in Drosophila.)」と題されている。「我々の研究は、生物の適応と進化を可能にし最終的に地球上の生命の多様性に貢献するプロセスに関する前例のない視点を提供する」と研究を率いたロックフェラーの助教授Li Zhao博士は述べた。近年、ハエからヒトまでの動物の研究により、精巣に由来する多くの若い遺伝子が発見された。これらの発見および他の発見は、遺伝子の進化のために、精巣が体の最も生産的な部位、すなわち男性または女性の間でランク付けされることを示唆している。しかし、この遺伝子変種の大量生産には重大なリスクが伴う。たとえば、ヒトの場合、父親の精子は、正常な発育の過程で母親の卵子よりも2〜3倍多くの新しい突然変異を獲得し、その精子は遺伝的な誤りに悩まされる。場合によって、そのような間違いは、父親の子孫を傷つけたりすること
人間やペンギンに感染するサルマラリア原虫に対するハイスループット薬物試験法が開発された
 オタゴ大学(ニュージーランド)の2人の科学者によるサルマラリア研究のブレークスルーが、再発型ヒトマラリアを診断・治療するのに役立つかもしれない。 マラリアは蚊を媒介とする感染症で、特にアジア、太平洋、南アメリカで毎年2億人以上の症例が発生しており、人間や他の動物にも影響を及ぼす。 症状には発熱、疲労感、嘔吐、頭痛などがあり、重度の場合、発作、昏睡、または死を引き起こす可能性がある。
マラリアの再発は三日熱マラリア原虫によって引き起こされるが、最も広く分布しており、人間のマラリアの原因を治療するのは困難だ。三日熱マラリアに対する新しい薬とワクチンを開発するための現在の努力は、試験管(in vitro)培養法の欠如により妨げられてきた。しかし、世界初の発見で、Adelina Chua 博士と Jessica Ong 氏は、再発性三日熱マラリア原虫に密接に関連したサルマラリア寄生虫を培養するためのin vitro法を開発した。「我々は三日熱マラリアを培養することはできないが、今ではほぼ同一の姉妹種を培養することができ、新しい抗マラリア薬を開発し、迅速にテストする前例のない機会を得た。」とオタゴ大学微生物学部の博士候補者は説明した。この研究からの興味深いスピンオフは、人間の再発性マラリアに対して開発された薬物は、ニュージーランド本土の絶滅危惧種である黄色目ペンギン(画像)を殺す鳥マラリアに対しても作用する可能性が高いことだという。 「我々が開発する以前は、再発性マラリアを標的とした抗マラリア薬をスクリーニングするためのハイスループットモデルは無かった。」とOng 氏は述べた。 「我々のモデルは、医薬品開発だけでなく、ワクチンおよび診断研究でも重要な役割を果たすだろう。」2019年8月12日にNature Communicationsのオンラインで公開されたこの新しいマラリア培養法
オタゴ大学(ニュージーランド)の2人の科学者によるサルマラリア研究のブレークスルーが、再発型ヒトマラリアを診断・治療するのに役立つかもしれない。 マラリアは蚊を媒介とする感染症で、特にアジア、太平洋、南アメリカで毎年2億人以上の症例が発生しており、人間や他の動物にも影響を及ぼす。 症状には発熱、疲労感、嘔吐、頭痛などがあり、重度の場合、発作、昏睡、または死を引き起こす可能性がある。
マラリアの再発は三日熱マラリア原虫によって引き起こされるが、最も広く分布しており、人間のマラリアの原因を治療するのは困難だ。三日熱マラリアに対する新しい薬とワクチンを開発するための現在の努力は、試験管(in vitro)培養法の欠如により妨げられてきた。しかし、世界初の発見で、Adelina Chua 博士と Jessica Ong 氏は、再発性三日熱マラリア原虫に密接に関連したサルマラリア寄生虫を培養するためのin vitro法を開発した。「我々は三日熱マラリアを培養することはできないが、今ではほぼ同一の姉妹種を培養することができ、新しい抗マラリア薬を開発し、迅速にテストする前例のない機会を得た。」とオタゴ大学微生物学部の博士候補者は説明した。この研究からの興味深いスピンオフは、人間の再発性マラリアに対して開発された薬物は、ニュージーランド本土の絶滅危惧種である黄色目ペンギン(画像)を殺す鳥マラリアに対しても作用する可能性が高いことだという。 「我々が開発する以前は、再発性マラリアを標的とした抗マラリア薬をスクリーニングするためのハイスループットモデルは無かった。」とOng 氏は述べた。 「我々のモデルは、医薬品開発だけでなく、ワクチンおよび診断研究でも重要な役割を果たすだろう。」2019年8月12日にNature Communicationsのオンラインで公開されたこの新しいマラリア培養法
膵臓癌の広がりを止める可能性がある標的マトリックスタンパク質(Perlecan)を特定
 オーストラリアのガルバン医学研究所が率いる国際研究チームは、膵臓癌の主な死因である攻撃的な膵臓癌細胞がどのように環境を変化させ、体の他の部位への転移を行うのか明らかにした。研究者らは、一部の膵臓腫瘍は「perlecan」と呼ばれる分子をより多く生成し、周囲の環境を改造することを発見した。この分子により、癌細胞は体の他の部位に拡散しやすくなり、化学療法に耐性を示すという。マウスモデルにおいて、研究者らは、perlecanのレベルを下げることで膵臓癌の広がりを減らし、化学療法に対する反応を改善することを示した。
ガルバン医学研究所のInvasion and Metastasis Laboratory 所長のPaul Timpson 准教授、およびMatrix and Metastasis Group のリーダーであるThomas Cox 博士が率いたこの研究は、膵臓癌およびその他の癌を有する人のためのより効果的な治療選択肢へ希望をもたらすかもしれない。Nature Communicationsで2019年8月12日にオンラインで公開されたこの論文は、「膵臓癌細胞によって駆動されるCAF階層p53-Statusにより、perlecanを介し転移性および化学療法抵抗性の環境が作り出される(CAF Hierarchy Driven by Pancreatic Cancer Cell p53-Status Creates a Pro-Metastatic and Chemoresistant Environment via Perlecan.)」と題されている。「膵臓癌は非常に攻撃的であり、ほとんどの症例が診断されるまでに、腫瘍はしばしば手術不能となる」とTimpson 准教授は述べた。 「この研究で発見したことは、化学療法の効率を改善し、腫瘍の進行と広がりを軽減する可能性がある、
オーストラリアのガルバン医学研究所が率いる国際研究チームは、膵臓癌の主な死因である攻撃的な膵臓癌細胞がどのように環境を変化させ、体の他の部位への転移を行うのか明らかにした。研究者らは、一部の膵臓腫瘍は「perlecan」と呼ばれる分子をより多く生成し、周囲の環境を改造することを発見した。この分子により、癌細胞は体の他の部位に拡散しやすくなり、化学療法に耐性を示すという。マウスモデルにおいて、研究者らは、perlecanのレベルを下げることで膵臓癌の広がりを減らし、化学療法に対する反応を改善することを示した。
ガルバン医学研究所のInvasion and Metastasis Laboratory 所長のPaul Timpson 准教授、およびMatrix and Metastasis Group のリーダーであるThomas Cox 博士が率いたこの研究は、膵臓癌およびその他の癌を有する人のためのより効果的な治療選択肢へ希望をもたらすかもしれない。Nature Communicationsで2019年8月12日にオンラインで公開されたこの論文は、「膵臓癌細胞によって駆動されるCAF階層p53-Statusにより、perlecanを介し転移性および化学療法抵抗性の環境が作り出される(CAF Hierarchy Driven by Pancreatic Cancer Cell p53-Status Creates a Pro-Metastatic and Chemoresistant Environment via Perlecan.)」と題されている。「膵臓癌は非常に攻撃的であり、ほとんどの症例が診断されるまでに、腫瘍はしばしば手術不能となる」とTimpson 准教授は述べた。 「この研究で発見したことは、化学療法の効率を改善し、腫瘍の進行と広がりを軽減する可能性がある、
遺伝性膵臓癌に関連する遺伝子変異(RABL3遺伝子)が特定された
 膵臓癌は、治療選択肢が限られている最も致命的な癌の1つだ。 通常、進行期まで症状がなく、多くの抗がん療法に抵抗する能力があるため、特に予後不良である。 その発達に関与する遺伝子を特定することで、より早期の診断と改善された治療が可能になると考えられる。
現在、マサチューセッツ総合病院(MGH)、ブリガムアンドウィメンズ病院、およびダナファーバーがん研究所の研究者が率いる研究チームは、特定の遺伝子の突然変異が、研究対象のある家族の膵臓癌の遺伝型と関連していることを発見した。 膵臓癌の約10%は遺伝性であると考えられている(後述するJimmy Carter 前大統領の家族の膵臓癌の議論を参照)。研究グループはまた、彼らが特定したような突然変異が腫瘍の発生に寄与するメカニズムを明らかにした。 2019年8月12日にNature Geneticsでオンライン公開されたこの研究では、複数のメンバーが膵臓癌にかかっている家族のゲノム配列を決定した。 解析により、RAS癌遺伝子ファミリー様3(RABL3)遺伝子の変異が明らかになった。 この論文は「RABL3の突然変異はKRASのプレニル化を変化させ、遺伝性膵臓癌に関連する。(Mutations in RABL3 Alter KRAS Prenylation and Are Associated with Hereditary Pancreatic Cancer.)」と題されている。この遺伝子突然変異の影響を評価するために、研究者らはゼブラフィッシュでそれを再現した。ゼブラフィッシュは、癌リスクに対する新たに発見された遺伝子突然変異の影響を研究するための大集団モデルである。 突然変異を持っている魚は、加速された頻度で癌を発症した。 追加の研究により、RABL3によって発現されるタンパク質はRASシグナル伝達経路の構成要素と相互作用すること
膵臓癌は、治療選択肢が限られている最も致命的な癌の1つだ。 通常、進行期まで症状がなく、多くの抗がん療法に抵抗する能力があるため、特に予後不良である。 その発達に関与する遺伝子を特定することで、より早期の診断と改善された治療が可能になると考えられる。
現在、マサチューセッツ総合病院(MGH)、ブリガムアンドウィメンズ病院、およびダナファーバーがん研究所の研究者が率いる研究チームは、特定の遺伝子の突然変異が、研究対象のある家族の膵臓癌の遺伝型と関連していることを発見した。 膵臓癌の約10%は遺伝性であると考えられている(後述するJimmy Carter 前大統領の家族の膵臓癌の議論を参照)。研究グループはまた、彼らが特定したような突然変異が腫瘍の発生に寄与するメカニズムを明らかにした。 2019年8月12日にNature Geneticsでオンライン公開されたこの研究では、複数のメンバーが膵臓癌にかかっている家族のゲノム配列を決定した。 解析により、RAS癌遺伝子ファミリー様3(RABL3)遺伝子の変異が明らかになった。 この論文は「RABL3の突然変異はKRASのプレニル化を変化させ、遺伝性膵臓癌に関連する。(Mutations in RABL3 Alter KRAS Prenylation and Are Associated with Hereditary Pancreatic Cancer.)」と題されている。この遺伝子突然変異の影響を評価するために、研究者らはゼブラフィッシュでそれを再現した。ゼブラフィッシュは、癌リスクに対する新たに発見された遺伝子突然変異の影響を研究するための大集団モデルである。 突然変異を持っている魚は、加速された頻度で癌を発症した。 追加の研究により、RABL3によって発現されるタンパク質はRASシグナル伝達経路の構成要素と相互作用すること
MS4A4A遺伝子変異体は可溶性TREM2レベルに影響し、アルツハイマー病のかかり易さに影響を与える
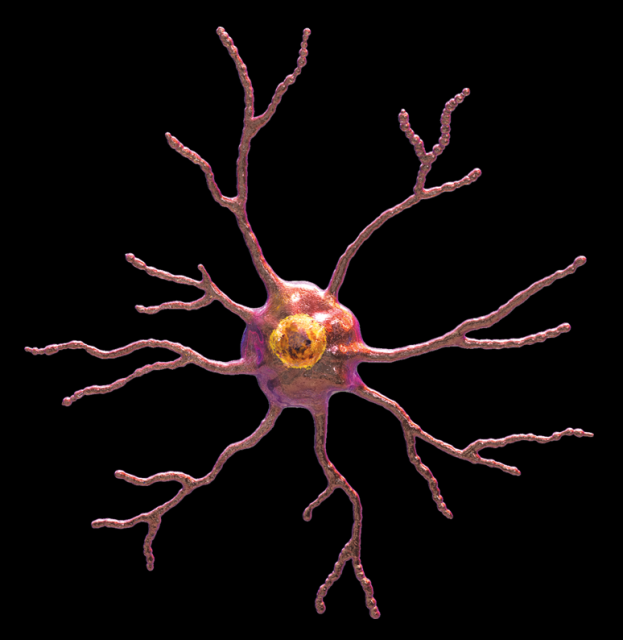 ワシントン大学医学部の科学者が率いる国際的な研究者チームは、遅発性および早発性双方のアルツハイマー病リスクに影響を及ぼす遺伝子ペアを特定した。 これまでアルツハイマー病に関与していたほとんどの遺伝子は、メッセージを伝達するニューロンに影響を及ぼし、脳の異なる領域が互いに通信できるようにするものだった。 しかし、新たに特定された遺伝子は、まったく異なる細胞集団、つまり脳の免疫細胞に影響を及ぼす。
2019年8月14日にScience Translational Medicineでオンラインで公開された研究成果は、アルツハイマー病の発症を遅らせるための新しい目標と戦略を科学者に提供する可能性がある。 この論文は「MS4A遺伝子クラスターは可溶性TREM2およびアルツハイマー病リスクの重要なモジュレーター(The MS4A Gene Cluster Is a Key Modulator of Soluble TREM2 and Alzheimer’s Disease Risk.)」と題されている。MS4A4AおよびTREM2として知られ特定された遺伝子は、脳の免疫細胞であるミクログリア(画像)で機能する。 遺伝子は、ミクログリア細胞が過剰量のアルツハイマー病タンパク質のベータアミロイドとタウを脳から除去するのに役立つと考えられているTREM2レベルを変え、アルツハイマー病のリスクに影響を与える。ワシントン大学医学部の精神医学教授兼神経ゲノム情報学グループのディレクターであるCarlos Cruchaga 博士は、「研究結果は新しい治療戦略を示唆している」と述べた。 「脳脊髄液中のTREM2タンパク質のレベルを上げるために何かできるなら、アルツハイマー病から保護したり、その発症を遅らせることができるかもしれない。」
この研究では、研究者は813人の高齢者の脳脊髄液の可溶性
ワシントン大学医学部の科学者が率いる国際的な研究者チームは、遅発性および早発性双方のアルツハイマー病リスクに影響を及ぼす遺伝子ペアを特定した。 これまでアルツハイマー病に関与していたほとんどの遺伝子は、メッセージを伝達するニューロンに影響を及ぼし、脳の異なる領域が互いに通信できるようにするものだった。 しかし、新たに特定された遺伝子は、まったく異なる細胞集団、つまり脳の免疫細胞に影響を及ぼす。
2019年8月14日にScience Translational Medicineでオンラインで公開された研究成果は、アルツハイマー病の発症を遅らせるための新しい目標と戦略を科学者に提供する可能性がある。 この論文は「MS4A遺伝子クラスターは可溶性TREM2およびアルツハイマー病リスクの重要なモジュレーター(The MS4A Gene Cluster Is a Key Modulator of Soluble TREM2 and Alzheimer’s Disease Risk.)」と題されている。MS4A4AおよびTREM2として知られ特定された遺伝子は、脳の免疫細胞であるミクログリア(画像)で機能する。 遺伝子は、ミクログリア細胞が過剰量のアルツハイマー病タンパク質のベータアミロイドとタウを脳から除去するのに役立つと考えられているTREM2レベルを変え、アルツハイマー病のリスクに影響を与える。ワシントン大学医学部の精神医学教授兼神経ゲノム情報学グループのディレクターであるCarlos Cruchaga 博士は、「研究結果は新しい治療戦略を示唆している」と述べた。 「脳脊髄液中のTREM2タンパク質のレベルを上げるために何かできるなら、アルツハイマー病から保護したり、その発症を遅らせることができるかもしれない。」
この研究では、研究者は813人の高齢者の脳脊髄液の可溶性
薬剤耐性病原体に効果がある自己滅菌ポリマーが開発される
 ノースカロライナ(NC)州立大学の研究者らは、弾性ポリマーが広域スペクトルの抗菌特性を有し、メチシリン耐性黄色ブドウ球菌(MRSA)を含むさまざまなウイルスや薬剤耐性菌を数分で殺すことができることを発見した。「このポリマーのいくつかの興味深い挙動を観察し、我々は抗菌材料を作製するためにその可能性をより深く調べることを決めた。 このポリマーは、病院や診療所などの臨床環境や、病原体の伝播が悲惨な結果をもたらす可能性がある高齢者向け施設で特に有用だ。」 ノースカロライナ州立大学の化学および生体分子工学の著名な教授であり、この研究に関する論文の共著者であるRich Spontak博士は語った。
このポリマーの抗菌特性は、スルホン酸基で化学修飾(または機能化)された一連の繰り返しユニットに水を引き付ける独自の分子構造に由来する。 「バクテリアがポリマーと接触すると、バクテリアの表面の水がポリマーのスルホン酸官能基と相互作用し、バクテリアを素早く殺す酸性溶液を生成する」と、論文の共著者で准教授であるReza Ghiladi博士は述べた。 「これらの酸性溶液は、ポリマー中のスルホン酸官能基の数を制御することにより、調整することができる。」この研究は、2019年7月17日にMaterials Horizonのオンラインで公開された。 このオープンアクセスの論文は、「薬剤耐性バクテリアを数分で殺す本質的に自己殺菌性の帯電マルチブロックポリマー(Inherently Self-Sterilizing Charged Multiblock Polymers That Kill Drug-Resistant Microbes in Minutes.)」と題されている。
研究者らは、MRSA、バンコマイシン耐性Enterococcus faecium、カルバペネム耐性Acinetobacter
ノースカロライナ(NC)州立大学の研究者らは、弾性ポリマーが広域スペクトルの抗菌特性を有し、メチシリン耐性黄色ブドウ球菌(MRSA)を含むさまざまなウイルスや薬剤耐性菌を数分で殺すことができることを発見した。「このポリマーのいくつかの興味深い挙動を観察し、我々は抗菌材料を作製するためにその可能性をより深く調べることを決めた。 このポリマーは、病院や診療所などの臨床環境や、病原体の伝播が悲惨な結果をもたらす可能性がある高齢者向け施設で特に有用だ。」 ノースカロライナ州立大学の化学および生体分子工学の著名な教授であり、この研究に関する論文の共著者であるRich Spontak博士は語った。
このポリマーの抗菌特性は、スルホン酸基で化学修飾(または機能化)された一連の繰り返しユニットに水を引き付ける独自の分子構造に由来する。 「バクテリアがポリマーと接触すると、バクテリアの表面の水がポリマーのスルホン酸官能基と相互作用し、バクテリアを素早く殺す酸性溶液を生成する」と、論文の共著者で准教授であるReza Ghiladi博士は述べた。 「これらの酸性溶液は、ポリマー中のスルホン酸官能基の数を制御することにより、調整することができる。」この研究は、2019年7月17日にMaterials Horizonのオンラインで公開された。 このオープンアクセスの論文は、「薬剤耐性バクテリアを数分で殺す本質的に自己殺菌性の帯電マルチブロックポリマー(Inherently Self-Sterilizing Charged Multiblock Polymers That Kill Drug-Resistant Microbes in Minutes.)」と題されている。
研究者らは、MRSA、バンコマイシン耐性Enterococcus faecium、カルバペネム耐性Acinetobacter
腸内細菌(クロストリジウム)がマウスの肥満を抑制。人の肥満防止への手掛りとなるか?
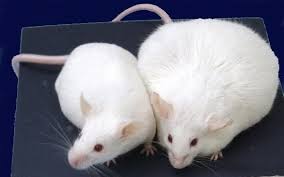 ユニバーシティ・オブ・ユタ・ヘルスの研究者は、マウスが肥満になるのを防ぐ腸の特定のクラスの細菌を特定し、同じ微生物が同様に人の体重を制御する可能性があることを示唆した。クロストリジウムと呼ばれるこの有益なバクテリアは、腸に生息する何兆ものバクテリアや他の微生物の総称であるマイクロバイオームの一部である。
Scienceの2019年7月26日号で発表されたこの研究では、健康なマウスには20から30のバクテリアのクラスであるクロストリジウムが豊富にあることを示しているが、免疫系が損なわれたマウスは加齢とともに腸からこれらの微生物を失うという。健康的な食事を与えられたとしても、免疫系が損なわれたマウスは必然的に肥満になるが、この種の微生物を戻すことでマウスはスリムになった。この論文のタイトルは「T細胞が媒介する微生物叢の調節が肥満を防ぐ(T Cell-Mediated Regulation of the Microbiota Protects Against Obesity.)」と題されている。ユニバーシティ・オブ・ユタ・ヘルスの病理学の准教授であるJune Round博士は、研究助教授W. Zac Stephens博士および、当時大学院生だったCharisse Petersen博士と共に研究を率いた。「この痩身効果の原因となる最低限の細菌が見つかった。この生物が何をしていて、治療に価値があるかどうかを理解できる可能性がある」とRound博士は言う。この研究結果はすでに進むべき方向を指し示している。
Petersen博士と同僚は、クロストリジウムが腸の脂肪吸収能力をブロックすることで体重増加を防ぐことを発見した。 腸内に生息するバクテリアがクロストリジウムだけになるように実験的に処理されたマウスは、微生物叢をまったく持たないマウスよりも脂肪が少なく、脂肪が少なかった。また、体
ユニバーシティ・オブ・ユタ・ヘルスの研究者は、マウスが肥満になるのを防ぐ腸の特定のクラスの細菌を特定し、同じ微生物が同様に人の体重を制御する可能性があることを示唆した。クロストリジウムと呼ばれるこの有益なバクテリアは、腸に生息する何兆ものバクテリアや他の微生物の総称であるマイクロバイオームの一部である。
Scienceの2019年7月26日号で発表されたこの研究では、健康なマウスには20から30のバクテリアのクラスであるクロストリジウムが豊富にあることを示しているが、免疫系が損なわれたマウスは加齢とともに腸からこれらの微生物を失うという。健康的な食事を与えられたとしても、免疫系が損なわれたマウスは必然的に肥満になるが、この種の微生物を戻すことでマウスはスリムになった。この論文のタイトルは「T細胞が媒介する微生物叢の調節が肥満を防ぐ(T Cell-Mediated Regulation of the Microbiota Protects Against Obesity.)」と題されている。ユニバーシティ・オブ・ユタ・ヘルスの病理学の准教授であるJune Round博士は、研究助教授W. Zac Stephens博士および、当時大学院生だったCharisse Petersen博士と共に研究を率いた。「この痩身効果の原因となる最低限の細菌が見つかった。この生物が何をしていて、治療に価値があるかどうかを理解できる可能性がある」とRound博士は言う。この研究結果はすでに進むべき方向を指し示している。
Petersen博士と同僚は、クロストリジウムが腸の脂肪吸収能力をブロックすることで体重増加を防ぐことを発見した。 腸内に生息するバクテリアがクロストリジウムだけになるように実験的に処理されたマウスは、微生物叢をまったく持たないマウスよりも脂肪が少なく、脂肪が少なかった。また、体
RNA編集機能を拡張した新CRISPR技術(RESCUE)でAPOE4 アルツハイマーリスクバリアントをAPOE2非リスクバリアントに変換できることを実証。
 CRISPRを基盤としたツールは、疾患関連遺伝子変異を標的にする能力に革命をもたらした。 CRISPRテクノロジーは、Cas9およびCas12酵素でDNAをターゲットにすることや、Cas13酵素でRNAをターゲットにすることなど、遺伝子とその発現を操作するツールファミリーとして成長している。 このラインナップは、突然変異に取り組むためのさまざまな戦略を提供する。
比較的一過性の疾患関連RNA変異を標的にすれば、ゲノムに永続的な変更を加えることを避けることができる。 さらに、ニューロンなどの一部の細胞タイプは、CRISPR/Cas9を介した編集が難しく、脳に影響を与える壊滅的な疾患を治療するための新戦略が必要だ。マクガヴァン脳研究所の研究者そしてハーバード大学とMITが共同で運営するブロード研究所のコアメンバーであるFeng Zhang博士(写真)と彼のチームは、RESCUE(RNA Editing for Specific C to U Exchange)と呼ばれる戦略を開発した。 Scienceの2019年7月26日号に掲載されたこの論文のタイトルは、「プログラム可能な単一塩基RNA編集のためのシトシンデアミナーゼ(A Cytosine Deaminase for Programmable Single-Base RNA Editing.)」と題されている。筆頭共著者であるOmar Abudayyeh 博士とJonathan Gootenberg 博士(現在、二人ともマクガヴァンのフェロー)を含むZhang 博士と彼のチームは、非活性化されたCas13を使用してRESCUEをRNA転写産物の標的シトシン塩基に導き、 望ましくないシトシンをウリジンに変換する新規の進化したプログラム可能な酵素により、RNAの指示を変更した。RESCUEは、Zhang博士のチームによっ
CRISPRを基盤としたツールは、疾患関連遺伝子変異を標的にする能力に革命をもたらした。 CRISPRテクノロジーは、Cas9およびCas12酵素でDNAをターゲットにすることや、Cas13酵素でRNAをターゲットにすることなど、遺伝子とその発現を操作するツールファミリーとして成長している。 このラインナップは、突然変異に取り組むためのさまざまな戦略を提供する。
比較的一過性の疾患関連RNA変異を標的にすれば、ゲノムに永続的な変更を加えることを避けることができる。 さらに、ニューロンなどの一部の細胞タイプは、CRISPR/Cas9を介した編集が難しく、脳に影響を与える壊滅的な疾患を治療するための新戦略が必要だ。マクガヴァン脳研究所の研究者そしてハーバード大学とMITが共同で運営するブロード研究所のコアメンバーであるFeng Zhang博士(写真)と彼のチームは、RESCUE(RNA Editing for Specific C to U Exchange)と呼ばれる戦略を開発した。 Scienceの2019年7月26日号に掲載されたこの論文のタイトルは、「プログラム可能な単一塩基RNA編集のためのシトシンデアミナーゼ(A Cytosine Deaminase for Programmable Single-Base RNA Editing.)」と題されている。筆頭共著者であるOmar Abudayyeh 博士とJonathan Gootenberg 博士(現在、二人ともマクガヴァンのフェロー)を含むZhang 博士と彼のチームは、非活性化されたCas13を使用してRESCUEをRNA転写産物の標的シトシン塩基に導き、 望ましくないシトシンをウリジンに変換する新規の進化したプログラム可能な酵素により、RNAの指示を変更した。RESCUEは、Zhang博士のチームによっ
細胞老化について新発見。老化防止薬の開発へ一歩を踏み出す。
 南カリフォルニア大学にあるUSC Viterbi School of Engineeringの新研究は、老化プロセスがどのように機能するか理解するための鍵となるかもしれない。 研究結果は高齢の人の健康を大幅に改善することができるより良い癌治療と革命的な新薬への道を開くポテンシャルを秘めている。化学工学および材料科学の助教授であるNick Graham博士のチーム、生物科学と生物医学工学の教授であるScott Fraser博士、そしてZohrab A. Kaprielianの工学博士であるPin Wang博士は、2019年5月28日にJournal of Biological Chemistryに「ヌクレオチド合成の阻害はヒト乳腺上皮細胞の複製老化を促進する(Inhibition of Nucleotide Synthesis Promotes Replicative Senescence of Human Mammary Epithelial Cells.)」と題された論文を発表した。
「若返りの泉を飲むためには、若返りの泉がどこにあるのかを理解し、若返りの泉が何をしているのか理解しなければならない」とGraham博士は述べた。 「我々は反対のこと、つまり細胞が老化する理由を研究しているので、老化を改善するための治療法を設計することができるかもしれない。」これを達成するために、Graham研究室の大学院生であるAlireza Delfarah氏は、老化、つまり細胞が恒久的に新しい細胞を作り出すのをやめる自然の過程に注目した。 このプロセスは、加齢による関節炎、骨粗鬆症、心臓病などの病気の主な原因の1つだ。「老化細胞は、自己再生や分裂の可能性が無限にある幹細胞とは実質的に反対の細胞だ。」とDelfarah氏は述べた。 「老化細胞は二度と分裂することはあり得ない。それは
南カリフォルニア大学にあるUSC Viterbi School of Engineeringの新研究は、老化プロセスがどのように機能するか理解するための鍵となるかもしれない。 研究結果は高齢の人の健康を大幅に改善することができるより良い癌治療と革命的な新薬への道を開くポテンシャルを秘めている。化学工学および材料科学の助教授であるNick Graham博士のチーム、生物科学と生物医学工学の教授であるScott Fraser博士、そしてZohrab A. Kaprielianの工学博士であるPin Wang博士は、2019年5月28日にJournal of Biological Chemistryに「ヌクレオチド合成の阻害はヒト乳腺上皮細胞の複製老化を促進する(Inhibition of Nucleotide Synthesis Promotes Replicative Senescence of Human Mammary Epithelial Cells.)」と題された論文を発表した。
「若返りの泉を飲むためには、若返りの泉がどこにあるのかを理解し、若返りの泉が何をしているのか理解しなければならない」とGraham博士は述べた。 「我々は反対のこと、つまり細胞が老化する理由を研究しているので、老化を改善するための治療法を設計することができるかもしれない。」これを達成するために、Graham研究室の大学院生であるAlireza Delfarah氏は、老化、つまり細胞が恒久的に新しい細胞を作り出すのをやめる自然の過程に注目した。 このプロセスは、加齢による関節炎、骨粗鬆症、心臓病などの病気の主な原因の1つだ。「老化細胞は、自己再生や分裂の可能性が無限にある幹細胞とは実質的に反対の細胞だ。」とDelfarah氏は述べた。 「老化細胞は二度と分裂することはあり得ない。それは
新研究でパクチーの抗けいれん分子メカニズムが明らかに
 コリアンダー(パクチー)を含むハーブは、民間療法の抗けいれん薬として長い歴史がある。 今までハーブがどのように働いたか根本的なメカニズムの多くは未知のままだった。 新しい研究でカリフォルニア大学アーバインスクールオブメディカル校の研究者らは、コリアンダーが癲癇や他の病気によく見られる特定の発作を効果的に遅らせることを可能にする分子作用を明らかにした。
2019年7月16日にThe FASEB Journalにオンラインで発表されたこの研究は、非常に強力なKCNQチャンネル活性化剤としてのコリアンダー(Coriandrum sativum)の分子作用を説明している。 この論文は「コリアンダーリーフは強力なカリウムチャンネル活性化抗けいれん薬である(Cilantro Leaf Harbors A Potent Potassium Channel–Activating Anticonvulsant.)」と題されている。カリフォルニア大学アーバインスクールオブメディカル校の生理学生物生物学博士でこの調査の主任研究員であるGeoff Abbott博士は、次のように述べている。 「具体的には、ドデセナールと呼ばれるコリアンダーの1つの成分がカリウムチャネルの特定の部分に結合してそれらを開き、細胞の興奮性を低下させることが解った。この発見は、抗けいれん薬としてのコリアンダーのより効果的な使用、またはより安全でより有効な抗けいれん薬を開発するためのドデセナールの改良につながる可能性があり重要だ。」
研究者らは、コリアンダーの葉の代謝産物をスクリーニングし、その1つ - 長鎖脂肪アルデヒド(E)-2-ドデセナール - が、脳内の電気活動の調節に関与している支配的なニューロンアイソフォームと心臓アイソフォームを含む複数のカリウムチャネルを活性化することを明らかにした。この代謝産物はコリアン
コリアンダー(パクチー)を含むハーブは、民間療法の抗けいれん薬として長い歴史がある。 今までハーブがどのように働いたか根本的なメカニズムの多くは未知のままだった。 新しい研究でカリフォルニア大学アーバインスクールオブメディカル校の研究者らは、コリアンダーが癲癇や他の病気によく見られる特定の発作を効果的に遅らせることを可能にする分子作用を明らかにした。
2019年7月16日にThe FASEB Journalにオンラインで発表されたこの研究は、非常に強力なKCNQチャンネル活性化剤としてのコリアンダー(Coriandrum sativum)の分子作用を説明している。 この論文は「コリアンダーリーフは強力なカリウムチャンネル活性化抗けいれん薬である(Cilantro Leaf Harbors A Potent Potassium Channel–Activating Anticonvulsant.)」と題されている。カリフォルニア大学アーバインスクールオブメディカル校の生理学生物生物学博士でこの調査の主任研究員であるGeoff Abbott博士は、次のように述べている。 「具体的には、ドデセナールと呼ばれるコリアンダーの1つの成分がカリウムチャネルの特定の部分に結合してそれらを開き、細胞の興奮性を低下させることが解った。この発見は、抗けいれん薬としてのコリアンダーのより効果的な使用、またはより安全でより有効な抗けいれん薬を開発するためのドデセナールの改良につながる可能性があり重要だ。」
研究者らは、コリアンダーの葉の代謝産物をスクリーニングし、その1つ - 長鎖脂肪アルデヒド(E)-2-ドデセナール - が、脳内の電気活動の調節に関与している支配的なニューロンアイソフォームと心臓アイソフォームを含む複数のカリウムチャネルを活性化することを明らかにした。この代謝産物はコリアン
NIH、サハラ以南のアフリカ地域における2型糖尿病のゲノム研究成果を発表。糖尿病とZRANB3遺伝子の重要な関連性を示した。
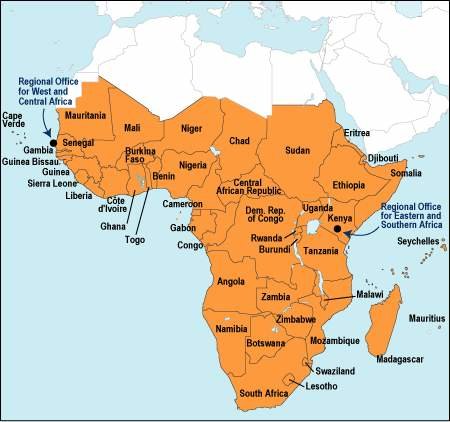 NIHの研究者らは、サハラ以南のアフリカ人における2型糖尿病の過去最大のゲノム研究を報告した。この研究は、ナイジェリア、ガーナ、およびケニアからの5,000人以上の個人データに基づく。 研究者らは、既知のゲノム変異体を確認し、サハラ以南のアフリカの集団における疾患感受性に影響を与える可能性がある新規遺伝子ZRANB3を同定した。 この遺伝子は他の集団における2型糖尿病の発症にも影響を及ぼし、さらなる研究成果が期待される。
ネイチャーコミュニケーションズに2019年7月19日オンラインで発表されたこの研究では、研究者は、アフリカ大陸で行われた単一で最大の糖尿病ゲノム協会研究であるアフリカアメリカ糖尿病研究を通して参加者に利用できるゲノムデータを分析した。 5,231人から入手可能な情報を使用して、研究者は多くのゲノム変異体が2型糖尿病と有意に関連していることを発見した。このオープンアクセスの論文は、「ZRANB3は、ベータ細胞量とインスリン反応に関連するアフリカ特有の2型糖尿病遺伝子座(ZRANB3 Is an African-Specific Type 2 Diabetes Locus Associated with Beta-Cell Mass and Insulin Response.)」と題されている。この調査結果は、他の研究がほとんどヨーロッパの祖先集団の2型糖尿病にすでに関与しているという多くのバリアントの結果を再現している。 この研究は、国立ヒトゲノム研究所(NHGRI)、国立糖尿病消化器病研究所、および国立衛生研究所の資金によって実施された。この論文の共著者であり、NHGRI Medical Genomics and Metabolic Genetics Branchの上席研究員であるFrancis S. Collins博士は、次のように述べている。
「ア
NIHの研究者らは、サハラ以南のアフリカ人における2型糖尿病の過去最大のゲノム研究を報告した。この研究は、ナイジェリア、ガーナ、およびケニアからの5,000人以上の個人データに基づく。 研究者らは、既知のゲノム変異体を確認し、サハラ以南のアフリカの集団における疾患感受性に影響を与える可能性がある新規遺伝子ZRANB3を同定した。 この遺伝子は他の集団における2型糖尿病の発症にも影響を及ぼし、さらなる研究成果が期待される。
ネイチャーコミュニケーションズに2019年7月19日オンラインで発表されたこの研究では、研究者は、アフリカ大陸で行われた単一で最大の糖尿病ゲノム協会研究であるアフリカアメリカ糖尿病研究を通して参加者に利用できるゲノムデータを分析した。 5,231人から入手可能な情報を使用して、研究者は多くのゲノム変異体が2型糖尿病と有意に関連していることを発見した。このオープンアクセスの論文は、「ZRANB3は、ベータ細胞量とインスリン反応に関連するアフリカ特有の2型糖尿病遺伝子座(ZRANB3 Is an African-Specific Type 2 Diabetes Locus Associated with Beta-Cell Mass and Insulin Response.)」と題されている。この調査結果は、他の研究がほとんどヨーロッパの祖先集団の2型糖尿病にすでに関与しているという多くのバリアントの結果を再現している。 この研究は、国立ヒトゲノム研究所(NHGRI)、国立糖尿病消化器病研究所、および国立衛生研究所の資金によって実施された。この論文の共著者であり、NHGRI Medical Genomics and Metabolic Genetics Branchの上席研究員であるFrancis S. Collins博士は、次のように述べている。
「ア
細菌のホーミング能力で幹細胞が心臓組織に帰ることを可能に。心臓病に苦しんでいる人々に大きな可能性を提供。
 世界で初めて、科学者たちは幹細胞を心臓組織に向かわせる新しい方法を発見した。 英国のブリストル大学の研究者によって先導され、最近発表されたこの研究結果は、英国で全死亡の4分の1以上を引き起こす心血管疾患の治療の根本的な改善につながるという。
この英国王立化学協会のオープンアクセスジャーナルに掲載された論文は「幹細胞を心筋に向ける改変人工膜結合タンパク質(Designer Artificial Membrane Binding Proteins to Direct Stem Cells to the Myocardium.)」と題されている。今日まで、患者またはドナーから採取して増殖し、患者の損傷した心臓組織を再生するために注入した幹細胞が有望な結果を生み出している。 しかし、これらの次世代細胞療法は実用化されつつあるが、幹細胞の分布に関連する重大な課題が残っている。循環細胞が接触する様々な組織シンクと心臓内の高い血流の組み合わせは、幹細胞の大部分が肺と脾臓に行き着くことを意味している。現在、ブリストル大学の細胞分子医学部の研究者らは、幹細胞が心臓組織の「ホーム」になるように、幹細胞を特殊なタンパク質で修飾することによってこれを克服する方法を見つけた。研究の筆頭著者であるAdam Perriman博士は、UKRI未来リーダーズフェローで細胞治療技術会社CytoSeek( https://www.cytoseek.uk/ )の創設者であり、次のように説明している。
心臓発作した患者を治療しようとしているのであれば、細胞が目的の場所に移動することはめったにない。我々の目的は細胞の膜を作り直すためにこの技術を使用することだ。注射すると、細胞は我々が選択した特定の組織に帰るだろう。」「我々は、いくつかの細菌細胞が病気になった組織を発見し帰ることを可能にする特性を持っていることを知
世界で初めて、科学者たちは幹細胞を心臓組織に向かわせる新しい方法を発見した。 英国のブリストル大学の研究者によって先導され、最近発表されたこの研究結果は、英国で全死亡の4分の1以上を引き起こす心血管疾患の治療の根本的な改善につながるという。
この英国王立化学協会のオープンアクセスジャーナルに掲載された論文は「幹細胞を心筋に向ける改変人工膜結合タンパク質(Designer Artificial Membrane Binding Proteins to Direct Stem Cells to the Myocardium.)」と題されている。今日まで、患者またはドナーから採取して増殖し、患者の損傷した心臓組織を再生するために注入した幹細胞が有望な結果を生み出している。 しかし、これらの次世代細胞療法は実用化されつつあるが、幹細胞の分布に関連する重大な課題が残っている。循環細胞が接触する様々な組織シンクと心臓内の高い血流の組み合わせは、幹細胞の大部分が肺と脾臓に行き着くことを意味している。現在、ブリストル大学の細胞分子医学部の研究者らは、幹細胞が心臓組織の「ホーム」になるように、幹細胞を特殊なタンパク質で修飾することによってこれを克服する方法を見つけた。研究の筆頭著者であるAdam Perriman博士は、UKRI未来リーダーズフェローで細胞治療技術会社CytoSeek( https://www.cytoseek.uk/ )の創設者であり、次のように説明している。
心臓発作した患者を治療しようとしているのであれば、細胞が目的の場所に移動することはめったにない。我々の目的は細胞の膜を作り直すためにこの技術を使用することだ。注射すると、細胞は我々が選択した特定の組織に帰るだろう。」「我々は、いくつかの細菌細胞が病気になった組織を発見し帰ることを可能にする特性を持っていることを知
糖尿病、心臓病など代謝障害の新しい治療法としてセラミドの役割が浮き彫りに
 たった2つの水素原子の位置をずらすだけの小さな化学変化が健康なマウスとインスリン抵抗性および脂肪肝を持つマウスとの違いを引き起こし、糖尿病と心臓病の主な危険因子になることを突き止めた。この変化を加えることで、高脂肪食を与えられたマウスにおけるこれらの症状の発症を防ぎ、肥満マウスにおける前糖尿病を逆転させた。 科学者たちは、dihydroceramide desaturase 1(DES1)と呼ばれる酵素を失活させることで代謝性疾患の流れを変えた。酵素がセラミドと呼ばれる脂肪脂質から水素を除去するのを止めれば、体内のセラミドの総量を減らす効果がある。
この発見は、代謝健康におけるセラミドの役割を浮き彫りにし、前糖尿病、糖尿病、心臓病など何億人ものアメリカ人の健康に影響を与える代謝障害の新しい治療法を開発するための「新薬の開発につながるような」ターゲットであるDES1に光を当てたものだ。ユタ大学ヘルスアンドメルク研究所の科学者らは、2019年7月4日にサイエンス誌のオンライン版で発表したこの研究を主導した。この論文のタイトルは「セラミド二重結合を標的にしてインスリン抵抗性と肝脂肪症を改善する(Targeting a Ceramide Double Bond Improves Insulin Resistance and Hepatic Steatosis.)」と題されている。ユタ大学の栄養および統合生理学会長のScott Summers博士(写真右)は、次のように述べている。「非常に効果的で潜在的な治療戦略を特定し、複雑な生物系が化学の微妙な変化によってどのように影響を受けるかに光を当てた。」 Summers博士は、以前からMerck Research LaboratoriesのDavid Kelley医師と共同研究を行なっていた。「我々の研究は、セラミドが代謝の健康に
たった2つの水素原子の位置をずらすだけの小さな化学変化が健康なマウスとインスリン抵抗性および脂肪肝を持つマウスとの違いを引き起こし、糖尿病と心臓病の主な危険因子になることを突き止めた。この変化を加えることで、高脂肪食を与えられたマウスにおけるこれらの症状の発症を防ぎ、肥満マウスにおける前糖尿病を逆転させた。 科学者たちは、dihydroceramide desaturase 1(DES1)と呼ばれる酵素を失活させることで代謝性疾患の流れを変えた。酵素がセラミドと呼ばれる脂肪脂質から水素を除去するのを止めれば、体内のセラミドの総量を減らす効果がある。
この発見は、代謝健康におけるセラミドの役割を浮き彫りにし、前糖尿病、糖尿病、心臓病など何億人ものアメリカ人の健康に影響を与える代謝障害の新しい治療法を開発するための「新薬の開発につながるような」ターゲットであるDES1に光を当てたものだ。ユタ大学ヘルスアンドメルク研究所の科学者らは、2019年7月4日にサイエンス誌のオンライン版で発表したこの研究を主導した。この論文のタイトルは「セラミド二重結合を標的にしてインスリン抵抗性と肝脂肪症を改善する(Targeting a Ceramide Double Bond Improves Insulin Resistance and Hepatic Steatosis.)」と題されている。ユタ大学の栄養および統合生理学会長のScott Summers博士(写真右)は、次のように述べている。「非常に効果的で潜在的な治療戦略を特定し、複雑な生物系が化学の微妙な変化によってどのように影響を受けるかに光を当てた。」 Summers博士は、以前からMerck Research LaboratoriesのDavid Kelley医師と共同研究を行なっていた。「我々の研究は、セラミドが代謝の健康に
母親の血中無細胞胎児DNAの次世代シーケンシングにより胎児鎌状赤血球症の非侵襲的出生前診断に一歩近づく
 鎌状赤血球症(Sickle cell disease:SCD)は、両方の親がヘモグロビン遺伝子の突然変異の保因者である場合に遺伝する貧血の一種だ。 現在、この疾患は、侵襲的検査を実施しなければ妊娠中に診断することができないが、流産リスクを伴うので、両親によって診断を拒否されることがある。
現在、英国のバーミンガムにあるNonacus Ltd.と協力して、英国のロンドンにあるGuy's and St Thomas' NHS Foundation Trust and Viapath Analyticsの研究者らは、この疾患の非侵襲的出生前診断を開発した。 この発表は、2019年6月16日に欧州人類遺伝学会(ESHG)の年次総会で行われた。この発表は、「無細胞DNAの次世代シークエンシングによる鎌状赤血球症の非侵襲的出生前診断(Non-Invasive Prenatal Diagnosis of Sickle Cell Disease by Next-Generation Sequencing of Cell-Free DNA.)」と題されている。Guy's and St Thomasの研究員であるJulia van Campen博士は、次のように説明している。「無細胞胎児DNA(母体血流中を循環する胎児由来のDNA)を使用して鎌状赤血球症の検査方法を開発した。 無細胞胎児DNA検査はすでにいくつかの疾患で利用可能だが、英国で最も一般的に要求されている出生前検査の1つであるにもかかわらず、技術的困難により鎌状赤血球症の検査法の開発が妨げられている。」鎌状赤血球症の赤ちゃんを産むリスクがあるカップルでは、各パートナーがヘモグロビン遺伝子の変異を保有している。つまり、どの胎児でも四分の1の確率で両方の変異を受け継ぐため、鎌状赤血球症の影響を受ける。 このように受け継がれた状態の非侵
鎌状赤血球症(Sickle cell disease:SCD)は、両方の親がヘモグロビン遺伝子の突然変異の保因者である場合に遺伝する貧血の一種だ。 現在、この疾患は、侵襲的検査を実施しなければ妊娠中に診断することができないが、流産リスクを伴うので、両親によって診断を拒否されることがある。
現在、英国のバーミンガムにあるNonacus Ltd.と協力して、英国のロンドンにあるGuy's and St Thomas' NHS Foundation Trust and Viapath Analyticsの研究者らは、この疾患の非侵襲的出生前診断を開発した。 この発表は、2019年6月16日に欧州人類遺伝学会(ESHG)の年次総会で行われた。この発表は、「無細胞DNAの次世代シークエンシングによる鎌状赤血球症の非侵襲的出生前診断(Non-Invasive Prenatal Diagnosis of Sickle Cell Disease by Next-Generation Sequencing of Cell-Free DNA.)」と題されている。Guy's and St Thomasの研究員であるJulia van Campen博士は、次のように説明している。「無細胞胎児DNA(母体血流中を循環する胎児由来のDNA)を使用して鎌状赤血球症の検査方法を開発した。 無細胞胎児DNA検査はすでにいくつかの疾患で利用可能だが、英国で最も一般的に要求されている出生前検査の1つであるにもかかわらず、技術的困難により鎌状赤血球症の検査法の開発が妨げられている。」鎌状赤血球症の赤ちゃんを産むリスクがあるカップルでは、各パートナーがヘモグロビン遺伝子の変異を保有している。つまり、どの胎児でも四分の1の確率で両方の変異を受け継ぐため、鎌状赤血球症の影響を受ける。 このように受け継がれた状態の非侵
胎盤を介して母親の抗体が胎児へ移動するメカニズムを調査。新生児を保護するためのより強力なワクチンの開発へ。
 世界中で感染症を減らす上で最も成功した介入の1つであるワクチン接種だが、新生児を保護する上では依然として有効性が限られている。 マサチューセッツ総合病院(MGH)、MITおよびハーバード大学によるラゴン研究所の研究は、妊娠中のワクチン誘発免疫がどのようにして胎児に移るのかを決定した。これはより効果的な母体ワクチンの開発に影響を与えるだろう。
Cellの6月27日号に掲載されたこの論文のタイトルは「Fcグリカンによる胎盤抗体導入の媒介調節(Fc Glycan-Mediated Regulation of Placental Antibody Transfer)」と題されている。「新生児は、子供自身の成長と同じく、自ら有益・有害な微生物の両方に対処することを学ぶ必要がある真新しい免疫システムと一緒にこの世界に到着する。」と、Cell論文の共著者でラゴン研究所およびマサチューセッツ総合病院(MGH)医学部のGalit Alter博士(写真)は語った。「新生児の免疫システムが敵と味方を区別することを学ぶのを助けるために、母親は胎盤を介して抗体を胎児に移す。胎盤がこの絶対的に不可欠な機能を果たす規則は知られていなかったが、これが解明されれば新生児を保護するためのより強力なワクチンとなるだろう。」はしかなど一部の病気に対する母親の抗体は母親から乳児に移すことができ、子供が個々のワクチン接種に十分な年齢になるまである程度の保護を提供するが、ポリオのような他の深刻な病気に対する抗体はあまり効率的に移転されない。抗体が母親から子供へと伝達されるメカニズムを調査するために、Alter博士と彼女のチーム(前MGH産科婦人科、現在はWeill Cornell Medicineの産婦人科長である共著者のLaura Riley医師を含む)はシステム血清学と呼ばれる新しいツールを使用して、母親の血液サ
世界中で感染症を減らす上で最も成功した介入の1つであるワクチン接種だが、新生児を保護する上では依然として有効性が限られている。 マサチューセッツ総合病院(MGH)、MITおよびハーバード大学によるラゴン研究所の研究は、妊娠中のワクチン誘発免疫がどのようにして胎児に移るのかを決定した。これはより効果的な母体ワクチンの開発に影響を与えるだろう。
Cellの6月27日号に掲載されたこの論文のタイトルは「Fcグリカンによる胎盤抗体導入の媒介調節(Fc Glycan-Mediated Regulation of Placental Antibody Transfer)」と題されている。「新生児は、子供自身の成長と同じく、自ら有益・有害な微生物の両方に対処することを学ぶ必要がある真新しい免疫システムと一緒にこの世界に到着する。」と、Cell論文の共著者でラゴン研究所およびマサチューセッツ総合病院(MGH)医学部のGalit Alter博士(写真)は語った。「新生児の免疫システムが敵と味方を区別することを学ぶのを助けるために、母親は胎盤を介して抗体を胎児に移す。胎盤がこの絶対的に不可欠な機能を果たす規則は知られていなかったが、これが解明されれば新生児を保護するためのより強力なワクチンとなるだろう。」はしかなど一部の病気に対する母親の抗体は母親から乳児に移すことができ、子供が個々のワクチン接種に十分な年齢になるまである程度の保護を提供するが、ポリオのような他の深刻な病気に対する抗体はあまり効率的に移転されない。抗体が母親から子供へと伝達されるメカニズムを調査するために、Alter博士と彼女のチーム(前MGH産科婦人科、現在はWeill Cornell Medicineの産婦人科長である共著者のLaura Riley医師を含む)はシステム血清学と呼ばれる新しいツールを使用して、母親の血液サ
多剤併用治療法(FOLFIRINOX)により、より多くの膵臓癌が切除可能になり、切除可能なボーダーラインにある腫瘍の患者の生存期間がほぼ2倍に。
 アメリカがん協会の予測が正確であれば、今年は、乳癌、脳腫瘍、卵巣癌、または前立腺癌よりも、膵臓癌でより多くの人々が死亡するだろう。 膵臓癌が非常に致命的である1つの理由は、伝統的な化学療法に対する耐性である。しかし、ウェストバージニア大学医学部の外科腫瘍専門医Brian Boone医師は、FOLFIRINOX(フォルフィリノックス:癌治療薬の新しい組み合わせ)により膵臓癌が安全に除去するには血管に近すぎる「切除可能なボーダーライン」にある患者のアウトカムを改善できるかどうかを調査している。
医学部の外科学科の助教授Boone博士は、次のように述べている。「膵臓腫瘍がどのようにして座るか、それらは無くては生きていけない重要な血管に非常に接近している。 それが化学療法が作用し始めるところだ。我々は腫瘍を静脈から縮小させ、切除可能なボーダーラインから切除可能なものへ、あるいは手術で除去可能なものに変えようとしている。」最近の24件の研究のメタアナリシスにおいて、Boone博士と彼の研究チームは、医師がFOLFIRINOXで治療した切除可能なボーダーラインの膵臓癌の313例を検討した。 彼らは患者の全生存率を分析した。また、どのくらいの頻度で腫瘍が外科的に切除されるのに十分に縮小したかを評価した。 チームは、FOLFIRINOXが平均して患者の寿命を延ばし、より多くの場合に手術を可能にしたことを発見した。彼らの調査結果は、Journal of the National Cancer Institute(JNCI)の2019年5月14日にオンラインで発表された。 この論文のタイトルは「切除可能なボーダーラインの膵臓癌患者におけるネオアジュバントFOLFIRINOX:系統的レビューと患者レベルのメタアナリシス(Neoadjuvant FOLFIRINOX in Patients
アメリカがん協会の予測が正確であれば、今年は、乳癌、脳腫瘍、卵巣癌、または前立腺癌よりも、膵臓癌でより多くの人々が死亡するだろう。 膵臓癌が非常に致命的である1つの理由は、伝統的な化学療法に対する耐性である。しかし、ウェストバージニア大学医学部の外科腫瘍専門医Brian Boone医師は、FOLFIRINOX(フォルフィリノックス:癌治療薬の新しい組み合わせ)により膵臓癌が安全に除去するには血管に近すぎる「切除可能なボーダーライン」にある患者のアウトカムを改善できるかどうかを調査している。
医学部の外科学科の助教授Boone博士は、次のように述べている。「膵臓腫瘍がどのようにして座るか、それらは無くては生きていけない重要な血管に非常に接近している。 それが化学療法が作用し始めるところだ。我々は腫瘍を静脈から縮小させ、切除可能なボーダーラインから切除可能なものへ、あるいは手術で除去可能なものに変えようとしている。」最近の24件の研究のメタアナリシスにおいて、Boone博士と彼の研究チームは、医師がFOLFIRINOXで治療した切除可能なボーダーラインの膵臓癌の313例を検討した。 彼らは患者の全生存率を分析した。また、どのくらいの頻度で腫瘍が外科的に切除されるのに十分に縮小したかを評価した。 チームは、FOLFIRINOXが平均して患者の寿命を延ばし、より多くの場合に手術を可能にしたことを発見した。彼らの調査結果は、Journal of the National Cancer Institute(JNCI)の2019年5月14日にオンラインで発表された。 この論文のタイトルは「切除可能なボーダーラインの膵臓癌患者におけるネオアジュバントFOLFIRINOX:系統的レビューと患者レベルのメタアナリシス(Neoadjuvant FOLFIRINOX in Patients
既存のニキビ薬(ミノサイクリン)が動脈硬化の予防・治療に非常に有効であることが判明
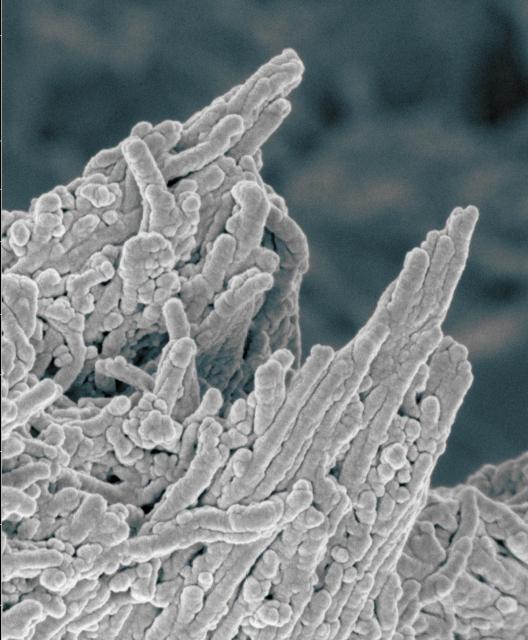 英国の研究チームは動脈硬化の背後にあるメカニズムを動物実験で確認し、通常ニキビの治療に使用される一般的な薬が動脈硬化の効果的な治療法になり得ることを示した。ケンブリッジ大学とキングスカレッジロンドン校が率いるチームは、かつてDNAを修復する目的で細胞内にのみ存在すると考えられていた分子も、認知症・心臓病・高血圧に関連する動脈硬化の原因であることを見出した。骨のようなカルシウム沈着物の蓄積、動脈の硬化および臓器および組織への血流の制限によって引き起こされる動脈硬化に対する治療法は現在ない。
ブリティッシュハート財団からの助成金により、研究者はPoly(ADP-Ribose)または通常DNA修復と関連する分子のPARも動脈の石灰化を推進することを発見した。さらに、慢性腎臓病のラットを使い、ニキビの治療によく使われる抗生物質であるミノサイクリンが、循環系のカルシウムの蓄積を防ぐことにより動脈硬化を治療できることを発見した。この研究は、10年以上の基礎研究の成果であり、2019年6月11日にCell Reportsにオンラインで掲載された。 このオープンアクセスの論文は「Poly(ADP-Ribose)はDNA損傷応答とバイオミネラリゼーションに関連する“Poly(ADP-Ribose) Links the DNA Damage Response and Biomineralization.”」と題されている。「動脈硬化は、年齢が上がるにつれて誰にでも起こり、透析中の患者では加速され、子供でさえ石灰化動脈は発達する。しかし、今までのところ、このプロセスを制御するもの、つまり治療法は知られていない。」 ケンブリッジ大学化学部のMelinda Duer博士は、キングスカレッジロンドン校のCathy Shanahan博士と長期共同研究の一環としてこの研究を推進した。
「この硬化、つま
英国の研究チームは動脈硬化の背後にあるメカニズムを動物実験で確認し、通常ニキビの治療に使用される一般的な薬が動脈硬化の効果的な治療法になり得ることを示した。ケンブリッジ大学とキングスカレッジロンドン校が率いるチームは、かつてDNAを修復する目的で細胞内にのみ存在すると考えられていた分子も、認知症・心臓病・高血圧に関連する動脈硬化の原因であることを見出した。骨のようなカルシウム沈着物の蓄積、動脈の硬化および臓器および組織への血流の制限によって引き起こされる動脈硬化に対する治療法は現在ない。
ブリティッシュハート財団からの助成金により、研究者はPoly(ADP-Ribose)または通常DNA修復と関連する分子のPARも動脈の石灰化を推進することを発見した。さらに、慢性腎臓病のラットを使い、ニキビの治療によく使われる抗生物質であるミノサイクリンが、循環系のカルシウムの蓄積を防ぐことにより動脈硬化を治療できることを発見した。この研究は、10年以上の基礎研究の成果であり、2019年6月11日にCell Reportsにオンラインで掲載された。 このオープンアクセスの論文は「Poly(ADP-Ribose)はDNA損傷応答とバイオミネラリゼーションに関連する“Poly(ADP-Ribose) Links the DNA Damage Response and Biomineralization.”」と題されている。「動脈硬化は、年齢が上がるにつれて誰にでも起こり、透析中の患者では加速され、子供でさえ石灰化動脈は発達する。しかし、今までのところ、このプロセスを制御するもの、つまり治療法は知られていない。」 ケンブリッジ大学化学部のMelinda Duer博士は、キングスカレッジロンドン校のCathy Shanahan博士と長期共同研究の一環としてこの研究を推進した。
「この硬化、つま
サソリ毒素には抗菌活性成分が含まれていることが判明。薬剤耐性菌に対する新しい武器となるかもしれない。
 メキシコ東部原産のサソリの毒液は、単なる毒素以上のものかもしれない。 スタンフォード大学とメキシコ国立大学の研究者らは、この毒には細菌感染と戦うのを助ける2色に変わる化合物も含まれていることを発見した。 チームはサソリの毒から化合物を分離するだけでなく、それらを実験室で合成し、実験室で作られた毒が組織サンプルとマウスでブドウ球菌と薬剤耐性結核菌を殺すことを確認した。
PNASで2019年6月10日にオンラインで発表された調査結果は、サソリ、ヘビ、カタツムリ、および他の有毒な生き物の毒素における潜在的な薬理学的価値を強調している。 このPNASの論文は「サソリ毒由来の黄色ブドウ球菌および結核菌に対する1,4-ベンゾキノン系抗菌剤(1,4-Benzoquinone Antimicrobial Agents Against Staphylococcus Aureus and Mycobacterium tuberculosis Derived from Scorpion Venom.)」と題されている。「ボリューム当たりで言えば、サソリの毒は世界で最も貴重な物質の1つだ。それを1ガロン生産するのに3900万ドルもかかる。」とスタンフォード大学のグループを率いた主任研究者のRichard Zare博士は述べた。「それを生産するためにサソリからだけに頼っていたら、誰もそれを扱おうとしなかっただろう。重要な成分が何であるかを識別し、それらを合成できることが重要だ。」Zare博士は、メキシコ国立大学の分子医学の教授であるLourival Possani博士を含むメキシコの彼の同僚と協力し、サソリDiplocentrus meliciの標本を研究のために捕獲した。「この種のサソリの捕獲は困難だ。冬と乾季にはサソリが埋まっているので、雨季にしか見つけられない。」とPossani博士は
メキシコ東部原産のサソリの毒液は、単なる毒素以上のものかもしれない。 スタンフォード大学とメキシコ国立大学の研究者らは、この毒には細菌感染と戦うのを助ける2色に変わる化合物も含まれていることを発見した。 チームはサソリの毒から化合物を分離するだけでなく、それらを実験室で合成し、実験室で作られた毒が組織サンプルとマウスでブドウ球菌と薬剤耐性結核菌を殺すことを確認した。
PNASで2019年6月10日にオンラインで発表された調査結果は、サソリ、ヘビ、カタツムリ、および他の有毒な生き物の毒素における潜在的な薬理学的価値を強調している。 このPNASの論文は「サソリ毒由来の黄色ブドウ球菌および結核菌に対する1,4-ベンゾキノン系抗菌剤(1,4-Benzoquinone Antimicrobial Agents Against Staphylococcus Aureus and Mycobacterium tuberculosis Derived from Scorpion Venom.)」と題されている。「ボリューム当たりで言えば、サソリの毒は世界で最も貴重な物質の1つだ。それを1ガロン生産するのに3900万ドルもかかる。」とスタンフォード大学のグループを率いた主任研究者のRichard Zare博士は述べた。「それを生産するためにサソリからだけに頼っていたら、誰もそれを扱おうとしなかっただろう。重要な成分が何であるかを識別し、それらを合成できることが重要だ。」Zare博士は、メキシコ国立大学の分子医学の教授であるLourival Possani博士を含むメキシコの彼の同僚と協力し、サソリDiplocentrus meliciの標本を研究のために捕獲した。「この種のサソリの捕獲は困難だ。冬と乾季にはサソリが埋まっているので、雨季にしか見つけられない。」とPossani博士は
何百万人もの心血管死は十分な果物や野菜を食べていないことに起因すると新研究で判明。果物や野菜の摂取量を地域・年齢・性別で追跡。
 ビル&メリンダ・ゲイツ財団が資金提供しているGlobal Dietary Databaseプロジェクトの一環として行われた新研究による予備的な発見は、不十分な果物と野菜の消費量が、毎年何百万もの心臓病と脳卒中による死因となっていることを明らかにした。 この研究では、7人に1人の心血管死が十分な果物を食べていないことに起因し、12人に1人の心血管死が十分な野菜を食べていないことに起因すると推定された。
研究者らによると、2010年の心血管系の死亡が180万人近くあり、そのうち野菜の摂取量が少ないために100万人が死亡した。全体的に見て、基準に満たない果物摂取量は野菜のほぼ2倍だった。この影響は、果物と野菜の平均摂取量が最も少ない国で最も深刻だった。 タフツ大学フリードマン栄養科学政策大学院博士研究員の主任研究者であるVictoria Miller博士は、次のように述べている。 「我々の調査結果は、世界中で果物と野菜の消費を増やすためのポピュレーションベースの努力の必要性を示している。」Miller博士は、2019年6月8〜11日に米国メリーランド州ボルチモアで開催されたNutrition 2019(https://meeting.nutrition.org/)、米国栄養学会の年次総会で研究成果を発表した。 彼女の講演タイトル(FS01-01-19)は、「果物と野菜の消費に関連する世界的、地域的、そして全国的な心血管疾患の負担の推定:世界的な食事データベースからの分析(Estimated Global, Regional, and National Cardiovascular Disease Burdens Related to Fruit and Vegetable Consumption: An Analysis from the Global Dieta
ビル&メリンダ・ゲイツ財団が資金提供しているGlobal Dietary Databaseプロジェクトの一環として行われた新研究による予備的な発見は、不十分な果物と野菜の消費量が、毎年何百万もの心臓病と脳卒中による死因となっていることを明らかにした。 この研究では、7人に1人の心血管死が十分な果物を食べていないことに起因し、12人に1人の心血管死が十分な野菜を食べていないことに起因すると推定された。
研究者らによると、2010年の心血管系の死亡が180万人近くあり、そのうち野菜の摂取量が少ないために100万人が死亡した。全体的に見て、基準に満たない果物摂取量は野菜のほぼ2倍だった。この影響は、果物と野菜の平均摂取量が最も少ない国で最も深刻だった。 タフツ大学フリードマン栄養科学政策大学院博士研究員の主任研究者であるVictoria Miller博士は、次のように述べている。 「我々の調査結果は、世界中で果物と野菜の消費を増やすためのポピュレーションベースの努力の必要性を示している。」Miller博士は、2019年6月8〜11日に米国メリーランド州ボルチモアで開催されたNutrition 2019(https://meeting.nutrition.org/)、米国栄養学会の年次総会で研究成果を発表した。 彼女の講演タイトル(FS01-01-19)は、「果物と野菜の消費に関連する世界的、地域的、そして全国的な心血管疾患の負担の推定:世界的な食事データベースからの分析(Estimated Global, Regional, and National Cardiovascular Disease Burdens Related to Fruit and Vegetable Consumption: An Analysis from the Global Dieta
ハダカデバネズミはワサビ香辛料の曝露で疼痛に免疫を示した。この発見はヒトの痛みを解決するための洞察を提供する。
 2019年5月31日号のScience誌における新しい報告によると、非常に長命としてよく知られている哺乳類である南アフリカに生息するほくろラット種の類縁が、わさびの有効成分であるイソチオシアン酸アリル(AITC)への暴露により疼痛への免疫が起こる初めてのエビデンスが発見された。これらのげっ歯類がどのようにしてこの特定の種類の疼痛に鈍感になるように進化したのかを理解することは、ヒトの疼痛を解決するための新たな方向を指し示す可能性があるとこの研究者は言う。
イリノイ大学シカゴ校(UIC)リベラルアーツ&サイエンスの生物科学教授であり共著者でもあるThomas Park博士は、次のように述べている。 「げっ歯類が、彼らの環境で一般的なある種の疼痛刺激に対して鈍感になるように進化してきたことをを発見したことは、研究で見付けた生物学的なもう一つの教訓だ。」Park博士は、ベルリンのMax Delbruck分子医学センターおよび南アフリカのプレトリアにあるプレトリア大学の科学者と共同でこの研究を進めた。 この研究はUICと南アフリカで行われた。新しいScience誌の論文は、「複数のアフリカのげっ歯類における痛みを感じない分子の急速な分子進化(Rapid Molecular Evolution of Pain Insensitivity in Multiple African Rodents.)」と題されている。研究者らは、8種類のハダカデバネズミの足を、痛みのような反応を引き起こす3つの化合物にさらした。3つの化合物は、AITC、レモン汁と同じpHの酸性溶液、およびカプサイシン、唐辛子の辛味成分であった。
Park博士と彼の同僚はまた、ハダカデバネズミから採取したサンプルから遺伝物質を分析したところ、南アフリカのハダカデバネズミの神経はその表面にリークチャンネルと呼ばれる異
2019年5月31日号のScience誌における新しい報告によると、非常に長命としてよく知られている哺乳類である南アフリカに生息するほくろラット種の類縁が、わさびの有効成分であるイソチオシアン酸アリル(AITC)への暴露により疼痛への免疫が起こる初めてのエビデンスが発見された。これらのげっ歯類がどのようにしてこの特定の種類の疼痛に鈍感になるように進化したのかを理解することは、ヒトの疼痛を解決するための新たな方向を指し示す可能性があるとこの研究者は言う。
イリノイ大学シカゴ校(UIC)リベラルアーツ&サイエンスの生物科学教授であり共著者でもあるThomas Park博士は、次のように述べている。 「げっ歯類が、彼らの環境で一般的なある種の疼痛刺激に対して鈍感になるように進化してきたことをを発見したことは、研究で見付けた生物学的なもう一つの教訓だ。」Park博士は、ベルリンのMax Delbruck分子医学センターおよび南アフリカのプレトリアにあるプレトリア大学の科学者と共同でこの研究を進めた。 この研究はUICと南アフリカで行われた。新しいScience誌の論文は、「複数のアフリカのげっ歯類における痛みを感じない分子の急速な分子進化(Rapid Molecular Evolution of Pain Insensitivity in Multiple African Rodents.)」と題されている。研究者らは、8種類のハダカデバネズミの足を、痛みのような反応を引き起こす3つの化合物にさらした。3つの化合物は、AITC、レモン汁と同じpHの酸性溶液、およびカプサイシン、唐辛子の辛味成分であった。
Park博士と彼の同僚はまた、ハダカデバネズミから採取したサンプルから遺伝物質を分析したところ、南アフリカのハダカデバネズミの神経はその表面にリークチャンネルと呼ばれる異
ER陽性乳がんの転移と薬剤耐性を転写因子スイッチが誘発することを初期段階の研究が示唆
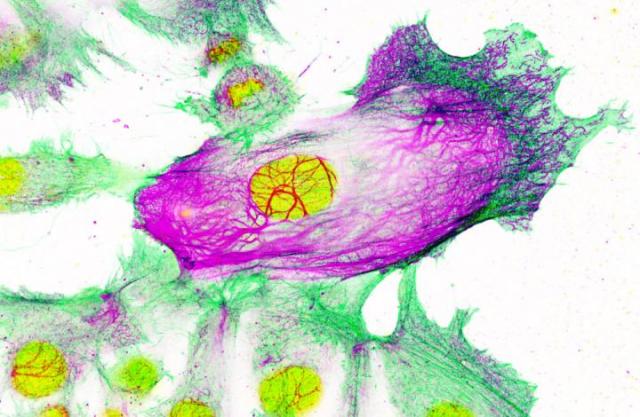 LondonのImperial CollegeおよびInstitute of Cancer Researchの科学者が率いる初期段階の研究で、乳がん細胞における遺伝的「スイッチ」が一種の内部足場の形成を促進することが確認された。この足場は、髪を強く保つのを助けるケラチンタンパク質に関連するケラチン80と呼ばれるタンパク質でできている。この足場の量を増やすと、がん細胞がより硬くなる。研究者らによれば、細胞が凝集して血流に乗って体の他の部分に移動するのを助けるかもしれない。
研究者らは、アロマターゼ阻害剤と呼ばれる一般的な乳がん薬で治療されたヒト乳がん細胞を研究した。研究チームは、同じスイッチが乳がん細胞の薬剤抵抗性に関与していることを発見した(つまり、がんが回復すれば薬はもはや有効ではない)。このスイッチを別の薬物で標的にすると、この耐性を逆転させることができ、癌が拡大する可能性が低くなる可能性があるとImperial Collegeの外科の研究を率いるLuca Magnani博士は説明している。アロマターゼ阻害剤は癌細胞を殺すのに効果的だが、術後10年以内に約30%の患者が再発。さらに悪いことに、癌が再発したとき、それは通常体の周りに拡がって、治療が困難である。」この新しい研究の結果は、2019年5月9日にNature Communicationsにオンラインで発表された。 オープンアクセスの論文は、「SREBP1は内分泌抵抗性ERα乳癌におけるケラチン80依存性細胞骨格変化および侵襲的行動を促進する(SREBP1 Drives Keratin-80-Dependent Cytoskeletal Changes and Invasive Behavior in Endocrine-Resistant ERα Breast Cancer.)」と題されている。Magnani博
LondonのImperial CollegeおよびInstitute of Cancer Researchの科学者が率いる初期段階の研究で、乳がん細胞における遺伝的「スイッチ」が一種の内部足場の形成を促進することが確認された。この足場は、髪を強く保つのを助けるケラチンタンパク質に関連するケラチン80と呼ばれるタンパク質でできている。この足場の量を増やすと、がん細胞がより硬くなる。研究者らによれば、細胞が凝集して血流に乗って体の他の部分に移動するのを助けるかもしれない。
研究者らは、アロマターゼ阻害剤と呼ばれる一般的な乳がん薬で治療されたヒト乳がん細胞を研究した。研究チームは、同じスイッチが乳がん細胞の薬剤抵抗性に関与していることを発見した(つまり、がんが回復すれば薬はもはや有効ではない)。このスイッチを別の薬物で標的にすると、この耐性を逆転させることができ、癌が拡大する可能性が低くなる可能性があるとImperial Collegeの外科の研究を率いるLuca Magnani博士は説明している。アロマターゼ阻害剤は癌細胞を殺すのに効果的だが、術後10年以内に約30%の患者が再発。さらに悪いことに、癌が再発したとき、それは通常体の周りに拡がって、治療が困難である。」この新しい研究の結果は、2019年5月9日にNature Communicationsにオンラインで発表された。 オープンアクセスの論文は、「SREBP1は内分泌抵抗性ERα乳癌におけるケラチン80依存性細胞骨格変化および侵襲的行動を促進する(SREBP1 Drives Keratin-80-Dependent Cytoskeletal Changes and Invasive Behavior in Endocrine-Resistant ERα Breast Cancer.)」と題されている。Magnani博
1型糖尿病に関与する新たな免疫細胞を発見。B細胞とT細胞の悪役ハイブリッドが膵臓のインスリン産生細胞への強力な自己免疫攻撃を促進。
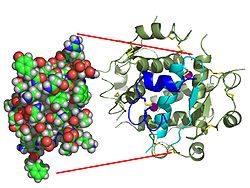 医学界のネッシー探しに例えられるかもしれない発見が、ジョンズホプキンス医学、IBM Research、および他の4つの共同研究機関からなる研究チームによって行われた。1型糖尿病の発症に重要な役割を果たす可能性がある疑わしい「X細胞」として、「悪役ハイブリッド」免疫系細胞についての存在が初めて報告された。Cellの2019年5月30日号の特集として発表された新しい論文の中で、異常なリンパ球(一種の白血球) - 正式には二重発現細胞(DE)細胞として知られている - を報告している。
このオープンアクセスの論文は、「1型糖尿病患者由来の特有の二重受容体発現リンパ球に存在するパブリックBCRは強力なT細胞自己抗原をコードする(A Public BCR Present in a Unique Dual-Receptor-Expression Lymphocyte from Type 1 Diabetes Patients Encodes a Potent T Cell Autoantigen.)」と題されている。「我々が同定した細胞は、適応免疫系の2つの主要な主力であるBリンパ球とTリンパ球の間のハイブリッドである」とジョンズホプキンス大学学校の病理学准教授Abdel-Rahim A. Hamad博士は述べた。「X細胞が存在することだけでなく、それが1型糖尿病を引き起こすと考えられている自己免疫応答の主要な推進力であるという強力な証拠があることを我々の発見は示している。」1型糖尿病は、以前は若年性糖尿病またはインスリン依存性糖尿病として知られているが、膵臓のβ細胞が破壊されてインスリン(画像)、つまり人の血糖値を調節するホルモンが破壊される慢性疾患だ。 主に小児期に診断されるが、すべての年齢で発病し、この病気は米国のすべての糖尿病ケースの5%と10%の間で、またはおよそ13
医学界のネッシー探しに例えられるかもしれない発見が、ジョンズホプキンス医学、IBM Research、および他の4つの共同研究機関からなる研究チームによって行われた。1型糖尿病の発症に重要な役割を果たす可能性がある疑わしい「X細胞」として、「悪役ハイブリッド」免疫系細胞についての存在が初めて報告された。Cellの2019年5月30日号の特集として発表された新しい論文の中で、異常なリンパ球(一種の白血球) - 正式には二重発現細胞(DE)細胞として知られている - を報告している。
このオープンアクセスの論文は、「1型糖尿病患者由来の特有の二重受容体発現リンパ球に存在するパブリックBCRは強力なT細胞自己抗原をコードする(A Public BCR Present in a Unique Dual-Receptor-Expression Lymphocyte from Type 1 Diabetes Patients Encodes a Potent T Cell Autoantigen.)」と題されている。「我々が同定した細胞は、適応免疫系の2つの主要な主力であるBリンパ球とTリンパ球の間のハイブリッドである」とジョンズホプキンス大学学校の病理学准教授Abdel-Rahim A. Hamad博士は述べた。「X細胞が存在することだけでなく、それが1型糖尿病を引き起こすと考えられている自己免疫応答の主要な推進力であるという強力な証拠があることを我々の発見は示している。」1型糖尿病は、以前は若年性糖尿病またはインスリン依存性糖尿病として知られているが、膵臓のβ細胞が破壊されてインスリン(画像)、つまり人の血糖値を調節するホルモンが破壊される慢性疾患だ。 主に小児期に診断されるが、すべての年齢で発病し、この病気は米国のすべての糖尿病ケースの5%と10%の間で、またはおよそ13
自閉症における腸と脳の関係が明らかに。腸と脳がNeuroligin-3の遺伝子に突然変異を共有していることが判明。
 自閉症の人はしばしば腸の問題に苦しんでいるが、誰もその理由が分からなかった。 オーストラリア・メルボルンのRMIT大学の研究者らは、脳と腸の両方に見られる同じ遺伝子変異が原因であることを突き止めた。この発見は自閉症における腸 - 脳神経系のつながりを確認し、腸を標的とすることによって自閉症に関連する行動の問題を緩和することができる潜在的な治療法の探求における新たな方向性を開くものだ。
2019年5月22日にAutism Researchにオンラインで論文が掲載されたこの論文は「Neuroligin‐3の自閉症関連r451c変異を発現する患者およびマウスの胃腸機能障害(Gastrointestinal Dysfunction in Patients and Mice Expressing the Autism‐Associated r451c Mutation in Neuroligin‐3.)」と題されており、イェーテボリ大学とルンド大学(スウェーデン)、ベイラー医科大学(アメリカ)、ミンホー大学(ポルトガル)、ラ・トローブ大学、メルボルン大学、フロリー神経科学研究所、モナシュ大学との共同研究によるものである。RMIT大学のElisa Hill-Yardin准教授(写真)は、「自閉症を理解しようとする科学者たちはずっと脳を見てきたので、腸神経系との関連は最近探究され始めたばかりだ」と述べた。「我々は脳と腸が同じニューロンを多数共有していることに気づいており、今回初めて、それらが自閉症関連の遺伝子突然変異も共有していることを確認した。」とHill-Yardin博士は述べた。 「自閉症患者の最大90%が腸の問題に苦しんでおり、それが彼らとその家族の日常生活に重大な影響を及ぼす可能性がある。」我々の調査結果は、これらの胃腸の問題は 自閉症の行動問題。 臨床医、家族、研究者にとっ
自閉症の人はしばしば腸の問題に苦しんでいるが、誰もその理由が分からなかった。 オーストラリア・メルボルンのRMIT大学の研究者らは、脳と腸の両方に見られる同じ遺伝子変異が原因であることを突き止めた。この発見は自閉症における腸 - 脳神経系のつながりを確認し、腸を標的とすることによって自閉症に関連する行動の問題を緩和することができる潜在的な治療法の探求における新たな方向性を開くものだ。
2019年5月22日にAutism Researchにオンラインで論文が掲載されたこの論文は「Neuroligin‐3の自閉症関連r451c変異を発現する患者およびマウスの胃腸機能障害(Gastrointestinal Dysfunction in Patients and Mice Expressing the Autism‐Associated r451c Mutation in Neuroligin‐3.)」と題されており、イェーテボリ大学とルンド大学(スウェーデン)、ベイラー医科大学(アメリカ)、ミンホー大学(ポルトガル)、ラ・トローブ大学、メルボルン大学、フロリー神経科学研究所、モナシュ大学との共同研究によるものである。RMIT大学のElisa Hill-Yardin准教授(写真)は、「自閉症を理解しようとする科学者たちはずっと脳を見てきたので、腸神経系との関連は最近探究され始めたばかりだ」と述べた。「我々は脳と腸が同じニューロンを多数共有していることに気づいており、今回初めて、それらが自閉症関連の遺伝子突然変異も共有していることを確認した。」とHill-Yardin博士は述べた。 「自閉症患者の最大90%が腸の問題に苦しんでおり、それが彼らとその家族の日常生活に重大な影響を及ぼす可能性がある。」我々の調査結果は、これらの胃腸の問題は 自閉症の行動問題。 臨床医、家族、研究者にとっ
母なる自然の救い- ヒヤシンスのフラボノイド誘導体は、糖尿病、未熟児網膜症、加齢黄斑変性に起因する失明を予防することが判明
 英国サリー大学、米国インディアナ大学医学部ユージーンおよびマリリングリックアイ研究所そしてロンドン大学の科学者らによる研究によると、天然物から失明のいくつかの原因を治療するための画期的な答えを得ることができたという。 科学者らは、増殖性糖尿病性網膜症などの退行性眼疾患の原因を治療するために有用である可能性が高い植物群から化合物を発見し、試験を実施した。 目の中の新しい血管細胞の異常な成長は、未熟児(未熟児網膜症)、糖尿病患者(増殖性糖尿病性網膜症)、および高齢者(湿性加齢黄斑変性症)を含む多くのタイプの失明に関連している。
論文の中で、サリー大学の科学者は、アメリカのインディアナ大学とロンドンのキングストン大学の専門家と共に、ヒヤシンス科植物で発見されたホモイソフラボノイドおよびそれらの合成誘導体について試験を行った。2019年4月5日にアメリカ化学会のJournal of Natural Productsにオンラインで発表されたこの論文は、「ヒヤシンス科由来の天然および合成ホモイソフラボノイドの抗血管新生活性(sensu APGII)(The Antiangiogenic Activity of Naturally Occurring and Synthetic Homoisoflavonoids from the Hyacinthaceae (sensu APGII))」と題されている。
チームは、これらの化合物が新しい血管の成長をいかにうまく阻止するかをテストし、いくつかの活性化合物を単離した。 特に1つの合成誘導体は、将来の治療法を開発するために使用され、より関連性のある化合物の合成を進めている。グレートオーモンドストリート病院(ロンドン)によると、未熟児網膜症は未熟児の約20%が罹患し、主に妊娠32週目以前に生まれた、または体重が1500グラム未満の乳児に発
英国サリー大学、米国インディアナ大学医学部ユージーンおよびマリリングリックアイ研究所そしてロンドン大学の科学者らによる研究によると、天然物から失明のいくつかの原因を治療するための画期的な答えを得ることができたという。 科学者らは、増殖性糖尿病性網膜症などの退行性眼疾患の原因を治療するために有用である可能性が高い植物群から化合物を発見し、試験を実施した。 目の中の新しい血管細胞の異常な成長は、未熟児(未熟児網膜症)、糖尿病患者(増殖性糖尿病性網膜症)、および高齢者(湿性加齢黄斑変性症)を含む多くのタイプの失明に関連している。
論文の中で、サリー大学の科学者は、アメリカのインディアナ大学とロンドンのキングストン大学の専門家と共に、ヒヤシンス科植物で発見されたホモイソフラボノイドおよびそれらの合成誘導体について試験を行った。2019年4月5日にアメリカ化学会のJournal of Natural Productsにオンラインで発表されたこの論文は、「ヒヤシンス科由来の天然および合成ホモイソフラボノイドの抗血管新生活性(sensu APGII)(The Antiangiogenic Activity of Naturally Occurring and Synthetic Homoisoflavonoids from the Hyacinthaceae (sensu APGII))」と題されている。
チームは、これらの化合物が新しい血管の成長をいかにうまく阻止するかをテストし、いくつかの活性化合物を単離した。 特に1つの合成誘導体は、将来の治療法を開発するために使用され、より関連性のある化合物の合成を進めている。グレートオーモンドストリート病院(ロンドン)によると、未熟児網膜症は未熟児の約20%が罹患し、主に妊娠32週目以前に生まれた、または体重が1500グラム未満の乳児に発
3つのタンパク質遺伝子の注射でハイリスクHPV型に対する免疫反応を誘発。子宮頸癌の前駆腫瘍の3分の1においてHPVを完全に消失させた。
 子宮頸部の前癌を治療するための新しい免疫療法により、臨床試験に参加した3分の1の女性が病変とHPV感染の両方を完全に排除することに成功した。この注射(治療用ワクチン)には、子宮頸部上皮内腫瘍(CIN: cervical intraepithelial neoplasia)として知られるほぼすべての子宮頸癌前駆体の原因となるハイリスクのヒトパピローマウイルス(HPV: human papilloma virus)を攻撃する免疫系反応を引き起こす3種類のタンパク質遺伝子が含まれている。
「HPVに感染している女性を治療するための製品は殆ど無い。比較的簡単で成功率がこのようなものを見たのは今回が初めてで、非常にエキサイティングだ。」とミシガン大学医学部の家族医学および産科婦人科教授のDiane Harper博士(写真)は述べた。頸部前癌病変は3段階の重症度に分類される。CIN 2病変はしばしば自然に消失するが、CIN 3病変に進行することもある。 CIN 3が最も重症で、成長が非常に遅い疾患だが、30年以内にCIN 3病変の半分以下が癌になることがある。「しかし、CIN 3のどの女性ががんになるのか、どの女性ががんにならないのかを判断する方法は無い。したがって、CIN 2または3の女性はすべてがんになる可能性があるものとして扱う」とHarper博士は語った。この研究では、CIN2またはCIN3と診断された192人の女性が登録し、129人がワクチン接種を受け、63人がプラセボ投与を受けた。 大腿部に3回、1週間に1回、3週間、女性に注射を3回行った。 6ヵ月後、女性はCIN 2/3のための標準的な外科的処置で治療され、切除された組織を検査した。ワクチン接種を受けた女性は、HPV感染症の種類に関わらず、プラセボグループの女性の2倍以上のCIN消失を確認した。 結果はより重症のCIN
子宮頸部の前癌を治療するための新しい免疫療法により、臨床試験に参加した3分の1の女性が病変とHPV感染の両方を完全に排除することに成功した。この注射(治療用ワクチン)には、子宮頸部上皮内腫瘍(CIN: cervical intraepithelial neoplasia)として知られるほぼすべての子宮頸癌前駆体の原因となるハイリスクのヒトパピローマウイルス(HPV: human papilloma virus)を攻撃する免疫系反応を引き起こす3種類のタンパク質遺伝子が含まれている。
「HPVに感染している女性を治療するための製品は殆ど無い。比較的簡単で成功率がこのようなものを見たのは今回が初めてで、非常にエキサイティングだ。」とミシガン大学医学部の家族医学および産科婦人科教授のDiane Harper博士(写真)は述べた。頸部前癌病変は3段階の重症度に分類される。CIN 2病変はしばしば自然に消失するが、CIN 3病変に進行することもある。 CIN 3が最も重症で、成長が非常に遅い疾患だが、30年以内にCIN 3病変の半分以下が癌になることがある。「しかし、CIN 3のどの女性ががんになるのか、どの女性ががんにならないのかを判断する方法は無い。したがって、CIN 2または3の女性はすべてがんになる可能性があるものとして扱う」とHarper博士は語った。この研究では、CIN2またはCIN3と診断された192人の女性が登録し、129人がワクチン接種を受け、63人がプラセボ投与を受けた。 大腿部に3回、1週間に1回、3週間、女性に注射を3回行った。 6ヵ月後、女性はCIN 2/3のための標準的な外科的処置で治療され、切除された組織を検査した。ワクチン接種を受けた女性は、HPV感染症の種類に関わらず、プラセボグループの女性の2倍以上のCIN消失を確認した。 結果はより重症のCIN
眼の血管の発達を調節する光依存性分子パスウェイが発見された。未熟児網膜症と近視の未熟児の治療に光線療法の可能性を示す。
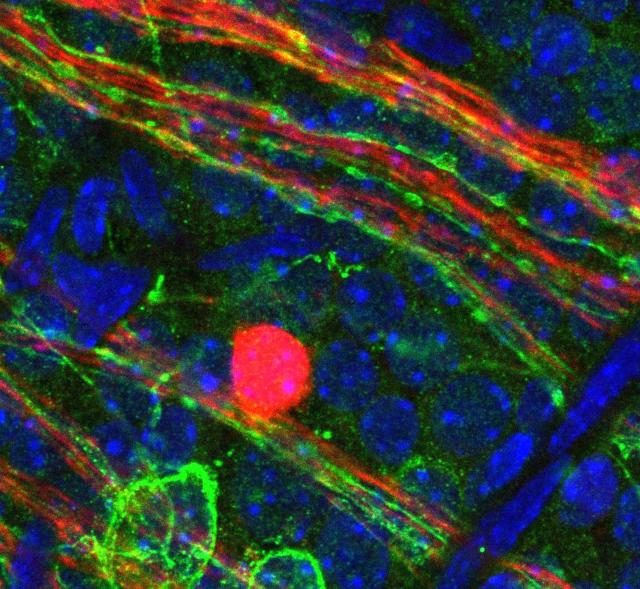 シンシナティ小児病院医療センターの研究チームによって、眼の中で血管の発達を調節する光依存性分子パスウェイが発見された。未熟児網膜症(ROP:retinopathy of prematurity)と近視(近視眼症)の未熟児を救うために光線療法を使うことが可能になるかもしれないことを示唆している。2019年4月1日にNature Cell Biologのオンラインで発表されたこの論文のタイトルは「オプシン5-ドーパミン パスウェイが眼の光依存性血管発達を媒介する(An Opsin 5–Dopamine Pathway Mediates Light-Dependent Vascular Development in the Eye.)」と題されている。
オプシン5-ドーパミン パスウェイと呼ばれる新しい分子プロセスは、目の血管発達が視覚機能のために準備を行い、適切なバランスをとるプロセスを助けている。医学的に脆弱な未熟児ではこのプロセスのバランスが崩れることがある。研究者たちは、しばしば起こり得る未熟児網膜症(ROP)および近視として知られる眼疾患を予防または治療する方法を探していた。近視は世界中の成人で珍しくない。シンシナティ小児病院医療センターのビジュアルシステムズグループディレクター、Richard A. Lang博士は、次のように述べている。「オプシン5-ドーパミン パスウェイはおそらく近視のような病気の光依存性疾患プロセスの一部であることが示唆された。これは、未熟児が生まれた後や近視の人の未熟児網膜症のような状態を治療するために、光線照射が有効かもしれないことを示唆している。」この新しい研究は、シンシナティのLang博士のチームによって導かれ、米国とチェコ共和国の研究機関の共同研究成果だ。研究者らは、出生後のマウスにおける眼の発生とオプシン5-ドーパミン パスウ
シンシナティ小児病院医療センターの研究チームによって、眼の中で血管の発達を調節する光依存性分子パスウェイが発見された。未熟児網膜症(ROP:retinopathy of prematurity)と近視(近視眼症)の未熟児を救うために光線療法を使うことが可能になるかもしれないことを示唆している。2019年4月1日にNature Cell Biologのオンラインで発表されたこの論文のタイトルは「オプシン5-ドーパミン パスウェイが眼の光依存性血管発達を媒介する(An Opsin 5–Dopamine Pathway Mediates Light-Dependent Vascular Development in the Eye.)」と題されている。
オプシン5-ドーパミン パスウェイと呼ばれる新しい分子プロセスは、目の血管発達が視覚機能のために準備を行い、適切なバランスをとるプロセスを助けている。医学的に脆弱な未熟児ではこのプロセスのバランスが崩れることがある。研究者たちは、しばしば起こり得る未熟児網膜症(ROP)および近視として知られる眼疾患を予防または治療する方法を探していた。近視は世界中の成人で珍しくない。シンシナティ小児病院医療センターのビジュアルシステムズグループディレクター、Richard A. Lang博士は、次のように述べている。「オプシン5-ドーパミン パスウェイはおそらく近視のような病気の光依存性疾患プロセスの一部であることが示唆された。これは、未熟児が生まれた後や近視の人の未熟児網膜症のような状態を治療するために、光線照射が有効かもしれないことを示唆している。」この新しい研究は、シンシナティのLang博士のチームによって導かれ、米国とチェコ共和国の研究機関の共同研究成果だ。研究者らは、出生後のマウスにおける眼の発生とオプシン5-ドーパミン パスウ
美の遺伝学 - 顔の魅力に関連する遺伝子は性別によって異なることが判明
 ウィスコンシン大学マディソン校の生物統計学および医学生物情報学科の助教授Qiongshi Lu博士とその同僚による新しい研究によると、遺伝子は人の顔の美しさを決定する役割を果たすが、その役割は性別によって異なるという。2019年4月4日にPLOS Geneticsに掲載されたこのオープンアクセス論文は「ゲノムワイド関連解析(GWAS)は顔の魅力の性特異的遺伝的構造を明らかにする(Genome-Wide Association Study Reveals Sex-Specific Genetic Architecture of Facial Attractiveness.)」と題されている。
人は美しさに夢中になる傾向がある - 人の魅力は学業成績、キャリアの成功、そして所得階層の上位移動に関連している。しかし、その重要性にもかかわらず、科学者たちはかわいい顔を持つことの遺伝的根拠についてほとんど何も知らなかった。現在の研究では、研究者らは4,383人の個人からの遺伝情報を用いてゲノムワイド関連解析(GWAS)を行い、顔の美しさに関連するゲノムの部分を特定した。彼らは、ヨーロッパ人の祖先を持つ参加者からの魅力に基づいて年鑑の写真を採点し、得点を各人の遺伝情報と比較した。 研究者らは、顔の魅力に関連するいくつかの遺伝子を同定したが、それらの役割および他のヒトの特徴との関連性は性別によって異なる。女性では、美しさに関連する特定の遺伝的変異も体重に影響を与える遺伝子に関連しているように見えたが、男性では、顔の魅力の変異は血中コレステロールレベルに影響を及ぼす遺伝子に関連していた。 この研究は、顔の魅力の根底にある遺伝的要因への新しい洞察を提供し、美と他の人間の特性との間の複雑な関係を浮き彫りにしている。「人間の他の多くの特性と同様に、人の魅力を決定づけるマスター遺伝子は存在しない
ウィスコンシン大学マディソン校の生物統計学および医学生物情報学科の助教授Qiongshi Lu博士とその同僚による新しい研究によると、遺伝子は人の顔の美しさを決定する役割を果たすが、その役割は性別によって異なるという。2019年4月4日にPLOS Geneticsに掲載されたこのオープンアクセス論文は「ゲノムワイド関連解析(GWAS)は顔の魅力の性特異的遺伝的構造を明らかにする(Genome-Wide Association Study Reveals Sex-Specific Genetic Architecture of Facial Attractiveness.)」と題されている。
人は美しさに夢中になる傾向がある - 人の魅力は学業成績、キャリアの成功、そして所得階層の上位移動に関連している。しかし、その重要性にもかかわらず、科学者たちはかわいい顔を持つことの遺伝的根拠についてほとんど何も知らなかった。現在の研究では、研究者らは4,383人の個人からの遺伝情報を用いてゲノムワイド関連解析(GWAS)を行い、顔の美しさに関連するゲノムの部分を特定した。彼らは、ヨーロッパ人の祖先を持つ参加者からの魅力に基づいて年鑑の写真を採点し、得点を各人の遺伝情報と比較した。 研究者らは、顔の魅力に関連するいくつかの遺伝子を同定したが、それらの役割および他のヒトの特徴との関連性は性別によって異なる。女性では、美しさに関連する特定の遺伝的変異も体重に影響を与える遺伝子に関連しているように見えたが、男性では、顔の魅力の変異は血中コレステロールレベルに影響を及ぼす遺伝子に関連していた。 この研究は、顔の魅力の根底にある遺伝的要因への新しい洞察を提供し、美と他の人間の特性との間の複雑な関係を浮き彫りにしている。「人間の他の多くの特性と同様に、人の魅力を決定づけるマスター遺伝子は存在しない
クロロフィルを生産するが光合成しない微生物 corallicolidが発見された。この微生物は絶滅の危機に瀕するサンゴ礁を保護する鍵になるかもしれない。
 初めて、クロロフィルを生産するにも関わらず光合成に従事しない微生物が発見された。 それは世界中のサンゴの70%で発見され、将来的にサンゴ礁を保護するための手がかりを提供する可能性があるため、この特殊な微生物は「corallicolid」と命名された。2019年4月3日にNatureのオンラインで報告されたこの論文は「クロロフィル生合成遺伝子を含む広範囲のサンゴ感染アピコンプレクサ(A Widespread Coral-Infecting Apicomplexan with Chlorophyll Biosynthesis Genes.)」と題されている。
この研究について、ブリティッシュコロンビア大学(UBC)の植物学者で上級研究者であるPatrick Keeling博士は、次のように述べている。「この微生物は全く新しい生化学的疑問を投げかけている。それは寄生虫のように見え、そしてそれは間違いなく光合成ではない。しかし、それは依然としてクロロフィルを作り出す。」クロロフィルは、植物や藻類に含まれる緑色の色素で、光合成中に太陽光からエネルギーを吸収することができる。 「クロロフィルはエネルギーを捕捉するのに非常に優れているので、光合成なしでクロロフィルを持つことは実際には非常に危険だ。それは光合成なしでエネルギーをゆっくり放出するのは、細胞の中に爆弾を抱えて生きるようなものだ。」とKeeling博士は語った。
サンゴ礁を構成する多種多様なサンゴならびに黒サンゴ、ファンサンゴ、マッシュルームサンゴ、イソギンチャクの胃腔に生息している。 それらは、光合成が起こる植物および藻類細胞の一部であるプラスチドと呼ばれる細胞コンパートメントを有する寄生虫グループの一部であるアピコンプレクサである。最も有名なアピコンプレクサは、マラリアの原因である寄生虫(熱帯熱マラリア原虫および他のマラ
初めて、クロロフィルを生産するにも関わらず光合成に従事しない微生物が発見された。 それは世界中のサンゴの70%で発見され、将来的にサンゴ礁を保護するための手がかりを提供する可能性があるため、この特殊な微生物は「corallicolid」と命名された。2019年4月3日にNatureのオンラインで報告されたこの論文は「クロロフィル生合成遺伝子を含む広範囲のサンゴ感染アピコンプレクサ(A Widespread Coral-Infecting Apicomplexan with Chlorophyll Biosynthesis Genes.)」と題されている。
この研究について、ブリティッシュコロンビア大学(UBC)の植物学者で上級研究者であるPatrick Keeling博士は、次のように述べている。「この微生物は全く新しい生化学的疑問を投げかけている。それは寄生虫のように見え、そしてそれは間違いなく光合成ではない。しかし、それは依然としてクロロフィルを作り出す。」クロロフィルは、植物や藻類に含まれる緑色の色素で、光合成中に太陽光からエネルギーを吸収することができる。 「クロロフィルはエネルギーを捕捉するのに非常に優れているので、光合成なしでクロロフィルを持つことは実際には非常に危険だ。それは光合成なしでエネルギーをゆっくり放出するのは、細胞の中に爆弾を抱えて生きるようなものだ。」とKeeling博士は語った。
サンゴ礁を構成する多種多様なサンゴならびに黒サンゴ、ファンサンゴ、マッシュルームサンゴ、イソギンチャクの胃腔に生息している。 それらは、光合成が起こる植物および藻類細胞の一部であるプラスチドと呼ばれる細胞コンパートメントを有する寄生虫グループの一部であるアピコンプレクサである。最も有名なアピコンプレクサは、マラリアの原因である寄生虫(熱帯熱マラリア原虫および他のマラ
痛みや不安、恐怖を感じないスコットランドの女性について、偽遺伝子(FAAH-OUT)とFAAH遺伝子の突然変異が原因であることを同定。傷の回復も迅速。
 71歳のスコットランド人女性(Jo Cameronさん・写真)は、これまでに同定されていない遺伝子の変異によって痛みをほとんど感じず、ごくわずかな不安や恐怖しか経験したことがなく、この突然変異のために創傷治癒能力が増強されているかもしれないので、新しい治療法を導くのに有用な可能性がある、とロンドン大学ユニバーシティカレッジ(UCL)の共同研究者がthe British Journal of Anaesthesiaで報告した。
このオープンアクセスの論文は、「高アナンダミド濃度と痛みを感じない患者で同定されたFAAH偽遺伝子の微小欠失(Microdeletion in a FAAH Pseudogene Identified In A Patient With High Anandamide Concentrations And Pain Insensitivity.)」と題されている。「この女性は、疼痛や不安の治療対象となるかもしれないと考えられている遺伝子の活性を低下させる特定の遺伝子型を持っていることが分かった。我々はこの新たに同定された遺伝子がどのように機能するのかを明らかにし、新しい治療標的をさらに進歩させることを望んでいる。」と、この研究の主要研究者の一人、James Cox博士(UCL Medicine)は述べた。65歳の時、この女性は股関節の治療を求めていたが、痛みがないにもかかわらず重度の関節変性を伴うことが判明した。 66歳の時、彼女は手の手術を受けたが、これは通常非常に痛みを伴うにも関わらず手術後も痛みは報告されなかった。彼女の疼痛感受性について、スコットランド北部のNHS病院の麻酔コンサルタントであるDevjit Srivastava博士と、この論文の共著者が診断した。女性は、歯科手術などの手術後に鎮痛剤を必要としたことがないことを研究者に伝えた。
71歳のスコットランド人女性(Jo Cameronさん・写真)は、これまでに同定されていない遺伝子の変異によって痛みをほとんど感じず、ごくわずかな不安や恐怖しか経験したことがなく、この突然変異のために創傷治癒能力が増強されているかもしれないので、新しい治療法を導くのに有用な可能性がある、とロンドン大学ユニバーシティカレッジ(UCL)の共同研究者がthe British Journal of Anaesthesiaで報告した。
このオープンアクセスの論文は、「高アナンダミド濃度と痛みを感じない患者で同定されたFAAH偽遺伝子の微小欠失(Microdeletion in a FAAH Pseudogene Identified In A Patient With High Anandamide Concentrations And Pain Insensitivity.)」と題されている。「この女性は、疼痛や不安の治療対象となるかもしれないと考えられている遺伝子の活性を低下させる特定の遺伝子型を持っていることが分かった。我々はこの新たに同定された遺伝子がどのように機能するのかを明らかにし、新しい治療標的をさらに進歩させることを望んでいる。」と、この研究の主要研究者の一人、James Cox博士(UCL Medicine)は述べた。65歳の時、この女性は股関節の治療を求めていたが、痛みがないにもかかわらず重度の関節変性を伴うことが判明した。 66歳の時、彼女は手の手術を受けたが、これは通常非常に痛みを伴うにも関わらず手術後も痛みは報告されなかった。彼女の疼痛感受性について、スコットランド北部のNHS病院の麻酔コンサルタントであるDevjit Srivastava博士と、この論文の共著者が診断した。女性は、歯科手術などの手術後に鎮痛剤を必要としたことがないことを研究者に伝えた。
黒死病原菌はおそらく絶滅している
 黒死病と呼ばれ14世紀のヨーロッパを襲った壊滅的な伝染病ペストは、今はもう絶滅したバクテリアYersinia pestisによるものだと思われる。この記事は2011年8月29日付けのPNAS誌に発表された。カナダのマックマスター大学のポワナー・ヘンデリック博士と研究者グループは、イギリスのロンドンにあるイースト・スミスフィールドの集団埋葬地から掘り出された109人の白骨遺体から検出されたDNAを分析し、この結果にたどり着いた。
また、セント・ニコラス・シャンブルから掘り出された10人の遺骨からもDNAを検出し、解析を行なった。イースト・スミスフィールドに埋葬されていた遺骨からはY. pestisの遺伝子が見つかり、著者達によって配列解析されたこの遺伝子は、古来の病原体の中でも最も歴史の長い遺伝子の集合体である。
この遺伝子配列は、既に知られている他のY. pestisのそれとは異なり、黒死病を起こした病原体はすでに絶滅していることを示していると著者達は断定した。現在の伝染病は世界中で年2000人もの被害者を出している。これらの病気の初期形態を調べる事で病原体の進化の歴史や、さらには黒死病の時のような広範囲にわたる惨状がどのように起こったのかを解明する手がかりになると著者達は考えている。[BioQuick News: Black Death Pathogen Likely Extinct">
黒死病と呼ばれ14世紀のヨーロッパを襲った壊滅的な伝染病ペストは、今はもう絶滅したバクテリアYersinia pestisによるものだと思われる。この記事は2011年8月29日付けのPNAS誌に発表された。カナダのマックマスター大学のポワナー・ヘンデリック博士と研究者グループは、イギリスのロンドンにあるイースト・スミスフィールドの集団埋葬地から掘り出された109人の白骨遺体から検出されたDNAを分析し、この結果にたどり着いた。
また、セント・ニコラス・シャンブルから掘り出された10人の遺骨からもDNAを検出し、解析を行なった。イースト・スミスフィールドに埋葬されていた遺骨からはY. pestisの遺伝子が見つかり、著者達によって配列解析されたこの遺伝子は、古来の病原体の中でも最も歴史の長い遺伝子の集合体である。
この遺伝子配列は、既に知られている他のY. pestisのそれとは異なり、黒死病を起こした病原体はすでに絶滅していることを示していると著者達は断定した。現在の伝染病は世界中で年2000人もの被害者を出している。これらの病気の初期形態を調べる事で病原体の進化の歴史や、さらには黒死病の時のような広範囲にわたる惨状がどのように起こったのかを解明する手がかりになると著者達は考えている。[BioQuick News: Black Death Pathogen Likely Extinct">
腎炎から腎臓を保護する合成ペプチド(TNF由来TIPペプチド)を開発
 合成ペプチド(TNF由来のTIPペプチド)が腎炎で起こる破壊的な炎症を中断し、腎臓がその重要な機能をよりよく回復し維持することを可能にするとジョージア医科大学の研究者らは報告している。TIPペプチドを全身に投与しても腎臓に直接投与しても、血圧を上昇させることなく免疫細胞の腎臓への移動を抑制し、炎症と損傷を解消し、腎機能を改善した。
2019年3月20日にKidney Internationalのオンラインで公開されたこの論文のタイトルは「TNF由来TIPペプチドは上皮ナトリウムチャネルを活性化し、実験的腎毒性血清腎炎を改善する(The TNF-Derived TIP Peptide Activates the Epithelial Sodium Channel and Ameliorates Experimental Nephrotoxic Serum Nephritis.)」と題されている。重度の感染症や怪我、そしてコントロールできない高血圧や糖尿病などの病気は、腎臓とそれぞれに含まれる100万のフィルターユニットの両方に影響を与え、急性または慢性の腎炎を引き起こす可能性がある。 特に腎炎が慢性の場合、患者はしばしば腎不全や透析を受けるため、基礎研究者や医師はより良い改善方法を求めている。そこで、この研究の研究者たちは、腎炎の徴候の数日以内に、将来患者に与えられるかもしれないのと同じ方法でTIPペプチドを与えた。研究者らは、中等度腎炎の動物モデルにおいて、腎臓機能不全の兆候である尿中の過剰な炎症やタンパク質のような顕著な問題を動物が回避できることを発見した、とジョージア医科大学(MCG)血管生物学センターの准教授で、Kidney Internationalの論文の上級著者であるRudolf Lucas博士は語った。致命的な重症腎炎マウスモデルにおいて、合成ペプチド
合成ペプチド(TNF由来のTIPペプチド)が腎炎で起こる破壊的な炎症を中断し、腎臓がその重要な機能をよりよく回復し維持することを可能にするとジョージア医科大学の研究者らは報告している。TIPペプチドを全身に投与しても腎臓に直接投与しても、血圧を上昇させることなく免疫細胞の腎臓への移動を抑制し、炎症と損傷を解消し、腎機能を改善した。
2019年3月20日にKidney Internationalのオンラインで公開されたこの論文のタイトルは「TNF由来TIPペプチドは上皮ナトリウムチャネルを活性化し、実験的腎毒性血清腎炎を改善する(The TNF-Derived TIP Peptide Activates the Epithelial Sodium Channel and Ameliorates Experimental Nephrotoxic Serum Nephritis.)」と題されている。重度の感染症や怪我、そしてコントロールできない高血圧や糖尿病などの病気は、腎臓とそれぞれに含まれる100万のフィルターユニットの両方に影響を与え、急性または慢性の腎炎を引き起こす可能性がある。 特に腎炎が慢性の場合、患者はしばしば腎不全や透析を受けるため、基礎研究者や医師はより良い改善方法を求めている。そこで、この研究の研究者たちは、腎炎の徴候の数日以内に、将来患者に与えられるかもしれないのと同じ方法でTIPペプチドを与えた。研究者らは、中等度腎炎の動物モデルにおいて、腎臓機能不全の兆候である尿中の過剰な炎症やタンパク質のような顕著な問題を動物が回避できることを発見した、とジョージア医科大学(MCG)血管生物学センターの准教授で、Kidney Internationalの論文の上級著者であるRudolf Lucas博士は語った。致命的な重症腎炎マウスモデルにおいて、合成ペプチド
癌パスウェイへの共通の鍵を発見:p53の新規調節因子PIPK1-αが同定された。
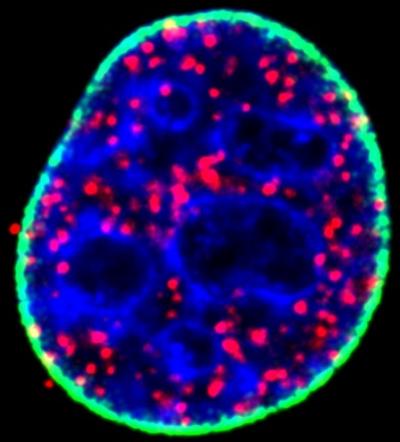 これまで突然変異したタンパク質p53が、さまざまな癌の発症において重要な因子であり、一方でその変異していない形態は、癌から保護することが知られてきた。 これらの対立する特質により、p53タンパク質およびそれをコードする遺伝子は生物学において最も研究されている対象の一つだが、その安定性および機能を支配する分子機構はまだ完全には理解されていない。
ウィスコンシン大学マディソン校(UW-Madison)の癌研究者であるRichard A. Anderson博士とウィスコンシン大学医学部のVincent Cryns医師らの研究チームは、重要なタンパク質の予想外の調節因子の発見を報告し、それを標的とする薬物の開発へ扉を開いた。2019年3月18日にNature Cell Biologyに掲載されたこの論文は、「核ホスホイノシチドキナーゼ複合体がp53を調節する(A Nuclear Phosphoinositide Kinase Complex Regulates p53.)」と題されている。「ローマ神話の出入り口と扉の守護神ヤヌスの様に、p53には2つの面がある。p53遺伝子は癌において最も頻繁に変異する遺伝子であり、そして変異すると、それはその機能を腫瘍抑制因子から癌遺伝子の大部分を駆動する癌遺伝子に変える。」とAnderson博士は述べた。Anderson博士によると、通常p53タンパク質は「ゲノムの保護者」として働き、紫外線、化学物質、その他の方法で損傷を受けたDNAの修復を開始し、腫瘍の増殖を防ぐ。 しかし、変異するとタンパク質は悪事を働くようになり、未変異のタンパク質よりも安定して豊富になり、細胞の核に蓄積して癌を引き起こす。ウィスコンシン大学の研究チームで、Suyong Choi博士とMo Chen博士がこの安定性を推進する新しいメカニズムを発見した。 この原因はPIP
これまで突然変異したタンパク質p53が、さまざまな癌の発症において重要な因子であり、一方でその変異していない形態は、癌から保護することが知られてきた。 これらの対立する特質により、p53タンパク質およびそれをコードする遺伝子は生物学において最も研究されている対象の一つだが、その安定性および機能を支配する分子機構はまだ完全には理解されていない。
ウィスコンシン大学マディソン校(UW-Madison)の癌研究者であるRichard A. Anderson博士とウィスコンシン大学医学部のVincent Cryns医師らの研究チームは、重要なタンパク質の予想外の調節因子の発見を報告し、それを標的とする薬物の開発へ扉を開いた。2019年3月18日にNature Cell Biologyに掲載されたこの論文は、「核ホスホイノシチドキナーゼ複合体がp53を調節する(A Nuclear Phosphoinositide Kinase Complex Regulates p53.)」と題されている。「ローマ神話の出入り口と扉の守護神ヤヌスの様に、p53には2つの面がある。p53遺伝子は癌において最も頻繁に変異する遺伝子であり、そして変異すると、それはその機能を腫瘍抑制因子から癌遺伝子の大部分を駆動する癌遺伝子に変える。」とAnderson博士は述べた。Anderson博士によると、通常p53タンパク質は「ゲノムの保護者」として働き、紫外線、化学物質、その他の方法で損傷を受けたDNAの修復を開始し、腫瘍の増殖を防ぐ。 しかし、変異するとタンパク質は悪事を働くようになり、未変異のタンパク質よりも安定して豊富になり、細胞の核に蓄積して癌を引き起こす。ウィスコンシン大学の研究チームで、Suyong Choi博士とMo Chen博士がこの安定性を推進する新しいメカニズムを発見した。 この原因はPIP
エピジェネティック変化を検出する新手法はバイサルファイトシーケンシングを置き換えるかもしれない
 イギリスのオックスフォードにあるルートヴィヒ癌研究所の科学者らは、2019年2月25日にNature Biotechnologyにオンラインで報告した研究で、DNAの化学修飾を検出するための新しく改良された方法を記載している。これらの修飾、または「エピジェネティック」マークは、遺伝子発現の制御を助け、それらのゲノム全体での異常な分布は癌の進行および治療抵抗性に関与している。
ルートヴィヒ癌研究所のアシスタントメンバーであるChunxiao Song博士とBenjamin Schuster-Boeckler博士が発表したこの論文は、「塩基分解での5-メチルシトシンおよび5-ヒドロキシメチルシトシンのバイサルファイトフリー直接検出(Bisulfite-Free Direct Detection of 5-methylcytosine and 5-hydroxymethylcytosine at Base Resolution.)」と題されている。この研究は、TET-assisted pyridine borane sequencing (TAPS)と呼ばれる彼らの方法が、DNAへのエピジェネティックな修飾をマッピングするための現在のゴールドスタンダードであるバイサルファイトシーケンシングと比べ、害が少なくより効率的な代替法であることを示している。「我々はTAPSがDNAエピジェネティックシークエンシングにおける新しい標準としてバイサルファイトシーケンシングを直接置き換えることができると思う。それはDNAエピジェネティックシークエンシングをより手頃な価格にし、より幅広い学術研究および臨床応用に利用できる。」とSong博士は述べた。エピジェネティック修飾の1つのクラスは、DNAの4つの塩基のうち1つへの化学基の結合を含む。 これらのマークはDNA配列自体を変えるのではなく、
イギリスのオックスフォードにあるルートヴィヒ癌研究所の科学者らは、2019年2月25日にNature Biotechnologyにオンラインで報告した研究で、DNAの化学修飾を検出するための新しく改良された方法を記載している。これらの修飾、または「エピジェネティック」マークは、遺伝子発現の制御を助け、それらのゲノム全体での異常な分布は癌の進行および治療抵抗性に関与している。
ルートヴィヒ癌研究所のアシスタントメンバーであるChunxiao Song博士とBenjamin Schuster-Boeckler博士が発表したこの論文は、「塩基分解での5-メチルシトシンおよび5-ヒドロキシメチルシトシンのバイサルファイトフリー直接検出(Bisulfite-Free Direct Detection of 5-methylcytosine and 5-hydroxymethylcytosine at Base Resolution.)」と題されている。この研究は、TET-assisted pyridine borane sequencing (TAPS)と呼ばれる彼らの方法が、DNAへのエピジェネティックな修飾をマッピングするための現在のゴールドスタンダードであるバイサルファイトシーケンシングと比べ、害が少なくより効率的な代替法であることを示している。「我々はTAPSがDNAエピジェネティックシークエンシングにおける新しい標準としてバイサルファイトシーケンシングを直接置き換えることができると思う。それはDNAエピジェネティックシークエンシングをより手頃な価格にし、より幅広い学術研究および臨床応用に利用できる。」とSong博士は述べた。エピジェネティック修飾の1つのクラスは、DNAの4つの塩基のうち1つへの化学基の結合を含む。 これらのマークはDNA配列自体を変えるのではなく、
ホオジロザメのゲノムが解読され、迅速な創傷治癒と癌抵抗性の秘密が明らかに。
 ホオジロザメは地球上で最も有名な海洋生物の1つであり、広く人々の注目を集め、ハリウッドの歴史の中で最も成功した映画の1つ「ジョーズ」を生み出した。このサメは、その巨大なサイズ(最大6メートルと3トン)、そしておよそ1200メートルの深さまで潜ることを含む顕著な特徴を有する。 ホオジロザメはまた、世界の海洋において比較的少数であることを考えると、重要な保全対象でもある。
この象徴的な頂点捕食者と一般的なサメの生物学を理解するために、ホオジロザメの全ゲノムが詳細に解読された。 (NSU)ノバサウスイースタン大学のSave Our Seas Foundationサメ研究センター(フロリダ州マイアミ)とガイハーヴェイ研究所(フロリダ州マイアミ)、コーネル大学獣医学部(ニューヨーク州イサカ)の科学者が率いるチーム そして、モントレーベイ水族館(カリフォルニア州モントレー)は、ホオジロザメのゲノムを完成させ、そしてそれを巨大なジンベイザメおよびヒトを含む他の様々な脊椎動物由来のゲノムと比較した。この研究論文はPNASで2019年2月19日にオンラインで報告され、「White Shark Genomeは創傷治癒とゲノム安定性の維持に関連する古代の軟骨魚類の適応を明らかにする(White Shark Genome Reveals Ancient Elasmobranch Adaptations Associated with Wound Healing and the Maintenance of Genome Stability.)」と題されている。ホオジロザメのゲノムを解読すると、その巨大なサイズ(ヒトゲノムの1.5倍のサイズ)だけでなく、大型で長寿命のサメの進化的な成功の背後にある豊富な遺伝的変化も明らかになった。研究者らは、ゲノム安定性の維持に重要な役割を果たす多数の遺伝子におけ
ホオジロザメは地球上で最も有名な海洋生物の1つであり、広く人々の注目を集め、ハリウッドの歴史の中で最も成功した映画の1つ「ジョーズ」を生み出した。このサメは、その巨大なサイズ(最大6メートルと3トン)、そしておよそ1200メートルの深さまで潜ることを含む顕著な特徴を有する。 ホオジロザメはまた、世界の海洋において比較的少数であることを考えると、重要な保全対象でもある。
この象徴的な頂点捕食者と一般的なサメの生物学を理解するために、ホオジロザメの全ゲノムが詳細に解読された。 (NSU)ノバサウスイースタン大学のSave Our Seas Foundationサメ研究センター(フロリダ州マイアミ)とガイハーヴェイ研究所(フロリダ州マイアミ)、コーネル大学獣医学部(ニューヨーク州イサカ)の科学者が率いるチーム そして、モントレーベイ水族館(カリフォルニア州モントレー)は、ホオジロザメのゲノムを完成させ、そしてそれを巨大なジンベイザメおよびヒトを含む他の様々な脊椎動物由来のゲノムと比較した。この研究論文はPNASで2019年2月19日にオンラインで報告され、「White Shark Genomeは創傷治癒とゲノム安定性の維持に関連する古代の軟骨魚類の適応を明らかにする(White Shark Genome Reveals Ancient Elasmobranch Adaptations Associated with Wound Healing and the Maintenance of Genome Stability.)」と題されている。ホオジロザメのゲノムを解読すると、その巨大なサイズ(ヒトゲノムの1.5倍のサイズ)だけでなく、大型で長寿命のサメの進化的な成功の背後にある豊富な遺伝的変化も明らかになった。研究者らは、ゲノム安定性の維持に重要な役割を果たす多数の遺伝子におけ
全身性エリテマトーデスは腸内マイクロバイオームの不均衡と強く関連。患者には5倍過剰のRuminococcus gnavisが見られた。
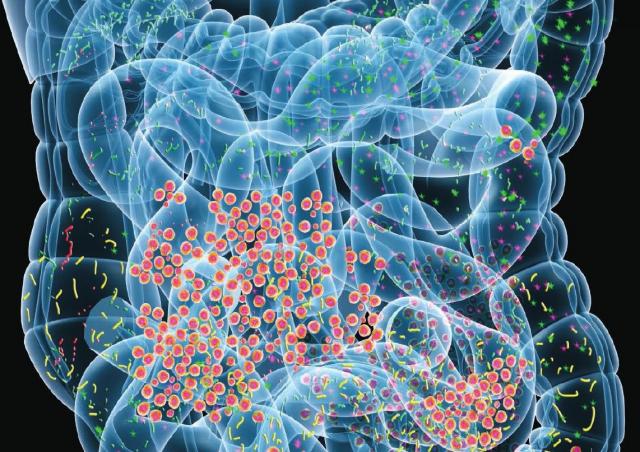 身体の免疫系による関節、皮膚、および腎臓への攻撃が特徴の病気である全身性エリテマトーデス(SLE:systemic lupus erythematosus)は、腸内のバクテリアの異常な混合と関連していることが新研究で判明した。これは、ニューヨーク大学Langone Health / ニューヨーク大学医学部の科学者らによる新研究によるものだ。 細菌性不均衡は炎症性腸疾患、関節炎、そしていくつかの癌を含む多くの免疫関連疾患と結びついているが、この研究は腸内の細菌性不均衡とSLEの潜在的な生命への脅威の関連についての初めての詳細な証拠である。
2019年2月19日にリウマチ性疾患学会誌にオンラインで発表されたこの新研究は、SLEと診断された61人の女性が、同じ年齢および人種的背景を持たない17人の健常な女性の約5倍以上の腸内細菌を持っていたことを示した。狼瘡(Lupus)は男性より女性の方が多い。研究結果によると、皮膚の発疹や関節の痛みから透析を必要とする重度の腎臓機能障害に至るまでの疾患「フレア(flares)」において、腸内で増殖するR.gnavus菌を示す抗体が血液サンプルに大幅に増加するという。腎臓フレアを有する試験参加者は、R. gnavusに対する抗体が特に高レベルであった。このオープンアクセスの論文は、「狼瘡腎炎は疾患活動の拡大と腸の常在菌に対する免疫に関連している(Lupus Nephritis Is Linked to Disease-Activity Associated Expansions and Immunity to a Gut Commensal.)」と題されている。著者らは、遺伝的要因もあり、150万人ものアメリカ人に影響を与える狼瘡の具体的な原因は不明であると述べている。
「一部の患者では、細菌性の不均衡が狼瘡とその関連疾患の再発を引き起こし
身体の免疫系による関節、皮膚、および腎臓への攻撃が特徴の病気である全身性エリテマトーデス(SLE:systemic lupus erythematosus)は、腸内のバクテリアの異常な混合と関連していることが新研究で判明した。これは、ニューヨーク大学Langone Health / ニューヨーク大学医学部の科学者らによる新研究によるものだ。 細菌性不均衡は炎症性腸疾患、関節炎、そしていくつかの癌を含む多くの免疫関連疾患と結びついているが、この研究は腸内の細菌性不均衡とSLEの潜在的な生命への脅威の関連についての初めての詳細な証拠である。
2019年2月19日にリウマチ性疾患学会誌にオンラインで発表されたこの新研究は、SLEと診断された61人の女性が、同じ年齢および人種的背景を持たない17人の健常な女性の約5倍以上の腸内細菌を持っていたことを示した。狼瘡(Lupus)は男性より女性の方が多い。研究結果によると、皮膚の発疹や関節の痛みから透析を必要とする重度の腎臓機能障害に至るまでの疾患「フレア(flares)」において、腸内で増殖するR.gnavus菌を示す抗体が血液サンプルに大幅に増加するという。腎臓フレアを有する試験参加者は、R. gnavusに対する抗体が特に高レベルであった。このオープンアクセスの論文は、「狼瘡腎炎は疾患活動の拡大と腸の常在菌に対する免疫に関連している(Lupus Nephritis Is Linked to Disease-Activity Associated Expansions and Immunity to a Gut Commensal.)」と題されている。著者らは、遺伝的要因もあり、150万人ものアメリカ人に影響を与える狼瘡の具体的な原因は不明であると述べている。
「一部の患者では、細菌性の不均衡が狼瘡とその関連疾患の再発を引き起こし
サイエンス誌が選んだ2018年のブレークスルー「細胞ごとに胚発生を追う」を加速するエール大学での数学の進歩
 カメラの進歩と同様、一般的なバイオインフォマティクスデータの可視化手法の重要な数学的更新により、単一細胞遺伝子発現のスナップショットが数倍の速さ且つ遥かに高い解像度で作成できるようになった。2019年2月11日にNature Methodsに掲載されたこのエール大学の数学者による革新は、100万点のシングルセルRNAシーケンス(scRNA-seq)データセットのレンダリング時間を3時間以上からわずか15分に短縮するものだ。
この論文は「単細胞RNA配列データの可視化を改善するための高速補間ベースのt-SNE(Fast Interpolation-Based t-SNE for Improved Visualization of Single-Cell RNA-seq Data.)」と題されている。科学者たちは、既存の10年前の方法であるt 分布型確率的近傍埋め込み(t-SNE:t-distributed Stochastic Neighborhood Embedding)は、単一細胞レベルで集められたRNA配列決定データ(scRNA-seqデータ)のパターンを二次元で表現するのに最適だと言う。
「t-SNEは発現する遺伝子によって細胞を纏め、新しい細胞型と細胞状態を発見するために使用されてきた。」と論文の筆頭著者であるエール大学の応用数学を専門とするGeorge Linderman博士は語った。しかし、計算標準では、t-SNEは非常に遅い。 したがって、研究者はしばしばt-SNEを適用する前に、scRNA-seqデータセットを「ダウンサンプリング」する。 しかし、ダウンサンプリングはt-SNEが希少細胞集団を捕獲することを出来なくするので、妥協案としては不十分だ。30年以上前に、エール大学の別の数学者チームが高速多極子法(FMM:fast multipole me
カメラの進歩と同様、一般的なバイオインフォマティクスデータの可視化手法の重要な数学的更新により、単一細胞遺伝子発現のスナップショットが数倍の速さ且つ遥かに高い解像度で作成できるようになった。2019年2月11日にNature Methodsに掲載されたこのエール大学の数学者による革新は、100万点のシングルセルRNAシーケンス(scRNA-seq)データセットのレンダリング時間を3時間以上からわずか15分に短縮するものだ。
この論文は「単細胞RNA配列データの可視化を改善するための高速補間ベースのt-SNE(Fast Interpolation-Based t-SNE for Improved Visualization of Single-Cell RNA-seq Data.)」と題されている。科学者たちは、既存の10年前の方法であるt 分布型確率的近傍埋め込み(t-SNE:t-distributed Stochastic Neighborhood Embedding)は、単一細胞レベルで集められたRNA配列決定データ(scRNA-seqデータ)のパターンを二次元で表現するのに最適だと言う。
「t-SNEは発現する遺伝子によって細胞を纏め、新しい細胞型と細胞状態を発見するために使用されてきた。」と論文の筆頭著者であるエール大学の応用数学を専門とするGeorge Linderman博士は語った。しかし、計算標準では、t-SNEは非常に遅い。 したがって、研究者はしばしばt-SNEを適用する前に、scRNA-seqデータセットを「ダウンサンプリング」する。 しかし、ダウンサンプリングはt-SNEが希少細胞集団を捕獲することを出来なくするので、妥協案としては不十分だ。30年以上前に、エール大学の別の数学者チームが高速多極子法(FMM:fast multipole me
膵臓癌に対する抗生物質・ストレプトゾトシンの細菌合成経路が明らかに。
 何十年もの間、科学者や医者は土壌中のバクテリアがある種の膵臓癌のための重要な治療薬である抗生物質化合物のストレプトゾトシンを製造することを知っていたが、バクテリアがどうやってそれを合成するのか不明だった。ハーバード大学の化学・化学生物学教授のEmily Balskus博士が率いる研究者チームはそのプロセスを解明し、この化合物が酵素経路を介して生産されることを初めて示し、そのプロセスを推進する新たな化学を明らかにした。
この研究は、2019年2月6日にNatureのオンラインに掲載された。 この論文は、「ストレプトゾトシンのファルマコフォアを構成するN-ニトロソ化金属酵素(An N-Nitrosating Metalloenzyme Constructs the Pharmacophore of Streptozotocin.)」と題されている。この分子を効果的な抗癌剤にするものは、ニトロソアミンとして知られている化学構造だ - これをBalskus博士は分子の反応性の「弾頭」と呼ぶ。 反応性が高いことが知られているニトロソアミンは、他の多くの化合物に対して有毒であることが示されており、たばこから塩漬け肉まであらゆるものに見られる発癌物質として癌治療以外で最も一般的に知られている。「この化学的モチーフは生物学的関連性が非常に高く、徹底的に調査されてきた。我々が研究するまで、この化学的モチーフが生物学的システムにおいてどのように生成されたのかという見解に非酵素化学が含まれていた - それは単に適切な条件下で起こったことにすぎない。」とBalskus博士は述べた。しかし、Balskus博士とその同僚は、この経緯はもっと複雑かもしれないと疑い、細菌がニトロソアミン化合物を生産するための自然な経路を進化させたかどうか探求に着手した。 「それがこの論文で我々が見つけたものだ。我
何十年もの間、科学者や医者は土壌中のバクテリアがある種の膵臓癌のための重要な治療薬である抗生物質化合物のストレプトゾトシンを製造することを知っていたが、バクテリアがどうやってそれを合成するのか不明だった。ハーバード大学の化学・化学生物学教授のEmily Balskus博士が率いる研究者チームはそのプロセスを解明し、この化合物が酵素経路を介して生産されることを初めて示し、そのプロセスを推進する新たな化学を明らかにした。
この研究は、2019年2月6日にNatureのオンラインに掲載された。 この論文は、「ストレプトゾトシンのファルマコフォアを構成するN-ニトロソ化金属酵素(An N-Nitrosating Metalloenzyme Constructs the Pharmacophore of Streptozotocin.)」と題されている。この分子を効果的な抗癌剤にするものは、ニトロソアミンとして知られている化学構造だ - これをBalskus博士は分子の反応性の「弾頭」と呼ぶ。 反応性が高いことが知られているニトロソアミンは、他の多くの化合物に対して有毒であることが示されており、たばこから塩漬け肉まであらゆるものに見られる発癌物質として癌治療以外で最も一般的に知られている。「この化学的モチーフは生物学的関連性が非常に高く、徹底的に調査されてきた。我々が研究するまで、この化学的モチーフが生物学的システムにおいてどのように生成されたのかという見解に非酵素化学が含まれていた - それは単に適切な条件下で起こったことにすぎない。」とBalskus博士は述べた。しかし、Balskus博士とその同僚は、この経緯はもっと複雑かもしれないと疑い、細菌がニトロソアミン化合物を生産するための自然な経路を進化させたかどうか探求に着手した。 「それがこの論文で我々が見つけたものだ。我
すべての生物における遺伝子発現制御と転写休止の要素メカニズムがウィスコンシン大学の研究で明らかに。
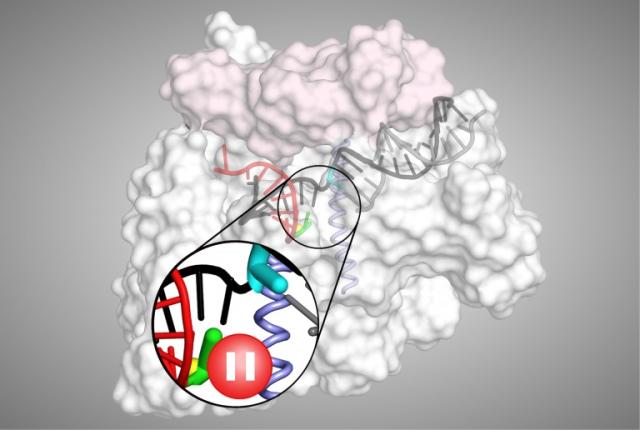 ウィスコンシン大学マディソン校の生化学および細菌学教授のRobert Landick博士と彼のチームが率いた研究は、すべての生物における遺伝子発現制御の根底にある現象、転写の一時停止の要素メカニズムを初めて明らかにした。この研究はまた、ディフィシル菌感染症や結核などの治療の重要な薬物標的である酵素RNAポリメラーゼについての新しい理解を提供している。
この発見は最終的に特定の薬がどのように酵素に対して作用し、積極的にそれを標的にするのを助けるかについての我々の理解を向上させることができる。遺伝子発現は、生物が必要とするすべてのタンパク質や他の分子にDNAが翻訳されるプロセスだ。 それはすべての生物学の学生が早い段階で学ぶプロセスだが、それは未だ完全には理解されていない。このプロセスは2段階で行われる。 転写は、RNAポリメラーゼがDNA鎖に関する情報を読む最初のもので、それからメッセンジャーRNA(mRNA)の新しい分子にコピーされる。 第二段階では、mRNAが移動してリボソームによってタンパク質にプロセシング(「翻訳」)される。遺伝子発現レベルを制御するのを助けるために、RNAポリメラーゼによる「転写休止」は2つの段階の間で起こり得、必要ならば転写が細胞によって終結または調節され得る一種の「障害」を提供する。「バクテリアから哺乳類まで、あらゆる生物においてRNAポリメラーゼの一時停止を引き起こすシーケンスは、より永続した一時停止が起こり得る一時停止状態で酵素を停止させる。この要素的な一時停止の基本的なメカニズムは明確に定義されていないので、我々はさまざまな生化学的および生物物理学的アプローチを使用してこれを調査することにした。」とLandick博士は説明した。
研究チームの分析によると、最初に、基本的な一時停止プロセスには、一時停止状態からの脱出を防ぐための障壁
ウィスコンシン大学マディソン校の生化学および細菌学教授のRobert Landick博士と彼のチームが率いた研究は、すべての生物における遺伝子発現制御の根底にある現象、転写の一時停止の要素メカニズムを初めて明らかにした。この研究はまた、ディフィシル菌感染症や結核などの治療の重要な薬物標的である酵素RNAポリメラーゼについての新しい理解を提供している。
この発見は最終的に特定の薬がどのように酵素に対して作用し、積極的にそれを標的にするのを助けるかについての我々の理解を向上させることができる。遺伝子発現は、生物が必要とするすべてのタンパク質や他の分子にDNAが翻訳されるプロセスだ。 それはすべての生物学の学生が早い段階で学ぶプロセスだが、それは未だ完全には理解されていない。このプロセスは2段階で行われる。 転写は、RNAポリメラーゼがDNA鎖に関する情報を読む最初のもので、それからメッセンジャーRNA(mRNA)の新しい分子にコピーされる。 第二段階では、mRNAが移動してリボソームによってタンパク質にプロセシング(「翻訳」)される。遺伝子発現レベルを制御するのを助けるために、RNAポリメラーゼによる「転写休止」は2つの段階の間で起こり得、必要ならば転写が細胞によって終結または調節され得る一種の「障害」を提供する。「バクテリアから哺乳類まで、あらゆる生物においてRNAポリメラーゼの一時停止を引き起こすシーケンスは、より永続した一時停止が起こり得る一時停止状態で酵素を停止させる。この要素的な一時停止の基本的なメカニズムは明確に定義されていないので、我々はさまざまな生化学的および生物物理学的アプローチを使用してこれを調査することにした。」とLandick博士は説明した。
研究チームの分析によると、最初に、基本的な一時停止プロセスには、一時停止状態からの脱出を防ぐための障壁
活性化PMNエクソソームはCOPDで肺の破壊を引き起こす病原体であることが判明した
 アラバマ大学バーミンガム校(University of Alabama at Birmingham :UAB)の研究者らは、慢性閉塞性肺疾患(COPD)患者の肺における慢性炎症と組織破壊との間の根本的なつながりである、これまで報告されていない新しい病原体を発見した。 COPDは世界における死因の第4位だ。精製された活性化多形核白血球(PMN: polymorphonuclear leukocytes)から収集された小さな細胞内粒子が健康なマウスの肺に点滴注入されたとき、この病原体 - PMN由来 エクソソーム - はCOPD損傷を引き起こした。
注目すべき点は、UABの研究者らはCOPDのヒト患者の肺液および肺疾患の気管支肺異形成症のICU乳児の肺液からエクソソームも収集した。 そのヒト由来のエクソソームを健康なマウスの肺に点滴注入すると、それらはまたCOPD肺損傷を引き起こした。損傷は主にヒトの肺由来のPMN由来のエクソソームからのものであった。 「この報告は、非感染性subcellular entityがヒトからマウスに移されたときに疾患表現型を再現する能力の最初のエビデンスのように思われる。これは非常に意味深い発見になると思われる。ここで発見したことの多くは、病気によっては他の組織にも当てはまるだろう。」とUAB医学部 肺・アレルギーおよび救急医療教授のJ. Edwin Blalock博士は述べた。免疫細胞炎症および組織破壊によって特徴付けられる他の疾患には、心臓発作、転移性癌および慢性腎臓病が含まれる。 活性化されたPMNエクソソームはまた、嚢胞性線維症などの過剰なPMN駆動炎症を有する他の疾患における肺損傷にも寄与し得る。この研究はCell誌で報告された。 この論文は2018年1月10日にオンラインで公開され、「活性化PMNエクソソーム:肺の中でマトリックスの破
アラバマ大学バーミンガム校(University of Alabama at Birmingham :UAB)の研究者らは、慢性閉塞性肺疾患(COPD)患者の肺における慢性炎症と組織破壊との間の根本的なつながりである、これまで報告されていない新しい病原体を発見した。 COPDは世界における死因の第4位だ。精製された活性化多形核白血球(PMN: polymorphonuclear leukocytes)から収集された小さな細胞内粒子が健康なマウスの肺に点滴注入されたとき、この病原体 - PMN由来 エクソソーム - はCOPD損傷を引き起こした。
注目すべき点は、UABの研究者らはCOPDのヒト患者の肺液および肺疾患の気管支肺異形成症のICU乳児の肺液からエクソソームも収集した。 そのヒト由来のエクソソームを健康なマウスの肺に点滴注入すると、それらはまたCOPD肺損傷を引き起こした。損傷は主にヒトの肺由来のPMN由来のエクソソームからのものであった。 「この報告は、非感染性subcellular entityがヒトからマウスに移されたときに疾患表現型を再現する能力の最初のエビデンスのように思われる。これは非常に意味深い発見になると思われる。ここで発見したことの多くは、病気によっては他の組織にも当てはまるだろう。」とUAB医学部 肺・アレルギーおよび救急医療教授のJ. Edwin Blalock博士は述べた。免疫細胞炎症および組織破壊によって特徴付けられる他の疾患には、心臓発作、転移性癌および慢性腎臓病が含まれる。 活性化されたPMNエクソソームはまた、嚢胞性線維症などの過剰なPMN駆動炎症を有する他の疾患における肺損傷にも寄与し得る。この研究はCell誌で報告された。 この論文は2018年1月10日にオンラインで公開され、「活性化PMNエクソソーム:肺の中でマトリックスの破
ブルドッグ、フレンチブルドッグ、ボストンテリアのWGSでスクリューテールの原因となる遺伝子変異を同定。ヒトの希少遺伝性疾患ルビノー症候群にも存在。
 その小さな体、頑固な顔つき、そして離れ目。ブルドッグ、フレンチブルドッグ、ボストンテリアは様々な犬種の中で最も人気が高い。カリフォルニア大学(UC)デイビス校 獣医学部の研究者らは、これらの犬の外観の遺伝的根拠を見出し、それをヒトにおける希少遺伝性疾患と結びつけた。
「ブルドッグ、フレンチブルドッグ、ボストンテリアは、短くて頭が広いというだけでなく、他の犬種には見られない別の特徴:短くてよじれた尾(スクリューテール)を共有している。これら3つの犬種はすべて尾骨を構成する椎骨を欠いている。」とカリフォルニア大学デービス校獣医学部のDanika Bannasch教授は述べている。研究者らは、100匹のイヌの全ゲノム - 全DNA配列 - のうち、10匹のスクリューテール犬種をシーケンスした。 参加している犬はすべて、カリフォルニア大学デービス校の獣医学教育病院で同意を得た個人所有のペットだった。大学院生のTamer MansourとKatherine Lucotは、獣医学部ゲノムセンターの准教授であるC. Titus Brown博士と一緒に、DNA配列を検索して、スクリューテール犬種に関連する変化を見つけた。この研究は、2018年12月のPLOS遺伝学のカバー記事として発表された。 この論文のタイトルは「100頭の犬における全ゲノム変異型関連がブルドッグ等スクリューテール犬種のルビノー様症候群に関与するDISHEVELED 2フレームシフト変異を識別(Whole Genome Variant Association Across 100 Dogs Identifies a Frame Shift Mutation in DISHEVELLED 2 Which Contributes to Robinow-Like Syndrome in Bulldogs and Rel
その小さな体、頑固な顔つき、そして離れ目。ブルドッグ、フレンチブルドッグ、ボストンテリアは様々な犬種の中で最も人気が高い。カリフォルニア大学(UC)デイビス校 獣医学部の研究者らは、これらの犬の外観の遺伝的根拠を見出し、それをヒトにおける希少遺伝性疾患と結びつけた。
「ブルドッグ、フレンチブルドッグ、ボストンテリアは、短くて頭が広いというだけでなく、他の犬種には見られない別の特徴:短くてよじれた尾(スクリューテール)を共有している。これら3つの犬種はすべて尾骨を構成する椎骨を欠いている。」とカリフォルニア大学デービス校獣医学部のDanika Bannasch教授は述べている。研究者らは、100匹のイヌの全ゲノム - 全DNA配列 - のうち、10匹のスクリューテール犬種をシーケンスした。 参加している犬はすべて、カリフォルニア大学デービス校の獣医学教育病院で同意を得た個人所有のペットだった。大学院生のTamer MansourとKatherine Lucotは、獣医学部ゲノムセンターの准教授であるC. Titus Brown博士と一緒に、DNA配列を検索して、スクリューテール犬種に関連する変化を見つけた。この研究は、2018年12月のPLOS遺伝学のカバー記事として発表された。 この論文のタイトルは「100頭の犬における全ゲノム変異型関連がブルドッグ等スクリューテール犬種のルビノー様症候群に関与するDISHEVELED 2フレームシフト変異を識別(Whole Genome Variant Association Across 100 Dogs Identifies a Frame Shift Mutation in DISHEVELLED 2 Which Contributes to Robinow-Like Syndrome in Bulldogs and Rel
癌治療における免疫チェックポイント阻害の成功に必要な転写因子を同定
 前臨床モデルにおいても癌患者においても、免疫チェックポイント阻害療法について多くの成功例がある。 しかし、そのような免疫療法がどのようにしてその反応を引き出すのか、そしてチェックポイント阻害療法が癌を根絶するための免疫システムの再活性化に成功(または失敗)する要因については、多くの疑問が残っている。ボストンのBrigham and Women's Hospitalの研究者らが同じくボストンにあるBroad研究所の同僚と共同で行った新しい研究で、腫瘍の免疫細胞の重要なクラスであるT細胞の異なる集団に対する免疫チェックポイント阻害療法の効果を調べた。このチームの驚くべき成果は、過去に見過ごされてきたT細胞の集団を示しており、治療に対する反応を予測する分子因子の同定につながっている。この論文は2019年1月8日のImmunityにオンラインで発表され、「チェックポイント阻害免疫療法は、PD-1-CD8 +腫瘍浸潤T細胞の動的変化を誘導する(Checkpoint Blockade Immunotherapy Induces Dynamic Changes in PD-1−CD8+ Tumor-Infiltrating T Cells.)」と題されている。「我々の研究は、腫瘍内のT細胞には非常に多様性があるという観察を利用している。異なる細胞集団に対する治療の効果を見て、我々は驚いて困惑した。 エクスプレスチェックポイント阻害剤は、遺伝レベルで有意な変化を示した」と、共著者であるBrighamの准科学者およびハーバード大学医学大学院の神経科学准教授のAna Anderson博士(写真)は述べた。 「以前はほとんど無視されてきた細胞だ。我々の研究ではチェックポイント阻害療法が何をしているのか、そしてそれがどのようにその効果を媒介するのかという焦点を広げている。」Anderson博士らは
前臨床モデルにおいても癌患者においても、免疫チェックポイント阻害療法について多くの成功例がある。 しかし、そのような免疫療法がどのようにしてその反応を引き出すのか、そしてチェックポイント阻害療法が癌を根絶するための免疫システムの再活性化に成功(または失敗)する要因については、多くの疑問が残っている。ボストンのBrigham and Women's Hospitalの研究者らが同じくボストンにあるBroad研究所の同僚と共同で行った新しい研究で、腫瘍の免疫細胞の重要なクラスであるT細胞の異なる集団に対する免疫チェックポイント阻害療法の効果を調べた。このチームの驚くべき成果は、過去に見過ごされてきたT細胞の集団を示しており、治療に対する反応を予測する分子因子の同定につながっている。この論文は2019年1月8日のImmunityにオンラインで発表され、「チェックポイント阻害免疫療法は、PD-1-CD8 +腫瘍浸潤T細胞の動的変化を誘導する(Checkpoint Blockade Immunotherapy Induces Dynamic Changes in PD-1−CD8+ Tumor-Infiltrating T Cells.)」と題されている。「我々の研究は、腫瘍内のT細胞には非常に多様性があるという観察を利用している。異なる細胞集団に対する治療の効果を見て、我々は驚いて困惑した。 エクスプレスチェックポイント阻害剤は、遺伝レベルで有意な変化を示した」と、共著者であるBrighamの准科学者およびハーバード大学医学大学院の神経科学准教授のAna Anderson博士(写真)は述べた。 「以前はほとんど無視されてきた細胞だ。我々の研究ではチェックポイント阻害療法が何をしているのか、そしてそれがどのようにその効果を媒介するのかという焦点を広げている。」Anderson博士らは
男女間の脳の違いと思春期のタイミングを左右する遺伝子に新たな知見。脳の性差は遺伝子に組み込まれているらしい。
 研究者らは、線虫のオスとメスの発育中の脳の違いを誘導し、思春期の開始、ヒトの性的成熟のタイミングを制御するのと同じ機能を持つであろう遺伝経路の引き金となる一群の遺伝子を同定した。コロンビア大学の科学者が率いるこの研究は、神経発達の性差における直接的な遺伝的影響についての新しい証拠を提供し、男性と女性の脳がどのように結びついているか、そしてそれらがどのように機能するかを理解しようとする試みである。
この研究は、2019年1月1日にハワード・ヒューズ医学研究所、マックス・プランク研究所、およびウェルカム・トラストによって設立されたオープンアクセスジャーナルeLifeに掲載された。 この論文のタイトルは「性的二型神経系分化のタイミングメカニズム(Timing Mechanism of Sexually Dimorphic Nervous System Differentiation.)」と題されている。思春期はホルモンシグナルの生成でニューロンが活性化することにより特徴付けられる脳の実質的な変化であることを科学者たちは長い間知っていた。しかし、思春期になるホルモンを脳が放出し始める原因は捉えどころのないままであった。コロンビア生物学科の教授でハワード・ヒューズ医学研究所の研究者であるOliver Hobert博士は、次のように述べている。「驚くべきことに、この経路の各メンバーはワームとヒトの間で受け継がれていることが分かった。これは、脳における性的な脳の違いが遺伝的にどのようにコードされるかについての一般原則を明らかにしたことを示している。」この研究のために、研究者らはゲノム配列を決定した最初の多細胞生物である透明線虫C. elegansを利用した。 このワームの遺伝子構成はヒトのものと非常によく似ており、分子遺伝学および発生生物学における最も強力な研究モデルの1つである。
研究者らは、線虫のオスとメスの発育中の脳の違いを誘導し、思春期の開始、ヒトの性的成熟のタイミングを制御するのと同じ機能を持つであろう遺伝経路の引き金となる一群の遺伝子を同定した。コロンビア大学の科学者が率いるこの研究は、神経発達の性差における直接的な遺伝的影響についての新しい証拠を提供し、男性と女性の脳がどのように結びついているか、そしてそれらがどのように機能するかを理解しようとする試みである。
この研究は、2019年1月1日にハワード・ヒューズ医学研究所、マックス・プランク研究所、およびウェルカム・トラストによって設立されたオープンアクセスジャーナルeLifeに掲載された。 この論文のタイトルは「性的二型神経系分化のタイミングメカニズム(Timing Mechanism of Sexually Dimorphic Nervous System Differentiation.)」と題されている。思春期はホルモンシグナルの生成でニューロンが活性化することにより特徴付けられる脳の実質的な変化であることを科学者たちは長い間知っていた。しかし、思春期になるホルモンを脳が放出し始める原因は捉えどころのないままであった。コロンビア生物学科の教授でハワード・ヒューズ医学研究所の研究者であるOliver Hobert博士は、次のように述べている。「驚くべきことに、この経路の各メンバーはワームとヒトの間で受け継がれていることが分かった。これは、脳における性的な脳の違いが遺伝的にどのようにコードされるかについての一般原則を明らかにしたことを示している。」この研究のために、研究者らはゲノム配列を決定した最初の多細胞生物である透明線虫C. elegansを利用した。 このワームの遺伝子構成はヒトのものと非常によく似ており、分子遺伝学および発生生物学における最も強力な研究モデルの1つである。
スタチンは褐色脂肪を減らすことが判明
 成人の一定割合は白色脂肪組織だけでなく褐色脂肪組織も有している。この褐色脂肪組織は糖と脂肪を熱に変えるのを助ける。 褐色脂肪組織を持つ人は、冬に体温を調整するのが得意で、体重超過や糖尿病に苦しむ可能性が低いとされている。
ETHチューリッヒのトランスレーショナル栄養生物学教授であるChristian Wolfrum博士が率いる国際的な研究チームは、スタチンクラスの医薬品が褐色脂肪組織の形成を減少させることを発見した。この論文は、2018年12月20日にCell Metabolismにオンライン掲載され、「タンパク質のプレニル化に影響を与えることによって、マウスおよび男性において脂肪細胞の褐変を防ぐメバロン酸経路の阻害(Inhibition of Mevalonate Pathway Prevents Adipocyte Browning in Mice and Men by Affecting Protein Prenylation.)」と題されている。スタチンは血液中のコレステロール値を下げ心臓発作の危険性を減らす目的で処方されている世界で最も一般的に処方されている薬の一つである。Wolfrum博士と彼の同僚は長年にわたり褐色脂肪組織を研究してきた。 彼らは、私たちの肌下脂肪層を形成する「悪い」白い脂肪細胞が、どのように「良い」褐色の脂肪細胞になるかという課題を調べた。 細胞培養実験を行った結果、彼らはコレステロールの生産に関与する生化学的経路がこの形質転換において中心的な役割を果たすことを発見した。 彼らはまた、変換を制御する重要な分子が代謝産物のゲラニルゲラニルピロリン酸であることを発見した。以前の研究は、コレステロールの生化学的経路もスタチンの機能の中心であることを示した。 それらの効果の1つは、ゲラニルゲラニルピロリン酸の産生を減少させることである。 スタチンが
成人の一定割合は白色脂肪組織だけでなく褐色脂肪組織も有している。この褐色脂肪組織は糖と脂肪を熱に変えるのを助ける。 褐色脂肪組織を持つ人は、冬に体温を調整するのが得意で、体重超過や糖尿病に苦しむ可能性が低いとされている。
ETHチューリッヒのトランスレーショナル栄養生物学教授であるChristian Wolfrum博士が率いる国際的な研究チームは、スタチンクラスの医薬品が褐色脂肪組織の形成を減少させることを発見した。この論文は、2018年12月20日にCell Metabolismにオンライン掲載され、「タンパク質のプレニル化に影響を与えることによって、マウスおよび男性において脂肪細胞の褐変を防ぐメバロン酸経路の阻害(Inhibition of Mevalonate Pathway Prevents Adipocyte Browning in Mice and Men by Affecting Protein Prenylation.)」と題されている。スタチンは血液中のコレステロール値を下げ心臓発作の危険性を減らす目的で処方されている世界で最も一般的に処方されている薬の一つである。Wolfrum博士と彼の同僚は長年にわたり褐色脂肪組織を研究してきた。 彼らは、私たちの肌下脂肪層を形成する「悪い」白い脂肪細胞が、どのように「良い」褐色の脂肪細胞になるかという課題を調べた。 細胞培養実験を行った結果、彼らはコレステロールの生産に関与する生化学的経路がこの形質転換において中心的な役割を果たすことを発見した。 彼らはまた、変換を制御する重要な分子が代謝産物のゲラニルゲラニルピロリン酸であることを発見した。以前の研究は、コレステロールの生化学的経路もスタチンの機能の中心であることを示した。 それらの効果の1つは、ゲラニルゲラニルピロリン酸の産生を減少させることである。 スタチンが
PMWC2019がシリコンバレーで1月に開催。ルミナリー賞受賞者のQ&Aインタビューを公開。
 今年で10周年となるPrecision Medicine World Conference(PMWC)が、2019年1月20日から23日まで、約2,500人が参加してサンタクララコンベンションセンター(カリフォルニア州シリコンバレー)で開催される。この興味深い複数の関連分野の著名な専門家との集まりは、UCSF、スタンフォードヘルスケア/スタンフォード大学医学部、デューク大学、デュークヘルスとジョンズホプキンス大学によって共催される。
このプログラムは革新的な技術、活発なイニシアチブ、そして医療の直接的な改善についての臨床ケーススタディーをカバーする。会議出席者は、精密医療の最新の進歩と進捗、および患者の在り方を変える最先端の新しい戦略と解決策について直接学ぶ機会を得るだろう。(https://www.pmwcintl.com/about/#audience)5つのトラックに分かれたプログラムには、以下の主要トピックに関するセッションが含まれている:AI&データサイエンス、臨床&研究ツール、臨床診断、リキッドバイオプシー・ctDNAなどによる臨床価値の創出、デジタルヘルス/健康とウェルネス、薬理ゲノム学、精密医療における新技術、免疫療法、大規模バイオデータリソース 医薬品開発、希少疾患の診断、健康と老化。
会議の主催者は、450人以上のヘルスケアおよびバイオテクノロジー分野の先駆的な研究者および第一人者をスピーカーに集めた。(https://www.pmwcintl.com/2019sv/speakers/) 会議はPMWCのルミナリー賞とパイオニア賞(https://www.pmwcintl.com/2019sv/awards/)の発表から始まる。PMWC ルミナリー賞は、個別化医療を臨床市場に普及させた著名人の最近の貢献を表彰するものだ。 PMWCパイオニア賞は
今年で10周年となるPrecision Medicine World Conference(PMWC)が、2019年1月20日から23日まで、約2,500人が参加してサンタクララコンベンションセンター(カリフォルニア州シリコンバレー)で開催される。この興味深い複数の関連分野の著名な専門家との集まりは、UCSF、スタンフォードヘルスケア/スタンフォード大学医学部、デューク大学、デュークヘルスとジョンズホプキンス大学によって共催される。
このプログラムは革新的な技術、活発なイニシアチブ、そして医療の直接的な改善についての臨床ケーススタディーをカバーする。会議出席者は、精密医療の最新の進歩と進捗、および患者の在り方を変える最先端の新しい戦略と解決策について直接学ぶ機会を得るだろう。(https://www.pmwcintl.com/about/#audience)5つのトラックに分かれたプログラムには、以下の主要トピックに関するセッションが含まれている:AI&データサイエンス、臨床&研究ツール、臨床診断、リキッドバイオプシー・ctDNAなどによる臨床価値の創出、デジタルヘルス/健康とウェルネス、薬理ゲノム学、精密医療における新技術、免疫療法、大規模バイオデータリソース 医薬品開発、希少疾患の診断、健康と老化。
会議の主催者は、450人以上のヘルスケアおよびバイオテクノロジー分野の先駆的な研究者および第一人者をスピーカーに集めた。(https://www.pmwcintl.com/2019sv/speakers/) 会議はPMWCのルミナリー賞とパイオニア賞(https://www.pmwcintl.com/2019sv/awards/)の発表から始まる。PMWC ルミナリー賞は、個別化医療を臨床市場に普及させた著名人の最近の貢献を表彰するものだ。 PMWCパイオニア賞は
母乳中のオリゴ糖とマイクロバイオームが新生児ロタウイルス感染に影響していることが判明
 学際的なアプローチにより、テキサス州のベイラー医科大学を含むいくつかの機関から成る国際研究チームは、人乳中のオリゴ糖とマイクロバイオームとの間の複雑な相互作用が新生児ロタウイルス感染に影響を及ぼすことを明らかにした。Nature Communications誌にオンラインで報告されたこの研究は、新生児におけるロタウイルス感染症についての新しい理解を提供し、生弱毒化ロタウイルスワクチンの性能を改善することができる母性成分の同定に役立つ。
2018年11月27日に掲載されたこのオープンアクセスの論文は、「ヒト乳オリゴ糖、乳マイクロバイオームおよび乳児腸マイクロバイオームは新生児ロタウイルス感染を調節する(Human Milk Oligosaccharides, Milk Microbiome and Infant Gut Microbiome Modulate Neonatal Rotavirus Infection.)」と題されている。「ロタウイルス感染症は生後28日未満の子供を除き、主に5歳未満の子供に下痢と嘔吐を引き起こすが、通常は症状はない。しかし、新生児の感染症は深刻な胃腸障害に関連することがある。症状の有無にかかわらず、どの要因が新生児の違いを示すかははっきりと分かっていない。」とベイラー医科大学分子ウイルス学・微生物学の助教授で筆頭著者であるSasirekha Ramani博士(写真)は語った。「我々は何年も前にこの調査をロタウイルスの特定の株が新生児の無症候性感染症と臨床症状の両方に関連していることを決定するために開始した。」Ramani博士とその同僚は、ウイルスの観点から最初の答えを探し始めた。彼女らは、新生児のウイルス量やウイルスのゲノムなどの因子が新生児の症状の存在と関連しているかどうかを調査したが、それらの因子間に関連性は見いだされなかった。その後、新
学際的なアプローチにより、テキサス州のベイラー医科大学を含むいくつかの機関から成る国際研究チームは、人乳中のオリゴ糖とマイクロバイオームとの間の複雑な相互作用が新生児ロタウイルス感染に影響を及ぼすことを明らかにした。Nature Communications誌にオンラインで報告されたこの研究は、新生児におけるロタウイルス感染症についての新しい理解を提供し、生弱毒化ロタウイルスワクチンの性能を改善することができる母性成分の同定に役立つ。
2018年11月27日に掲載されたこのオープンアクセスの論文は、「ヒト乳オリゴ糖、乳マイクロバイオームおよび乳児腸マイクロバイオームは新生児ロタウイルス感染を調節する(Human Milk Oligosaccharides, Milk Microbiome and Infant Gut Microbiome Modulate Neonatal Rotavirus Infection.)」と題されている。「ロタウイルス感染症は生後28日未満の子供を除き、主に5歳未満の子供に下痢と嘔吐を引き起こすが、通常は症状はない。しかし、新生児の感染症は深刻な胃腸障害に関連することがある。症状の有無にかかわらず、どの要因が新生児の違いを示すかははっきりと分かっていない。」とベイラー医科大学分子ウイルス学・微生物学の助教授で筆頭著者であるSasirekha Ramani博士(写真)は語った。「我々は何年も前にこの調査をロタウイルスの特定の株が新生児の無症候性感染症と臨床症状の両方に関連していることを決定するために開始した。」Ramani博士とその同僚は、ウイルスの観点から最初の答えを探し始めた。彼女らは、新生児のウイルス量やウイルスのゲノムなどの因子が新生児の症状の存在と関連しているかどうかを調査したが、それらの因子間に関連性は見いだされなかった。その後、新
低温で寿命が延びるのは、代謝率の低下による受動的な反応性酸素種(ROS)の減少によるものではなく、遺伝子によって能動的に制御されていることが新研究で証明された
 なぜ私たちは年を取るのか? 何世紀にも渡り研究されているが(そしてアンチエイジングは巨大な産業でもあるが)、年齢とともに細胞や臓器が劣化する要因はまだほとんど解っていない。一つ知られているファクターは温度である。多くの動物種は、より高い温度よりも低い温度でより長く生きる。
シカゴ大学の関連組織であるマサチューセッツ州ウッズホールの海洋生物学研究所(MBL)の助教授であるKristin Gribble博士(写真)は、「毎日冷たいシャワーを浴びると、寿命を延ばすことができると強く信じている人々がいる」と述べている。しかし、Gribble博士の新研究では、単にサーモスタットを下げるだけではないことを示している。 むしろ、温度が寿命に影響を及ぼす度合いは、個体の遺伝子に依存する。Experimental Gerontology(114:99-106; 2018)に掲載されたこの新しい研究論文は、「寿命延長と老化の併発性変化は、低温に対応した加齢の能動的調節を示唆する(Congeneric Variability in Lifespan Extension and Onset of Senescence Suggest Active Regulation of Aging in Response to Low Temperature.)」と題されている。
Gribble博士の研究は、100年以上の老化研究に用いられてきた小動物のワムシ類で行われた。Gribble博士のチームは、生存期間延長のメカニズムが純粋に熱力学的応答であるならば、全ての株が同様の寿命を増加させるはずであるという仮説を立てて、11種の遺伝的に異なるワムシ(ツボワムシ)を低温にさらした。しかし、寿命の中央値は6%から100%の範囲で増加した。 彼らは死亡率の差も観察した。この研究は、1950年代からこの分野
なぜ私たちは年を取るのか? 何世紀にも渡り研究されているが(そしてアンチエイジングは巨大な産業でもあるが)、年齢とともに細胞や臓器が劣化する要因はまだほとんど解っていない。一つ知られているファクターは温度である。多くの動物種は、より高い温度よりも低い温度でより長く生きる。
シカゴ大学の関連組織であるマサチューセッツ州ウッズホールの海洋生物学研究所(MBL)の助教授であるKristin Gribble博士(写真)は、「毎日冷たいシャワーを浴びると、寿命を延ばすことができると強く信じている人々がいる」と述べている。しかし、Gribble博士の新研究では、単にサーモスタットを下げるだけではないことを示している。 むしろ、温度が寿命に影響を及ぼす度合いは、個体の遺伝子に依存する。Experimental Gerontology(114:99-106; 2018)に掲載されたこの新しい研究論文は、「寿命延長と老化の併発性変化は、低温に対応した加齢の能動的調節を示唆する(Congeneric Variability in Lifespan Extension and Onset of Senescence Suggest Active Regulation of Aging in Response to Low Temperature.)」と題されている。
Gribble博士の研究は、100年以上の老化研究に用いられてきた小動物のワムシ類で行われた。Gribble博士のチームは、生存期間延長のメカニズムが純粋に熱力学的応答であるならば、全ての株が同様の寿命を増加させるはずであるという仮説を立てて、11種の遺伝的に異なるワムシ(ツボワムシ)を低温にさらした。しかし、寿命の中央値は6%から100%の範囲で増加した。 彼らは死亡率の差も観察した。この研究は、1950年代からこの分野
希少遺伝病の研究から重要な免疫調節因子が明らかに
 スクリプス研究所の科学者は、原理上、癌および慢性ウイルス感染を治療するための標的にすることができる重要な免疫系調節タンパク質を発見した。2018年11月12日にNature Chemical Biologyに掲載されたこの研究では、脳と神経の宿主を特徴とする希少な遺伝病を引き起こすタンパク質ABHD12 (abhydrolase domain containing protein 12)の機能について特定している。
この論文は、「Lyso-PSリパーゼABHD12の選択的遮断は、in vivoでの免疫応答を刺激する(Selective Blockade of the Lyso-PS Lipase ABHD12 Stimulates Immune Responses in Vivo.)」と題されている。研究者らは、ABHD12が通常、過活動にならないようにするため、免疫系の強力な「ブレーキ」として機能することを発見した。 このタンパク質を持たない操作されたマウスは炎症の徴候を示し、その免疫系はウイルス感染に過剰反応する可能性がより高い。この発見は、その遺伝子の突然変異型を有する人々におけるABHD12の欠損が、過度の免疫活性によって少なくとも部分的に神経疾患を引き起こし得ることを示唆している。 また、ABHD12は、免疫システムを強化する薬剤(例えば、通常、人の免疫防御を止めることによって持続する癌およびウイルスなどに対する)の有用な標的であり得ることも示している。「これは、希少遺伝病の研究がヒト生物学において重要な役割を果たすパスウェイを明らかにした良い事例だ」と、共同研究者のスクリプス研究所の化学生理学教授であるBenjamin Cravatt博士は述べた。この場合の稀少疾患は、科学者が略語PHARC(多発性神経障害、難聴、運動失調、色素性網膜炎、および白内障)と
スクリプス研究所の科学者は、原理上、癌および慢性ウイルス感染を治療するための標的にすることができる重要な免疫系調節タンパク質を発見した。2018年11月12日にNature Chemical Biologyに掲載されたこの研究では、脳と神経の宿主を特徴とする希少な遺伝病を引き起こすタンパク質ABHD12 (abhydrolase domain containing protein 12)の機能について特定している。
この論文は、「Lyso-PSリパーゼABHD12の選択的遮断は、in vivoでの免疫応答を刺激する(Selective Blockade of the Lyso-PS Lipase ABHD12 Stimulates Immune Responses in Vivo.)」と題されている。研究者らは、ABHD12が通常、過活動にならないようにするため、免疫系の強力な「ブレーキ」として機能することを発見した。 このタンパク質を持たない操作されたマウスは炎症の徴候を示し、その免疫系はウイルス感染に過剰反応する可能性がより高い。この発見は、その遺伝子の突然変異型を有する人々におけるABHD12の欠損が、過度の免疫活性によって少なくとも部分的に神経疾患を引き起こし得ることを示唆している。 また、ABHD12は、免疫システムを強化する薬剤(例えば、通常、人の免疫防御を止めることによって持続する癌およびウイルスなどに対する)の有用な標的であり得ることも示している。「これは、希少遺伝病の研究がヒト生物学において重要な役割を果たすパスウェイを明らかにした良い事例だ」と、共同研究者のスクリプス研究所の化学生理学教授であるBenjamin Cravatt博士は述べた。この場合の稀少疾患は、科学者が略語PHARC(多発性神経障害、難聴、運動失調、色素性網膜炎、および白内障)と
米国血液学会で急性骨髄性白血病(AML)の患者特異的治療法への取り組みが報告された
 急性骨髄性白血病(AML)の患者に合わせた治療のために、白血病細胞の薬物感受性および耐性の迅速スクリーニングに進歩がみられている。 白血病幹細胞の薬物応答に関する研究は、治療が成功しなかった理由、または最初は有望な治療結果がなぜ持続しなかった理由を明らかにするかもしれない。 AMLは、ある種の血液形成細胞の重大な障害である。
この病気では、白血球に通常発達する骨髄中の特定の初期前駆細胞が適切に成熟しない。 それらは芽球と呼ばれる原始細胞として凍結され、さらに分化し成熟することはできない。これらが蓄積し、低血球数を引き起こして感染症と戦う能力を低下させ、低血小板数は生命を脅かす出血のリスクを引き起こす。未成熟の癌性血液細胞の前駆細胞である白血病幹細胞は、AMLを増殖させ、また治療後の再発にも関与する。がんの研究者は、このデータが標準的な療法への抵抗の手がかりといくつかの患者が再発する理由に対する手掛かりとなる可能性があるため、この細胞集団で遺伝子がどのように発現するかに興味があった。サンディエゴの第60回米国血液学会(2018年12月1-4日)で発表されたこの研究では、AMLと診断された個々の患者から採取した幹細胞および芽細胞の薬物応答パターンを調べた。 この情報は、多くのサンプルをすばやく評価してテストする最先端の方法であるハイスループットスクリーニングによって収集された。
研究者らは、白血病幹細胞および芽球細胞が薬剤感受性パターンで分岐し、これらのパターンが患者ごとに異なることを見出した。 例えば、芽細胞は、患者を治療するために最も一般的に使用される薬物に試験で応答したが、これらの薬物のいずれも白血病幹細胞に対して有効ではなかった。 研究者らは、芽細胞と比較して白血病幹細胞を優先的に標的としていると思われる12の薬物を8クラスから見出した。 これらの薬物の多くは、この
急性骨髄性白血病(AML)の患者に合わせた治療のために、白血病細胞の薬物感受性および耐性の迅速スクリーニングに進歩がみられている。 白血病幹細胞の薬物応答に関する研究は、治療が成功しなかった理由、または最初は有望な治療結果がなぜ持続しなかった理由を明らかにするかもしれない。 AMLは、ある種の血液形成細胞の重大な障害である。
この病気では、白血球に通常発達する骨髄中の特定の初期前駆細胞が適切に成熟しない。 それらは芽球と呼ばれる原始細胞として凍結され、さらに分化し成熟することはできない。これらが蓄積し、低血球数を引き起こして感染症と戦う能力を低下させ、低血小板数は生命を脅かす出血のリスクを引き起こす。未成熟の癌性血液細胞の前駆細胞である白血病幹細胞は、AMLを増殖させ、また治療後の再発にも関与する。がんの研究者は、このデータが標準的な療法への抵抗の手がかりといくつかの患者が再発する理由に対する手掛かりとなる可能性があるため、この細胞集団で遺伝子がどのように発現するかに興味があった。サンディエゴの第60回米国血液学会(2018年12月1-4日)で発表されたこの研究では、AMLと診断された個々の患者から採取した幹細胞および芽細胞の薬物応答パターンを調べた。 この情報は、多くのサンプルをすばやく評価してテストする最先端の方法であるハイスループットスクリーニングによって収集された。
研究者らは、白血病幹細胞および芽球細胞が薬剤感受性パターンで分岐し、これらのパターンが患者ごとに異なることを見出した。 例えば、芽細胞は、患者を治療するために最も一般的に使用される薬物に試験で応答したが、これらの薬物のいずれも白血病幹細胞に対して有効ではなかった。 研究者らは、芽細胞と比較して白血病幹細胞を優先的に標的としていると思われる12の薬物を8クラスから見出した。 これらの薬物の多くは、この
NASAアストロバイオロジー研究所の研究者ら、非相同末端結合(NHEJ)とレトロトランスポゾンが真核生物に進化を引き起こしたと発表
 ゲノムにおける相互作用は、何十億年も前の先進的な生命の発生の原動力の1つになった可能性がある。この発見は「ジャンピング遺伝子」として知られるレトロトランスポゾンへの好奇心がきっかけになった。ヒトゲノムのほぼ半分はレトロトランスポゾンで構成されているが、バクテリアにはほとんど存在しない。
イリノイ大学アーバナシャンペーン校(UIUC)の物理学教授でありNASAアストロバイオロジー研究所のディレクターでもあるNigel Goldenfeld博士と、元UIUC(現在はカリフォルニア大)の物理学教授であるThomas Kuhlman博士らは、これがなぜなのか疑問に思っていた。「本当に単純に、自分のゲノムからレトロトランスポゾンを取り出し、それをバクテリアに入れて何が起こるか見てみたいと考えた。それは本当に興味深いことになった。」とKuhlman博士は語った。彼らの成果は2018年11月19日にPNASでオンライン公開され、数十億年前に高度な生命がどのように誕生したかの謎に迫っている。また、他の惑星の生命の可能性を判断するのにも役立つ。このオープンアクセスのPNASの論文のタイトルは、「祖先真核細胞の出現のためのレトロエレメント侵入仮説のテスト(Testing the Retroelement Invasion Hypothesis for the Emergence of the Ancestral Eukaryotic Cell.)」と題されている。
研究の中で、研究者らは最初に死(細菌死)に遭遇した。細菌にレトロトランスポゾンを入れたとき、結果は致命的だった。 「彼らが飛び回って自分自身のコピーを作っていくうちに、バクテリアが生き残るために必要な遺伝子にジャンプした。それは信じられないほど致命的だ。」とKuhlman博士は語った。レトロトランスポゾンは、ゲノム内で自分自身を
ゲノムにおける相互作用は、何十億年も前の先進的な生命の発生の原動力の1つになった可能性がある。この発見は「ジャンピング遺伝子」として知られるレトロトランスポゾンへの好奇心がきっかけになった。ヒトゲノムのほぼ半分はレトロトランスポゾンで構成されているが、バクテリアにはほとんど存在しない。
イリノイ大学アーバナシャンペーン校(UIUC)の物理学教授でありNASAアストロバイオロジー研究所のディレクターでもあるNigel Goldenfeld博士と、元UIUC(現在はカリフォルニア大)の物理学教授であるThomas Kuhlman博士らは、これがなぜなのか疑問に思っていた。「本当に単純に、自分のゲノムからレトロトランスポゾンを取り出し、それをバクテリアに入れて何が起こるか見てみたいと考えた。それは本当に興味深いことになった。」とKuhlman博士は語った。彼らの成果は2018年11月19日にPNASでオンライン公開され、数十億年前に高度な生命がどのように誕生したかの謎に迫っている。また、他の惑星の生命の可能性を判断するのにも役立つ。このオープンアクセスのPNASの論文のタイトルは、「祖先真核細胞の出現のためのレトロエレメント侵入仮説のテスト(Testing the Retroelement Invasion Hypothesis for the Emergence of the Ancestral Eukaryotic Cell.)」と題されている。
研究の中で、研究者らは最初に死(細菌死)に遭遇した。細菌にレトロトランスポゾンを入れたとき、結果は致命的だった。 「彼らが飛び回って自分自身のコピーを作っていくうちに、バクテリアが生き残るために必要な遺伝子にジャンプした。それは信じられないほど致命的だ。」とKuhlman博士は語った。レトロトランスポゾンは、ゲノム内で自分自身を
良い栄養は、早期ストレスによって引き起こされる認知障害から子供を守ることができる
 2018年の内分泌学学会年次大会(11月19-21日 イギリス・グラスゴー)で、若年マウスのストレスに起因する脳の発育の変化を予防することがアムステルダム大学の研究チームによって発表された。この研究成果は、栄養豊富な食事が、早期ストレスに曝された若いマウスの脳の発達に保護的効果をもたらし、後の学習および記憶障害を軽減することを示唆している。
ヒトや動物において初期ストレスのような逆境への曝露は、脳機能に長期間影響を及ぼし、後の人生で認知障害を引き起こすことが報告されている。 出生直後の期間は脳の発達にとって重要であり、栄養素の需要は、エネルギーのためにも、発達する脳のための不可欠な構成要素である。したがって、この期間中の必須栄養素の欠損は、学習プロセスを含む脳機能の長期的な異常をもたらす可能性がある。身体のストレスと代謝過程は密接に関連しており、良質な栄養は早期のストレスに関連する認知障害を予防することができるが、これまで精力的に調査されて来なかった。
この研究で、アムステルダム大学のAniko Korosi博士らは、マウスの早期ストレスモデルを用いて、脳機能に必須の栄養素の影響を調べた。早期ストレスは母親の世話数を減らし、出生の最初の2週間以内の仔への注意を減らすことで模倣した。4ヵ月齢までに、これらの無視されたマウスは、体脂肪の増加、ストレスホルモンの高いレベル、および学習および記憶課題における貧弱なパフォーマンスを含むいくつかの障害を示す。 しかし、早期ストレス期間中わずか1週間の間、微量栄養素(ビタミンBや必須脂肪酸を含む)のカクテルを与えられたマウスは、4ヶ月で同じ学習および記憶課題の改善を示した。Korosi博士は次のように述べている。「早期ストレスに曝されたときの栄養状態が良いと、脳機能を保護することができ、後の人生で子供がよりうまく対処できるようになるか
2018年の内分泌学学会年次大会(11月19-21日 イギリス・グラスゴー)で、若年マウスのストレスに起因する脳の発育の変化を予防することがアムステルダム大学の研究チームによって発表された。この研究成果は、栄養豊富な食事が、早期ストレスに曝された若いマウスの脳の発達に保護的効果をもたらし、後の学習および記憶障害を軽減することを示唆している。
ヒトや動物において初期ストレスのような逆境への曝露は、脳機能に長期間影響を及ぼし、後の人生で認知障害を引き起こすことが報告されている。 出生直後の期間は脳の発達にとって重要であり、栄養素の需要は、エネルギーのためにも、発達する脳のための不可欠な構成要素である。したがって、この期間中の必須栄養素の欠損は、学習プロセスを含む脳機能の長期的な異常をもたらす可能性がある。身体のストレスと代謝過程は密接に関連しており、良質な栄養は早期のストレスに関連する認知障害を予防することができるが、これまで精力的に調査されて来なかった。
この研究で、アムステルダム大学のAniko Korosi博士らは、マウスの早期ストレスモデルを用いて、脳機能に必須の栄養素の影響を調べた。早期ストレスは母親の世話数を減らし、出生の最初の2週間以内の仔への注意を減らすことで模倣した。4ヵ月齢までに、これらの無視されたマウスは、体脂肪の増加、ストレスホルモンの高いレベル、および学習および記憶課題における貧弱なパフォーマンスを含むいくつかの障害を示す。 しかし、早期ストレス期間中わずか1週間の間、微量栄養素(ビタミンBや必須脂肪酸を含む)のカクテルを与えられたマウスは、4ヶ月で同じ学習および記憶課題の改善を示した。Korosi博士は次のように述べている。「早期ストレスに曝されたときの栄養状態が良いと、脳機能を保護することができ、後の人生で子供がよりうまく対処できるようになるか
脊髄損傷の修復を促進する新しい幹細胞集団が同定された
 イェール大学医学部とイタリアのピサ大学の生物学科のチームは、動物モデルで脊髄損傷の修復に特に効果的である特定の幹細胞集団(神経上皮幹細胞)を同定した。この実験では、これらの細胞が損傷組織内に組み込まれ、移植後に数センチメートルのプロセスを延長し、治療を受けた動物に運動機能回復をもたらすことを実証した。さらに、ラボの試験で示されているように、回復は傷害の程度に比例した。
例えば、脊髄損傷が25%以下であれば、2ヶ月以内に下肢の使用が有意に改善した。「この研究のおかげで、幹細胞の解剖学的起源は移植の成功にとって非常に重要であることが初めて明らかにされた。」と2018年8月24日にネイチャーコミュニケーションズでオンラインで公開されたこの研究の筆頭著者であるピサ大学のMarco Onorati博士は説明した。このオープンアクセスの論文は、「ヒト神経上皮幹細胞の部位特異性により、リレー回路を介して脊髄修復を可能にする(Human Neuroepithelial Stem Cell Regional Specificity Enables Spinal Cord Repair Through a Relay Circuit.)」と題されている。
実際、インビトロと同様だが、レシピエント組織(この場合、脊髄)と同じ起源を有する神経幹細胞は、多様な起源(例えば、脳由来)よりもはるかに効率的であることが判明し、 損傷領域との接続を再確立し、新しいニューロン回路の形成を保証する。「すべての幹細胞が同じ可能性を持っているわけではない。我々がこの神経幹細胞に関する研究から得た知識は、脊髄損傷の場合にどのように反応するのか、将来の研究に役立つだろう」とOnorati博士は述べた。この研究分野では、ピサ大学の生物学科の細胞および発達生物学ユニットのOnorati博士が、インビトロでそれらの
イェール大学医学部とイタリアのピサ大学の生物学科のチームは、動物モデルで脊髄損傷の修復に特に効果的である特定の幹細胞集団(神経上皮幹細胞)を同定した。この実験では、これらの細胞が損傷組織内に組み込まれ、移植後に数センチメートルのプロセスを延長し、治療を受けた動物に運動機能回復をもたらすことを実証した。さらに、ラボの試験で示されているように、回復は傷害の程度に比例した。
例えば、脊髄損傷が25%以下であれば、2ヶ月以内に下肢の使用が有意に改善した。「この研究のおかげで、幹細胞の解剖学的起源は移植の成功にとって非常に重要であることが初めて明らかにされた。」と2018年8月24日にネイチャーコミュニケーションズでオンラインで公開されたこの研究の筆頭著者であるピサ大学のMarco Onorati博士は説明した。このオープンアクセスの論文は、「ヒト神経上皮幹細胞の部位特異性により、リレー回路を介して脊髄修復を可能にする(Human Neuroepithelial Stem Cell Regional Specificity Enables Spinal Cord Repair Through a Relay Circuit.)」と題されている。
実際、インビトロと同様だが、レシピエント組織(この場合、脊髄)と同じ起源を有する神経幹細胞は、多様な起源(例えば、脳由来)よりもはるかに効率的であることが判明し、 損傷領域との接続を再確立し、新しいニューロン回路の形成を保証する。「すべての幹細胞が同じ可能性を持っているわけではない。我々がこの神経幹細胞に関する研究から得た知識は、脊髄損傷の場合にどのように反応するのか、将来の研究に役立つだろう」とOnorati博士は述べた。この研究分野では、ピサ大学の生物学科の細胞および発達生物学ユニットのOnorati博士が、インビトロでそれらの
パーキンソン病の潜在的な出発点は盲腸だった
 虫垂の切除は、パーキンソン病の発症リスクを19〜25%低下させる可能性があることが2018年10月31日発行のScience Translational Medicineに掲載された。このオープンアクセスの論文は、「虫垂がパーキンソン病を発症するリスクに影響する(The Vermiform Appendix Impacts the Risk of Developing Parkinson’s Disease.)」と題されている。
この発見はまた、パーキンソン病の発生における腸および免疫系の役割を明確にし、パーキンソン病の発症および進行と密接に関連している異常に折り畳まれたα-シヌクレインタンパク質の主要リザーバーとして機能することを明らかにした。「我々の結果は、パーキンソン病の原因部位としての虫垂を指し、この病気の発症における胃腸管の役割を活用する新しい治療戦略を考案するための道筋を提供している。大部分が不必要であるという評判があるにもかかわらず、虫垂は実際に我々の免疫系の主要部分であり、私たちの腸内細菌の構成を調節し、今度はパーキンソン病における役割も我々の研究で示された。」とViviane Labrie 研究所(VARI)の助教授であり論文のシニア著者であるVan Andel博士は語った。パーキンソン病のリスクの低下は、パーキンソン病の発症の数年前に、虫垂およびその中に含まれるα-シヌクレインが、早期に取り除かれたときにのみ明らかであり、虫垂が疾患の開始に関与する可能性があることを示唆している。 しかしながら、疾患プロセスが開始した後の虫垂の除去は、疾患の進行に影響を及ぼさなかった。 一般の集団では、虫垂切除術を受けた人々は、パーキンソン病を発症する可能性が19%低くなった。 この効果は農村部に住む人々に特に顕著で、虫垂切除術により疾患リスクが25%低下した。 パーキ
虫垂の切除は、パーキンソン病の発症リスクを19〜25%低下させる可能性があることが2018年10月31日発行のScience Translational Medicineに掲載された。このオープンアクセスの論文は、「虫垂がパーキンソン病を発症するリスクに影響する(The Vermiform Appendix Impacts the Risk of Developing Parkinson’s Disease.)」と題されている。
この発見はまた、パーキンソン病の発生における腸および免疫系の役割を明確にし、パーキンソン病の発症および進行と密接に関連している異常に折り畳まれたα-シヌクレインタンパク質の主要リザーバーとして機能することを明らかにした。「我々の結果は、パーキンソン病の原因部位としての虫垂を指し、この病気の発症における胃腸管の役割を活用する新しい治療戦略を考案するための道筋を提供している。大部分が不必要であるという評判があるにもかかわらず、虫垂は実際に我々の免疫系の主要部分であり、私たちの腸内細菌の構成を調節し、今度はパーキンソン病における役割も我々の研究で示された。」とViviane Labrie 研究所(VARI)の助教授であり論文のシニア著者であるVan Andel博士は語った。パーキンソン病のリスクの低下は、パーキンソン病の発症の数年前に、虫垂およびその中に含まれるα-シヌクレインが、早期に取り除かれたときにのみ明らかであり、虫垂が疾患の開始に関与する可能性があることを示唆している。 しかしながら、疾患プロセスが開始した後の虫垂の除去は、疾患の進行に影響を及ぼさなかった。 一般の集団では、虫垂切除術を受けた人々は、パーキンソン病を発症する可能性が19%低くなった。 この効果は農村部に住む人々に特に顕著で、虫垂切除術により疾患リスクが25%低下した。 パーキ
ASHG2018特集:古代アンデス人のゲノムが農業と標高への明確な適応を示す
 2018年10月16-20日にカリフォルニア州サンディエゴで開催されたアメリカ人類遺伝学会年次総会(ASHG2018)で、ペルー・アンデス山脈の古代人は、高所への環境と農業の導入に他の世界の人々とは異なる方法で適応したことが発表された。ASHGは今年の会議で記録的な出席者8,500人を報告している。
エモリー大学の人類学助教授John Lindo博士、シカゴ大学Anna Di Rienzo博士、カリフォルニア大学メルセデス大学のMark Aldenderfer博士が指揮する国際共同研究者グループ 7つの全ゲノムから得られた7,000年前のDNAの新たに入手可能なサンプルを使用して、アンデスの古代の人々がどのように環境に適応したかを研究した。科学者らは、これらのゲノムを、1500年代にヨーロッパ人が到着する前に起こった遺伝的適応を同定するために、高地のアンデス人集団とチリの低地集団の両方から現代の64のゲノムと比較した。 「ヨーロッパ人との接触は、疾病、戦争、社会的混乱など、南米の人々に甚大な影響を与えた。その前の期間に焦点を当てることで、私たちは環境適応と歴史的出来事から生じる適応とを区別することができた。」とLindo博士は述べた。
科学者たちは、アンデス集団のゲノムが農業の導入に適応し、他の集団とは違ってデンプン消費の増加をもたらすことを発見した。 例えば、ヨーロッパの農業集団のゲノムは、デンプンを分解するのに役立つ唾液中の酵素であるアミラーゼをコードする遺伝子のコピー数の増加を示す。 アンデスは、栽培を開始した後も高澱粉飼料を摂取したが、ゲノムにはアミラーゼ遺伝子のコピーが追加されていなかったため、この変化にどのように適応しているのか疑問を呈した。同様に、高高度への適応のために広範に研究されてきたチベット人のゲノムは、低酸素応答に関連した多くの遺伝的変化を示
2018年10月16-20日にカリフォルニア州サンディエゴで開催されたアメリカ人類遺伝学会年次総会(ASHG2018)で、ペルー・アンデス山脈の古代人は、高所への環境と農業の導入に他の世界の人々とは異なる方法で適応したことが発表された。ASHGは今年の会議で記録的な出席者8,500人を報告している。
エモリー大学の人類学助教授John Lindo博士、シカゴ大学Anna Di Rienzo博士、カリフォルニア大学メルセデス大学のMark Aldenderfer博士が指揮する国際共同研究者グループ 7つの全ゲノムから得られた7,000年前のDNAの新たに入手可能なサンプルを使用して、アンデスの古代の人々がどのように環境に適応したかを研究した。科学者らは、これらのゲノムを、1500年代にヨーロッパ人が到着する前に起こった遺伝的適応を同定するために、高地のアンデス人集団とチリの低地集団の両方から現代の64のゲノムと比較した。 「ヨーロッパ人との接触は、疾病、戦争、社会的混乱など、南米の人々に甚大な影響を与えた。その前の期間に焦点を当てることで、私たちは環境適応と歴史的出来事から生じる適応とを区別することができた。」とLindo博士は述べた。
科学者たちは、アンデス集団のゲノムが農業の導入に適応し、他の集団とは違ってデンプン消費の増加をもたらすことを発見した。 例えば、ヨーロッパの農業集団のゲノムは、デンプンを分解するのに役立つ唾液中の酵素であるアミラーゼをコードする遺伝子のコピー数の増加を示す。 アンデスは、栽培を開始した後も高澱粉飼料を摂取したが、ゲノムにはアミラーゼ遺伝子のコピーが追加されていなかったため、この変化にどのように適応しているのか疑問を呈した。同様に、高高度への適応のために広範に研究されてきたチベット人のゲノムは、低酸素応答に関連した多くの遺伝的変化を示
ASHG2018特集:遺伝子と環境団体がプレシジョンメディシンの機会をもたらすかもしれない。
 遺伝子解析の新しいアプローチは、環境因子とpharmacogene(薬物に反応するヒト遺伝子)の関連性を見出した。これは、集団遺伝学と医薬の境界で新しい研究のための発想を呼び起こすものである。
米国人類遺伝学会(ASHG)2018年次会合で発表されたこの内容について、「人間は数世紀に渡って医薬品を開発し、使用してきたが、それらの遺伝子は独自に機能しており、それ以前から他の環境要因と相互作用していた」とコロラド大学のChris Gignoux博士(写真)は語った。この要旨は「薬理ゲノム変異の世界的景観(The Global Landscape of Pharmacogenomic Variation.)」と題されている。物理的環境の変化と同様に、薬物は体内の微小環境に影響を及ぼし、その細胞と遺伝子の働きを変える。 このことは、薬理ゲノムとの関連性を有する遺伝子が、遺伝学と環境とのより広い相関を研究する上でも有用であり得ることを示唆している。さまざまな環境要因を探るために、Gignoux博士はスタンフォード大学のElena Sorokin博士と協力し、NASA、世界自然保護基金などのデータを使用して、20以上の気候、地理、生態学的変数のジオコード化されたリソースを作成した。米国の共同研究者らは、ゲノミックスと疫学(PAGE: Population Architecture using Genomics and Epidemiology)研究を用い、99の世界人口から51,698人の臨床的および疫学的に関連するバリエーションのサンプルを調査する大きなイニシアチブである。新しい分析手法は、Enviro-WAS(environment-wide association study)と呼ばれ、遺伝子型と20の環境変数との間の関連性を同定するために19,690の薬理ゲノム関連変異体を調
遺伝子解析の新しいアプローチは、環境因子とpharmacogene(薬物に反応するヒト遺伝子)の関連性を見出した。これは、集団遺伝学と医薬の境界で新しい研究のための発想を呼び起こすものである。
米国人類遺伝学会(ASHG)2018年次会合で発表されたこの内容について、「人間は数世紀に渡って医薬品を開発し、使用してきたが、それらの遺伝子は独自に機能しており、それ以前から他の環境要因と相互作用していた」とコロラド大学のChris Gignoux博士(写真)は語った。この要旨は「薬理ゲノム変異の世界的景観(The Global Landscape of Pharmacogenomic Variation.)」と題されている。物理的環境の変化と同様に、薬物は体内の微小環境に影響を及ぼし、その細胞と遺伝子の働きを変える。 このことは、薬理ゲノムとの関連性を有する遺伝子が、遺伝学と環境とのより広い相関を研究する上でも有用であり得ることを示唆している。さまざまな環境要因を探るために、Gignoux博士はスタンフォード大学のElena Sorokin博士と協力し、NASA、世界自然保護基金などのデータを使用して、20以上の気候、地理、生態学的変数のジオコード化されたリソースを作成した。米国の共同研究者らは、ゲノミックスと疫学(PAGE: Population Architecture using Genomics and Epidemiology)研究を用い、99の世界人口から51,698人の臨床的および疫学的に関連するバリエーションのサンプルを調査する大きなイニシアチブである。新しい分析手法は、Enviro-WAS(environment-wide association study)と呼ばれ、遺伝子型と20の環境変数との間の関連性を同定するために19,690の薬理ゲノム関連変異体を調
抗精神病薬はトリプルネガティブ乳癌に対して有効かもしれない
 一般的に使用されている抗精神病薬は、治療が最も困難なトリプルネガティブ乳癌に対しても有効であるという新たな研究が発表された。英国のブラッドフォード大学が率いるこの研究では、ピモジド(pimozide)がトリプルネガティブ乳癌の他、最も一般的なタイプの肺がんをも治療できる可能性があることが示された。
抗精神病薬は、抗癌特性を有することが知られており、精神分裂症を有する人々の間でがんの発生率が低下しているとは言い難いが、いくつかの研究がある。2018年10月9日にOncotargetにオンラインで公開されたこの新しい研究は、これらの薬物の1つがトリプルネガティブ乳癌に対してどのように作用し、最初の標的治療法である可能性について初めて明らかにした。ブラッドフォード大学のMohamed El-Tanani教授(写真)は、「トリプルネガティブ乳癌は、生存率が低く、再発リスクが高いことから、限られた標的治療のみが行われている唯一の乳癌である 我々の研究は、ピモジドがこのギャップを埋める可能性があることを示しており、既に臨床応用されているので臨床試験に迅速に移行する可能性がある」と語った。ブラッドフォード大学、ベルファスト女王大学(北アイルランド)、サラマンカ大学(スペイン)の研究者らは、トリプルネガティブ乳癌細胞、非小細胞肺癌細胞、および正常乳房細胞について、実験室でピモジドを試験した。彼らは、最も高い投薬量で、正常細胞のほんの5%と比較して、癌細胞の90%が薬物による治療後に死亡したことを発見した。研究者らは、トリプルネガティブ乳癌を移植したマウスでこの薬剤を試験した。 ピモジドで治療したマウスの腫瘍は、未治療のマウスよりも65%小さく、腫瘍の数は61%まで減少した。この薬はまた、がんの広がりを予防するのにも役立った。治療されたマウスは、ピモジドを投与されていないマウスより、
一般的に使用されている抗精神病薬は、治療が最も困難なトリプルネガティブ乳癌に対しても有効であるという新たな研究が発表された。英国のブラッドフォード大学が率いるこの研究では、ピモジド(pimozide)がトリプルネガティブ乳癌の他、最も一般的なタイプの肺がんをも治療できる可能性があることが示された。
抗精神病薬は、抗癌特性を有することが知られており、精神分裂症を有する人々の間でがんの発生率が低下しているとは言い難いが、いくつかの研究がある。2018年10月9日にOncotargetにオンラインで公開されたこの新しい研究は、これらの薬物の1つがトリプルネガティブ乳癌に対してどのように作用し、最初の標的治療法である可能性について初めて明らかにした。ブラッドフォード大学のMohamed El-Tanani教授(写真)は、「トリプルネガティブ乳癌は、生存率が低く、再発リスクが高いことから、限られた標的治療のみが行われている唯一の乳癌である 我々の研究は、ピモジドがこのギャップを埋める可能性があることを示しており、既に臨床応用されているので臨床試験に迅速に移行する可能性がある」と語った。ブラッドフォード大学、ベルファスト女王大学(北アイルランド)、サラマンカ大学(スペイン)の研究者らは、トリプルネガティブ乳癌細胞、非小細胞肺癌細胞、および正常乳房細胞について、実験室でピモジドを試験した。彼らは、最も高い投薬量で、正常細胞のほんの5%と比較して、癌細胞の90%が薬物による治療後に死亡したことを発見した。研究者らは、トリプルネガティブ乳癌を移植したマウスでこの薬剤を試験した。 ピモジドで治療したマウスの腫瘍は、未治療のマウスよりも65%小さく、腫瘍の数は61%まで減少した。この薬はまた、がんの広がりを予防するのにも役立った。治療されたマウスは、ピモジドを投与されていないマウスより、
診断とドラッグデリバリーに革命を起こす小型磁気スイミング装置を工業規模で製作
 英国のエクセター大学の科学者たちは、身体の特定の部位に薬物を運ぶことによって疾患の治療に革命を起こす可能性のある、精子細胞を模倣した小型の磁気スイミング装置を作製した。長さが1ミリメートルのこの小型デバイスは、磁気ヘッドとフレキシブルテールで構成されており、磁場によって活性化されると特定の位置に「泳ぐ」ことができる。
デバイスと磁気制御機構を設計したエクセター大学の研究者は、マイクロ流体チャネルや複雑な液体などのさまざまな環境でのデバイスの挙動を予測できる数学モデルを作成した。研究者らは、この装置を使用して身体の特定の領域に薬物を送達することができ、潜在的に治療時間および成功を大幅に改善すると考えている。科学者たちはまた、デバイスが非常に狭いチャネルを通って液体を移動させることに焦点を当てた、より広い分野のマイクロ流体に革命を起こす可能性があるとも考えている。チームの研究は現在、顕微プロトタイプを実施することに重点を置いており、研究者は赤血球のサイズに匹敵するスイマーを既に成功裏に実証している。この研究は最近、「流体物理学ジャーナル」に掲載された。
エクセター大学の主任研究員であるFeodor Ogrin教授は、「この技術を開発することで、医学のやり方を根本的に変えることができるだろう。スイマーは、血管を通って泳ぐことによって、薬物を身体の正しい領域に向けることができる。 病気の診断などの実験室で通常行われる複雑な手順が単純なチップ上で行われるラボ・オン・ザ・チップ技術で使用されているデバイスの微視的なバージョンも想定している。 潜在的に人命を救うことができる。」と語った。類似の装置は以前より複雑で高価な技術を用いて作られてきた。 これは、工業規模で製造することができる最初のスイマーであり、したがって、安価で使い捨てのマイクロ流体チップを製造するための道を開く。O
英国のエクセター大学の科学者たちは、身体の特定の部位に薬物を運ぶことによって疾患の治療に革命を起こす可能性のある、精子細胞を模倣した小型の磁気スイミング装置を作製した。長さが1ミリメートルのこの小型デバイスは、磁気ヘッドとフレキシブルテールで構成されており、磁場によって活性化されると特定の位置に「泳ぐ」ことができる。
デバイスと磁気制御機構を設計したエクセター大学の研究者は、マイクロ流体チャネルや複雑な液体などのさまざまな環境でのデバイスの挙動を予測できる数学モデルを作成した。研究者らは、この装置を使用して身体の特定の領域に薬物を送達することができ、潜在的に治療時間および成功を大幅に改善すると考えている。科学者たちはまた、デバイスが非常に狭いチャネルを通って液体を移動させることに焦点を当てた、より広い分野のマイクロ流体に革命を起こす可能性があるとも考えている。チームの研究は現在、顕微プロトタイプを実施することに重点を置いており、研究者は赤血球のサイズに匹敵するスイマーを既に成功裏に実証している。この研究は最近、「流体物理学ジャーナル」に掲載された。
エクセター大学の主任研究員であるFeodor Ogrin教授は、「この技術を開発することで、医学のやり方を根本的に変えることができるだろう。スイマーは、血管を通って泳ぐことによって、薬物を身体の正しい領域に向けることができる。 病気の診断などの実験室で通常行われる複雑な手順が単純なチップ上で行われるラボ・オン・ザ・チップ技術で使用されているデバイスの微視的なバージョンも想定している。 潜在的に人命を救うことができる。」と語った。類似の装置は以前より複雑で高価な技術を用いて作られてきた。 これは、工業規模で製造することができる最初のスイマーであり、したがって、安価で使い捨てのマイクロ流体チップを製造するための道を開く。O
40億年前、生命の始まりとなったであろう12アミノ酸からなるタンパク質をラトガース大学の科学者がモデル化
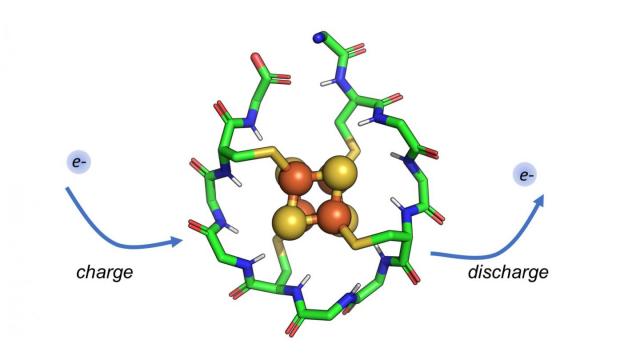 地球上で生命はどのように起こったのか?ニュージャージー州のラトガース大学の研究者は、単純なタンパク質触媒の最初で唯一の証拠の中に、細胞に不可欠な、生命が始まったときに存在していたかもしれない生命のビルディングブロックを発見した。この原始のペプチドまたは小さなタンパク質の研究が、米国化学会誌に掲載された。
この論文は、「頑強な電子移動が可能な最小ヘテロキラルデノロ設計4Fe-4S結合ペプチド(Minimal Heterochiral de Novo Designed 4Fe–4S Binding Peptide Capable of Robust Electron Transfer.)」と題されている。1980年代後半から1990年代初頭にかけて、化学者Günter Wächtershäuserは、海洋の鉄と岩石に含まれる硫黄が生命の始まりと仮定した。ラトガースの共同研究者であるRobert Wood Johnson医科大学の副学長であるVikas Nanda博士によると、Wutchtershäuserらは、短いペプチドが金属に結合し、生命を生み出す触媒として役立つと予測した。ヒトDNAは、数百から数千アミノ酸長のタンパク質をコードする遺伝子からなる。これらの複雑なタンパク質は、すべての生命体を適切に機能させるために必要なもので、数十億年の進化の結果でである。生命が始まったとき、たぶんタンパク質ははるかに単純で、恐らくわずか10〜20アミノ酸長だったはずだ。Nanda博士によると、ラトガースの科学者は、コンピュータモデリングを用いて、初期のペプチドがどのようなものか、そしてそれらの可能な化学的機能を探索してきたという。科学者はコンピュータを使って短い12アミノ酸のタンパク質(ambidoxin)をモデル化し、それを試験した。このペプチドは、いくつかの印象的かつ重要な特
地球上で生命はどのように起こったのか?ニュージャージー州のラトガース大学の研究者は、単純なタンパク質触媒の最初で唯一の証拠の中に、細胞に不可欠な、生命が始まったときに存在していたかもしれない生命のビルディングブロックを発見した。この原始のペプチドまたは小さなタンパク質の研究が、米国化学会誌に掲載された。
この論文は、「頑強な電子移動が可能な最小ヘテロキラルデノロ設計4Fe-4S結合ペプチド(Minimal Heterochiral de Novo Designed 4Fe–4S Binding Peptide Capable of Robust Electron Transfer.)」と題されている。1980年代後半から1990年代初頭にかけて、化学者Günter Wächtershäuserは、海洋の鉄と岩石に含まれる硫黄が生命の始まりと仮定した。ラトガースの共同研究者であるRobert Wood Johnson医科大学の副学長であるVikas Nanda博士によると、Wutchtershäuserらは、短いペプチドが金属に結合し、生命を生み出す触媒として役立つと予測した。ヒトDNAは、数百から数千アミノ酸長のタンパク質をコードする遺伝子からなる。これらの複雑なタンパク質は、すべての生命体を適切に機能させるために必要なもので、数十億年の進化の結果でである。生命が始まったとき、たぶんタンパク質ははるかに単純で、恐らくわずか10〜20アミノ酸長だったはずだ。Nanda博士によると、ラトガースの科学者は、コンピュータモデリングを用いて、初期のペプチドがどのようなものか、そしてそれらの可能な化学的機能を探索してきたという。科学者はコンピュータを使って短い12アミノ酸のタンパク質(ambidoxin)をモデル化し、それを試験した。このペプチドは、いくつかの印象的かつ重要な特
オプトジェネティックスを用い、癌は増殖シグナル伝達のタイミングの変化が鍵であることを発見
 2018年8月29日にサイエンスのオンラインで公開された新研究で、非小細胞肺癌(NSCLC)での遺伝子変異は、細胞の主要な増殖シグナルの認識を妨げて、腫瘍形成を促進する可能性があると報告された。この論文は、「癌突然変異と標的薬物は、Ras-Erk経路によるダイナミックシグナルエンコーディングを混乱させる可能性がある(Cancer Mutations and Targeted Drugs Can Disrupt Dynamic Signal Encoding by the Ras-Erk Pathway.)」と題されている。
カリフォルニア大学サンフランシスコ校(UCSF)の研究者が率いるこの研究は、多くのヒト癌の根底にある欠陥メカニズムを理解し、欠陥メカニズムを最終標的とする重要な意味を持つ可能性がある。健常細胞は、いつ、どのように増殖、分裂、および移動するかについて外部の手がかりを解釈するために、Ras / Erk増殖シグナル伝達経路(Ras / MAPK経路)に依存するが、これらのメッセージが伝達される際の欠陥は、 制御不能に陥り、身体の他の部分へ浸潤する原因となりうる。このような突然変異は、大多数のヒト癌で発見され、Ras / Erkの治療法を開発は、癌研究の至高の目標である。何十年もの研究により、科学者は、突然変異により経路の1つ以上のコンポーネントが成長前の状態から抜け出せなくなった場合に、Ras / Erkによる癌が生じると考えている。研究者らは、これらの壊れたスイッチを元に戻す標的治療法を開発するために努力してきたが、これまでのところほとんどが臨床試験に失敗している。現在、光パルスを用いてRas / Erkシグナル伝達を制御し、ゲノム動態を迅速に読み取ることが可能なUCSFで開発されたハイスループット技術を用い、この広範囲に研究された経路について驚くべき発見
2018年8月29日にサイエンスのオンラインで公開された新研究で、非小細胞肺癌(NSCLC)での遺伝子変異は、細胞の主要な増殖シグナルの認識を妨げて、腫瘍形成を促進する可能性があると報告された。この論文は、「癌突然変異と標的薬物は、Ras-Erk経路によるダイナミックシグナルエンコーディングを混乱させる可能性がある(Cancer Mutations and Targeted Drugs Can Disrupt Dynamic Signal Encoding by the Ras-Erk Pathway.)」と題されている。
カリフォルニア大学サンフランシスコ校(UCSF)の研究者が率いるこの研究は、多くのヒト癌の根底にある欠陥メカニズムを理解し、欠陥メカニズムを最終標的とする重要な意味を持つ可能性がある。健常細胞は、いつ、どのように増殖、分裂、および移動するかについて外部の手がかりを解釈するために、Ras / Erk増殖シグナル伝達経路(Ras / MAPK経路)に依存するが、これらのメッセージが伝達される際の欠陥は、 制御不能に陥り、身体の他の部分へ浸潤する原因となりうる。このような突然変異は、大多数のヒト癌で発見され、Ras / Erkの治療法を開発は、癌研究の至高の目標である。何十年もの研究により、科学者は、突然変異により経路の1つ以上のコンポーネントが成長前の状態から抜け出せなくなった場合に、Ras / Erkによる癌が生じると考えている。研究者らは、これらの壊れたスイッチを元に戻す標的治療法を開発するために努力してきたが、これまでのところほとんどが臨床試験に失敗している。現在、光パルスを用いてRas / Erkシグナル伝達を制御し、ゲノム動態を迅速に読み取ることが可能なUCSFで開発されたハイスループット技術を用い、この広範囲に研究された経路について驚くべき発見
ケシゲノムの解読に成功:高品質のゲノムアセンブリを使用してゲノムの70.9%を構成する反復要素を克服
 科学者は、ケシゲノムのDNA配列を決定し、生薬の製造に使用される薬学的化合物を生産するために植物がどのように進化したかを明らかにした。この発見は、科学者が薬草植物の収量および耐病性を向上させ、鎮痛および緩和ケアのための最も効果的な薬剤の信頼できる安価な供給を確保する道を開くかもしれない。ヨーク大学の研究者たちは、英国のウェルカム・サンガー・インスティテュート、および国際的な協力により、咳抑制薬ノスカピンおよび鎮痛薬モルヒネおよびコデインの生産につながる遺伝的経路の起源を明らかにした。この研究は2018年8月30日にScienceでオンラインで報告された。 この論文は、「ケシのゲノムとモルフィナン生産(The Opium Poppy Genome and Morphinan Production.)」と題されている。共同執筆者であるヨーク大学の生物学科の新農産物センターのIan Graham教授は「生化学者は植物がどのように進化して地球上で最も豊富な化学物質リソースになったか長年関心があった。高品質のゲノムアセンブリを使用して、我々は、これがケシにおいてどのように起こったかを解明した。同時に、この研究は、途上国において痛みの緩和と緩和ケアのために利用可能な最も有効な鎮痛剤の信頼できる安価な供給が確保されるために分子植物育種ツールの開発の基盤を提供するだろう。」と語った。
ノスカピン、コデイン、およびモルヒネなどの合成化合物を製造するための合成生物学ベースのアプローチが開発されており、植物由来の遺伝子を工業用発酵槽で生産可能にするために酵母などの微生物系に改変されている。しかし、ケシは、これらの製薬化合物の最も安価で唯一の商業的供給源であり続けている。
ゲノム重複英国のヨーク大学とウェルカムサンガー研究所の科学者は、中国の西安交通大学と上海海洋大学、サン・マニュファクチュア
科学者は、ケシゲノムのDNA配列を決定し、生薬の製造に使用される薬学的化合物を生産するために植物がどのように進化したかを明らかにした。この発見は、科学者が薬草植物の収量および耐病性を向上させ、鎮痛および緩和ケアのための最も効果的な薬剤の信頼できる安価な供給を確保する道を開くかもしれない。ヨーク大学の研究者たちは、英国のウェルカム・サンガー・インスティテュート、および国際的な協力により、咳抑制薬ノスカピンおよび鎮痛薬モルヒネおよびコデインの生産につながる遺伝的経路の起源を明らかにした。この研究は2018年8月30日にScienceでオンラインで報告された。 この論文は、「ケシのゲノムとモルフィナン生産(The Opium Poppy Genome and Morphinan Production.)」と題されている。共同執筆者であるヨーク大学の生物学科の新農産物センターのIan Graham教授は「生化学者は植物がどのように進化して地球上で最も豊富な化学物質リソースになったか長年関心があった。高品質のゲノムアセンブリを使用して、我々は、これがケシにおいてどのように起こったかを解明した。同時に、この研究は、途上国において痛みの緩和と緩和ケアのために利用可能な最も有効な鎮痛剤の信頼できる安価な供給が確保されるために分子植物育種ツールの開発の基盤を提供するだろう。」と語った。
ノスカピン、コデイン、およびモルヒネなどの合成化合物を製造するための合成生物学ベースのアプローチが開発されており、植物由来の遺伝子を工業用発酵槽で生産可能にするために酵母などの微生物系に改変されている。しかし、ケシは、これらの製薬化合物の最も安価で唯一の商業的供給源であり続けている。
ゲノム重複英国のヨーク大学とウェルカムサンガー研究所の科学者は、中国の西安交通大学と上海海洋大学、サン・マニュファクチュア
FKBP5遺伝子変異体が、外傷性損傷後の慢性疼痛に影響することが明らかに。
 遺伝子FKBP5は、ストレス応答の重要な調節因子であり、我々がどのように環境刺激に応答するかに影響する。以前の研究では、この遺伝子の特定の変異体が、外傷後ストレス障害、うつ病、自殺リスクおよび攻撃的行動などの神経精神障害の発症において役割を果たすことが示されている。
しかし、2013年にノースカロライナ大学(UNC)医学部の研究者らが、FKBP5の遺伝子変異と外傷後慢性疼痛との関連を初めて示した。特に、rs3800373として知られている第6染色体の変異型または軽症/リスクアレルを持つ人々は、この亜種を持たない人と比較して外傷(性的暴行または自動車衝突など)に曝された後により多くの痛みを経験する可能性があることが判明した。現在、Journal of Neuroscienceに掲載された同じ研究グループによる新しい研究では、自動車衝突の外傷を経験した1,500人以上の欧州アメリカ人およびアフリカ系アメリカ人の子孫のコホートにおいてこの関連が確認されている。 外傷修復研究所の麻酔科の助教授Sarah Linnstaedt博士(写真)がこの研究の筆頭著者である。この論文は「FKBP5の3'UTR中の機能性riboSNitchはMicroRNA-320a結合効率を変え、慢性外傷後疼痛の脆弱性を介在する(A Functional riboSNitch in the 3′UTR of FKBP5 Alters MicroRNA-320a Binding Efficiency and Mediates Vulnerability to Chronic Posttraumatic Pain.)」と題されている。
「今回の研究で、この変異が慢性疼痛の結果に影響する理由が、FKBP5がmiR-320aと呼ばれるマイクロRNAによって調節される能力を変化させるためであることが示された」とLi
遺伝子FKBP5は、ストレス応答の重要な調節因子であり、我々がどのように環境刺激に応答するかに影響する。以前の研究では、この遺伝子の特定の変異体が、外傷後ストレス障害、うつ病、自殺リスクおよび攻撃的行動などの神経精神障害の発症において役割を果たすことが示されている。
しかし、2013年にノースカロライナ大学(UNC)医学部の研究者らが、FKBP5の遺伝子変異と外傷後慢性疼痛との関連を初めて示した。特に、rs3800373として知られている第6染色体の変異型または軽症/リスクアレルを持つ人々は、この亜種を持たない人と比較して外傷(性的暴行または自動車衝突など)に曝された後により多くの痛みを経験する可能性があることが判明した。現在、Journal of Neuroscienceに掲載された同じ研究グループによる新しい研究では、自動車衝突の外傷を経験した1,500人以上の欧州アメリカ人およびアフリカ系アメリカ人の子孫のコホートにおいてこの関連が確認されている。 外傷修復研究所の麻酔科の助教授Sarah Linnstaedt博士(写真)がこの研究の筆頭著者である。この論文は「FKBP5の3'UTR中の機能性riboSNitchはMicroRNA-320a結合効率を変え、慢性外傷後疼痛の脆弱性を介在する(A Functional riboSNitch in the 3′UTR of FKBP5 Alters MicroRNA-320a Binding Efficiency and Mediates Vulnerability to Chronic Posttraumatic Pain.)」と題されている。
「今回の研究で、この変異が慢性疼痛の結果に影響する理由が、FKBP5がmiR-320aと呼ばれるマイクロRNAによって調節される能力を変化させるためであることが示された」とLi
CRISPRで犬のデュシェンヌ型筋ジストロフィーの進行を停止させることに成功
 テキサス大学(UT)の科学者によって、初めて大型哺乳動物(犬)のデュシェンヌ型筋ジストロフィー(DMD)の進行を停止させるためにCRISPR遺伝子編集が使用され、救命の可能性が示された。2018年8月30日にサイエンスでオンラインで公開されたこの研究では、筋機能に重要なタンパク質であるジストロフィンの産生を阻害する突然変異によって引き起こされ、小児の最も一般的な致死的遺伝病であるDMDを有する犬の筋繊維に前例のない改善があったとしている。
この論文は、「遺伝子編集はデュシェンヌ型筋ジストロフィーのイヌモデルにおけるジストロフィン発現を回復させる(Gene Editing Restores Dystrophin Expression in a Canine Model Of Duchenne Muscular Dystrophy.)」と題されている。研究では、筋肉や心臓組織のジストロフィンを正常レベルの92%まで回復させるために、シングルカット遺伝子編集技術を使用した。科学者は、患者を有意に助けるのに15%の閾値が必要であると推定している。「DMDを患う子供たちは、心臓が鼓動する力が失われたり、横隔膜が息をするには弱すぎたりするため、しばしば死亡する。このレベルのジストロフィン発現なら、うまくいけばそれが起こらないようにするだろう。」とUTサウスウエスタンのハモン再生医科学センターのEric Olson博士は語った。5,000人の少年のうちの1人に影響を及ぼすDMDは、筋肉および心不全に至り、30代前半で早死を引き起こす。患者は、筋肉が退化して車椅子に乗せられることになり、最終的には横隔膜が弱くなるにつれて呼吸器が着けられる。効果的な治療は存在しないが、科学者はジストロフィン遺伝子の欠損がその状態を引き起こすことを何十年も前に分かっていた。サイエンスに発表されたこの研究は、
テキサス大学(UT)の科学者によって、初めて大型哺乳動物(犬)のデュシェンヌ型筋ジストロフィー(DMD)の進行を停止させるためにCRISPR遺伝子編集が使用され、救命の可能性が示された。2018年8月30日にサイエンスでオンラインで公開されたこの研究では、筋機能に重要なタンパク質であるジストロフィンの産生を阻害する突然変異によって引き起こされ、小児の最も一般的な致死的遺伝病であるDMDを有する犬の筋繊維に前例のない改善があったとしている。
この論文は、「遺伝子編集はデュシェンヌ型筋ジストロフィーのイヌモデルにおけるジストロフィン発現を回復させる(Gene Editing Restores Dystrophin Expression in a Canine Model Of Duchenne Muscular Dystrophy.)」と題されている。研究では、筋肉や心臓組織のジストロフィンを正常レベルの92%まで回復させるために、シングルカット遺伝子編集技術を使用した。科学者は、患者を有意に助けるのに15%の閾値が必要であると推定している。「DMDを患う子供たちは、心臓が鼓動する力が失われたり、横隔膜が息をするには弱すぎたりするため、しばしば死亡する。このレベルのジストロフィン発現なら、うまくいけばそれが起こらないようにするだろう。」とUTサウスウエスタンのハモン再生医科学センターのEric Olson博士は語った。5,000人の少年のうちの1人に影響を及ぼすDMDは、筋肉および心不全に至り、30代前半で早死を引き起こす。患者は、筋肉が退化して車椅子に乗せられることになり、最終的には横隔膜が弱くなるにつれて呼吸器が着けられる。効果的な治療は存在しないが、科学者はジストロフィン遺伝子の欠損がその状態を引き起こすことを何十年も前に分かっていた。サイエンスに発表されたこの研究は、
ヒト幹細胞から作られた3D肝臓組織移植片がマウスの肝機能をサポート
 スコットランドのエジンバラ大学の再生医学研究センター(MRC)の科学者によって3Dヒト肝臓組織に形質転換された幹細胞は、肝臓疾患のマウスに移植された際に肝機能の有望なサポートをした。科学者は、ヒト肝臓組織インプラントを開発するための初期段階の進歩に加えて、実験室でのヒト肝臓疾患および試験薬の研究のためのより良いプラットフォームを提供することによって、実験動物の必要性を低減できるとも述べている。
この研究はArchives of Toxicologyに掲載された。科学者はヒト胚性幹細胞を採取して人工多能性幹細胞(iPSCs)を誘導し、慎重にそれらを刺激して肝細胞の特性を発達させた。研究者らは、これらの細胞を1年以上にわたりディッシュの中の小さな塊として成長させた。この研究を主導したエジンバラ大学の再生医療センターMRCのDavid Hay博士は、「研究室で幹細胞由来の肝臓組織を1年以上生存させたのは、これが初めてだ。 長い間細胞を生きて安定した肝細胞として維持することは非常に難しいが、人にこの技術を応用することを望むなら、非常に重要なステップである。」と述べた。科学者は3Dの足場を開発するため、ヒトで既に承認された適切なポリマーを特定するために材料化学者および技術者と協力した。
最良の材料は生分解性ポリエステル、ポリカプロラクトン(polycaprolactone)であり、マイクロファイバーに紡糸された。繊維のメッシュは、1センチメートル四方、厚さ数ミリメートルの足場を形成した。20日間培養した胚性幹細胞由来の肝細胞を足場に載せ、マウスの皮膚下に移植した。血管は足場上で首尾よく成長し、マウスは血液中にヒト肝臓タンパク質を有することが判明し、組織が循環系とうまく一体化したことが示された。 足場は動物の免疫系によって拒絶されなかった。肝組織スキャホールドは、チロシン血症を有す
スコットランドのエジンバラ大学の再生医学研究センター(MRC)の科学者によって3Dヒト肝臓組織に形質転換された幹細胞は、肝臓疾患のマウスに移植された際に肝機能の有望なサポートをした。科学者は、ヒト肝臓組織インプラントを開発するための初期段階の進歩に加えて、実験室でのヒト肝臓疾患および試験薬の研究のためのより良いプラットフォームを提供することによって、実験動物の必要性を低減できるとも述べている。
この研究はArchives of Toxicologyに掲載された。科学者はヒト胚性幹細胞を採取して人工多能性幹細胞(iPSCs)を誘導し、慎重にそれらを刺激して肝細胞の特性を発達させた。研究者らは、これらの細胞を1年以上にわたりディッシュの中の小さな塊として成長させた。この研究を主導したエジンバラ大学の再生医療センターMRCのDavid Hay博士は、「研究室で幹細胞由来の肝臓組織を1年以上生存させたのは、これが初めてだ。 長い間細胞を生きて安定した肝細胞として維持することは非常に難しいが、人にこの技術を応用することを望むなら、非常に重要なステップである。」と述べた。科学者は3Dの足場を開発するため、ヒトで既に承認された適切なポリマーを特定するために材料化学者および技術者と協力した。
最良の材料は生分解性ポリエステル、ポリカプロラクトン(polycaprolactone)であり、マイクロファイバーに紡糸された。繊維のメッシュは、1センチメートル四方、厚さ数ミリメートルの足場を形成した。20日間培養した胚性幹細胞由来の肝細胞を足場に載せ、マウスの皮膚下に移植した。血管は足場上で首尾よく成長し、マウスは血液中にヒト肝臓タンパク質を有することが判明し、組織が循環系とうまく一体化したことが示された。 足場は動物の免疫系によって拒絶されなかった。肝組織スキャホールドは、チロシン血症を有す
人間性とは何か?新種のヒト脳細胞(ローズヒップニューロン)が同定される
 人間の脳に関する最も興味深い疑問は「私たちの脳を他の動物の脳と区別するのは何か?」であり、これは神経科学者にとって答えるのが最も難しい質問の1つである。「人間の脳を特別なものにするのは何か本当のところ分からない」とワシントン州シアトルにあるアレン脳科学研究所のEd Lein博士は述べている。「細胞と回路のレベルで違いを学ぶことはスタート地点としては適しており、今や我々はそれを行う新しいツールを持っている」
2018年8月27日にNature Neuroscienceでオンラインで公開されたこの新研究で、Lein博士とその同僚は、この難しい疑問に対する可能性のある答えを発表した。この論文は、「特殊化されたヒト皮質ガバレクチン細胞型のトランスクリプトームおよび形態生理学的証拠(Transcriptomic and Morphophysiological Evidence for a Specialized Human Cortical Gabaergic Cell Type.)」と題されている。Lein博士とハンガリーのセゲド大学の神経科学者であるGábor Tamás博士の共同研究チームは、マウスや他のよく研究された実験動物では見られなかった新しいタイプのヒト脳細胞を発見した。Tamás博士とセゲド大学の博士課程学生であるEszter Boldogは、これらの新しい細胞を "ローズヒップニューロン"と呼んだ。なぜなら、細胞の中心の周りの各脳細胞の軸索形態が花弁をはずした後のバラのように見えるからだ。
新たに発見された細胞は、阻害性ニューロンとして知られるニューロンクラスに属し、脳内の他のニューロンの活動にブレーキをかける。この研究は、この特殊な脳細胞がヒトに特有であることをまだ証明していない。しかし、特別なニューロンがげっ歯類に存在しないという事実は興味深いものであり、こ
人間の脳に関する最も興味深い疑問は「私たちの脳を他の動物の脳と区別するのは何か?」であり、これは神経科学者にとって答えるのが最も難しい質問の1つである。「人間の脳を特別なものにするのは何か本当のところ分からない」とワシントン州シアトルにあるアレン脳科学研究所のEd Lein博士は述べている。「細胞と回路のレベルで違いを学ぶことはスタート地点としては適しており、今や我々はそれを行う新しいツールを持っている」
2018年8月27日にNature Neuroscienceでオンラインで公開されたこの新研究で、Lein博士とその同僚は、この難しい疑問に対する可能性のある答えを発表した。この論文は、「特殊化されたヒト皮質ガバレクチン細胞型のトランスクリプトームおよび形態生理学的証拠(Transcriptomic and Morphophysiological Evidence for a Specialized Human Cortical Gabaergic Cell Type.)」と題されている。Lein博士とハンガリーのセゲド大学の神経科学者であるGábor Tamás博士の共同研究チームは、マウスや他のよく研究された実験動物では見られなかった新しいタイプのヒト脳細胞を発見した。Tamás博士とセゲド大学の博士課程学生であるEszter Boldogは、これらの新しい細胞を "ローズヒップニューロン"と呼んだ。なぜなら、細胞の中心の周りの各脳細胞の軸索形態が花弁をはずした後のバラのように見えるからだ。
新たに発見された細胞は、阻害性ニューロンとして知られるニューロンクラスに属し、脳内の他のニューロンの活動にブレーキをかける。この研究は、この特殊な脳細胞がヒトに特有であることをまだ証明していない。しかし、特別なニューロンがげっ歯類に存在しないという事実は興味深いものであり、こ
幹細胞の健常時とストレス時の行動の主な違いが明らかに
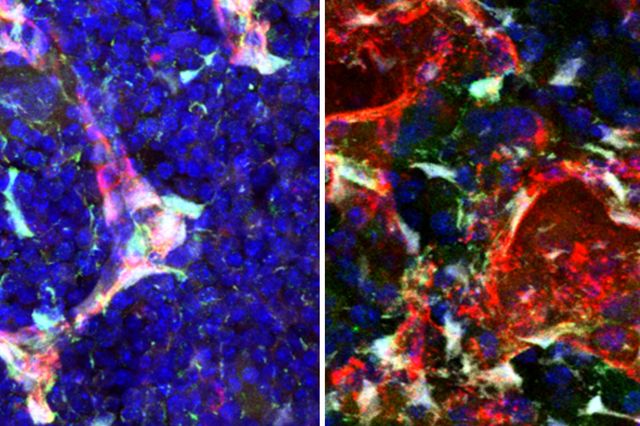 カリフォルニア州のUCLA ジョンソン総合がんセンターは、健常時および傷害後の微小環境によって造血幹細胞がどのように維持されているか重要な違いを発見した。人体は、健常時や、例えば癌の放射線治療のようなストレスやけがの時に単一成長因子を産生する細胞種を切り替えているように思われる。この研究結果は、放射線治療で造血幹細胞が実質的に枯渇していそうな時や、骨髄移植を受けている人の治療に影響を及ぼす可能性がある。
この研究は、UCLAのデーヴィッドゲフェン医学部 血液学・腫瘍学の教授であるJohn Chute博士が率いたもので、Cell Stem Cellで発表された。この論文は、「プレオトロフィン制御造血幹細胞の維持および再生の骨髄源(Distinct Bone Marrow Sources of Pleiotrophin Control Hematopoietic Stem Cell Maintenance and Regeneration)」と題されている。血液形成または造血幹細胞は、白血球、赤血球および血小板などの様々な種類の成熟血液要素に分化することができる。それらは、様々なタイプの周囲の細胞が取り囲む骨髄中の「血管性ニッチ」に生存し、部分的には成長因子と呼ばれる化合物を分泌する。このUCLAの研究は、プレオトロフィン(PTN)と呼ばれる成長因子に焦点を当てている。
Chute博士と彼のチームは以前にプレオトロフィンを発見していたが、それを分泌する細胞の種類を特定していなかった。「幹細胞研究には、幹細胞を制御する微小環境細胞は何か?どうのようにしてそれが行われるのか?という2つの重要な課題がある。」とChute博士は語った。これを調べるために、研究チームは、血管を構成する内皮細胞、結合組織を構成する間質細胞などを含む様々なタイプの骨髄細胞において、プレオトロフィン発現を
カリフォルニア州のUCLA ジョンソン総合がんセンターは、健常時および傷害後の微小環境によって造血幹細胞がどのように維持されているか重要な違いを発見した。人体は、健常時や、例えば癌の放射線治療のようなストレスやけがの時に単一成長因子を産生する細胞種を切り替えているように思われる。この研究結果は、放射線治療で造血幹細胞が実質的に枯渇していそうな時や、骨髄移植を受けている人の治療に影響を及ぼす可能性がある。
この研究は、UCLAのデーヴィッドゲフェン医学部 血液学・腫瘍学の教授であるJohn Chute博士が率いたもので、Cell Stem Cellで発表された。この論文は、「プレオトロフィン制御造血幹細胞の維持および再生の骨髄源(Distinct Bone Marrow Sources of Pleiotrophin Control Hematopoietic Stem Cell Maintenance and Regeneration)」と題されている。血液形成または造血幹細胞は、白血球、赤血球および血小板などの様々な種類の成熟血液要素に分化することができる。それらは、様々なタイプの周囲の細胞が取り囲む骨髄中の「血管性ニッチ」に生存し、部分的には成長因子と呼ばれる化合物を分泌する。このUCLAの研究は、プレオトロフィン(PTN)と呼ばれる成長因子に焦点を当てている。
Chute博士と彼のチームは以前にプレオトロフィンを発見していたが、それを分泌する細胞の種類を特定していなかった。「幹細胞研究には、幹細胞を制御する微小環境細胞は何か?どうのようにしてそれが行われるのか?という2つの重要な課題がある。」とChute博士は語った。これを調べるために、研究チームは、血管を構成する内皮細胞、結合組織を構成する間質細胞などを含む様々なタイプの骨髄細胞において、プレオトロフィン発現を
メープル葉エキスが、しわ防止に効くことがアメリカ化学会で発表される
 メープルツリーはメープルシロップと美しい紅葉でよく知られている。 しかし、その葉の美しさは肌にとっても役立つものになる可能性があることが判明した。科学者らは、葉からの抽出物がしわを防止し得ることを報告している。この研究成果は第256回アメリカ化学会(ACS)の全国会議および博覧会で発表された。世界最大級の学会であるACSは、2018年8月19日〜8月23日にボストンでこの会議を開催した。ACSミーティングでは、幅広い科学分野で10,000件以上のプレゼンテーションが行われた。このメープルリーフの研究者は、以前に、サトウキビとレッドメープルの樹木から得た樹液とシロップの化学的および健康的利点を研究していた。プロジェクトの主任研究者であるロードアイランド大学のNavindra P. Seeram博士によれば、歴史の記録から木の他の部分も有用であることが示唆されたと言う。「ネイティブアメリカンは、伝統薬にレッドメープルの葉を使っていた。葉を無視する理由はない。」と彼は言う。皮膚の弾力性は、エラスチンなどのタンパク質によって維持される。 しわは、酵素エラスターゼが老化過程の一部として皮膚のエラスチンを分解するときに形成される。ACSの会議でこの研究を発表し、Seeram博士の研究室の研究員であるHang Ma博士は、「我々はレッドメープルの葉の抽出物がエラスターゼの活性を阻害するかどうかを知りたがっていた。」と語った。ロードアイランド大学の研究者らは、グルシトール含有ガロタンニン(GCGs)として知られている葉のフェノール化合物をゼロにし、各化合物が試験管内でエラスターゼ活性を阻害する能力を調べた。科学者はまた、GCGがエラスターゼとどのように相互作用してその活性をブロックするか、分子の構造がブロッキング能力にどのように影響するかを調べるためのコンピューター解析を行った。
複数
メープルツリーはメープルシロップと美しい紅葉でよく知られている。 しかし、その葉の美しさは肌にとっても役立つものになる可能性があることが判明した。科学者らは、葉からの抽出物がしわを防止し得ることを報告している。この研究成果は第256回アメリカ化学会(ACS)の全国会議および博覧会で発表された。世界最大級の学会であるACSは、2018年8月19日〜8月23日にボストンでこの会議を開催した。ACSミーティングでは、幅広い科学分野で10,000件以上のプレゼンテーションが行われた。このメープルリーフの研究者は、以前に、サトウキビとレッドメープルの樹木から得た樹液とシロップの化学的および健康的利点を研究していた。プロジェクトの主任研究者であるロードアイランド大学のNavindra P. Seeram博士によれば、歴史の記録から木の他の部分も有用であることが示唆されたと言う。「ネイティブアメリカンは、伝統薬にレッドメープルの葉を使っていた。葉を無視する理由はない。」と彼は言う。皮膚の弾力性は、エラスチンなどのタンパク質によって維持される。 しわは、酵素エラスターゼが老化過程の一部として皮膚のエラスチンを分解するときに形成される。ACSの会議でこの研究を発表し、Seeram博士の研究室の研究員であるHang Ma博士は、「我々はレッドメープルの葉の抽出物がエラスターゼの活性を阻害するかどうかを知りたがっていた。」と語った。ロードアイランド大学の研究者らは、グルシトール含有ガロタンニン(GCGs)として知られている葉のフェノール化合物をゼロにし、各化合物が試験管内でエラスターゼ活性を阻害する能力を調べた。科学者はまた、GCGがエラスターゼとどのように相互作用してその活性をブロックするか、分子の構造がブロッキング能力にどのように影響するかを調べるためのコンピューター解析を行った。
複数
ハイドロゲルで損傷した筋肉組織に筋肉幹細胞を送達する技術が報告される。
 自動車事故は、高齢の患者に、癒されない重度の筋肉傷害を残す。 ドナーからの筋肉幹細胞による治療は、損傷した組織を回復させるかもしれないが、医師にはそれらを効果的に送達することが困難だ。新しい方法がこの状況を変えるのに役立つかもしれない。 ジョージア工科大学(Georgia Tech)の研究者は、筋肉がうまく再生しない患者の筋衛星細胞(MuSC)を筋肉組織に直接送達するために、ハイドロゲルである分子マトリックスを設計した。
マウスによるラボ実験では、ハイドロゲルは、損傷した老化筋肉組織にMuSCをうまく送達して、幹細胞を過酷な免疫反応から保護しながら治癒過程を促進した。この方法は、デュシェンヌ型筋ジストロフィーを模倣した筋肉組織欠損マウスでも成功し、研究が進めば、新しいハイドロゲル療法は、この病気にかかっている人々の命を救うことができるかもしれない。損傷した炎症を起こした組織に筋衛星細胞を単に注入するだけでは、幹細胞がそれらに対抗する免疫系に遭遇するため、非効率的であることが分かっている。「どのような筋肉傷害も免疫細胞を引き寄せるだろう。 通常、これは筋幹細胞が損傷を修復するのに役立つ。しかし、老化した筋肉やジストロフィー筋では、免疫細胞が、新しい幹細胞を殺すサイトカインやフリーラジカルなどの毒性化学物質を多く放出する。」とジョージア工科大学の生物科学院助教授でこの研究の主任研究者であるYoung Jang博士は述べた。注入されたMuSCの1〜20%しか損傷組織には到達しない。また、組織の損傷によっては、注入が不可能になるため、新しい配送戦略の必要性が生じる。
「我々の新しいハイドロゲルは、幹細胞を保護し、幹細胞は増殖し、マトリックス内で増殖する。 ゲルは傷ついた筋肉に適応し、細胞が組織に移植されて治癒するのを助ける。」とジョージア工科大学工学部のポスドク研究員であ
自動車事故は、高齢の患者に、癒されない重度の筋肉傷害を残す。 ドナーからの筋肉幹細胞による治療は、損傷した組織を回復させるかもしれないが、医師にはそれらを効果的に送達することが困難だ。新しい方法がこの状況を変えるのに役立つかもしれない。 ジョージア工科大学(Georgia Tech)の研究者は、筋肉がうまく再生しない患者の筋衛星細胞(MuSC)を筋肉組織に直接送達するために、ハイドロゲルである分子マトリックスを設計した。
マウスによるラボ実験では、ハイドロゲルは、損傷した老化筋肉組織にMuSCをうまく送達して、幹細胞を過酷な免疫反応から保護しながら治癒過程を促進した。この方法は、デュシェンヌ型筋ジストロフィーを模倣した筋肉組織欠損マウスでも成功し、研究が進めば、新しいハイドロゲル療法は、この病気にかかっている人々の命を救うことができるかもしれない。損傷した炎症を起こした組織に筋衛星細胞を単に注入するだけでは、幹細胞がそれらに対抗する免疫系に遭遇するため、非効率的であることが分かっている。「どのような筋肉傷害も免疫細胞を引き寄せるだろう。 通常、これは筋幹細胞が損傷を修復するのに役立つ。しかし、老化した筋肉やジストロフィー筋では、免疫細胞が、新しい幹細胞を殺すサイトカインやフリーラジカルなどの毒性化学物質を多く放出する。」とジョージア工科大学の生物科学院助教授でこの研究の主任研究者であるYoung Jang博士は述べた。注入されたMuSCの1〜20%しか損傷組織には到達しない。また、組織の損傷によっては、注入が不可能になるため、新しい配送戦略の必要性が生じる。
「我々の新しいハイドロゲルは、幹細胞を保護し、幹細胞は増殖し、マトリックス内で増殖する。 ゲルは傷ついた筋肉に適応し、細胞が組織に移植されて治癒するのを助ける。」とジョージア工科大学工学部のポスドク研究員であ
ヒト幹細胞における脆弱X症候群の抑制されたFMR1遺伝子を再活性化するCRISPRツール
 研究者は遺伝子編集ツールを用いて、ヒト幹細胞における脆弱X症候群で抑制されたFMR1遺伝子の再活性化に成功した。このニュースは、2018年8月16日にDiogo PintoによりFragile X News Todayの記事で報告された。 このオープンアクセスの科学論文は「脆弱なX症候群の胚性幹細胞におけるFMR1転写の標的化された再活性化(Targeted Reactivation of FMR1 Transcription In Fragile X Syndrome Embryonic Stem Cells)」と題されており、2018年8月15日に分子神経科学のフロンティアでオンライン公開された。
脆弱X症候群(FXS)は、3つの余分なヌクレオチド(DNAのビルディングブロック)をその配列に付加することによって生じるFMR1遺伝子の突然変異によって引き起こされる。 これは、CGGリピートと呼ばれ、健常者では5から55まで変化する。リピートが繰り返されるほど、疾患を発症するリスクが高くなる。 この突然変異は、FMR1遺伝子によって産生されるタンパク質である脆弱X精神遅滞タンパク質(FMRP)の喪失をもたらす。これまでに試験された治療法は、FMRPタンパク質の損失を補うことを試み、通常はタンパク質機能の1つのみを標的とする。しかしながら、それらはこの疾患を治療するには不十分であることが証明されている。研究者らは、神経細胞および他の細胞型においてFMRPによって果たされる異なる機能は、1つの調節不能な分子経路のみを標的とする任意の治療では矯正するのが困難であり、今日までのヒト臨床試験での成功の欠如に関する潜在的な理由の1つと考えている 。
新たに報告された治療アプローチでは、ミシガン大学およびVA Ann Arbor Healthcare Systemの研究者は、突然変異
研究者は遺伝子編集ツールを用いて、ヒト幹細胞における脆弱X症候群で抑制されたFMR1遺伝子の再活性化に成功した。このニュースは、2018年8月16日にDiogo PintoによりFragile X News Todayの記事で報告された。 このオープンアクセスの科学論文は「脆弱なX症候群の胚性幹細胞におけるFMR1転写の標的化された再活性化(Targeted Reactivation of FMR1 Transcription In Fragile X Syndrome Embryonic Stem Cells)」と題されており、2018年8月15日に分子神経科学のフロンティアでオンライン公開された。
脆弱X症候群(FXS)は、3つの余分なヌクレオチド(DNAのビルディングブロック)をその配列に付加することによって生じるFMR1遺伝子の突然変異によって引き起こされる。 これは、CGGリピートと呼ばれ、健常者では5から55まで変化する。リピートが繰り返されるほど、疾患を発症するリスクが高くなる。 この突然変異は、FMR1遺伝子によって産生されるタンパク質である脆弱X精神遅滞タンパク質(FMRP)の喪失をもたらす。これまでに試験された治療法は、FMRPタンパク質の損失を補うことを試み、通常はタンパク質機能の1つのみを標的とする。しかしながら、それらはこの疾患を治療するには不十分であることが証明されている。研究者らは、神経細胞および他の細胞型においてFMRPによって果たされる異なる機能は、1つの調節不能な分子経路のみを標的とする任意の治療では矯正するのが困難であり、今日までのヒト臨床試験での成功の欠如に関する潜在的な理由の1つと考えている 。
新たに報告された治療アプローチでは、ミシガン大学およびVA Ann Arbor Healthcare Systemの研究者は、突然変異
ショウジョウバエの研究で睡眠の抗酸化効果が判明
 睡眠についての理解は、慢性的な睡眠不足が蔓延している現代社会において、ますます重要になってきている。 睡眠不足と健康への悪影響の相関関係を示すエビデンスとして、睡眠の核心機能は謎のままである。しかし、2018年7月12日にオープン・アクセス・ジャーナルPLOS Biologyに掲載された新しい研究では、ニューヨークのコロンビア大学のVanessa Hill博士、Mimi Shirasu-Hiza博士および同僚らは、短睡眠ショウジョウバエ変異体が急性酸化ストレスに対する感受性の共通の欠陥を共有し、睡眠が抗酸化プロセスをサポートすることを見出した。地味な存在のショウジョウバエだが、睡眠と酸化ストレスの古くからの双方向の関係を理解することは、睡眠障害や神経変性疾患など現代人の病気についての洞察を得ることができる。この論文は、「ショウジョウバエの睡眠と酸化ストレスとの間の双方向の関係(A Bidirectional Relationship Between Sleep and Oxidative Stress in Drosophila.)」と題されている。 睡眠中の動物は脆弱で不動であり、環境に反応しにくく、捕食者から逃げることができない。
睡眠行動の対価にも関わらず、ほとんどの動物は睡眠をとるため、睡眠はヒトからショウジョウバエまで本質的かつ進化的に保存された機能を示唆している。 研究者らは、健康の中枢機能のために睡眠が必要な場合、通常よりも睡眠時間が有意に少ない動物はすべて、その中枢機能に欠陥を共有するはずだと推論した。この研究のために、彼らは短睡眠ショウジョウバエ突然変異体の多様なグループを使用した。 彼らは、これらの短睡眠突然変異体が実際に共通の欠陥を共有していることを発見した。それらはすべて急性酸化ストレスに敏感である。 過剰のフリーラジカルに起因する酸化ストレスは、
睡眠についての理解は、慢性的な睡眠不足が蔓延している現代社会において、ますます重要になってきている。 睡眠不足と健康への悪影響の相関関係を示すエビデンスとして、睡眠の核心機能は謎のままである。しかし、2018年7月12日にオープン・アクセス・ジャーナルPLOS Biologyに掲載された新しい研究では、ニューヨークのコロンビア大学のVanessa Hill博士、Mimi Shirasu-Hiza博士および同僚らは、短睡眠ショウジョウバエ変異体が急性酸化ストレスに対する感受性の共通の欠陥を共有し、睡眠が抗酸化プロセスをサポートすることを見出した。地味な存在のショウジョウバエだが、睡眠と酸化ストレスの古くからの双方向の関係を理解することは、睡眠障害や神経変性疾患など現代人の病気についての洞察を得ることができる。この論文は、「ショウジョウバエの睡眠と酸化ストレスとの間の双方向の関係(A Bidirectional Relationship Between Sleep and Oxidative Stress in Drosophila.)」と題されている。 睡眠中の動物は脆弱で不動であり、環境に反応しにくく、捕食者から逃げることができない。
睡眠行動の対価にも関わらず、ほとんどの動物は睡眠をとるため、睡眠はヒトからショウジョウバエまで本質的かつ進化的に保存された機能を示唆している。 研究者らは、健康の中枢機能のために睡眠が必要な場合、通常よりも睡眠時間が有意に少ない動物はすべて、その中枢機能に欠陥を共有するはずだと推論した。この研究のために、彼らは短睡眠ショウジョウバエ突然変異体の多様なグループを使用した。 彼らは、これらの短睡眠突然変異体が実際に共通の欠陥を共有していることを発見した。それらはすべて急性酸化ストレスに敏感である。 過剰のフリーラジカルに起因する酸化ストレスは、
チェックポイント阻害剤による第一選択治療でメラノーマ脳転移患者の全生存期間が改善
 米国コホートの結果からメラノーマ脳転移(MBM: melanoma brain metastases)を有する皮膚メラノーマ患者のうち、チェックポイント阻害剤を用いた第一選択治療では、全生存期間の中央値が1.4倍増加していた。これらの結果は、Cancer Immunology Researchの2018年7月12日にオンラインで公開された。
この論文は、「免疫チェックポイント阻害療法の時代におけるメラノーマ脳転移のリスク調整後の生存の改善:全国コホートの結果(Improved Risk-Adjusted Survival for Melanoma Brain Metastases in the Era of Checkpoint Blockade Immunotherapies: Results from a National Cohort.)」と題されている。この研究の筆頭著者は、ブライアン・アンド・ウィメンズ病院/ハーバード大学医学部のポスドク研究員であり、ダナ・ファーバーがん研究所の医学腫瘍科であるJ. Bryan Iorgulescu博士だ。 上席著者は、ブリガム・アンド・ウイメンズ病院、ハーバード大学医学部脳神経外科およびダナ・ファーバー癌研究所 神経腫瘍センターのTimothy Smith 博士である。「免疫チェックポイント阻害療法は、進行したメラノーマ患者のケア方法に革命をもたらし、多くの患者で長期にわたる治療反応を導く」とIorgulescu博士は語る。しかし、免疫チェックポイント阻害療法の早期臨床試験の多くには、脳転移の患者数は少なかった - その発生率は高いにもかかわらず、このようなエキサイティングな療法の生存率は、この患者のかなりの部分で不明だった」
Iorgulescu博士らは、全米癌データベース(NCDB)から収集したデータを評価した。こ
米国コホートの結果からメラノーマ脳転移(MBM: melanoma brain metastases)を有する皮膚メラノーマ患者のうち、チェックポイント阻害剤を用いた第一選択治療では、全生存期間の中央値が1.4倍増加していた。これらの結果は、Cancer Immunology Researchの2018年7月12日にオンラインで公開された。
この論文は、「免疫チェックポイント阻害療法の時代におけるメラノーマ脳転移のリスク調整後の生存の改善:全国コホートの結果(Improved Risk-Adjusted Survival for Melanoma Brain Metastases in the Era of Checkpoint Blockade Immunotherapies: Results from a National Cohort.)」と題されている。この研究の筆頭著者は、ブライアン・アンド・ウィメンズ病院/ハーバード大学医学部のポスドク研究員であり、ダナ・ファーバーがん研究所の医学腫瘍科であるJ. Bryan Iorgulescu博士だ。 上席著者は、ブリガム・アンド・ウイメンズ病院、ハーバード大学医学部脳神経外科およびダナ・ファーバー癌研究所 神経腫瘍センターのTimothy Smith 博士である。「免疫チェックポイント阻害療法は、進行したメラノーマ患者のケア方法に革命をもたらし、多くの患者で長期にわたる治療反応を導く」とIorgulescu博士は語る。しかし、免疫チェックポイント阻害療法の早期臨床試験の多くには、脳転移の患者数は少なかった - その発生率は高いにもかかわらず、このようなエキサイティングな療法の生存率は、この患者のかなりの部分で不明だった」
Iorgulescu博士らは、全米癌データベース(NCDB)から収集したデータを評価した。こ
極地生物の不凍タンパク質が革命的な細菌凍結保存技術の開発を促す
 この新しい技術は、ヒト組織を保管し輸送する作業を根本的に改善することがでるだろう。英国のWarwick Medical School 化学部の研究者らは、ある極地生物に見られる天然の不凍タンパク質の合成を人工的に再現し、広範囲の細菌を凍結保存(または「凍結」)する方法を確立した。科学者らは、タンパク質の模倣体を加えることによって氷結晶の成長が遅くなり、それらが細菌細胞を破壊するのを止めることを見出した。 この革新的な方法は、食品産業、臓器輸送、医薬品、ならびに実験室における研究など、様々な用途の可能性を秘めている。
細菌は、食品技術(例えば、ヨーグルトおよびプロバイオティクス)、医薬品製造(例えば、インスリン)、および酵素生産(例えば、洗剤)を含む広範なプロセスで使用され、研究室では感染や生活プロセスの基本を研究するために日常的に使用されている。世界中のほぼすべての実験室で使用されている細菌を保存する伝統的なアプローチは、凍結中の低温誘発損傷を減少させるため細菌にグリセロールを添加する方法である。しかし、すべての細菌が解凍後に回復するわけではなく、その成長および有用性を可能にするために、グリセロールを細菌から除去する必要がある。Matthew I. Gibson教授が率いるWarwickのチームは、地球上で最も寒い地域に生存する極地生物にヒントを得て、凍結保存のための新しい方法を開発した。極地生物の中で特に関心を寄せているのは、
不凍タンパク質を生成する極地魚類である。研究チームは、極地魚類のタンパク質を模倣した合成ポリマーが、同じ作用を発揮することを実証した。凍結保存中の氷の成長を遅らせるために2つのポリマーを組み合わせることにより、研究者は従来の方法を使用するよりも凍結後に多くの細菌を回収することができた。 彼らはまた、いくつかのケースで従来の方法で典型的に使用され
この新しい技術は、ヒト組織を保管し輸送する作業を根本的に改善することがでるだろう。英国のWarwick Medical School 化学部の研究者らは、ある極地生物に見られる天然の不凍タンパク質の合成を人工的に再現し、広範囲の細菌を凍結保存(または「凍結」)する方法を確立した。科学者らは、タンパク質の模倣体を加えることによって氷結晶の成長が遅くなり、それらが細菌細胞を破壊するのを止めることを見出した。 この革新的な方法は、食品産業、臓器輸送、医薬品、ならびに実験室における研究など、様々な用途の可能性を秘めている。
細菌は、食品技術(例えば、ヨーグルトおよびプロバイオティクス)、医薬品製造(例えば、インスリン)、および酵素生産(例えば、洗剤)を含む広範なプロセスで使用され、研究室では感染や生活プロセスの基本を研究するために日常的に使用されている。世界中のほぼすべての実験室で使用されている細菌を保存する伝統的なアプローチは、凍結中の低温誘発損傷を減少させるため細菌にグリセロールを添加する方法である。しかし、すべての細菌が解凍後に回復するわけではなく、その成長および有用性を可能にするために、グリセロールを細菌から除去する必要がある。Matthew I. Gibson教授が率いるWarwickのチームは、地球上で最も寒い地域に生存する極地生物にヒントを得て、凍結保存のための新しい方法を開発した。極地生物の中で特に関心を寄せているのは、
不凍タンパク質を生成する極地魚類である。研究チームは、極地魚類のタンパク質を模倣した合成ポリマーが、同じ作用を発揮することを実証した。凍結保存中の氷の成長を遅らせるために2つのポリマーを組み合わせることにより、研究者は従来の方法を使用するよりも凍結後に多くの細菌を回収することができた。 彼らはまた、いくつかのケースで従来の方法で典型的に使用され
先天性免疫の警報システムセンサーを同定
 テキサス大学(UTサウスウェスタン)の研究者らは、DNA感知酵素が小さなバイオリアクターとして作用し、先天性免疫を刺激する分子を作り出す液滴を形成すると報告している。2018年7月5日にScience誌でオンライン公開された。この研究は、感染、自己免疫疾患、および癌に対する新規治療法につながる可能性がある。
ハワード・ヒューズ医学研究所の研究者で、この研究の上席著者であるUTサウスウェスタンの分子生物学教授 Zhijian James Chen博士は、これらの病気3つの共通点は、細胞質として知られている細胞のゲル様の内部にDNAが存在することであると言う。
この研究の筆頭著者は大学院生のMingjian Du氏である。 2012年、Chen博士の研究室では、先天性免疫に対する細胞性警報システムのセンサーとして機能するサイクリックGMP-AMP合成酵素(cGAS)を発見した。人体には2つの免疫系がある。第一は、脅威から身を守る生まれつきの先天性免疫システム。第二は、病原体を根絶するために特殊な免疫細胞を配備する適応免疫システムです。先天性免疫センサーであるcGASは、病原体や自己免疫疾患の場合は自己細胞から、遺伝物質が存在すべきでない細胞領域にDNAが出現すると警報を鳴らす。
Chen博士はまた、酵素cGASによって産生され、先天性免疫応答を引き起こす二次メッセンジャー小分子cGAMPを同定した。今回の研究では、cGASが病原性のDNAに遭遇するとDNAと結合して液滴サイズのマイクロリアクターが形成され、膜が欠損しているにも関わらず保持されることが判明している。この研究では、液滴を液相分離として保持するメカニズムが同定された。これは、サラダドレッシングのボトルを振り混ぜた後、油が酢から分離する方法に似ている。「液滴はマイクロリアクターとして働き、免疫系を活性化する
テキサス大学(UTサウスウェスタン)の研究者らは、DNA感知酵素が小さなバイオリアクターとして作用し、先天性免疫を刺激する分子を作り出す液滴を形成すると報告している。2018年7月5日にScience誌でオンライン公開された。この研究は、感染、自己免疫疾患、および癌に対する新規治療法につながる可能性がある。
ハワード・ヒューズ医学研究所の研究者で、この研究の上席著者であるUTサウスウェスタンの分子生物学教授 Zhijian James Chen博士は、これらの病気3つの共通点は、細胞質として知られている細胞のゲル様の内部にDNAが存在することであると言う。
この研究の筆頭著者は大学院生のMingjian Du氏である。 2012年、Chen博士の研究室では、先天性免疫に対する細胞性警報システムのセンサーとして機能するサイクリックGMP-AMP合成酵素(cGAS)を発見した。人体には2つの免疫系がある。第一は、脅威から身を守る生まれつきの先天性免疫システム。第二は、病原体を根絶するために特殊な免疫細胞を配備する適応免疫システムです。先天性免疫センサーであるcGASは、病原体や自己免疫疾患の場合は自己細胞から、遺伝物質が存在すべきでない細胞領域にDNAが出現すると警報を鳴らす。
Chen博士はまた、酵素cGASによって産生され、先天性免疫応答を引き起こす二次メッセンジャー小分子cGAMPを同定した。今回の研究では、cGASが病原性のDNAに遭遇するとDNAと結合して液滴サイズのマイクロリアクターが形成され、膜が欠損しているにも関わらず保持されることが判明している。この研究では、液滴を液相分離として保持するメカニズムが同定された。これは、サラダドレッシングのボトルを振り混ぜた後、油が酢から分離する方法に似ている。「液滴はマイクロリアクターとして働き、免疫系を活性化する
8,000年前の古代人のDNAを解析し、東南アジアの先史時代に関する長年の論争を解決
 東南アジア人の祖先に関する2つの競合する学説は、8,000年前の骨格から抽出された古代人のDNAを革新的手法で分析することによって否定された。東南アジアは世界で最も遺伝的に多様な地域の一つだが、100年以上に渡り科学者たちは、この地域の集団の起源についてどの理論が正しいかについて意見が割れていた。
1つの理論は、44,000年前から東南アジアに住んでいた先住民のホアビン狩猟採集民が、東アジアの初期の農家からの提供なしに、独立して農業慣行を採択したと主張している。 "2層モデル"と呼ばれるもう一つの理論は、現在の中国にあたる地域の米農家が移住し、ホアビン狩猟採集民を置き換えたという見解を支持している。2018年7月6日のScience誌に掲載された新研究に協力した世界各地の学者は、どちらの理論も完全に正確ではないことを見出した。彼らの研究は、現在の東南アジア人が少なくとも4つの古代人集団を祖先に持つことを発見した。この論文は「東南アジアの先史時代の人類学(The prehistoric peopling of Southeast Asia.)」と題されたもので、8,000年前のマレーシア、タイ、フィリピン、ベトナム、インドネシア、ラオス、日本からのヒト骨格遺体からDNAが抽出された(これまで成功したDNAシーケンシングは4,000年前のサンプルだけであった)。これらのサンプルには、集団間の遺伝的連鎖が疑われているホアビン狩猟採集民と日本の縄文人のDNAも含まれていた。合計26の古代人のヒトゲノム配列を研究し、東南アジアに住む現代人のDNAサンプルと比較した。東南アジアの暑さと湿気はDNA保存にとって最も困難な環境の一つであり、この先駆的研究は科学者に大きな課題を提起する印象的なものと言える。
この国際的な調査は、セントジョンズ・カレッジ、ケンブリッジ大学、コペンハーゲン大
東南アジア人の祖先に関する2つの競合する学説は、8,000年前の骨格から抽出された古代人のDNAを革新的手法で分析することによって否定された。東南アジアは世界で最も遺伝的に多様な地域の一つだが、100年以上に渡り科学者たちは、この地域の集団の起源についてどの理論が正しいかについて意見が割れていた。
1つの理論は、44,000年前から東南アジアに住んでいた先住民のホアビン狩猟採集民が、東アジアの初期の農家からの提供なしに、独立して農業慣行を採択したと主張している。 "2層モデル"と呼ばれるもう一つの理論は、現在の中国にあたる地域の米農家が移住し、ホアビン狩猟採集民を置き換えたという見解を支持している。2018年7月6日のScience誌に掲載された新研究に協力した世界各地の学者は、どちらの理論も完全に正確ではないことを見出した。彼らの研究は、現在の東南アジア人が少なくとも4つの古代人集団を祖先に持つことを発見した。この論文は「東南アジアの先史時代の人類学(The prehistoric peopling of Southeast Asia.)」と題されたもので、8,000年前のマレーシア、タイ、フィリピン、ベトナム、インドネシア、ラオス、日本からのヒト骨格遺体からDNAが抽出された(これまで成功したDNAシーケンシングは4,000年前のサンプルだけであった)。これらのサンプルには、集団間の遺伝的連鎖が疑われているホアビン狩猟採集民と日本の縄文人のDNAも含まれていた。合計26の古代人のヒトゲノム配列を研究し、東南アジアに住む現代人のDNAサンプルと比較した。東南アジアの暑さと湿気はDNA保存にとって最も困難な環境の一つであり、この先駆的研究は科学者に大きな課題を提起する印象的なものと言える。
この国際的な調査は、セントジョンズ・カレッジ、ケンブリッジ大学、コペンハーゲン大
クモはシルクを使い、電場で数千マイルも気球飛行する
 クモの空気力学的能力は、何百年もの間科学者を虜にしてきた。 チャールズ・ダーウィン自身、どのように何百もの生き物たちが穏やかな日にビーグル号に 来て、そして風が吹かない日に素早く船から飛び立つのかをじっと考えていた。科学者らは、これら無翅の節足動物のクモの飛行行動が、風に乗るシルクの尾を放つことによって数千マイルも移動することができる「気球飛行」に起因していると考えていた。
しかし、無風、曇り空、そして雨が降っているときでさえ気球飛行が観察されたという事実は、ある疑問を生じさせる。"クモはどのように空力抵抗が低い状態で飛ぶのか?" ブリストル大学(英国)の生物学者は、その答えを見つけたと確信している。「多くのクモは、扇状に広がった複数本のシルクを使って気球を膨らましている。これは斥力的な静電気力が必要であることを示唆している」と感覚生物物理学の主任研究員 Erica Morley博士は説明する。「現在の理論は、風だけでクモの気球パターンを予測することはできない。何日も大量に飛んだり、他の日にはクモが全く気球を使わなくなるのは何故か? 他の外的な力や気球の空気抵抗を引き起こす可能性があるかどうか、そしてこの刺激を検出するためにどのような知覚システムが使用されるのか探し当てたいと考えていた。」
この謎に対する解決策は、常に大気中に存在する大域電気回路である大気電位勾配(Atmospheric Potential Gradient:APG)の可能性がある。 APGとすべての物質を囲む電場は昆虫によって検出することができる。例えば、バンブルビーは、自分自身と花との間で発生する電界を検出することができ、ミツバチは巣と通信するために使用することができる。 クモのシルクは長い間、効果的な電気絶縁体として知られていたが、今まで、クモが蜂と同様に電場を検出して応答することは知られていな
クモの空気力学的能力は、何百年もの間科学者を虜にしてきた。 チャールズ・ダーウィン自身、どのように何百もの生き物たちが穏やかな日にビーグル号に 来て、そして風が吹かない日に素早く船から飛び立つのかをじっと考えていた。科学者らは、これら無翅の節足動物のクモの飛行行動が、風に乗るシルクの尾を放つことによって数千マイルも移動することができる「気球飛行」に起因していると考えていた。
しかし、無風、曇り空、そして雨が降っているときでさえ気球飛行が観察されたという事実は、ある疑問を生じさせる。"クモはどのように空力抵抗が低い状態で飛ぶのか?" ブリストル大学(英国)の生物学者は、その答えを見つけたと確信している。「多くのクモは、扇状に広がった複数本のシルクを使って気球を膨らましている。これは斥力的な静電気力が必要であることを示唆している」と感覚生物物理学の主任研究員 Erica Morley博士は説明する。「現在の理論は、風だけでクモの気球パターンを予測することはできない。何日も大量に飛んだり、他の日にはクモが全く気球を使わなくなるのは何故か? 他の外的な力や気球の空気抵抗を引き起こす可能性があるかどうか、そしてこの刺激を検出するためにどのような知覚システムが使用されるのか探し当てたいと考えていた。」
この謎に対する解決策は、常に大気中に存在する大域電気回路である大気電位勾配(Atmospheric Potential Gradient:APG)の可能性がある。 APGとすべての物質を囲む電場は昆虫によって検出することができる。例えば、バンブルビーは、自分自身と花との間で発生する電界を検出することができ、ミツバチは巣と通信するために使用することができる。 クモのシルクは長い間、効果的な電気絶縁体として知られていたが、今まで、クモが蜂と同様に電場を検出して応答することは知られていな
プラスチック容器中の化合物が炎症性腸疾患(IBD)を悪化させる可能性。動物研究が示唆。
 炎症性腸疾患(IBD)の前臨床モデルにおける最近の研究で、ポリカーボネートプラスチックおよびエポキシ樹脂中に見出されるビスフェノールAまたはBPAの食物曝露が死亡率を増加させ、その症状を悪化させる可能性があることを示している。Experimental Biology and Medicine誌で2018年6月6日にオンラインで公開された研究は、テキサスA&M大学の栄養食品科学研究科のClint Allred博士が主導した。
この論文は、「芳香族アミノ酸から誘導された微生物代謝産物を変え、大腸炎の間の病気の活動を悪化させるビスフェノールA変種(Bisphenol-A Alters Microbiota Metabolites Derived From Aromatic Amino Acids And Worsens Disease Activity During Colitis.)」と題されている。全文はオンライン< https://tinyurl.com/IBDresearchBPA >で見ることができる。「これはBPAが過敏性腸疾患に関連している腸内微生物のアミノ酸代謝に悪影響を与えることを示す最初の研究である」と栄養食品科学部の大学院生であるJennifer DeLucaは述べた。この研究に参加したのはKimberly Allred博士(栄養食品科学部門)とRami Menon(Texas A&M化学工学科の化学エンジニア)であった。 IBDは、潰瘍性大腸炎およびクローン病を含む複雑な疾患の集合である。 消化管の慢性炎症があり、IBDに関連する症状としては、重度の下痢、腹痛、疲労および体重減少が挙げられる。 より深刻な例は、生涯にわたる治療または場合によっては外科手術を必要とする可能性がある。「IBDの原因はまだ明らかにされていないが、食生活、喫煙、感染、腸内微生物の
炎症性腸疾患(IBD)の前臨床モデルにおける最近の研究で、ポリカーボネートプラスチックおよびエポキシ樹脂中に見出されるビスフェノールAまたはBPAの食物曝露が死亡率を増加させ、その症状を悪化させる可能性があることを示している。Experimental Biology and Medicine誌で2018年6月6日にオンラインで公開された研究は、テキサスA&M大学の栄養食品科学研究科のClint Allred博士が主導した。
この論文は、「芳香族アミノ酸から誘導された微生物代謝産物を変え、大腸炎の間の病気の活動を悪化させるビスフェノールA変種(Bisphenol-A Alters Microbiota Metabolites Derived From Aromatic Amino Acids And Worsens Disease Activity During Colitis.)」と題されている。全文はオンライン< https://tinyurl.com/IBDresearchBPA >で見ることができる。「これはBPAが過敏性腸疾患に関連している腸内微生物のアミノ酸代謝に悪影響を与えることを示す最初の研究である」と栄養食品科学部の大学院生であるJennifer DeLucaは述べた。この研究に参加したのはKimberly Allred博士(栄養食品科学部門)とRami Menon(Texas A&M化学工学科の化学エンジニア)であった。 IBDは、潰瘍性大腸炎およびクローン病を含む複雑な疾患の集合である。 消化管の慢性炎症があり、IBDに関連する症状としては、重度の下痢、腹痛、疲労および体重減少が挙げられる。 より深刻な例は、生涯にわたる治療または場合によっては外科手術を必要とする可能性がある。「IBDの原因はまだ明らかにされていないが、食生活、喫煙、感染、腸内微生物の
迅速に血液サンプルから循環腫瘍細胞(CTC)を分離する音響マイクロ流体プラットフォーム
 国際的な研究者チームが音波を用い、血液サンプルから循環腫瘍細胞を臨床使用に迅速かつ効率的に分離する、穏やかで非接触の方法を開発した。循環腫瘍細胞(CTC)は、血流に漏れ出して流れる腫瘍の一部である。腫瘍の種類、身体的特徴、遺伝的変異など、豊富な情報が含まれている。
これらの細胞を血液サンプルから迅速かつ効率的に採取して増殖させることにより、個々のCTCプロファイリングに基づいた治療戦略のための強力な診断、予後および示唆を提供することができる「液体生検」が可能になる。しかし、CTCは非常に希少であり、捕らえるのが難しい。通常、患者の静脈を通っている数十億の血液細胞当たりほんの少数存在するのみである。また、腫瘍細胞を正常な血液細胞から分離するために設計された多くの技術があるが、いずれも完全ではない。それらは、処理中の細胞を損傷または殺してしまう傾向があり、効率が不十分であり、特定のタイプの癌にのみ作用するか、または多くの状況で使用するのに時間が長すぎる。新研究では、1時間以内に7.5mLバイアルの血液からCTCを少なくとも86%の効率で分離することができる音波を利用したプラットフォームを、デューク大学、MIT、および南洋理工大学(シンガポール)の研究者が実証した。 さらに改良された技術により、安価で使い捨てのチップを使い新たにテストすることが期待されている。この結果は、2018年7月3日にオンラインで the journal Smallに掲載された。 この記事は、「ハイスループット音響分離による循環腫瘍細胞の表現型解析(Circulating Tumor Cell Phenotyping via High‐Throughput Acoustic Separation.)」と題されている。
毎年がんで世界中の何百万人もの人々の命が奪われており、研究者たちはがんの診断、予
国際的な研究者チームが音波を用い、血液サンプルから循環腫瘍細胞を臨床使用に迅速かつ効率的に分離する、穏やかで非接触の方法を開発した。循環腫瘍細胞(CTC)は、血流に漏れ出して流れる腫瘍の一部である。腫瘍の種類、身体的特徴、遺伝的変異など、豊富な情報が含まれている。
これらの細胞を血液サンプルから迅速かつ効率的に採取して増殖させることにより、個々のCTCプロファイリングに基づいた治療戦略のための強力な診断、予後および示唆を提供することができる「液体生検」が可能になる。しかし、CTCは非常に希少であり、捕らえるのが難しい。通常、患者の静脈を通っている数十億の血液細胞当たりほんの少数存在するのみである。また、腫瘍細胞を正常な血液細胞から分離するために設計された多くの技術があるが、いずれも完全ではない。それらは、処理中の細胞を損傷または殺してしまう傾向があり、効率が不十分であり、特定のタイプの癌にのみ作用するか、または多くの状況で使用するのに時間が長すぎる。新研究では、1時間以内に7.5mLバイアルの血液からCTCを少なくとも86%の効率で分離することができる音波を利用したプラットフォームを、デューク大学、MIT、および南洋理工大学(シンガポール)の研究者が実証した。 さらに改良された技術により、安価で使い捨てのチップを使い新たにテストすることが期待されている。この結果は、2018年7月3日にオンラインで the journal Smallに掲載された。 この記事は、「ハイスループット音響分離による循環腫瘍細胞の表現型解析(Circulating Tumor Cell Phenotyping via High‐Throughput Acoustic Separation.)」と題されている。
毎年がんで世界中の何百万人もの人々の命が奪われており、研究者たちはがんの診断、予
オーストラリア連邦科学産業研究機構が特定のサイトカインの産生を調節する遺伝子を同定
 オーストラリア連邦科学産業研究機構(CSIRO)は、感染と病気に対する身体の免疫応答を調節する上で重要な役割を果たす遺伝子を同定した。 この発見は、インフルエンザ、関節炎、さらには癌のための新しい治療法の開発につながる可能性がある。 C6orf106または「C6」と呼ばれるこの遺伝子は、感染症、癌および糖尿病に関与するタンパク質の産生を制御している。
この遺伝子は5億年前から存在していたが、その潜在力は今解ったばかりだ。この論文は、「C6orf106は、インターフェロン調節因子-3依存性 抗ウイルス応答の新規阻害物質である。(C6orf106 Is A Novel Inhibitor of the Interferon-Regulatory Factor 3-Dependent Innate Antiviral Response.)」と題されている。
CSIROの研究員であるCameron Stewart博士は、「私たちの免疫系は、免疫系を強化しウイルスや他の病原体が複製して病気を引き起こすのを防ぐ働きをするサイトカインと呼ばれるタンパク質を産生する。 C6は、制御不能なスパイラルから特定のサイトカインの産生をスイッチオフし、免疫応答を止めることによって、このプロセスを制御している。C6によって制御されるサイトカインは、癌、糖尿病および関節リウマチなどの炎症性疾患を含む様々な疾患に関係する。」と語った。この発見は、我々の免疫系の理解向上に役立ち、この理解により科学者がより標的を絞った新しい治療法を開発することが期待される。「ヒトゲノムは2003年に初めて完全に配列決定されたが、まだほとんど知られていない数千もの遺伝子がある」とCSIROの元研究員でハドソン医学研究所のRebecca Ambrose博士は語った。 Ambrose博士はC6遺伝子を発見したCSIROチ
オーストラリア連邦科学産業研究機構(CSIRO)は、感染と病気に対する身体の免疫応答を調節する上で重要な役割を果たす遺伝子を同定した。 この発見は、インフルエンザ、関節炎、さらには癌のための新しい治療法の開発につながる可能性がある。 C6orf106または「C6」と呼ばれるこの遺伝子は、感染症、癌および糖尿病に関与するタンパク質の産生を制御している。
この遺伝子は5億年前から存在していたが、その潜在力は今解ったばかりだ。この論文は、「C6orf106は、インターフェロン調節因子-3依存性 抗ウイルス応答の新規阻害物質である。(C6orf106 Is A Novel Inhibitor of the Interferon-Regulatory Factor 3-Dependent Innate Antiviral Response.)」と題されている。
CSIROの研究員であるCameron Stewart博士は、「私たちの免疫系は、免疫系を強化しウイルスや他の病原体が複製して病気を引き起こすのを防ぐ働きをするサイトカインと呼ばれるタンパク質を産生する。 C6は、制御不能なスパイラルから特定のサイトカインの産生をスイッチオフし、免疫応答を止めることによって、このプロセスを制御している。C6によって制御されるサイトカインは、癌、糖尿病および関節リウマチなどの炎症性疾患を含む様々な疾患に関係する。」と語った。この発見は、我々の免疫系の理解向上に役立ち、この理解により科学者がより標的を絞った新しい治療法を開発することが期待される。「ヒトゲノムは2003年に初めて完全に配列決定されたが、まだほとんど知られていない数千もの遺伝子がある」とCSIROの元研究員でハドソン医学研究所のRebecca Ambrose博士は語った。 Ambrose博士はC6遺伝子を発見したCSIROチ
鉄-硫黄クラスターの研究は、病気を調べる新しい手段を提案する
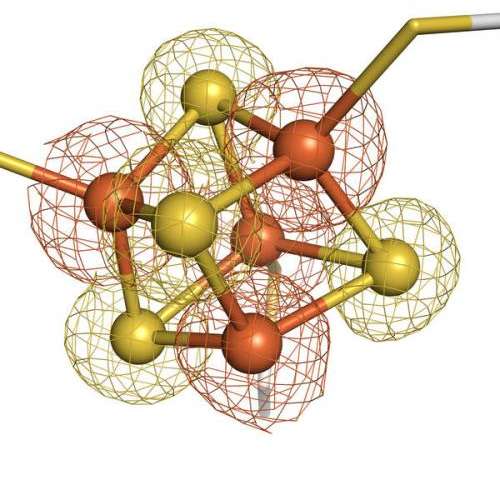 人体の多くの重要なタンパク質は、正しく働くために、鉄 - 硫黄クラスター、鉄と硫黄原子でできた小さな構造を必要とする。アメリカ国立がん研究所(NCI)、アメリカ国立衛生研究所(NIH)、およびケンタッキー大学の研究者は、鉄硫黄クラスターの形成の中断が特定の細胞に脂肪小滴の蓄積をもたらす可能性があることを発見した。
これらの発見は、Journal of Biological Chemistryの2018年5月25日号に掲載されており、非アルコール性脂肪肝疾患や腎明細胞癌のような状態の生化学的原因に関する手がかりを提供する。この記事は、「哺乳動物細胞における代謝再プログラミングおよび脂質液滴の形成における鉄-硫黄クラスターの急性喪失(Acute loss of Iron–Sulfur Clusters Results in Metabolic Reprogramming and Generation of Lipid Droplets in Mammalian Cells.)」と題されている。「鉄-硫黄クラスターは繊細で、細胞内の損傷を受けやすい」と新しい研究を率いたポスドクのDaniel Crooks博士は語った。「この理由から、私たちの体内の細胞は常に新しい鉄-硫黄クラスターを構築している」 Crooks博士は、NIH傘下機関の国立小児保健発達研究所(Eunice Kennedy Shriver National Institute of Child Health and Human Development:NICHD)のTracey Rouault博士のラボで、鉄-硫黄クラスターを形成する酵素の研究を開始した。
これらの酵素の1つの突然変異は、強く健康的に見えるにもかかわらず、患者が痛みや衰弱を感じることなく短時間以上運動できない遺伝的状態であるISCU(鉄-硫黄クラ
人体の多くの重要なタンパク質は、正しく働くために、鉄 - 硫黄クラスター、鉄と硫黄原子でできた小さな構造を必要とする。アメリカ国立がん研究所(NCI)、アメリカ国立衛生研究所(NIH)、およびケンタッキー大学の研究者は、鉄硫黄クラスターの形成の中断が特定の細胞に脂肪小滴の蓄積をもたらす可能性があることを発見した。
これらの発見は、Journal of Biological Chemistryの2018年5月25日号に掲載されており、非アルコール性脂肪肝疾患や腎明細胞癌のような状態の生化学的原因に関する手がかりを提供する。この記事は、「哺乳動物細胞における代謝再プログラミングおよび脂質液滴の形成における鉄-硫黄クラスターの急性喪失(Acute loss of Iron–Sulfur Clusters Results in Metabolic Reprogramming and Generation of Lipid Droplets in Mammalian Cells.)」と題されている。「鉄-硫黄クラスターは繊細で、細胞内の損傷を受けやすい」と新しい研究を率いたポスドクのDaniel Crooks博士は語った。「この理由から、私たちの体内の細胞は常に新しい鉄-硫黄クラスターを構築している」 Crooks博士は、NIH傘下機関の国立小児保健発達研究所(Eunice Kennedy Shriver National Institute of Child Health and Human Development:NICHD)のTracey Rouault博士のラボで、鉄-硫黄クラスターを形成する酵素の研究を開始した。
これらの酵素の1つの突然変異は、強く健康的に見えるにもかかわらず、患者が痛みや衰弱を感じることなく短時間以上運動できない遺伝的状態であるISCU(鉄-硫黄クラ
ヒト独特と考えられた筋肉が、類人猿で発見された
 「ヒト独特」と考えられていた筋肉が、いくつかの類人猿の種で発見されており、ヒトの軟組織の起源と進化に関する長年の理論に議論が起こっている。 この発見は、特定の筋肉が、二足歩行、道具の使用、声によるコミュニケーション、表情など、ヒトの特質に対する特別な適応を提供する唯一の目的のために進化したというヒト中心の見解に疑問を投げかけている。
Frontiers in Ecology and Evolutionで2018年4月26日に発表されたこの研究は、ヒトの進化をより良く理解するためには、類人猿の解剖学の徹底的な知識が必要であることを強調している。この論文は、「ボノボの最初の詳細な解剖学的研究は、特定の変異を明らかにし、ヒトの進化、二足歩行、および道具の使用に関するストーリーを明らかにする。(First Detailed Anatomical Study of Bonobos Reveals Intra-Specific Variations and Exposes Just-So Stories of Human Evolution, Bipedalism, and Tool Use.)」と題されている。 「この研究は、ヒトの進化と〝自然の階段〟におけるヒトの位置付けについてのドグマと矛盾している」とワシントンDCのハワード大学 解剖学科のRui Diogo博士は言う。
「私たちの詳細な分析によれば、実際には、一意にヒト独特であり、二足歩行、道具の使用、および声と顔のコミュニケーションのための重要な特異的機能の適応を提供するためのものと長年捉えられてきた筋肉は、ボノボや他の類人猿(チンパンジーやゴリラ)でも類似した形態であることが分かった。」長年に渡る進化論は主に先史時代の標本の骨構造に基づいており、ヒトは他の動物よりもはるかに特殊で複雑であるという考えに基づいている。これ
「ヒト独特」と考えられていた筋肉が、いくつかの類人猿の種で発見されており、ヒトの軟組織の起源と進化に関する長年の理論に議論が起こっている。 この発見は、特定の筋肉が、二足歩行、道具の使用、声によるコミュニケーション、表情など、ヒトの特質に対する特別な適応を提供する唯一の目的のために進化したというヒト中心の見解に疑問を投げかけている。
Frontiers in Ecology and Evolutionで2018年4月26日に発表されたこの研究は、ヒトの進化をより良く理解するためには、類人猿の解剖学の徹底的な知識が必要であることを強調している。この論文は、「ボノボの最初の詳細な解剖学的研究は、特定の変異を明らかにし、ヒトの進化、二足歩行、および道具の使用に関するストーリーを明らかにする。(First Detailed Anatomical Study of Bonobos Reveals Intra-Specific Variations and Exposes Just-So Stories of Human Evolution, Bipedalism, and Tool Use.)」と題されている。 「この研究は、ヒトの進化と〝自然の階段〟におけるヒトの位置付けについてのドグマと矛盾している」とワシントンDCのハワード大学 解剖学科のRui Diogo博士は言う。
「私たちの詳細な分析によれば、実際には、一意にヒト独特であり、二足歩行、道具の使用、および声と顔のコミュニケーションのための重要な特異的機能の適応を提供するためのものと長年捉えられてきた筋肉は、ボノボや他の類人猿(チンパンジーやゴリラ)でも類似した形態であることが分かった。」長年に渡る進化論は主に先史時代の標本の骨構造に基づいており、ヒトは他の動物よりもはるかに特殊で複雑であるという考えに基づいている。これ
NIHはプレシジョンメディシンを進歩させるため100万人のボランティアによる野心的な“All of Us”研究プログラムを始動
 アメリカ国立衛生研究所(NIH)は、2018年5月6日(日)に、すべてのバックグラウンドの人々の個別化予防・治療・ケアを目指し、「All of Us 研究プログラム」(https://www.joinallofus.org/en)の全国登録を開始した。健康状態にかかわらず、18歳以上の人々が登録することができる。
公開日には、全国の7つの都市でのコミュニティイベントとオンラインイベントが行われた。プログラムの全国立ち上げの準備期間における1年間のベータテストを通じ、All of Usにすでに2万5千人以上のボランティアが登録している。全体的な目的は、100万人以上のボランティアと研究で過小評価されているオーバーサンプリングコミュニティを登録することです。Alex Azar 保健福祉部長官は、「All of Usは、病気や医療の研究方法に革命を起こす可能性のある野心的なプロジェクトだ」と述べた。「NIHの前例のない努力は、パーソナライズされた、非常に効果的なヘルスケアの新しい時代のための科学的基礎を築くだろう。 私たちは、全てのバックグラウンドの人々と協力して、この国の健康のために大きな一歩を踏み出すことを楽しみにしている。」プレシジョンメディシンは、人々のライフスタイル、環境、遺伝子を含む生物学的構成の違いを考慮した、疾患の治療と予防への新たなアプローチである。眼鏡や補聴器では、私たちは長い間、個人のニーズに合わせたカスタマイズされたソリューションを提供されてきた。 もっと最近では、特定のタイプの癌の治療は、患者のDNAを標的とした治療で可能になった。 それでも、個人、その家族、地域社会、医療界に良い選択肢を与えられずに多くの未解決の課題が残っている。
NIHのFrancis S. Collins 博士(PhD)は、「All of Us 研究プログラムはすべて、あらゆる
アメリカ国立衛生研究所(NIH)は、2018年5月6日(日)に、すべてのバックグラウンドの人々の個別化予防・治療・ケアを目指し、「All of Us 研究プログラム」(https://www.joinallofus.org/en)の全国登録を開始した。健康状態にかかわらず、18歳以上の人々が登録することができる。
公開日には、全国の7つの都市でのコミュニティイベントとオンラインイベントが行われた。プログラムの全国立ち上げの準備期間における1年間のベータテストを通じ、All of Usにすでに2万5千人以上のボランティアが登録している。全体的な目的は、100万人以上のボランティアと研究で過小評価されているオーバーサンプリングコミュニティを登録することです。Alex Azar 保健福祉部長官は、「All of Usは、病気や医療の研究方法に革命を起こす可能性のある野心的なプロジェクトだ」と述べた。「NIHの前例のない努力は、パーソナライズされた、非常に効果的なヘルスケアの新しい時代のための科学的基礎を築くだろう。 私たちは、全てのバックグラウンドの人々と協力して、この国の健康のために大きな一歩を踏み出すことを楽しみにしている。」プレシジョンメディシンは、人々のライフスタイル、環境、遺伝子を含む生物学的構成の違いを考慮した、疾患の治療と予防への新たなアプローチである。眼鏡や補聴器では、私たちは長い間、個人のニーズに合わせたカスタマイズされたソリューションを提供されてきた。 もっと最近では、特定のタイプの癌の治療は、患者のDNAを標的とした治療で可能になった。 それでも、個人、その家族、地域社会、医療界に良い選択肢を与えられずに多くの未解決の課題が残っている。
NIHのFrancis S. Collins 博士(PhD)は、「All of Us 研究プログラムはすべて、あらゆる
肺の界面活性タンパク質を模したペプトイドで損傷した肺の能力を回復
 スタンフォード大学の研究者は、新研究でラットの傷ついた肺の呼吸能力を回復させるのに有効なタンパク質模倣物を生物工学により作った。この合成産物は、ヒトの急性肺傷害に対して、より良い、より安価な治療につながる可能性がある。 ラットで使用した際、それはいくつかの生理的尺度で高価な動物由来の製品と同等またはそれ以上の性能を示したと研究は述べている。
この研究論文は、5月1日にScientific Reportsにオンラインで掲載された。このオープンアクセス論文は、「肺サーファクタントタンパク質のヘリックス性、両親媒性ペプトイド模倣物による急性肺傷害の有効なインビボ治療(Effective in vivo treatment of acute lung injury with helical, amphipathic peptoid mimics of pulmonary surfactant proteins.)」と題されている。テニスコートぐらいの表面積を持つ風船を膨らませるために必要な力を想像してください。 さらに、その風船にはポケットがあり、湿った内面を持ち、繊細な素材で作られていると想像してください。その風船とはあなたの肺のことです。すべての呼吸は奇跡的なことなのです。石鹸の様な膜または界面活性剤の薄いコーティングが肺の内面の張力を低下させ、吸入するのに必要な力を大きく減少させる。この界面活性剤なくして、呼吸することはできない。スタンフォード大学の生物工学准教授であるAnnelise Barron 博士(写真)は、「肺の界面活性剤には素晴らしい生物学的特性がある。」と述べた。
「この存在の鍵は、表面張力を切断する独自の構造を持つ2つの特殊なタンパク質が界面活性剤に存在することである。 しかし、これらの驚くべき構造特性も、合成や精製が難しく、溶液中では比較的不安定であり、
スタンフォード大学の研究者は、新研究でラットの傷ついた肺の呼吸能力を回復させるのに有効なタンパク質模倣物を生物工学により作った。この合成産物は、ヒトの急性肺傷害に対して、より良い、より安価な治療につながる可能性がある。 ラットで使用した際、それはいくつかの生理的尺度で高価な動物由来の製品と同等またはそれ以上の性能を示したと研究は述べている。
この研究論文は、5月1日にScientific Reportsにオンラインで掲載された。このオープンアクセス論文は、「肺サーファクタントタンパク質のヘリックス性、両親媒性ペプトイド模倣物による急性肺傷害の有効なインビボ治療(Effective in vivo treatment of acute lung injury with helical, amphipathic peptoid mimics of pulmonary surfactant proteins.)」と題されている。テニスコートぐらいの表面積を持つ風船を膨らませるために必要な力を想像してください。 さらに、その風船にはポケットがあり、湿った内面を持ち、繊細な素材で作られていると想像してください。その風船とはあなたの肺のことです。すべての呼吸は奇跡的なことなのです。石鹸の様な膜または界面活性剤の薄いコーティングが肺の内面の張力を低下させ、吸入するのに必要な力を大きく減少させる。この界面活性剤なくして、呼吸することはできない。スタンフォード大学の生物工学准教授であるAnnelise Barron 博士(写真)は、「肺の界面活性剤には素晴らしい生物学的特性がある。」と述べた。
「この存在の鍵は、表面張力を切断する独自の構造を持つ2つの特殊なタンパク質が界面活性剤に存在することである。 しかし、これらの驚くべき構造特性も、合成や精製が難しく、溶液中では比較的不安定であり、
ダークチョコレートのストレス・炎症・気分・記憶および免疫に対する効果が新研究により示された
 新しい研究によると、特定の種類のダークチョコレートを食べると健康上の恩恵があるかもしれない。 サンディエゴで行われたExperimental Biology 2018年次会議(2月21-25日)で発表された2つの研究結果は、高濃度のカカオ(カカオ70%、有機砂糖30%)を含むダークチョコレートを摂取すると、ストレスレベル、炎症、気分、記憶、および免疫にポジティブな効果が見られた。
カカオがフラボノイドを多く含むことはよく知られているが、認知、内分泌、および心臓血管の健康をどの様にサポートするのかを特定するため、ヒト被験者で効果が研究されたのはこれが初めてである。米国ロマリンダ大学の連合医療専門学校、精神免疫学および食品科学の研究部長 Lee S. Berk 公衆衛生学博士は、両研究の主任研究員を務めた。 「数年前から、ダークチョコレートの糖度の観点からの神経学的機能への影響を見てきた。砂糖が多いほど私たちはより幸せだ。」とBerk博士は述べた。 「短期間または長期間にわたり、通常サイズのチョコレートバーと同程度の少量のカカオの影響を見てきたのはこれが初めてのことである。これらの研究は、カカオの濃度が高いほど認知、記憶、気分、免疫、および他の有益な効果への影響がよりポジティブなものであることを示している」カカオのフラボノイドは、脳や心臓血管の健康に有益な既知のメカニズムを有する極めて強力な抗酸化剤および抗炎症剤である。下記の結果は「ダークチョコレート(70%カカオ)がヒトの遺伝子発現に及ぼす影響:カカオは細胞の免疫応答、神経シグナル伝達および知覚を調節する」(4月23日月曜日10: 00〜12:00、サンディエゴ・コンベンションセンター・展示ホールA〜D)で発表された。
このパイロット実証試験は、炎症性サイトカインに焦点を当て、70%のカカオチョコレートの消費がヒト免疫お
新しい研究によると、特定の種類のダークチョコレートを食べると健康上の恩恵があるかもしれない。 サンディエゴで行われたExperimental Biology 2018年次会議(2月21-25日)で発表された2つの研究結果は、高濃度のカカオ(カカオ70%、有機砂糖30%)を含むダークチョコレートを摂取すると、ストレスレベル、炎症、気分、記憶、および免疫にポジティブな効果が見られた。
カカオがフラボノイドを多く含むことはよく知られているが、認知、内分泌、および心臓血管の健康をどの様にサポートするのかを特定するため、ヒト被験者で効果が研究されたのはこれが初めてである。米国ロマリンダ大学の連合医療専門学校、精神免疫学および食品科学の研究部長 Lee S. Berk 公衆衛生学博士は、両研究の主任研究員を務めた。 「数年前から、ダークチョコレートの糖度の観点からの神経学的機能への影響を見てきた。砂糖が多いほど私たちはより幸せだ。」とBerk博士は述べた。 「短期間または長期間にわたり、通常サイズのチョコレートバーと同程度の少量のカカオの影響を見てきたのはこれが初めてのことである。これらの研究は、カカオの濃度が高いほど認知、記憶、気分、免疫、および他の有益な効果への影響がよりポジティブなものであることを示している」カカオのフラボノイドは、脳や心臓血管の健康に有益な既知のメカニズムを有する極めて強力な抗酸化剤および抗炎症剤である。下記の結果は「ダークチョコレート(70%カカオ)がヒトの遺伝子発現に及ぼす影響:カカオは細胞の免疫応答、神経シグナル伝達および知覚を調節する」(4月23日月曜日10: 00〜12:00、サンディエゴ・コンベンションセンター・展示ホールA〜D)で発表された。
このパイロット実証試験は、炎症性サイトカインに焦点を当て、70%のカカオチョコレートの消費がヒト免疫お
世界初!生細胞で明らかにされたiモチーフ(ツイストノット)DNAの新構造
 それはDNAだが、私たちの知っているそれではない。オーストラリアの研究者は世界で初めて細胞内に“iモチーフ”と呼ばれる新しいDNA構造を同定した。DNAのねじれた“結び目”、iモチーフはこれまで生きている細胞の中で直接見られたことはなかった。ガルバン医学研究所の新しい発見は、Nature Chemistryの2018年4月23日にオンラインで公開された。
この論文は、「I-モチーフDNA構造はヒト細胞の核に形成される(I-Motif DNA Structures Are Formed in the Nuclei of Human Cells.)」と題されている。私たちの細胞の奥深くにある60億のA、C、G、T文字のDNAコードの情報は、私たちの体がどのように構築され、どのように機能するかについて正確な指示を提供する。James WatsonとFrancis CrickがDNAの構造を明らかにした1953年以来、DNAの象徴的な形状は“二重らせん”とイメージされている。 しかし、DNAの短い配列が、他の形でも存在することが実験室ではっきりと分かっている。そして、科学者は、DNAコードがいつどのように“読み込まれる”かに、二本鎖DNA二重らせんとは全く異なるこれらの形が重要な役割を果たすかもしれないと考えている。
「我々の大部分がDNAを二重らせんと捉えている」と研究を共同主導したDaniel Christ教授(ガルバン 抗体治療 ラボ長)は語る。「この新しい研究は、全く異なるDNA構造が存在することを思い起こさせるものであり、我々の細胞にとって重要である可能性が高い。iモチーフは、DNAの4本鎖の“結び目”である」と、Christ助教授と共に研究を主導した Marcel Dinger助教授(ガルバン Kinghorn Centre臨床ゲノミックス長)は言う。「結び目
それはDNAだが、私たちの知っているそれではない。オーストラリアの研究者は世界で初めて細胞内に“iモチーフ”と呼ばれる新しいDNA構造を同定した。DNAのねじれた“結び目”、iモチーフはこれまで生きている細胞の中で直接見られたことはなかった。ガルバン医学研究所の新しい発見は、Nature Chemistryの2018年4月23日にオンラインで公開された。
この論文は、「I-モチーフDNA構造はヒト細胞の核に形成される(I-Motif DNA Structures Are Formed in the Nuclei of Human Cells.)」と題されている。私たちの細胞の奥深くにある60億のA、C、G、T文字のDNAコードの情報は、私たちの体がどのように構築され、どのように機能するかについて正確な指示を提供する。James WatsonとFrancis CrickがDNAの構造を明らかにした1953年以来、DNAの象徴的な形状は“二重らせん”とイメージされている。 しかし、DNAの短い配列が、他の形でも存在することが実験室ではっきりと分かっている。そして、科学者は、DNAコードがいつどのように“読み込まれる”かに、二本鎖DNA二重らせんとは全く異なるこれらの形が重要な役割を果たすかもしれないと考えている。
「我々の大部分がDNAを二重らせんと捉えている」と研究を共同主導したDaniel Christ教授(ガルバン 抗体治療 ラボ長)は語る。「この新しい研究は、全く異なるDNA構造が存在することを思い起こさせるものであり、我々の細胞にとって重要である可能性が高い。iモチーフは、DNAの4本鎖の“結び目”である」と、Christ助教授と共に研究を主導した Marcel Dinger助教授(ガルバン Kinghorn Centre臨床ゲノミックス長)は言う。「結び目
ペンシルバニア大学が新視点で進める癌免疫療法
 免疫革命と呼ばれる中、ペンシルベニア大学のアブラムソンがんセンター(UPenn)のディレクターであるRobert H. Vonderheide MD,PhD(写真)が、癌免疫療法の分野で革新的な進歩を続けている。Vonderheide博士は画期的な免疫療法の成功について、多くの患者が初期の成功の後に反応しなくなるか、または再発するかのいずれかであるため、甘くないと説明している。
現在の癌免疫療法の主な戦略は、免疫系のオフスイッチを阻止することである。例えば、免疫細胞上のPD-1分子が腫瘍細胞上のPD-L1に結合すると、免疫系は不活性化し、 免疫系から隠れる。 PD-1(pembrolizumab、商品名Keytruda)に対する抗体は、PD-1 / PD-L1結合によって引き起こされる失活をブロックすることができ、PD-L1の過剰発現を伴う転移性非小細胞肺癌の第一選択治療薬として承認されている 。約30%の患者はこの治療に反応せず、他の25%は1年後にさらなる腫瘍の進行を示す。 現在の免疫療法を改善するためCD40に対するモノクローナル抗体による新しい種類の免疫療法薬が開発された。 CD40は、免疫系の抗原提示細胞によって発現され、抗腫瘍応答を誘発する役割を果たす。
CD40がTヘルパー細胞上の他の表面マーカーによって結合されると、抗原提示細胞(B細胞または樹状細胞など)が活性化され、最終的に腫瘍細胞を標的化および殺すために多数の機能を果たす。 この分子を抗体で刺激することにより、抗腫瘍応答が強化される。 Vonderheide博士は次のように述べている。「癌を攻撃するために他の治療法を用いて免疫系を急発進させる前に、最初に戻りT細胞をプライミングする必要がある。」免疫応答は多段階の組立ラインであり、pembrolizumabなどのチェックポイントインヒビターは腫
免疫革命と呼ばれる中、ペンシルベニア大学のアブラムソンがんセンター(UPenn)のディレクターであるRobert H. Vonderheide MD,PhD(写真)が、癌免疫療法の分野で革新的な進歩を続けている。Vonderheide博士は画期的な免疫療法の成功について、多くの患者が初期の成功の後に反応しなくなるか、または再発するかのいずれかであるため、甘くないと説明している。
現在の癌免疫療法の主な戦略は、免疫系のオフスイッチを阻止することである。例えば、免疫細胞上のPD-1分子が腫瘍細胞上のPD-L1に結合すると、免疫系は不活性化し、 免疫系から隠れる。 PD-1(pembrolizumab、商品名Keytruda)に対する抗体は、PD-1 / PD-L1結合によって引き起こされる失活をブロックすることができ、PD-L1の過剰発現を伴う転移性非小細胞肺癌の第一選択治療薬として承認されている 。約30%の患者はこの治療に反応せず、他の25%は1年後にさらなる腫瘍の進行を示す。 現在の免疫療法を改善するためCD40に対するモノクローナル抗体による新しい種類の免疫療法薬が開発された。 CD40は、免疫系の抗原提示細胞によって発現され、抗腫瘍応答を誘発する役割を果たす。
CD40がTヘルパー細胞上の他の表面マーカーによって結合されると、抗原提示細胞(B細胞または樹状細胞など)が活性化され、最終的に腫瘍細胞を標的化および殺すために多数の機能を果たす。 この分子を抗体で刺激することにより、抗腫瘍応答が強化される。 Vonderheide博士は次のように述べている。「癌を攻撃するために他の治療法を用いて免疫系を急発進させる前に、最初に戻りT細胞をプライミングする必要がある。」免疫応答は多段階の組立ラインであり、pembrolizumabなどのチェックポイントインヒビターは腫
ヒト胚のゲノム発現を活性化する重要な転写因子(Oct-4)を発見
 科学誌Cellの2018年3月22日号に掲載された論文によると、非常に初期の段階のヒト胚でヒト発生の謎を解明するのに一歩近づく、ヒト胚の遺伝子発現を活性化させる重要なファクターを中国の科学者が明らかにした。この論文は、「ヒト初期胚のクロマチン・アクセシビリティの状況と進化との関連(Chromatin Accessibility Landscape in Human Early Embryos and Its Association with Evolution.)」と題されている。
ヒトの生命は受精卵から始まる。 しかし、受精後の最初の2日間は、ヒト胚で遺伝子発現はほとんどなかった。 これまでゲノムがどのように活性化し、初期胚で遺伝子発現を開始するのか、科学者は知らなかった。「遺伝子発現を活性化するものは何か?このパズルは世界中の科学者を悩ませています。私たちはこれを最初に見つけました」と、この論文の上級著者であるLiu Jiang博士は述べている。 ヒトが成長する間、適切な時と場所で異なる遺伝子が発現されなければならない。DNAに保存されている遺伝コードは、遺伝子発現によって「解釈」され、これにより個体の特徴が生じる。中国科学アカデミー(CAS)の北京研究所のLiu博士主導のチーム、Shandong大学・繁殖医学センターのChen Zijiang博士、Guangzhou医科大学のLiu Jianqiao博士のグループは、転写因子であるOct-4が接合体のゲノム発現を活性化するのに重要な役割を果たすことを見出した。
最初の2日間で、ヒト接合子が3度の細胞分裂の後、8つの細胞に成長する。 胚に8個の細胞があると、十分な量のOct-4が生成され、これがDNAと直接結合して遺伝子発現を切り替えるのだろう、とLiu博士は述べた。この研究では、ゲノム活性化が特定の配列に従うことも
科学誌Cellの2018年3月22日号に掲載された論文によると、非常に初期の段階のヒト胚でヒト発生の謎を解明するのに一歩近づく、ヒト胚の遺伝子発現を活性化させる重要なファクターを中国の科学者が明らかにした。この論文は、「ヒト初期胚のクロマチン・アクセシビリティの状況と進化との関連(Chromatin Accessibility Landscape in Human Early Embryos and Its Association with Evolution.)」と題されている。
ヒトの生命は受精卵から始まる。 しかし、受精後の最初の2日間は、ヒト胚で遺伝子発現はほとんどなかった。 これまでゲノムがどのように活性化し、初期胚で遺伝子発現を開始するのか、科学者は知らなかった。「遺伝子発現を活性化するものは何か?このパズルは世界中の科学者を悩ませています。私たちはこれを最初に見つけました」と、この論文の上級著者であるLiu Jiang博士は述べている。 ヒトが成長する間、適切な時と場所で異なる遺伝子が発現されなければならない。DNAに保存されている遺伝コードは、遺伝子発現によって「解釈」され、これにより個体の特徴が生じる。中国科学アカデミー(CAS)の北京研究所のLiu博士主導のチーム、Shandong大学・繁殖医学センターのChen Zijiang博士、Guangzhou医科大学のLiu Jianqiao博士のグループは、転写因子であるOct-4が接合体のゲノム発現を活性化するのに重要な役割を果たすことを見出した。
最初の2日間で、ヒト接合子が3度の細胞分裂の後、8つの細胞に成長する。 胚に8個の細胞があると、十分な量のOct-4が生成され、これがDNAと直接結合して遺伝子発現を切り替えるのだろう、とLiu博士は述べた。この研究では、ゲノム活性化が特定の配列に従うことも
6か月以上母乳育児すると母体の2型糖尿病リスクを50%近く引き下げることが明らかに
 2018年1月16日付JAMA Internal Medicineオンライン版に掲載された新Kaiser Permanente研究は、長期的な全国研究で6か月以上母乳育児すると、妊娠可能期間を通じて母体の2型糖尿病発病リスクが半分近くまで低下することを突き止めたと述べている。このオープン・アクセス論文は、「Lactation Duration and Progression to Diabetes in Women Across the Childbearing Years: The 30-Year CARDIA Study (授乳期間と妊娠可能期間を通じての糖尿病発症の関係:30年間のCARDIA研究)」と題されている。
論文の筆頭著者であり、Kaiser Permanente Division of ResearchのSenior Research Scientistを務めるErica P. Gunderson, PhD, MS, MPHは、「母乳育児期間と糖尿病発症リスク低下の間には、考えられる他のリスク・ファクターをすべて計算に入れても強い関連性が認められた」と述べている。出産の度に6か月以上母乳育児していた女性は、母乳育児をまったくしなかった女性に比べると、2型糖尿病を発症するリスクが47%も低下していた。また、母乳育児の期間が6か月以下の女性の場合、糖尿病リスク低下率は25%だった。
Dr. Gundersonの研究チームは、Coronary Artery Risk Development in Young Adults (CARDIA) 研究の30年間のフォローアップデータを分析した。このCARDIA研究は全国のいくつものセンターの循環器系疾患リスク・ファクターを調査するもので、最初は1985年から1986年にかけて、18歳から30歳までの成人約5,00
2018年1月16日付JAMA Internal Medicineオンライン版に掲載された新Kaiser Permanente研究は、長期的な全国研究で6か月以上母乳育児すると、妊娠可能期間を通じて母体の2型糖尿病発病リスクが半分近くまで低下することを突き止めたと述べている。このオープン・アクセス論文は、「Lactation Duration and Progression to Diabetes in Women Across the Childbearing Years: The 30-Year CARDIA Study (授乳期間と妊娠可能期間を通じての糖尿病発症の関係:30年間のCARDIA研究)」と題されている。
論文の筆頭著者であり、Kaiser Permanente Division of ResearchのSenior Research Scientistを務めるErica P. Gunderson, PhD, MS, MPHは、「母乳育児期間と糖尿病発症リスク低下の間には、考えられる他のリスク・ファクターをすべて計算に入れても強い関連性が認められた」と述べている。出産の度に6か月以上母乳育児していた女性は、母乳育児をまったくしなかった女性に比べると、2型糖尿病を発症するリスクが47%も低下していた。また、母乳育児の期間が6か月以下の女性の場合、糖尿病リスク低下率は25%だった。
Dr. Gundersonの研究チームは、Coronary Artery Risk Development in Young Adults (CARDIA) 研究の30年間のフォローアップデータを分析した。このCARDIA研究は全国のいくつものセンターの循環器系疾患リスク・ファクターを調査するもので、最初は1985年から1986年にかけて、18歳から30歳までの成人約5,00
妊娠中に極度のつわりを起こす可能性が高い2つの遺伝子を同定
 ほとんどの女性は妊娠中につわりを経験するが、妊娠中の女性の約2%が、ときには症状が深刻で入院が必要な程の、より重度の悪心および嘔吐の症状を経験する。妊娠中の重度妊婦とも呼ばれるこの状態は、ケイト・ミドルトン/ケンブリッジ公爵夫人が妊娠中に耐えたものと同じである。 UCLAの研究者によって主導され、2018年3月23日にNature Communicationsのオンライン版に公開されたこの新しい研究では、前回の研究では原因が特定されていない、催吐性重篤度に関連する2つの遺伝子が同定された。
GDF15およびIGFBP7として知られているこの遺伝子は、胎盤の発達に関与しており、早期妊娠および食欲調節において重要な役割を果たす。このオープンアクセスの論文は「胎盤と食欲遺伝子GDF15とIGFBP7は、妊娠悪阻に関連している。(Placenta and Appetite Genes GDF15 And IGFBP7 Are Associated with Hyperemesis Gravidarum.)」と題されている。
「長い間、妊娠ホルモン、ヒト絨毛性性腺刺激ホルモンまたはエストロゲンが極度の吐き気と嘔吐の犯人であると推定されていた。しかし私たちの研究はこれを裏付ける証拠を見いだせなかった。」と論文の筆頭著者、Marlena Fejzo博士は語った。彼女はUCLAのDavid Geffen School of MedicineのAssociate Researcherである。彼女は、偶然にも、癌患者の約20%が死に至る悪液質(体重減少と筋肉疲労状態)に関与しており、 Fejzo博士自身は妊娠悪阻のため1999年に流産を経験した。衰弱症状には、持続性の吐き気および/または嘔吐による急速な体重減少、栄養失調および脱水が含まれる。病状を治療する現在の薬物療法はほとんど効果がなく
ほとんどの女性は妊娠中につわりを経験するが、妊娠中の女性の約2%が、ときには症状が深刻で入院が必要な程の、より重度の悪心および嘔吐の症状を経験する。妊娠中の重度妊婦とも呼ばれるこの状態は、ケイト・ミドルトン/ケンブリッジ公爵夫人が妊娠中に耐えたものと同じである。 UCLAの研究者によって主導され、2018年3月23日にNature Communicationsのオンライン版に公開されたこの新しい研究では、前回の研究では原因が特定されていない、催吐性重篤度に関連する2つの遺伝子が同定された。
GDF15およびIGFBP7として知られているこの遺伝子は、胎盤の発達に関与しており、早期妊娠および食欲調節において重要な役割を果たす。このオープンアクセスの論文は「胎盤と食欲遺伝子GDF15とIGFBP7は、妊娠悪阻に関連している。(Placenta and Appetite Genes GDF15 And IGFBP7 Are Associated with Hyperemesis Gravidarum.)」と題されている。
「長い間、妊娠ホルモン、ヒト絨毛性性腺刺激ホルモンまたはエストロゲンが極度の吐き気と嘔吐の犯人であると推定されていた。しかし私たちの研究はこれを裏付ける証拠を見いだせなかった。」と論文の筆頭著者、Marlena Fejzo博士は語った。彼女はUCLAのDavid Geffen School of MedicineのAssociate Researcherである。彼女は、偶然にも、癌患者の約20%が死に至る悪液質(体重減少と筋肉疲労状態)に関与しており、 Fejzo博士自身は妊娠悪阻のため1999年に流産を経験した。衰弱症状には、持続性の吐き気および/または嘔吐による急速な体重減少、栄養失調および脱水が含まれる。病状を治療する現在の薬物療法はほとんど効果がなく
ハダカデバネズミの長寿と超がん化耐性の謎が老化の整序化で解明できるかもしれない
 大きな出っ歯、シワだらけで毛が無い身体。こんなハダカデバネズミは「かわいい齧歯類」コンテストでとても勝てそうにない。しかし、ハダカデバネズミの寿命は齧歯類としては最長の30年という長寿であり、加齢性の疾患に驚くほどの耐性があるため、加齢とがんという謎を解くカギを与えてくれている。それこそが、University of Rochester のVera Gorbunova, PhD、Andrei Seluanov, PhDら生物学教授とポスドク研究員のYang Zhao, PhDのハダカデバネズミ研究の動機であり、2018年2月5日付PNASオンライン版に掲載された研究論文の筆頭著者、Dr. Zhaoは、「この齧歯類で、細胞老化と呼ばれる抗がんメカニズムが見られるだろうか? 見られるとすれば、そのメカニズムはマウスのような寿命の短い動物とどのように異なるのだろうか、ということを調べた」と述べている。
この論文は、「Naked Mole Rats Can Undergo Developmental, Oncogene-Induced and DNA Damage-Induced Cellular Senescence (発生学的な細胞老化、がん遺伝子やDNA損傷により誘導される細胞老化に耐えられるハダカデバネズミ)」と題されている。細胞老化とは、損傷を受けた細胞が無制限に分裂を続け、完全ながんにまで成長するのを防ぐ進化的適応の一つである。しかし、老化には望ましくない面もある。がんに成長するのを防ぐために細胞分裂を停止するというのは加齢を促進することでもある。過去の研究で、マウスの身体から細胞老化を受けた細胞を取り除くと、そのマウスは、老化細胞をそのままにして自然に老化したマウスと比べて、老化してもそれほど身体が弱らないということが突き止められている。そこで、研究者らは、細
大きな出っ歯、シワだらけで毛が無い身体。こんなハダカデバネズミは「かわいい齧歯類」コンテストでとても勝てそうにない。しかし、ハダカデバネズミの寿命は齧歯類としては最長の30年という長寿であり、加齢性の疾患に驚くほどの耐性があるため、加齢とがんという謎を解くカギを与えてくれている。それこそが、University of Rochester のVera Gorbunova, PhD、Andrei Seluanov, PhDら生物学教授とポスドク研究員のYang Zhao, PhDのハダカデバネズミ研究の動機であり、2018年2月5日付PNASオンライン版に掲載された研究論文の筆頭著者、Dr. Zhaoは、「この齧歯類で、細胞老化と呼ばれる抗がんメカニズムが見られるだろうか? 見られるとすれば、そのメカニズムはマウスのような寿命の短い動物とどのように異なるのだろうか、ということを調べた」と述べている。
この論文は、「Naked Mole Rats Can Undergo Developmental, Oncogene-Induced and DNA Damage-Induced Cellular Senescence (発生学的な細胞老化、がん遺伝子やDNA損傷により誘導される細胞老化に耐えられるハダカデバネズミ)」と題されている。細胞老化とは、損傷を受けた細胞が無制限に分裂を続け、完全ながんにまで成長するのを防ぐ進化的適応の一つである。しかし、老化には望ましくない面もある。がんに成長するのを防ぐために細胞分裂を停止するというのは加齢を促進することでもある。過去の研究で、マウスの身体から細胞老化を受けた細胞を取り除くと、そのマウスは、老化細胞をそのままにして自然に老化したマウスと比べて、老化してもそれほど身体が弱らないということが突き止められている。そこで、研究者らは、細
Life Science News from Around the Globe
Edited by Michael D. O'Neill

バイオクイックニュースは、サイエンスライターとして30年以上の豊富な経験があるマイケルD. オニールによって発行されている独立系科学ニュースメディアです。世界中のバイオニュース(生命科学・医学研究の動向)をタイムリーにお届けします。バイオクイックニュースは、現在160カ国以上に読者がおり、2010年から6年連続で米国APEX Award for Publication Excellenceを受賞しました。
BioQuick is a trademark of Michael D. O'Neill