妊娠中に極度のつわりを起こす可能性が高い2つの遺伝子を同定
 ほとんどの女性は妊娠中につわりを経験するが、妊娠中の女性の約2%が、ときには症状が深刻で入院が必要な程の、より重度の悪心および嘔吐の症状を経験する。妊娠中の重度妊婦とも呼ばれるこの状態は、ケイト・ミドルトン/ケンブリッジ公爵夫人が妊娠中に耐えたものと同じである。 UCLAの研究者によって主導され、2018年3月23日にNature Communicationsのオンライン版に公開されたこの新しい研究では、前回の研究では原因が特定されていない、催吐性重篤度に関連する2つの遺伝子が同定された。
GDF15およびIGFBP7として知られているこの遺伝子は、胎盤の発達に関与しており、早期妊娠および食欲調節において重要な役割を果たす。このオープンアクセスの論文は「胎盤と食欲遺伝子GDF15とIGFBP7は、妊娠悪阻に関連している。(Placenta and Appetite Genes GDF15 And IGFBP7 Are Associated with Hyperemesis Gravidarum.)」と題されている。
「長い間、妊娠ホルモン、ヒト絨毛性性腺刺激ホルモンまたはエストロゲンが極度の吐き気と嘔吐の犯人であると推定されていた。しかし私たちの研究はこれを裏付ける証拠を見いだせなかった。」と論文の筆頭著者、Marlena Fejzo博士は語った。彼女はUCLAのDavid Geffen School of MedicineのAssociate Researcherである。彼女は、偶然にも、癌患者の約20%が死に至る悪液質(体重減少と筋肉疲労状態)に関与しており、 Fejzo博士自身は妊娠悪阻のため1999年に流産を経験した。衰弱症状には、持続性の吐き気および/または嘔吐による急速な体重減少、栄養失調および脱水が含まれる。病状を治療する現在の薬物療法はほとんど効果がなく
ほとんどの女性は妊娠中につわりを経験するが、妊娠中の女性の約2%が、ときには症状が深刻で入院が必要な程の、より重度の悪心および嘔吐の症状を経験する。妊娠中の重度妊婦とも呼ばれるこの状態は、ケイト・ミドルトン/ケンブリッジ公爵夫人が妊娠中に耐えたものと同じである。 UCLAの研究者によって主導され、2018年3月23日にNature Communicationsのオンライン版に公開されたこの新しい研究では、前回の研究では原因が特定されていない、催吐性重篤度に関連する2つの遺伝子が同定された。
GDF15およびIGFBP7として知られているこの遺伝子は、胎盤の発達に関与しており、早期妊娠および食欲調節において重要な役割を果たす。このオープンアクセスの論文は「胎盤と食欲遺伝子GDF15とIGFBP7は、妊娠悪阻に関連している。(Placenta and Appetite Genes GDF15 And IGFBP7 Are Associated with Hyperemesis Gravidarum.)」と題されている。
「長い間、妊娠ホルモン、ヒト絨毛性性腺刺激ホルモンまたはエストロゲンが極度の吐き気と嘔吐の犯人であると推定されていた。しかし私たちの研究はこれを裏付ける証拠を見いだせなかった。」と論文の筆頭著者、Marlena Fejzo博士は語った。彼女はUCLAのDavid Geffen School of MedicineのAssociate Researcherである。彼女は、偶然にも、癌患者の約20%が死に至る悪液質(体重減少と筋肉疲労状態)に関与しており、 Fejzo博士自身は妊娠悪阻のため1999年に流産を経験した。衰弱症状には、持続性の吐き気および/または嘔吐による急速な体重減少、栄養失調および脱水が含まれる。病状を治療する現在の薬物療法はほとんど効果がなく
ハダカデバネズミの長寿と超がん化耐性の謎が老化の整序化で解明できるかもしれない
 大きな出っ歯、シワだらけで毛が無い身体。こんなハダカデバネズミは「かわいい齧歯類」コンテストでとても勝てそうにない。しかし、ハダカデバネズミの寿命は齧歯類としては最長の30年という長寿であり、加齢性の疾患に驚くほどの耐性があるため、加齢とがんという謎を解くカギを与えてくれている。それこそが、University of Rochester のVera Gorbunova, PhD、Andrei Seluanov, PhDら生物学教授とポスドク研究員のYang Zhao, PhDのハダカデバネズミ研究の動機であり、2018年2月5日付PNASオンライン版に掲載された研究論文の筆頭著者、Dr. Zhaoは、「この齧歯類で、細胞老化と呼ばれる抗がんメカニズムが見られるだろうか? 見られるとすれば、そのメカニズムはマウスのような寿命の短い動物とどのように異なるのだろうか、ということを調べた」と述べている。
この論文は、「Naked Mole Rats Can Undergo Developmental, Oncogene-Induced and DNA Damage-Induced Cellular Senescence (発生学的な細胞老化、がん遺伝子やDNA損傷により誘導される細胞老化に耐えられるハダカデバネズミ)」と題されている。細胞老化とは、損傷を受けた細胞が無制限に分裂を続け、完全ながんにまで成長するのを防ぐ進化的適応の一つである。しかし、老化には望ましくない面もある。がんに成長するのを防ぐために細胞分裂を停止するというのは加齢を促進することでもある。過去の研究で、マウスの身体から細胞老化を受けた細胞を取り除くと、そのマウスは、老化細胞をそのままにして自然に老化したマウスと比べて、老化してもそれほど身体が弱らないということが突き止められている。そこで、研究者らは、細
大きな出っ歯、シワだらけで毛が無い身体。こんなハダカデバネズミは「かわいい齧歯類」コンテストでとても勝てそうにない。しかし、ハダカデバネズミの寿命は齧歯類としては最長の30年という長寿であり、加齢性の疾患に驚くほどの耐性があるため、加齢とがんという謎を解くカギを与えてくれている。それこそが、University of Rochester のVera Gorbunova, PhD、Andrei Seluanov, PhDら生物学教授とポスドク研究員のYang Zhao, PhDのハダカデバネズミ研究の動機であり、2018年2月5日付PNASオンライン版に掲載された研究論文の筆頭著者、Dr. Zhaoは、「この齧歯類で、細胞老化と呼ばれる抗がんメカニズムが見られるだろうか? 見られるとすれば、そのメカニズムはマウスのような寿命の短い動物とどのように異なるのだろうか、ということを調べた」と述べている。
この論文は、「Naked Mole Rats Can Undergo Developmental, Oncogene-Induced and DNA Damage-Induced Cellular Senescence (発生学的な細胞老化、がん遺伝子やDNA損傷により誘導される細胞老化に耐えられるハダカデバネズミ)」と題されている。細胞老化とは、損傷を受けた細胞が無制限に分裂を続け、完全ながんにまで成長するのを防ぐ進化的適応の一つである。しかし、老化には望ましくない面もある。がんに成長するのを防ぐために細胞分裂を停止するというのは加齢を促進することでもある。過去の研究で、マウスの身体から細胞老化を受けた細胞を取り除くと、そのマウスは、老化細胞をそのままにして自然に老化したマウスと比べて、老化してもそれほど身体が弱らないということが突き止められている。そこで、研究者らは、細
トカゲの急速進化の証拠をゲノム・シーケンシングで発見
 トカゲには特別な超能力がある。鳥類は羽根を再生できるし、ほ乳類は皮膚を再生できる。しかし、トカゲはしっぽのような構造全体を再生できるのだ。このような違いはあっても、動物はすべてトカゲのような共通の祖先から進化してきたものだ。アメリカ全体に広がっているトカゲのグループ、アノールは、ダーウィン・フィンチのように、様々な島や、大陸本土の様々な棲息地の条件に適応している。現在では、その種は400を超える。
Arizona State University (ASU) の研究者は、パナマのSmithsonian Tropical Research Institute (STRI) を通じてパナマで採集した3種のトカゲと、アメリカ南東部で採集した1種のトカゲの系統樹を再構成し、トカゲのゲノムのDNAコード全体を他の動物と比較した。その結果、松果体その他の内分泌腺のある間脳で、色覚、ホルモン、オスがメスを誘うために上下に揺らす喉袋などに関わる遺伝子の変化が起きており、それが種の境界を形成している可能性があることを突き止めた。四肢の発達を調節する遺伝子も特に急速に進化している。責任著者でASU School of Life Sciencesの教授を務めるDr. Kenro Kusumiは、「リクガメのような爬虫類は何百万年もの間、ほとんど変わっていないが、アノール・トカゲは急速に進化しており、様々な形や行動の違いを生み出している。今はゲノム全体をシーケンシングすることも低コストかつ容易になっており、今回の研究で急激な進化の分子遺伝学的証拠がつかめており、この進化こそが動物の棲む環境が異なればその身体にも著しい違いが生まれる理由かも知れない」と述べている。この研究は2018年2月1日付Genome Biology and Evolutionのオープンアクセス論文として掲載されており、「Co
トカゲには特別な超能力がある。鳥類は羽根を再生できるし、ほ乳類は皮膚を再生できる。しかし、トカゲはしっぽのような構造全体を再生できるのだ。このような違いはあっても、動物はすべてトカゲのような共通の祖先から進化してきたものだ。アメリカ全体に広がっているトカゲのグループ、アノールは、ダーウィン・フィンチのように、様々な島や、大陸本土の様々な棲息地の条件に適応している。現在では、その種は400を超える。
Arizona State University (ASU) の研究者は、パナマのSmithsonian Tropical Research Institute (STRI) を通じてパナマで採集した3種のトカゲと、アメリカ南東部で採集した1種のトカゲの系統樹を再構成し、トカゲのゲノムのDNAコード全体を他の動物と比較した。その結果、松果体その他の内分泌腺のある間脳で、色覚、ホルモン、オスがメスを誘うために上下に揺らす喉袋などに関わる遺伝子の変化が起きており、それが種の境界を形成している可能性があることを突き止めた。四肢の発達を調節する遺伝子も特に急速に進化している。責任著者でASU School of Life Sciencesの教授を務めるDr. Kenro Kusumiは、「リクガメのような爬虫類は何百万年もの間、ほとんど変わっていないが、アノール・トカゲは急速に進化しており、様々な形や行動の違いを生み出している。今はゲノム全体をシーケンシングすることも低コストかつ容易になっており、今回の研究で急激な進化の分子遺伝学的証拠がつかめており、この進化こそが動物の棲む環境が異なればその身体にも著しい違いが生まれる理由かも知れない」と述べている。この研究は2018年2月1日付Genome Biology and Evolutionのオープンアクセス論文として掲載されており、「Co
マイクロバイオームの個人差にヒト宿主の遺伝子は関与していないことが判明
 遺伝環境論争は、ヒトが腸内に持っている通常有益な細菌群、マイクロバイオーム(微生物叢)の構成にまで広がっている。研究に次ぐ研究でマイクロバイオームが私達の健康のほぼ全ての面に関わっていることが突き止められており、また、人それぞれに異なっているマイクロバイオームの構成が体重増加やその人の気分にまで関わっている可能性も示されている。
一部のマイクロバイオーム研究者は、このような個人差は遺伝子の違いから始まっているのではないかとしているが、イスラエルのWeizmann Institute of Scienceで行われた大規模な研究はこの遺伝子説に反証しており、さらにマイクロバイオームと健康の間には私達が考えている以上に重要な関係を示す証拠を提出している。事実、その研究でも作業仮説としてマイクロバイオームの個人差に遺伝子が大きく関わっているのではないかと予想していた。その仮説に従えば、遺伝子がマイクロバイオームの棲息する環境を決定し、さらに個々の環境がそこで繁殖する細菌種を決定するはずだった。ところが、実際には宿主の遺伝はマイクロバイオームの構成にごくわずかしか関わっておらず、大人口で考えた場合、わずか2%程度の違いにしかならないことを突き止め、Weizmannの研究チームにとってはむしろ意外だった。
この研究は、Weizmann Institute of Science, Computer Science and Applied Mathematics Department, Professor Eran Segal研究室のDaphna Rothschild研究生、Dr. Omer Weissbrod、Dr. Elad Barkanらと、同じWeizmann Institute of Science, Immunology DepartmentのProfessor Eran
遺伝環境論争は、ヒトが腸内に持っている通常有益な細菌群、マイクロバイオーム(微生物叢)の構成にまで広がっている。研究に次ぐ研究でマイクロバイオームが私達の健康のほぼ全ての面に関わっていることが突き止められており、また、人それぞれに異なっているマイクロバイオームの構成が体重増加やその人の気分にまで関わっている可能性も示されている。
一部のマイクロバイオーム研究者は、このような個人差は遺伝子の違いから始まっているのではないかとしているが、イスラエルのWeizmann Institute of Scienceで行われた大規模な研究はこの遺伝子説に反証しており、さらにマイクロバイオームと健康の間には私達が考えている以上に重要な関係を示す証拠を提出している。事実、その研究でも作業仮説としてマイクロバイオームの個人差に遺伝子が大きく関わっているのではないかと予想していた。その仮説に従えば、遺伝子がマイクロバイオームの棲息する環境を決定し、さらに個々の環境がそこで繁殖する細菌種を決定するはずだった。ところが、実際には宿主の遺伝はマイクロバイオームの構成にごくわずかしか関わっておらず、大人口で考えた場合、わずか2%程度の違いにしかならないことを突き止め、Weizmannの研究チームにとってはむしろ意外だった。
この研究は、Weizmann Institute of Science, Computer Science and Applied Mathematics Department, Professor Eran Segal研究室のDaphna Rothschild研究生、Dr. Omer Weissbrod、Dr. Elad Barkanらと、同じWeizmann Institute of Science, Immunology DepartmentのProfessor Eran
肺再生をもたらす幹細胞が発見される
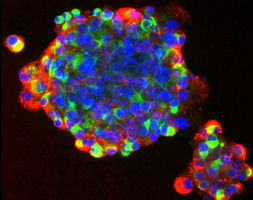 肺再生研究を飛躍的に進める画期的な結果が、このたび、シンガポール科学技術研究庁(Agency for Science, Technology and Research (A*STAR))遺伝子研究所(GIS)と分子生物学研究所(IMB)との共同研究で得られた。彼らの研究は、肺に存在する特殊な幹細胞である末梢気道胚細胞(DASCs)が、損傷を受けた胚組織を新しい肺胞に取り換える機能を有する事を実証し、肺の再生研究に大きな基礎を築いた。この研究は2011年10月28日付けのセル誌に掲載された。肺は、インフルエンザや慢性閉塞成敗疾患(COPD)などの慢性呼吸器疾患を含む様々な肺疾患により損傷を受ける。
急性呼吸窮迫症候群(ARDS)を誘発するインフルエンザの感染は、米国では年間15万人以上に達し、患者の死亡率は最大50%にも上る。そして、COPDは世界で5番目に死亡率の高い疾患だ。肺再生の問題に取り組むにあたって、研究チームは斬新なアプローチをとった。肺の3つの部分から採取した成人の幹細胞をクローンしたのだ。
この3つの部分は、鼻上皮幹細胞(NESCs)、気管気道幹細胞(TASCs)、および遠位気道幹細胞(DASCs)である。遺伝的に99%同一である3つの細胞ではあるが、インビボでクローンされたときにのみDASCsが肺胞を形成するのが観測された。「我々は、生体幹細胞は本来的に機能が決められているために、由来している特定の細胞にしか分化しないということを初めて示しました。今回の場合、肺胞細胞は、鼻粘膜上皮や気道気管ではなく遠位気道に位置しているため、DASCsだけが肺胞を形成しました。このような理解は大きな進歩であり、再生医療における成体幹細胞の可能性の研究を促すでしょう。 」と、IMBの主任研究員ワ・シアン博士は説明する。研究ではインフルエンザのマウスモデルが使用された
肺再生研究を飛躍的に進める画期的な結果が、このたび、シンガポール科学技術研究庁(Agency for Science, Technology and Research (A*STAR))遺伝子研究所(GIS)と分子生物学研究所(IMB)との共同研究で得られた。彼らの研究は、肺に存在する特殊な幹細胞である末梢気道胚細胞(DASCs)が、損傷を受けた胚組織を新しい肺胞に取り換える機能を有する事を実証し、肺の再生研究に大きな基礎を築いた。この研究は2011年10月28日付けのセル誌に掲載された。肺は、インフルエンザや慢性閉塞成敗疾患(COPD)などの慢性呼吸器疾患を含む様々な肺疾患により損傷を受ける。
急性呼吸窮迫症候群(ARDS)を誘発するインフルエンザの感染は、米国では年間15万人以上に達し、患者の死亡率は最大50%にも上る。そして、COPDは世界で5番目に死亡率の高い疾患だ。肺再生の問題に取り組むにあたって、研究チームは斬新なアプローチをとった。肺の3つの部分から採取した成人の幹細胞をクローンしたのだ。
この3つの部分は、鼻上皮幹細胞(NESCs)、気管気道幹細胞(TASCs)、および遠位気道幹細胞(DASCs)である。遺伝的に99%同一である3つの細胞ではあるが、インビボでクローンされたときにのみDASCsが肺胞を形成するのが観測された。「我々は、生体幹細胞は本来的に機能が決められているために、由来している特定の細胞にしか分化しないということを初めて示しました。今回の場合、肺胞細胞は、鼻粘膜上皮や気道気管ではなく遠位気道に位置しているため、DASCsだけが肺胞を形成しました。このような理解は大きな進歩であり、再生医療における成体幹細胞の可能性の研究を促すでしょう。 」と、IMBの主任研究員ワ・シアン博士は説明する。研究ではインフルエンザのマウスモデルが使用された
無性生殖のアマゾン・モーリーのゲノム・シーケンシング完了
 報いられない愛に苦しまない種はない。しかし、アメリカのテキサス州在来種の個体全てがメスで無性生殖をすることで知られたカダヤシ属の淡水魚、アマゾン・モーリーは何千年も栄えてきた種である。最近、この魚のゲノムシーケンス解析が完了しており、その性の生物学的基礎情報から学ぶことは多いのではないかと研究者は期待している。
テキサス州・メキシコ国境線に沿った淡水の河川はこの進化異常の種の棲息地になっており、この魚は自然の法則に反して受精なしで胚の発育と発達が起き、母親とまったく同一のクローンの娘だけができる単為生殖という自然の形式によって繁栄してきた。Texas A&M University Hagler Institute for Advanced Study (HIAS) のFaculty Fellow、Dr. Manfred Schartlは、この魚の生殖がどのようにして通常の雌雄両性生殖から逸れたのか、またどのようにしてアマゾン・モーリーが種としてその過程を無事に通過したのかをより深く理解するため、世界で初めてアマゾン・モーリーと、この独特な魚をつくり出した元の親種のゲノムのシーケンス解析を完了した。National Institutes of Healthの研究資金を受けて行われたこの研究の結果は、2018年2月12日付Nature Ecology & Evolutionオンライン版に掲載された。このオープンアクセス論文は、「Clonal Polymorphism and High Heterozygosity in the Celibate Genome of the Amazon Molly (アマゾン・モーリーの独身型ゲノムにおけるクローン多形性と高異型接合性)」と題されている。
プラティ、ソードテールなどクシフォフォルス・モデル系魚類の細胞生物学、
報いられない愛に苦しまない種はない。しかし、アメリカのテキサス州在来種の個体全てがメスで無性生殖をすることで知られたカダヤシ属の淡水魚、アマゾン・モーリーは何千年も栄えてきた種である。最近、この魚のゲノムシーケンス解析が完了しており、その性の生物学的基礎情報から学ぶことは多いのではないかと研究者は期待している。
テキサス州・メキシコ国境線に沿った淡水の河川はこの進化異常の種の棲息地になっており、この魚は自然の法則に反して受精なしで胚の発育と発達が起き、母親とまったく同一のクローンの娘だけができる単為生殖という自然の形式によって繁栄してきた。Texas A&M University Hagler Institute for Advanced Study (HIAS) のFaculty Fellow、Dr. Manfred Schartlは、この魚の生殖がどのようにして通常の雌雄両性生殖から逸れたのか、またどのようにしてアマゾン・モーリーが種としてその過程を無事に通過したのかをより深く理解するため、世界で初めてアマゾン・モーリーと、この独特な魚をつくり出した元の親種のゲノムのシーケンス解析を完了した。National Institutes of Healthの研究資金を受けて行われたこの研究の結果は、2018年2月12日付Nature Ecology & Evolutionオンライン版に掲載された。このオープンアクセス論文は、「Clonal Polymorphism and High Heterozygosity in the Celibate Genome of the Amazon Molly (アマゾン・モーリーの独身型ゲノムにおけるクローン多形性と高異型接合性)」と題されている。
プラティ、ソードテールなどクシフォフォルス・モデル系魚類の細胞生物学、
ヤツメウナギの脊髄治癒を助ける遺伝子が人間にも存在。カギ握るWnt経路。
 マサチューセッツ州Woods HoleのMarine Biological Laboratory (MBL) 他の研究機関の共同グループの研究によると、ヤツメウナギの脊髄損傷自然治癒にかかわっている遺伝子の多くが哺乳動物の末梢神経系の修復でも大きく関わっている。このことから、長期的に見れば、人間の脊髄損傷治療法向上のために同じ遺伝子を利用できるようになる可能性がある。 2018年1月15日付Scientific Reportsオンライン版に掲載された研究の著者の一人であり、MBL, Eugene Bell Center for Regenerative Biology and Tissue EngineeringのDirectorを務めるJennifer Morgan, PhDは、「研究で、哺乳動物の末梢神経系の再生の原動力となる転写因子の中心部と大きくダブることが突き止められた」と述べている。
このオープンアクセス論文は、「Highly Conserved Molecular Pathways, Including Wnt Signaling, Promote Functional Recovery from Spinal Cord Injury in Lampreys (ヤツメウナギの脊髄損傷では、Wntシグナル伝達を含め、高度に保存された分子経路が機能回復を促進)」と題されている。 ヤツメウナギはアゴのないウナギのような魚で、人間とは約5億5,000万年前に共通の祖先を持っている。この研究は、ヤツメウナギが脊髄を切断されても、医薬その他の治療なしに完全に回復できるという観察に基づいて始められた。Dr. Morganは、「ヤツメウナギは10週間から12週間でマヒ状態から完全に泳げるようになる」と述べている。元MBL Whitman Center Fellowで、
マサチューセッツ州Woods HoleのMarine Biological Laboratory (MBL) 他の研究機関の共同グループの研究によると、ヤツメウナギの脊髄損傷自然治癒にかかわっている遺伝子の多くが哺乳動物の末梢神経系の修復でも大きく関わっている。このことから、長期的に見れば、人間の脊髄損傷治療法向上のために同じ遺伝子を利用できるようになる可能性がある。 2018年1月15日付Scientific Reportsオンライン版に掲載された研究の著者の一人であり、MBL, Eugene Bell Center for Regenerative Biology and Tissue EngineeringのDirectorを務めるJennifer Morgan, PhDは、「研究で、哺乳動物の末梢神経系の再生の原動力となる転写因子の中心部と大きくダブることが突き止められた」と述べている。
このオープンアクセス論文は、「Highly Conserved Molecular Pathways, Including Wnt Signaling, Promote Functional Recovery from Spinal Cord Injury in Lampreys (ヤツメウナギの脊髄損傷では、Wntシグナル伝達を含め、高度に保存された分子経路が機能回復を促進)」と題されている。 ヤツメウナギはアゴのないウナギのような魚で、人間とは約5億5,000万年前に共通の祖先を持っている。この研究は、ヤツメウナギが脊髄を切断されても、医薬その他の治療なしに完全に回復できるという観察に基づいて始められた。Dr. Morganは、「ヤツメウナギは10週間から12週間でマヒ状態から完全に泳げるようになる」と述べている。元MBL Whitman Center Fellowで、
インフルエンザウイルスの広範なペプチド阻害剤を開発
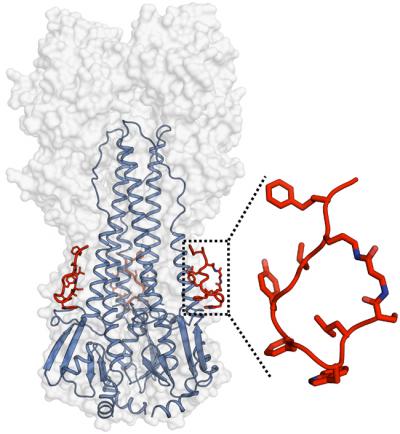 Scripps Research Institute (TSRI) とJanssen Research & Development (Janssen) の研究チームは、広いスペクトルのインフルエンザ・ウイルス株を中和する人工ペプチド分子を開発した。ペプチドはアミノ酸の短い鎖であり、タンパク質と似ているがもっと小さくて単純な構造である。この人工ペプチド分子はインフルエンザを標的とする医薬になる可能性を秘めている。
毎年、世界中で50万人がインフルエンザで亡くなっており、アメリカ経済にとって病気欠勤日と生産性の損失で年間何十億ドルもの負担になっている。新しく開発されたペプチドは、アジア地域で何百人もの人に感染し、死者さえ出した鳥インフルエンザ株のH5N1や、2009年から2010年にかけて世界的に蔓延した豚インフルエンザのH1N1などを含め、世界的にもっとも一般的なグループ1のインフルエンザA型ウイルスの伝染力をブロックするものである。同チームは、最近発見された、事実上すべてのインフルエンザA型株を中和できる「スーパー抗体」という酵素がウイルスを捕捉する結合部位を取り入れたペプチドを設計した。抗体は大きなタンパク質であり、つくるのにはコストもかかり、人体への注入も注射か輸液で行わなければならない。しかし、「研究で開発されたペプチドは、将来的には錠剤タイプの医薬として利用できる可能性がある」。TSRIのHansen Professor of Structural Biologyで、共同主任研究員を務めるDr. Ian Wilsonは、「私達の新しい研究成果が示すように、広いスペクトラムでウイルスを中和する大きな分子の抗体と基本的に同じことを小さな分子でやらせるというのは将来性のある楽しみな戦略だ」と述べている。この新しいペプチドに関する研究論文は、2017年9月27日付
Scripps Research Institute (TSRI) とJanssen Research & Development (Janssen) の研究チームは、広いスペクトルのインフルエンザ・ウイルス株を中和する人工ペプチド分子を開発した。ペプチドはアミノ酸の短い鎖であり、タンパク質と似ているがもっと小さくて単純な構造である。この人工ペプチド分子はインフルエンザを標的とする医薬になる可能性を秘めている。
毎年、世界中で50万人がインフルエンザで亡くなっており、アメリカ経済にとって病気欠勤日と生産性の損失で年間何十億ドルもの負担になっている。新しく開発されたペプチドは、アジア地域で何百人もの人に感染し、死者さえ出した鳥インフルエンザ株のH5N1や、2009年から2010年にかけて世界的に蔓延した豚インフルエンザのH1N1などを含め、世界的にもっとも一般的なグループ1のインフルエンザA型ウイルスの伝染力をブロックするものである。同チームは、最近発見された、事実上すべてのインフルエンザA型株を中和できる「スーパー抗体」という酵素がウイルスを捕捉する結合部位を取り入れたペプチドを設計した。抗体は大きなタンパク質であり、つくるのにはコストもかかり、人体への注入も注射か輸液で行わなければならない。しかし、「研究で開発されたペプチドは、将来的には錠剤タイプの医薬として利用できる可能性がある」。TSRIのHansen Professor of Structural Biologyで、共同主任研究員を務めるDr. Ian Wilsonは、「私達の新しい研究成果が示すように、広いスペクトラムでウイルスを中和する大きな分子の抗体と基本的に同じことを小さな分子でやらせるというのは将来性のある楽しみな戦略だ」と述べている。この新しいペプチドに関する研究論文は、2017年9月27日付
動物の複雑さを決定している遺伝子は、それぞれのコードに対応するタンパク質同士の相互作用でクロマチンの構成を動的に調節
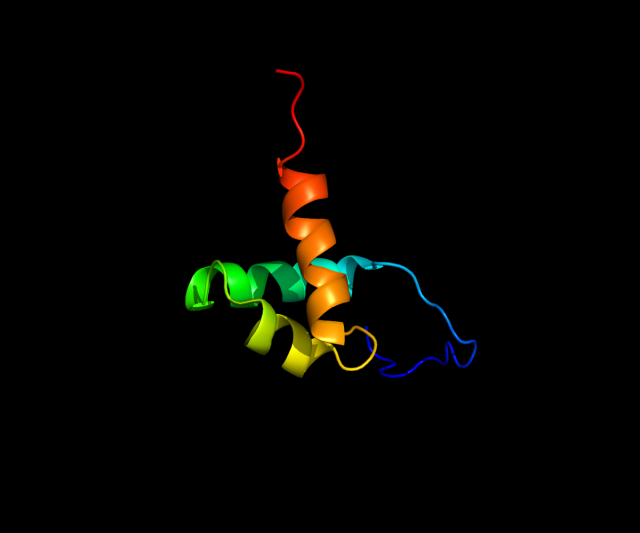 動物の複雑さを決定する遺伝子、人間をミバエやウニよりも複雑な生き物にしている遺伝子が初めて突き止められた。ある動物の細胞が他の動物の類似の細胞よりもかなり複雑にできているということがあるのはなぜか、その秘密は特定のタンパク質と、そのタンパク質が細胞核内の動きを調節する能力にあるらしいことが明らかにされた。イギリスのUniversity of Portsmouthの生化学者、Dr. Colin Sharpeと同僚研究者の研究論文は、2017年9月25日付PLoS One誌オンライン版に掲載されている。
このオープンアクセス論文は、「Relating Protein Functional Diversity to Cell Type Number Identifies Genes That Determine Dynamic Aspects of Chromatin Organisation As Potential Contributors to Organismal Complexity (タンパク質の機能多様性を細胞タイプの数と関連させることで、クロマチン構成の動的状態を決定する遺伝子を生物複雑性の要因となる可能性を突き止める)」と題されている。Dr. Sharpeは、「ほとんどの人が、ほ乳類、特に人間は虫やミバエよりも複雑だという考えにうなずくが、その理由をほんとうに知っている人はいない。長年、私も他の者もその疑問が頭から離れなかった。動物の複雑さを測る一般的な尺度の一つとして細胞の種類の数がある。しかし、遺伝子レベルでどのようにして複雑な生命体が構成されるのかについてはほとんど分かっていない。多細胞動物では遺伝子総数はわずかな違いしかなく、ゲノム中の遺伝子の数が動物の複雑さを決める因子とは考えられない。そうすると、他の因子を考えなければならない」と述べている。Dr.
動物の複雑さを決定する遺伝子、人間をミバエやウニよりも複雑な生き物にしている遺伝子が初めて突き止められた。ある動物の細胞が他の動物の類似の細胞よりもかなり複雑にできているということがあるのはなぜか、その秘密は特定のタンパク質と、そのタンパク質が細胞核内の動きを調節する能力にあるらしいことが明らかにされた。イギリスのUniversity of Portsmouthの生化学者、Dr. Colin Sharpeと同僚研究者の研究論文は、2017年9月25日付PLoS One誌オンライン版に掲載されている。
このオープンアクセス論文は、「Relating Protein Functional Diversity to Cell Type Number Identifies Genes That Determine Dynamic Aspects of Chromatin Organisation As Potential Contributors to Organismal Complexity (タンパク質の機能多様性を細胞タイプの数と関連させることで、クロマチン構成の動的状態を決定する遺伝子を生物複雑性の要因となる可能性を突き止める)」と題されている。Dr. Sharpeは、「ほとんどの人が、ほ乳類、特に人間は虫やミバエよりも複雑だという考えにうなずくが、その理由をほんとうに知っている人はいない。長年、私も他の者もその疑問が頭から離れなかった。動物の複雑さを測る一般的な尺度の一つとして細胞の種類の数がある。しかし、遺伝子レベルでどのようにして複雑な生命体が構成されるのかについてはほとんど分かっていない。多細胞動物では遺伝子総数はわずかな違いしかなく、ゲノム中の遺伝子の数が動物の複雑さを決める因子とは考えられない。そうすると、他の因子を考えなければならない」と述べている。Dr.
新発見の脂質メディエーター (Elovanoids) が脳を卒中や神経変性疾患から護っている可能性
 LSU Health New Orleans, Neuroscience Center of ExcellenceのBoyd ProfessorとDirectorを兼任するNicolas Bazan (photo), MD, PhDの率いる研究グループは、傷害や疾患に反応して細胞間情報伝達と神経炎症/免疫活動を同調させる、これまで知られていなかったクラスの化学物質を脳の中に見つけた。このクラスの化学物質は、elovanoids (ELVs) と呼ばれ、オメガ3極長鎖多価不飽和脂肪酸 (VLC-PUFAs, n-3) で構成されている生理活性的な化学的伝達物質である。
また、この化学物質は細胞が損傷を受けたり、ストレスにさらされるとその細胞の要求に応じて分泌される。Dr. Bazanは、「neuroprotectin D1 (22 carbons) など、オメガ3脂肪酸の伝達物質については以前から知っていたが、この発見の目新しいところは、elovanoidsが長さにして炭素原子32個ないし34個でできていることだ。このタイプの構造を研究すれば、ニューロン回路を支えている細胞間のクロストーク、特に疾患による傷害が起きた場合に細胞の平衡状態を回復する細胞間のクロストークに関する理解をさらに深めてくれるものと期待している」と述べている。大脳皮質や海馬から採取した神経細胞の培養や虚血性脳卒中のモデルを対象にした研究グループは、elovanoidsが単に神経細胞を保護したり、その生存を助けたりするだけでなく、神経細胞の完全性や安定性の維持を助けることも明らかにした。この研究論文は、2017年9月27日付Science Advancesオンライン版に掲載されたこのオープンアクセス論文は、「Elovanoids Are a Novel Class of Homeostatic Li
LSU Health New Orleans, Neuroscience Center of ExcellenceのBoyd ProfessorとDirectorを兼任するNicolas Bazan (photo), MD, PhDの率いる研究グループは、傷害や疾患に反応して細胞間情報伝達と神経炎症/免疫活動を同調させる、これまで知られていなかったクラスの化学物質を脳の中に見つけた。このクラスの化学物質は、elovanoids (ELVs) と呼ばれ、オメガ3極長鎖多価不飽和脂肪酸 (VLC-PUFAs, n-3) で構成されている生理活性的な化学的伝達物質である。
また、この化学物質は細胞が損傷を受けたり、ストレスにさらされるとその細胞の要求に応じて分泌される。Dr. Bazanは、「neuroprotectin D1 (22 carbons) など、オメガ3脂肪酸の伝達物質については以前から知っていたが、この発見の目新しいところは、elovanoidsが長さにして炭素原子32個ないし34個でできていることだ。このタイプの構造を研究すれば、ニューロン回路を支えている細胞間のクロストーク、特に疾患による傷害が起きた場合に細胞の平衡状態を回復する細胞間のクロストークに関する理解をさらに深めてくれるものと期待している」と述べている。大脳皮質や海馬から採取した神経細胞の培養や虚血性脳卒中のモデルを対象にした研究グループは、elovanoidsが単に神経細胞を保護したり、その生存を助けたりするだけでなく、神経細胞の完全性や安定性の維持を助けることも明らかにした。この研究論文は、2017年9月27日付Science Advancesオンライン版に掲載されたこのオープンアクセス論文は、「Elovanoids Are a Novel Class of Homeostatic Li
CRISPR-Cas9の輸送にCRISPR-Goldを用い、マウス・モデルでデュシェンヌ型筋ジストロフィー突然変異を治療
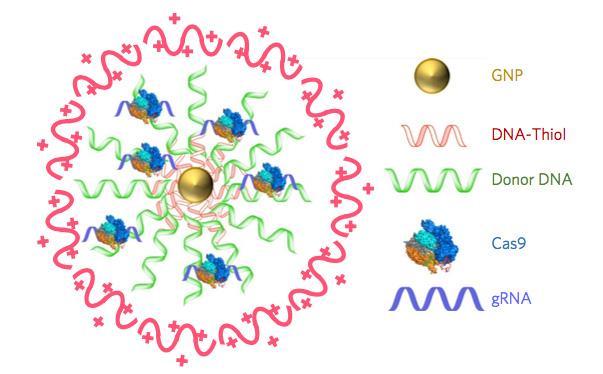 University of California, Berkeleyの研究グループは、CRISPR-Cas9遺伝子編集技術を細胞内に送り込む方法を新しく考案し、マウス・モデルを使って、筋肉衰弱の疾患であるデュシェンヌ型筋ジストロフィーを引き起こす突然変異を修復できることを確かめた。この新研究では、デュシェンヌ型筋ジストロフィーのマウスにCRISPR-Goldと名付けられたCRISPR-Cas9輸送系を1回注射するだけで、対照グループに比べて突然変異遺伝子修復率18倍、筋力と敏捷性テストで2倍の成績を達成した。
この研究の共著者で、UC BerkeleyのMolecular and Cell BiologyとChemistryの教授を兼任するDr. Jennifer DoudnaとMax Planck Institute for Infection Biology所属のEmmanuelle Charpentierが、2012年にCas9タンパク質を転用して、安価、正確かつ使いやすい遺伝子編集技術を開発して以来、研究者は、CRISPR-Cas9を基礎とした治療法が遺伝病の治療に革命をもたらすのではないかと期待している。しかし、遺伝病治療法の開発は、医学界でも依然として難問のままである。それというのも、遺伝病のほとんどは、疾患の原因となる遺伝子の突然変異を正常なシーケンスに回復することでしか治療できず、従来の治療法ではそれは不可能だからである。しかし、CRISPR/Cas9なら、突然変異したDNAを切断し、相同組換えDNA修復を開始することで遺伝子突然変異を修復できるのである。ただし、このCRISPR-Cas9ベースの治療法を実現するためには、Cas9、Cas9を特定の遺伝子に導くガイドとなるRNA、ドナーDNAなど必要な材料を安全に細胞に送り届ける手段を開発しなければならない
University of California, Berkeleyの研究グループは、CRISPR-Cas9遺伝子編集技術を細胞内に送り込む方法を新しく考案し、マウス・モデルを使って、筋肉衰弱の疾患であるデュシェンヌ型筋ジストロフィーを引き起こす突然変異を修復できることを確かめた。この新研究では、デュシェンヌ型筋ジストロフィーのマウスにCRISPR-Goldと名付けられたCRISPR-Cas9輸送系を1回注射するだけで、対照グループに比べて突然変異遺伝子修復率18倍、筋力と敏捷性テストで2倍の成績を達成した。
この研究の共著者で、UC BerkeleyのMolecular and Cell BiologyとChemistryの教授を兼任するDr. Jennifer DoudnaとMax Planck Institute for Infection Biology所属のEmmanuelle Charpentierが、2012年にCas9タンパク質を転用して、安価、正確かつ使いやすい遺伝子編集技術を開発して以来、研究者は、CRISPR-Cas9を基礎とした治療法が遺伝病の治療に革命をもたらすのではないかと期待している。しかし、遺伝病治療法の開発は、医学界でも依然として難問のままである。それというのも、遺伝病のほとんどは、疾患の原因となる遺伝子の突然変異を正常なシーケンスに回復することでしか治療できず、従来の治療法ではそれは不可能だからである。しかし、CRISPR/Cas9なら、突然変異したDNAを切断し、相同組換えDNA修復を開始することで遺伝子突然変異を修復できるのである。ただし、このCRISPR-Cas9ベースの治療法を実現するためには、Cas9、Cas9を特定の遺伝子に導くガイドとなるRNA、ドナーDNAなど必要な材料を安全に細胞に送り届ける手段を開発しなければならない
研究グループ、台湾ハブのゲノムのシーケンスとヘビ毒進化上の遺伝的浮動の役割を研究
 台湾や沖縄でハブと呼ばれるクサリヘビ科のヘビにかまれると一生障害が残ることもあり、場合によっては死に至ることもある。しかし、その毒に関しては依然として謎のままである。毒の組成は非常にばらつきがあり、同腹仔の間でさえ異なっていることがある。また、この毒素の混合物は何世代もかけて変化してきた。
2017年9月27日付Genome Biology and Evolutionのオンライン版に掲載されたこの研究論文は、ヘビ毒の進化の解明を進めている。この研究グループは、初めてハブのゲノム・シーケンスを解析し、タイワンハブ (Protobothrops mucrosquamatus) のゲノムを近縁種、サキシマハブ (Protobothrops elegans) のゲノムと比較した。この論文は、「Population Genomic Analysis of a Pitviper Reveals Microevolutionary Forces Underlying Venom Chemistry (ハブの集団ゲノム解析で、ハブ毒化学組成の小進化駆動力を解明)」と題されている。沖縄県庁の統計によれば、過去1年間に沖縄だけで50件をヘビ咬傷事故が起きており、世界保健機関 (WHO) によれば、世界全体では年間81,000人から138,000人がヘビに咬まれて亡くなっている。特に発展途上国や農村地域は毒蛇に出会うことも多く、一方で医療機関も少ないため、ヘビの咬傷は重大事になりやすい。そのような地域では効果的な抗毒素を開発することが住民の生死を分ける結果になる。この研究論文の首席著者で、Okinawa Institute of Science and Technology (沖縄科学技術大学院大学、OIST) のEcology and Evolution Unit (生態・進化学ユニット)
台湾や沖縄でハブと呼ばれるクサリヘビ科のヘビにかまれると一生障害が残ることもあり、場合によっては死に至ることもある。しかし、その毒に関しては依然として謎のままである。毒の組成は非常にばらつきがあり、同腹仔の間でさえ異なっていることがある。また、この毒素の混合物は何世代もかけて変化してきた。
2017年9月27日付Genome Biology and Evolutionのオンライン版に掲載されたこの研究論文は、ヘビ毒の進化の解明を進めている。この研究グループは、初めてハブのゲノム・シーケンスを解析し、タイワンハブ (Protobothrops mucrosquamatus) のゲノムを近縁種、サキシマハブ (Protobothrops elegans) のゲノムと比較した。この論文は、「Population Genomic Analysis of a Pitviper Reveals Microevolutionary Forces Underlying Venom Chemistry (ハブの集団ゲノム解析で、ハブ毒化学組成の小進化駆動力を解明)」と題されている。沖縄県庁の統計によれば、過去1年間に沖縄だけで50件をヘビ咬傷事故が起きており、世界保健機関 (WHO) によれば、世界全体では年間81,000人から138,000人がヘビに咬まれて亡くなっている。特に発展途上国や農村地域は毒蛇に出会うことも多く、一方で医療機関も少ないため、ヘビの咬傷は重大事になりやすい。そのような地域では効果的な抗毒素を開発することが住民の生死を分ける結果になる。この研究論文の首席著者で、Okinawa Institute of Science and Technology (沖縄科学技術大学院大学、OIST) のEcology and Evolution Unit (生態・進化学ユニット)
ノンコーディングDNAの重複が人間固有の特徴の進化に影響を与えていた可能性
 2017年10月18日、フロリダ州オーランドで開催された2017年American Society of Human Genetics (ASHG) 年次会議においてプレゼンテーションのあった研究によると、ヒト・ゲノム中のノンコーディングDNAの大きなセグメントが重複されてきたことが人間と他の霊長類との違いを生んだ可能性がある。調節塩基配列を含むこのような重複と人間の特徴と行動に及ぼすその影響を突き止めれば人間の疾患の遺伝的要因が説明できるようになる可能性がある。
この研究の報告を行ったPaulina Carmona-Mora, PhD、Megan Dennis, PhDや同僚研究者らUniversity of California, Davisの研究グループは、ヒト・ゲノムにはあっても他の霊長類やその他の動物に見られない、1,000塩基対以上の長さのDNAセグメントの反復というヒト固有の重複 (HSD) の履歴を調べた。また、その研究では、遺伝子コードを持たず、他の遺伝子の発現を調節するだけのHSD領域に注目した。
Dr. Dennisは、「このような調節エレメントが特別なものになっている理由は、これが同じ染色体中で周辺の遺伝子の発現に影響するだけでなく、同じゲノム中の他の部分にも影響することであり、ただ一つの重複が数多くの遺伝子に影響を与えることになるため、その効果が増幅されることになる」と述べている。さらに、重複したセグメントは98%以上が同一なため、それぞれを区別することは難しく、過去のゲノム解析では捨てられることも多かったと述べている。そのことから、研究グループは重複したセグメントを含んだヒトの基準ゲノムを新たに作ることを始めた。そうすることにより、他の遺伝子の発現を強化する調節エレメントのエンハンサーを含んでいそうな部分を特定し、器官や組織全体にわたって遺伝
2017年10月18日、フロリダ州オーランドで開催された2017年American Society of Human Genetics (ASHG) 年次会議においてプレゼンテーションのあった研究によると、ヒト・ゲノム中のノンコーディングDNAの大きなセグメントが重複されてきたことが人間と他の霊長類との違いを生んだ可能性がある。調節塩基配列を含むこのような重複と人間の特徴と行動に及ぼすその影響を突き止めれば人間の疾患の遺伝的要因が説明できるようになる可能性がある。
この研究の報告を行ったPaulina Carmona-Mora, PhD、Megan Dennis, PhDや同僚研究者らUniversity of California, Davisの研究グループは、ヒト・ゲノムにはあっても他の霊長類やその他の動物に見られない、1,000塩基対以上の長さのDNAセグメントの反復というヒト固有の重複 (HSD) の履歴を調べた。また、その研究では、遺伝子コードを持たず、他の遺伝子の発現を調節するだけのHSD領域に注目した。
Dr. Dennisは、「このような調節エレメントが特別なものになっている理由は、これが同じ染色体中で周辺の遺伝子の発現に影響するだけでなく、同じゲノム中の他の部分にも影響することであり、ただ一つの重複が数多くの遺伝子に影響を与えることになるため、その効果が増幅されることになる」と述べている。さらに、重複したセグメントは98%以上が同一なため、それぞれを区別することは難しく、過去のゲノム解析では捨てられることも多かったと述べている。そのことから、研究グループは重複したセグメントを含んだヒトの基準ゲノムを新たに作ることを始めた。そうすることにより、他の遺伝子の発現を強化する調節エレメントのエンハンサーを含んでいそうな部分を特定し、器官や組織全体にわたって遺伝
遺伝学者はゲノム編集をどう考えるか? ASHG2017年次大会で調査結果が発表された
 フロリダ州オーランド市で開催された2017年American Society of Human Genetics (ASHG) 年次会議の10月19日には、世界の遺伝学専門家を対象とした意見調査が発表され、ヒトのゲノム編集について一般社会と意見の一致するところもあれば異なるところもあるという結果が明らかにされた。Stanford Center for Biomedical EthicsのCertified Genetic Counselorを務めるProfessor Kelly Ormond, MSがこの調査結果発表を行った。
Stanford University School of MedicineのAlyssa Armsby (写真), MSの指導する研究グループは、国際的な遺伝学研究機関10機関のメンバーを対象に、ゲノム編集の研究や臨床応用の可能性についての考え方や、この比較的新しいテクノロジーとメンバー個人の世界観とのつながりについて意見調査を行った。2013年に発表されたゲノム編集ツールのCRISPR/Cas9システムは、カスタマイズの容易さや細胞タイプ、生物種全般にわたる有効性などから、急速に遺伝子研究の分野で広く用いられるようになった。しかし、急速に広まったことから、科学界だけでなく一般社会からも、その研究や利用の仕方について社会的な問題、倫理的な疑問が次々と出された。
Ms. Armsbyは、「ゲノム編集について常に国際的な対話が必要だが、このテクノロジーに対する遺伝学を学んだ人々の考えに関するデータはほとんどない。遺伝子の研究を行い、患者やその家族と協力している人達は、重要な利害関係者といえる」と述べている。この分析の対象となった遺伝学専門家500人のうち、85%以上がゲノム編集の研究結果を人体に用いてもいいのではないかとしており、これはアメ
フロリダ州オーランド市で開催された2017年American Society of Human Genetics (ASHG) 年次会議の10月19日には、世界の遺伝学専門家を対象とした意見調査が発表され、ヒトのゲノム編集について一般社会と意見の一致するところもあれば異なるところもあるという結果が明らかにされた。Stanford Center for Biomedical EthicsのCertified Genetic Counselorを務めるProfessor Kelly Ormond, MSがこの調査結果発表を行った。
Stanford University School of MedicineのAlyssa Armsby (写真), MSの指導する研究グループは、国際的な遺伝学研究機関10機関のメンバーを対象に、ゲノム編集の研究や臨床応用の可能性についての考え方や、この比較的新しいテクノロジーとメンバー個人の世界観とのつながりについて意見調査を行った。2013年に発表されたゲノム編集ツールのCRISPR/Cas9システムは、カスタマイズの容易さや細胞タイプ、生物種全般にわたる有効性などから、急速に遺伝子研究の分野で広く用いられるようになった。しかし、急速に広まったことから、科学界だけでなく一般社会からも、その研究や利用の仕方について社会的な問題、倫理的な疑問が次々と出された。
Ms. Armsbyは、「ゲノム編集について常に国際的な対話が必要だが、このテクノロジーに対する遺伝学を学んだ人々の考えに関するデータはほとんどない。遺伝子の研究を行い、患者やその家族と協力している人達は、重要な利害関係者といえる」と述べている。この分析の対象となった遺伝学専門家500人のうち、85%以上がゲノム編集の研究結果を人体に用いてもいいのではないかとしており、これはアメ
遺伝子組み換え幹細胞で増殖した皮膚を移植し、致死性の遺伝性皮膚疾患の児童を救うことに成功
 ドイツのRuhr-Universität Bochum, burn unitとイタリアのUniversity of Modena, Center for Regenerative Medicineの医療チームは、遺伝疾患で広範な皮膚の損傷を受けている児童に遺伝子組み換え幹細胞から増殖した皮膚を移植し、治療に初めて成功した。少年の症状はいわゆる” butterfly child”と呼ばれる遺伝性の表皮水疱症に苦しんでおり、表皮の約80%が損傷を受けるひどい状態だった。既存の治療法がすべて失敗したことから、Bochumの医療チームは実験的な治療を施してみることにした。
その治療が成功し、治療開始から2年経った今、少年は家族との生活や社会生活にも参加できるようになった。研究論文は2017年11月8日付Nature誌オンライン版に掲載されており、「Regeneration of the Entire Human Epidermis by Transgenic Stem Cells (トランスジェニック幹細胞で人間の表皮全体を再生)」と題されている。「epidermolysis bullosa」は、現在のところ、不治の病と考えられている遺伝性皮膚疾患の科学的名称である。この疾患の原因になっているメカニズムは、皮膚の再生に不可欠なタンパク質を生成する遺伝子の欠陥にある。ごく軽微なストレスでさえ火ぶくれ、外傷になり、皮膚損傷によって傷口が形成されることになる。疾患の重さによっては内臓が同じように影響を受ける場合もあり、深刻な臓器不全を引き起こすことがある。この疾患は患者の生活の質を著しく損ね、7歳の少年、Hassanの場合のようにしばしば生命の危険さえ伴う。2015年6月、Hassanが、Katholisches Klinikum Bochumの小児集中治療室に運び込まれた時には
ドイツのRuhr-Universität Bochum, burn unitとイタリアのUniversity of Modena, Center for Regenerative Medicineの医療チームは、遺伝疾患で広範な皮膚の損傷を受けている児童に遺伝子組み換え幹細胞から増殖した皮膚を移植し、治療に初めて成功した。少年の症状はいわゆる” butterfly child”と呼ばれる遺伝性の表皮水疱症に苦しんでおり、表皮の約80%が損傷を受けるひどい状態だった。既存の治療法がすべて失敗したことから、Bochumの医療チームは実験的な治療を施してみることにした。
その治療が成功し、治療開始から2年経った今、少年は家族との生活や社会生活にも参加できるようになった。研究論文は2017年11月8日付Nature誌オンライン版に掲載されており、「Regeneration of the Entire Human Epidermis by Transgenic Stem Cells (トランスジェニック幹細胞で人間の表皮全体を再生)」と題されている。「epidermolysis bullosa」は、現在のところ、不治の病と考えられている遺伝性皮膚疾患の科学的名称である。この疾患の原因になっているメカニズムは、皮膚の再生に不可欠なタンパク質を生成する遺伝子の欠陥にある。ごく軽微なストレスでさえ火ぶくれ、外傷になり、皮膚損傷によって傷口が形成されることになる。疾患の重さによっては内臓が同じように影響を受ける場合もあり、深刻な臓器不全を引き起こすことがある。この疾患は患者の生活の質を著しく損ね、7歳の少年、Hassanの場合のようにしばしば生命の危険さえ伴う。2015年6月、Hassanが、Katholisches Klinikum Bochumの小児集中治療室に運び込まれた時には
ヒツジは平面画像から人間の顔を認識できる
 University of Cambridge (UK) の研究者が行った新研究は、ヒツジが写真からでも人間の顔を認識でき、また事前の訓練なしに飼い主の写真を識別できるとしている。2017年11月8日付Royal Society: Open Scienceオンライン版に掲載されたこの研究は、ヒツジの認識能力を観察するために行っているいくつかの実験の一つである。
このオープンアクセス論文は、「Sheep Recognize Familiar and Unfamiliar Human Faces from Two-Dimensional Images (ヒツジが平面画像で見慣れた人と見慣れない人の顔を識別)」と題されている。ヒツジは比較的脳も大きく、また寿命も長いため、ハンチントン病など神経変性疾患の動物モデルに適している。また、顔を認識する能力は人間のもっとも重要な社会的能力の一つである。見慣れた人の顔をたやすく認識できるし、見慣れない人の顔でも画像を繰り返し見せられれば認識できるようになる。ヒツジもイヌやサルなどと同じように社会性動物であり、他のヒツジだけでなく、見慣れた人も認識できる。ただし、ヒツジが顔貌情報を処理する全体的な能力についてはほとんど知られていない。University of CambridgeのDepartment of Physiology, Development, and Neuroscienceの研究チームは8頭のヒツジを訓練し、コンピュータ・スクリーンに表示された4人の有名人の肖像写真を認識させる試みを行った。4人の有名人にはFiona Bruce、Jake Gyllenhaal、Barack Obama、Emma Watsonを選んだ。その訓練では、ヒツジが特別設計の囲いを歩き回るようになっており、囲いの一方の端に置かれた2台のコンピュータ・
University of Cambridge (UK) の研究者が行った新研究は、ヒツジが写真からでも人間の顔を認識でき、また事前の訓練なしに飼い主の写真を識別できるとしている。2017年11月8日付Royal Society: Open Scienceオンライン版に掲載されたこの研究は、ヒツジの認識能力を観察するために行っているいくつかの実験の一つである。
このオープンアクセス論文は、「Sheep Recognize Familiar and Unfamiliar Human Faces from Two-Dimensional Images (ヒツジが平面画像で見慣れた人と見慣れない人の顔を識別)」と題されている。ヒツジは比較的脳も大きく、また寿命も長いため、ハンチントン病など神経変性疾患の動物モデルに適している。また、顔を認識する能力は人間のもっとも重要な社会的能力の一つである。見慣れた人の顔をたやすく認識できるし、見慣れない人の顔でも画像を繰り返し見せられれば認識できるようになる。ヒツジもイヌやサルなどと同じように社会性動物であり、他のヒツジだけでなく、見慣れた人も認識できる。ただし、ヒツジが顔貌情報を処理する全体的な能力についてはほとんど知られていない。University of CambridgeのDepartment of Physiology, Development, and Neuroscienceの研究チームは8頭のヒツジを訓練し、コンピュータ・スクリーンに表示された4人の有名人の肖像写真を認識させる試みを行った。4人の有名人にはFiona Bruce、Jake Gyllenhaal、Barack Obama、Emma Watsonを選んだ。その訓練では、ヒツジが特別設計の囲いを歩き回るようになっており、囲いの一方の端に置かれた2台のコンピュータ・
正常細胞中の線維芽活性化タンパク質 (FAP) の阻害で膵がん抑制も可能と証明
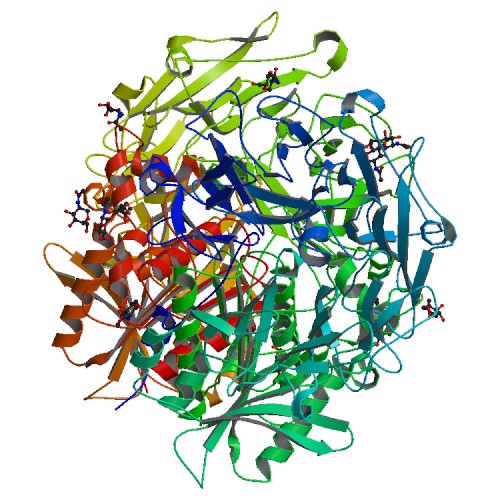 膵臓がんは致命的であり、生存期間中央値は6か月未満である。また、診断後5年生存する膵臓がん患者は20人に1人しかいない。そのように致命的な原因はこのがんの狡猾さにある。がん細胞は身体の奥深くに隠れており、がんが他の器官に広がってしまう末期になるまでどんな症状も示さないのである。
University of Pennsylvaniaが中心になって行った研究チームの研究により、将来的には奥深く隠れている転移性がん患部でさえも根こそぎしてしまう治療法の有望な標的が示されている。研究チームが膵臓がんのマウスでこのタンパク質をエンコードしている遺伝子を削除したところ、マウスは長生きし、他の器官へのがん転移が減ったとしている。 University of Pennsylvania, School of Veterinary MedicineのChair of the Department of Biomedical Scienceで、論文の首席著者を務めたDr. Ellen Puréは、「このタンパク質を標的にすることで原発腫瘍に大きな変化があるものと期待していた。確かに原発腫瘍の進行に遅れは出たが、もっと大きな変化は転移にあった。このタンパク質はドラッガブルな標的のように見えており、今後さらにフォローアップ研究を続けることで患者に役立つ新薬に結びつく可能性がある」と述べている。Dr. Puréは、Penn VetのAlbert Lo、Elizabeth L. Buza、Rachel Blomberg、Priya Govindaraju、Diana Avery、James Monslow各Dr.、Taipei Veterans General HospitalおよびNational Yang-Ming University School of Medicine所属のDr. Chung
膵臓がんは致命的であり、生存期間中央値は6か月未満である。また、診断後5年生存する膵臓がん患者は20人に1人しかいない。そのように致命的な原因はこのがんの狡猾さにある。がん細胞は身体の奥深くに隠れており、がんが他の器官に広がってしまう末期になるまでどんな症状も示さないのである。
University of Pennsylvaniaが中心になって行った研究チームの研究により、将来的には奥深く隠れている転移性がん患部でさえも根こそぎしてしまう治療法の有望な標的が示されている。研究チームが膵臓がんのマウスでこのタンパク質をエンコードしている遺伝子を削除したところ、マウスは長生きし、他の器官へのがん転移が減ったとしている。 University of Pennsylvania, School of Veterinary MedicineのChair of the Department of Biomedical Scienceで、論文の首席著者を務めたDr. Ellen Puréは、「このタンパク質を標的にすることで原発腫瘍に大きな変化があるものと期待していた。確かに原発腫瘍の進行に遅れは出たが、もっと大きな変化は転移にあった。このタンパク質はドラッガブルな標的のように見えており、今後さらにフォローアップ研究を続けることで患者に役立つ新薬に結びつく可能性がある」と述べている。Dr. Puréは、Penn VetのAlbert Lo、Elizabeth L. Buza、Rachel Blomberg、Priya Govindaraju、Diana Avery、James Monslow各Dr.、Taipei Veterans General HospitalおよびNational Yang-Ming University School of Medicine所属のDr. Chung
自己免疫疾患の発見から新薬開発へ:TLR8阻害低分子を合成
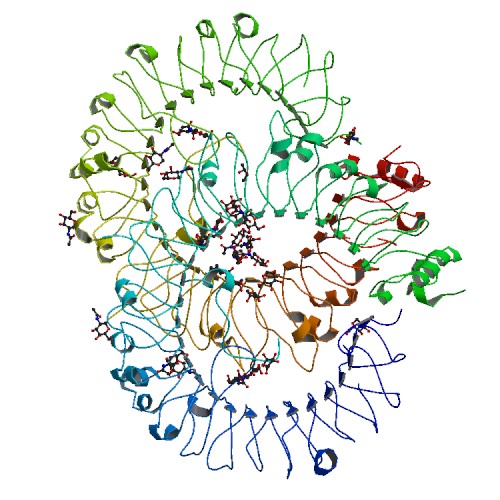 University of Colorado (UC) Boulderの研究チームは、身体の自己組織攻撃の原因となるタンパク質を阻害する有望な薬物に似た化合物を発見した。この化合物はいつかリューマチ様関節炎その他の自己免疫疾患の治療に一大改革をもたらすかもしれない。
2017年11月20日付Nature Chemical Biologyに掲載された研究論文の筆頭著者で、BioFrontiers Instituteの生化学教授を務めるDr. Hang Hubert Yinは、「私達は、このタンパク質を休眠状態に閉じ込めるカギを見つけた。これはパラダイム・シフトになる可能性もある」と述べている。この論文は、「Small-Molecule Inhibition of TLR8 Through Stabilization of Its Resting State (TLR8休眠状態の安定化でその働きを阻害する低分子)」と題されている。リューマチ様関節炎、強皮症、あるいは過剰な免疫反応が痛み、炎症、皮膚疾患その他の慢性的な健康障害を引き起こす全身性紅斑性狼瘡など自己免疫疾患に悩むアメリカ国民は2,350万人を超える。 アメリカ国内でもっとも売れている医薬5品目のうち3品目までが自己免疫疾患の症状緩和を目的としている。しかし、自己免疫疾患を完治させる治療法はなく、対症療法も高価なうえに副作用がある。Dr. Yinは、「この疾患の患者が多いことから代わりの治療法の研究もよく行われている」と述べている。長年、研究者は、Toll様受容体8 (TLR8) と呼ばれるタンパク質が先天免疫反応に重要な役割を果たしているのではないかと疑っていた。TLR8はウイルスや細菌の存在を感知するといくつかの段階を経て受動状態から能動状態に変化し、侵入異物を撃退するために一連の炎症シグナルを送り出す。しかし
University of Colorado (UC) Boulderの研究チームは、身体の自己組織攻撃の原因となるタンパク質を阻害する有望な薬物に似た化合物を発見した。この化合物はいつかリューマチ様関節炎その他の自己免疫疾患の治療に一大改革をもたらすかもしれない。
2017年11月20日付Nature Chemical Biologyに掲載された研究論文の筆頭著者で、BioFrontiers Instituteの生化学教授を務めるDr. Hang Hubert Yinは、「私達は、このタンパク質を休眠状態に閉じ込めるカギを見つけた。これはパラダイム・シフトになる可能性もある」と述べている。この論文は、「Small-Molecule Inhibition of TLR8 Through Stabilization of Its Resting State (TLR8休眠状態の安定化でその働きを阻害する低分子)」と題されている。リューマチ様関節炎、強皮症、あるいは過剰な免疫反応が痛み、炎症、皮膚疾患その他の慢性的な健康障害を引き起こす全身性紅斑性狼瘡など自己免疫疾患に悩むアメリカ国民は2,350万人を超える。 アメリカ国内でもっとも売れている医薬5品目のうち3品目までが自己免疫疾患の症状緩和を目的としている。しかし、自己免疫疾患を完治させる治療法はなく、対症療法も高価なうえに副作用がある。Dr. Yinは、「この疾患の患者が多いことから代わりの治療法の研究もよく行われている」と述べている。長年、研究者は、Toll様受容体8 (TLR8) と呼ばれるタンパク質が先天免疫反応に重要な役割を果たしているのではないかと疑っていた。TLR8はウイルスや細菌の存在を感知するといくつかの段階を経て受動状態から能動状態に変化し、侵入異物を撃退するために一連の炎症シグナルを送り出す。しかし
耳たぶの形に最低49個の遺伝子が関与と判明
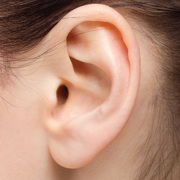 小学校で遺伝の意味を教えるのにもっとも手近に用いられるのが生徒の耳たぶの形を親の耳たぶの形と比べなさいというもので、主として耳たぶ下端の線が滑らかに側頭部につながっている密着型と、側頭部から出て垂れ下がっている分離型とがある。この比較は優性遺伝子と劣性遺伝子について教えるもので、簡単なことのようだが、実はそれほど簡単なことではない。
University of Pittsburgh (Pitt)のGraduate School of Public HealthとSchool of Dental Medicineが中心になって進め、2017年11月30日付American Journal of Human Geneticsオンライン版に掲載された新研究は、この耳たぶの遺伝ははるかに複雑で、耳たぶの密着度については少なくとも49個の遺伝子の相互関係が関わっていることを明らかにした。この研究論文の筆頭著者で、Pitt Public HealthのDepartment of Human GeneticsとPittのSchool of Dental MedicineのDepartment of Oral Biologyで准教授を務めるJohn R. Shaffer, Ph.D.は、「かなりシンプルな形質が遺伝的には非常に複雑だということが時々ある。その複雑さを理解すれば、遺伝疾患の治療への手がかりが得られるのではないか。そういう遺伝的疾患の中には、モワットウィルソン症候群のように、耳穴を覆うような耳殻や突き出した耳たぶなど、独特の顔貌を特徴とするものがある」と述べている。この研究は、イギリスと中国の研究者の国際的な共同作業で行われ、アメリカの個人遺伝学企業、23andMe Inc.のデータも使っている。この論文の首席著者で、PittのDepartments of Oral Biol
小学校で遺伝の意味を教えるのにもっとも手近に用いられるのが生徒の耳たぶの形を親の耳たぶの形と比べなさいというもので、主として耳たぶ下端の線が滑らかに側頭部につながっている密着型と、側頭部から出て垂れ下がっている分離型とがある。この比較は優性遺伝子と劣性遺伝子について教えるもので、簡単なことのようだが、実はそれほど簡単なことではない。
University of Pittsburgh (Pitt)のGraduate School of Public HealthとSchool of Dental Medicineが中心になって進め、2017年11月30日付American Journal of Human Geneticsオンライン版に掲載された新研究は、この耳たぶの遺伝ははるかに複雑で、耳たぶの密着度については少なくとも49個の遺伝子の相互関係が関わっていることを明らかにした。この研究論文の筆頭著者で、Pitt Public HealthのDepartment of Human GeneticsとPittのSchool of Dental MedicineのDepartment of Oral Biologyで准教授を務めるJohn R. Shaffer, Ph.D.は、「かなりシンプルな形質が遺伝的には非常に複雑だということが時々ある。その複雑さを理解すれば、遺伝疾患の治療への手がかりが得られるのではないか。そういう遺伝的疾患の中には、モワットウィルソン症候群のように、耳穴を覆うような耳殻や突き出した耳たぶなど、独特の顔貌を特徴とするものがある」と述べている。この研究は、イギリスと中国の研究者の国際的な共同作業で行われ、アメリカの個人遺伝学企業、23andMe Inc.のデータも使っている。この論文の首席著者で、PittのDepartments of Oral Biol
2017年ノーベル生理学医学賞は、概日リズムを制御する分子の発見に授与
 2017年10月2日、Karolinska InstitutetのNobel Assemblyは、2017年ノーベル生理学医学賞を「概日リズムを制御する分子的仕組みを発見」したJeffrey C. Hall、Michael Rosbash、Michael W. Youngの3氏に授与すると決定した。Jeffrey C. Hallは、1945年、アメリカのニューヨーク生まれ。1971年にワシントン州シアトル市のUniversity of Washingtonから博士号を授与され、1971年から1973年までカリフォルニア州パサディナ市のCalifornia Institute of Technologyでポスドク研究員の地位にあった。
1974年にマサチューセッツ州ウォルサム市のBrandeis Universityに移籍。2002年にはUniversity of Maineのassociatedになっている。Michael Rosbashは、1944年、アメリカのカンザス・シティ生まれ。1970年にケンブリッジ市のMassachusetts Institute of Technologyから博士号を授与されている。その後の3年間、ポスドク研究員としてスコットランドのUniversity of Edinburghに所属していた。1974年以来ウォルサム市のBrandeis Universityの教授会メンバー。Michael W. Youngは、1949年、アメリカのマイアミ市生まれ。1975年にオースチン市のUniversity of Texasから博士号を授与されている。1975年から77年まで、カリフォルニア州パロ・アルト市のStanford Universityでポスドク研究員の地位にあった。1978年以来、ニューヨーク市のRockefeller Univer
2017年10月2日、Karolinska InstitutetのNobel Assemblyは、2017年ノーベル生理学医学賞を「概日リズムを制御する分子的仕組みを発見」したJeffrey C. Hall、Michael Rosbash、Michael W. Youngの3氏に授与すると決定した。Jeffrey C. Hallは、1945年、アメリカのニューヨーク生まれ。1971年にワシントン州シアトル市のUniversity of Washingtonから博士号を授与され、1971年から1973年までカリフォルニア州パサディナ市のCalifornia Institute of Technologyでポスドク研究員の地位にあった。
1974年にマサチューセッツ州ウォルサム市のBrandeis Universityに移籍。2002年にはUniversity of Maineのassociatedになっている。Michael Rosbashは、1944年、アメリカのカンザス・シティ生まれ。1970年にケンブリッジ市のMassachusetts Institute of Technologyから博士号を授与されている。その後の3年間、ポスドク研究員としてスコットランドのUniversity of Edinburghに所属していた。1974年以来ウォルサム市のBrandeis Universityの教授会メンバー。Michael W. Youngは、1949年、アメリカのマイアミ市生まれ。1975年にオースチン市のUniversity of Texasから博士号を授与されている。1975年から77年まで、カリフォルニア州パロ・アルト市のStanford Universityでポスドク研究員の地位にあった。1978年以来、ニューヨーク市のRockefeller Univer
偏頭痛には脳脊髄中のナトリウム濃度が関与している
 ナトリウムMRIという造影検査法を使って偏頭痛患者を調べた初の研究で、偏頭痛患者は健康な人に比べて脳脊髄液中のナトリウム濃度がかなり高いという結果が出た。この研究結果は、2017年11月26日から12月1日までシカゴで開かれていたRadiological Society of North America (RSNA) 年次大会の11月28日でプレゼンテーションがあった。
偏頭痛は頭痛の一種で、激しい頭痛や時には吐き気、吐瀉などの症状を特徴としており、女性の18%、男性の6%がこの障害に悩む比較的多い頭痛障害である。偏頭痛患者の中には視覚異常や、アウラと呼ばれる身体症状を経験する者もいる。しかし、偏頭痛の特徴や発作のタイプは患者ごとに様々で、診断は難しい。そのため、偏頭痛と確定されず、治療を受けないままの患者も多い。逆に、もっと一般的な緊張性頭痛などでありながら、偏頭痛の投薬を受ける患者もいる。 この研究論文の著者、ドイツのハイデルベルクのUniversity Hospital Mannheim and Heidelberg University, Institute of Clinical Radiology and Nuclear MedicineのMelissa Meyer, MD, Radiology Residentは、「偏頭痛の診断を助けるか、あるいはむしろ偏頭痛を発見し、偏頭痛と他のあらゆるタイプの頭痛とを判別する診断ツールがあれば非常にありがたい」と述べている。Dr. Meyerの研究チームは、偏頭痛の診断と理解を助ける手段として、脳脊髄液ナトリウムMRIという磁気共鳴造影法を採用した。MRIは原子中の陽子を利用して画像をつくり出すのが普通だが、ナトリウム原子も画像化できる。これまでの研究で、脳の化学反応にナトリウムが重要な役割を果たしていることが示されて
ナトリウムMRIという造影検査法を使って偏頭痛患者を調べた初の研究で、偏頭痛患者は健康な人に比べて脳脊髄液中のナトリウム濃度がかなり高いという結果が出た。この研究結果は、2017年11月26日から12月1日までシカゴで開かれていたRadiological Society of North America (RSNA) 年次大会の11月28日でプレゼンテーションがあった。
偏頭痛は頭痛の一種で、激しい頭痛や時には吐き気、吐瀉などの症状を特徴としており、女性の18%、男性の6%がこの障害に悩む比較的多い頭痛障害である。偏頭痛患者の中には視覚異常や、アウラと呼ばれる身体症状を経験する者もいる。しかし、偏頭痛の特徴や発作のタイプは患者ごとに様々で、診断は難しい。そのため、偏頭痛と確定されず、治療を受けないままの患者も多い。逆に、もっと一般的な緊張性頭痛などでありながら、偏頭痛の投薬を受ける患者もいる。 この研究論文の著者、ドイツのハイデルベルクのUniversity Hospital Mannheim and Heidelberg University, Institute of Clinical Radiology and Nuclear MedicineのMelissa Meyer, MD, Radiology Residentは、「偏頭痛の診断を助けるか、あるいはむしろ偏頭痛を発見し、偏頭痛と他のあらゆるタイプの頭痛とを判別する診断ツールがあれば非常にありがたい」と述べている。Dr. Meyerの研究チームは、偏頭痛の診断と理解を助ける手段として、脳脊髄液ナトリウムMRIという磁気共鳴造影法を採用した。MRIは原子中の陽子を利用して画像をつくり出すのが普通だが、ナトリウム原子も画像化できる。これまでの研究で、脳の化学反応にナトリウムが重要な役割を果たしていることが示されて
特定遺伝子の発現が若々しい肌のカギか? その発現パターンが突き止められる
 生活年齢に比べて肌が若く見える人がいる。クリーム、ローション、薬液注射、外科手術などでこのように若々しい肌を実現しようとする人は多いが、2017年11月14日付Journal of the American Academy of Dermatologyオンライン版に掲載された新しい研究論文は、このように若々しくみずみずしい肌は、特定の遺伝子発現の高さがカギになっているようだとしている。
JAADの研究論文は、「Age-Induced and Photoinduced Changes in Gene Expression Profiles in Facial Skin of Caucasian Females Across 6 Decades of Age (白人女性の顔面皮膚の遺伝子発現プロフィールの60年間にわたる加齢性および感光性変化)」と題されている。Beth Israel Deaconess Medical Center, Harvard Medical Faculty Physiciansのdermatologistであり、PresidentとCEOを兼任するAlexa B. Kimball, MD, MPHは、Massachusetts General Hospital所属期にこの研究を進めており、研究論文の筆頭著者を務めている。同氏は、この論文で、「これは持って生まれた遺伝子の問題ではなく、生活している間にどの遺伝子がオンになり、どの遺伝子がオフになるかということである。加齢に影響を受ける様々な皮膚のプロセスを突き止めており、生活年齢より若く見える女性に特有の遺伝子発現パターンを発見した」と述べている。 老化する皮膚の包括的なモデルをつくるため、Dr. Kimballの研究チームは、20歳から74歳までの白人女性158人の日光にさらされた皮膚 (顔面と前腕)
生活年齢に比べて肌が若く見える人がいる。クリーム、ローション、薬液注射、外科手術などでこのように若々しい肌を実現しようとする人は多いが、2017年11月14日付Journal of the American Academy of Dermatologyオンライン版に掲載された新しい研究論文は、このように若々しくみずみずしい肌は、特定の遺伝子発現の高さがカギになっているようだとしている。
JAADの研究論文は、「Age-Induced and Photoinduced Changes in Gene Expression Profiles in Facial Skin of Caucasian Females Across 6 Decades of Age (白人女性の顔面皮膚の遺伝子発現プロフィールの60年間にわたる加齢性および感光性変化)」と題されている。Beth Israel Deaconess Medical Center, Harvard Medical Faculty Physiciansのdermatologistであり、PresidentとCEOを兼任するAlexa B. Kimball, MD, MPHは、Massachusetts General Hospital所属期にこの研究を進めており、研究論文の筆頭著者を務めている。同氏は、この論文で、「これは持って生まれた遺伝子の問題ではなく、生活している間にどの遺伝子がオンになり、どの遺伝子がオフになるかということである。加齢に影響を受ける様々な皮膚のプロセスを突き止めており、生活年齢より若く見える女性に特有の遺伝子発現パターンを発見した」と述べている。 老化する皮膚の包括的なモデルをつくるため、Dr. Kimballの研究チームは、20歳から74歳までの白人女性158人の日光にさらされた皮膚 (顔面と前腕)
CLOCK遺伝子が人間の脳の進化の秘密を握るのか?
 人間の脳を特別なものにしている分子レベルの秘密を解明しようとして、多くの研究者が、何千年もの間の進化を促してきたプロセス、認知発達に重要な役割を果たした遺伝子などの解明に取り組んできた。さらには人間の体内時計を制御している遺伝子が、脳の進化に重要な人間固有の遺伝子の働きを調節する役割も引き受けていることを示す新しい研究が発表され、この分野に新しい知見が生まれている。
University of Texas (UT) Southwestern, O’Donnell Brain Instituteの研究結果は、脳の機能や、ニューロンが脳の中で所定の位置を見つけるプロセスにCLOCK遺伝子のつくるCLOCKタンパク質が関わる仕組みを解明する道筋を示している。UT Southwestern, Peter O’Donnell Jr. Brain Institute所属の神経科学者、Dr. Genevieve Konopka (写真) は、「特に人間のよく折りたたまれた大型の脳に関して、その進化に重要な遺伝子が研究課題になっている。私達は、CLOCKが概日リズム以外にも様々な遺伝子を調節しているという証拠を見つけており、人間の脳の発達と進化にとって重要な分子的経路の序列の中のキーポイントとして位置づけることができる」と述べている。人間の脳は、人間に最も近い生物のチンパンジーと比べてもはるかに大きい。しかし、脳の認知能力は大きさだけでは決まらず、クジラやイルカなどの哺乳動物は人間より大きい脳を持っている。そのため、人間の脳が他の動物より賢い原因を解明しようと努めてきた。Dr. Konopkaの研究は新皮質という領域に焦点を当てた。新皮質は皮質の中ではもっとも新しく進化した部分と考えられており、独特な折り畳みが特徴で、視覚や聴覚に関連した領域である。2012年、Dr. Konopkaの研
人間の脳を特別なものにしている分子レベルの秘密を解明しようとして、多くの研究者が、何千年もの間の進化を促してきたプロセス、認知発達に重要な役割を果たした遺伝子などの解明に取り組んできた。さらには人間の体内時計を制御している遺伝子が、脳の進化に重要な人間固有の遺伝子の働きを調節する役割も引き受けていることを示す新しい研究が発表され、この分野に新しい知見が生まれている。
University of Texas (UT) Southwestern, O’Donnell Brain Instituteの研究結果は、脳の機能や、ニューロンが脳の中で所定の位置を見つけるプロセスにCLOCK遺伝子のつくるCLOCKタンパク質が関わる仕組みを解明する道筋を示している。UT Southwestern, Peter O’Donnell Jr. Brain Institute所属の神経科学者、Dr. Genevieve Konopka (写真) は、「特に人間のよく折りたたまれた大型の脳に関して、その進化に重要な遺伝子が研究課題になっている。私達は、CLOCKが概日リズム以外にも様々な遺伝子を調節しているという証拠を見つけており、人間の脳の発達と進化にとって重要な分子的経路の序列の中のキーポイントとして位置づけることができる」と述べている。人間の脳は、人間に最も近い生物のチンパンジーと比べてもはるかに大きい。しかし、脳の認知能力は大きさだけでは決まらず、クジラやイルカなどの哺乳動物は人間より大きい脳を持っている。そのため、人間の脳が他の動物より賢い原因を解明しようと努めてきた。Dr. Konopkaの研究は新皮質という領域に焦点を当てた。新皮質は皮質の中ではもっとも新しく進化した部分と考えられており、独特な折り畳みが特徴で、視覚や聴覚に関連した領域である。2012年、Dr. Konopkaの研
極端な寒冷環境への適応進化と特定のがん発生率の関連性が明らかに
 世界的にがんの発生率が上昇していることはよく知られており、また、特定の人口集団や地理的位置で他よりもがんの発生率が高いらしいことも知られている。University of Cyrpus Medical Schoolの研究者、Konstantinos Voskarides, PhDは、「デンマークやノルウェーのように気温の非常に低い地域の人口は世界的にもがん発生率のもっとも高い地域の一つだ」と述べている。彼は、2017年12月5日付Molecular Biology and Evolutionオンライン版に掲載された新論文で新しい仮説を提出しており、それによると、寒冷地や高高地など極端な環境条件への適応とがん発生率上昇との間に進化論的な関係があるとしている。
Dr. Voskaridesは、「この研究結果で、極端な環境に有利な遺伝的変異体が同時にがんにかかりやすい原因になっているという証拠が示されている。低温や高高度などに耐性を持つ細胞がおそらく悪性化する確率も高くなるのだろう。このような効果は、ほとんどのがんは、子供も生まれてしまったくらいの年齢で発症するため、自然淘汰で取り除かれることはまずない」と述べている。この論文は、「Combination of 247 Genome-Wide Association Studies Reveals High Cancer Risk As a Result of Evolutionary Adaptation (247件のゲノムワイド関連研究を総合し、適応進化の結果としてのがんリスク増大を究明)」と題されている。
Dr. Voskaridesは、極地およびスカンジナビア気候地域や高地の低温の影響に的を絞り、特にがんリスクと地域の年平均気温との関係を調べた。その結果、極端な寒冷環境ががんリスクを押し上げていると結論した。その研究に
世界的にがんの発生率が上昇していることはよく知られており、また、特定の人口集団や地理的位置で他よりもがんの発生率が高いらしいことも知られている。University of Cyrpus Medical Schoolの研究者、Konstantinos Voskarides, PhDは、「デンマークやノルウェーのように気温の非常に低い地域の人口は世界的にもがん発生率のもっとも高い地域の一つだ」と述べている。彼は、2017年12月5日付Molecular Biology and Evolutionオンライン版に掲載された新論文で新しい仮説を提出しており、それによると、寒冷地や高高地など極端な環境条件への適応とがん発生率上昇との間に進化論的な関係があるとしている。
Dr. Voskaridesは、「この研究結果で、極端な環境に有利な遺伝的変異体が同時にがんにかかりやすい原因になっているという証拠が示されている。低温や高高度などに耐性を持つ細胞がおそらく悪性化する確率も高くなるのだろう。このような効果は、ほとんどのがんは、子供も生まれてしまったくらいの年齢で発症するため、自然淘汰で取り除かれることはまずない」と述べている。この論文は、「Combination of 247 Genome-Wide Association Studies Reveals High Cancer Risk As a Result of Evolutionary Adaptation (247件のゲノムワイド関連研究を総合し、適応進化の結果としてのがんリスク増大を究明)」と題されている。
Dr. Voskaridesは、極地およびスカンジナビア気候地域や高地の低温の影響に的を絞り、特にがんリスクと地域の年平均気温との関係を調べた。その結果、極端な寒冷環境ががんリスクを押し上げていると結論した。その研究に
細胞外小胞に抗体様RNAナノ粒子を付加した新世代の抗がん剤の開発へ
 細胞外微小胞(extracellular microvesicles)に抗体様RNAナノ粒子を結合させることで、低分子干渉RNA (siRNA) など効果的なRNA薬剤を選択的にがん細胞に向けて送り込めることが新しい研究で示されている。研究チームは動物モデルの3種のがんを対象に、RNAナノテクノロジーを用いて、この実験にRNAナノ粒子を使い、微小なRNA薬剤を搭載した細胞外微小胞をがん細胞に向けて送り込むことに成功した。
2017年12月11日付Nature Nanotechnologyオンライン版に掲載された研究成果が、siRNA、microRNAその他のRNA干渉技術を用いた新世代の抗がん剤の開発に結びつくことも考えられる。この論文は、「Nanoparticle Orientation to Control RNA Loading and Ligand Display on Extracellular Vesicles for Cancer Regression (ナノ粒子配向で細胞外小胞のRNA搭載とリガンド・ディスプレイを制御し、がん退縮を狙う)」と題されている。
この研究は、Ohio State University College of PharmacyとOhio State University Comprehensive Cancer Center – James Cancer Hospital and Solove Research Institute (OSUCCC – James) の研究チームが主導して行った。この研究の研究責任者、College of PharmacyのSylvan G. Frank Endowed Chair ProfessorでOSUCCC – James Translational Therapeutics Program
細胞外微小胞(extracellular microvesicles)に抗体様RNAナノ粒子を結合させることで、低分子干渉RNA (siRNA) など効果的なRNA薬剤を選択的にがん細胞に向けて送り込めることが新しい研究で示されている。研究チームは動物モデルの3種のがんを対象に、RNAナノテクノロジーを用いて、この実験にRNAナノ粒子を使い、微小なRNA薬剤を搭載した細胞外微小胞をがん細胞に向けて送り込むことに成功した。
2017年12月11日付Nature Nanotechnologyオンライン版に掲載された研究成果が、siRNA、microRNAその他のRNA干渉技術を用いた新世代の抗がん剤の開発に結びつくことも考えられる。この論文は、「Nanoparticle Orientation to Control RNA Loading and Ligand Display on Extracellular Vesicles for Cancer Regression (ナノ粒子配向で細胞外小胞のRNA搭載とリガンド・ディスプレイを制御し、がん退縮を狙う)」と題されている。
この研究は、Ohio State University College of PharmacyとOhio State University Comprehensive Cancer Center – James Cancer Hospital and Solove Research Institute (OSUCCC – James) の研究チームが主導して行った。この研究の研究責任者、College of PharmacyのSylvan G. Frank Endowed Chair ProfessorでOSUCCC – James Translational Therapeutics Program
食欲制御は脳神経細胞の一次繊毛でのシグナル伝達に依存と判明
 University of California-San Francisco (UCSF) の研究チームは、脳が体重を調節する能力は、脳の「飢餓回路」が神経細胞の一次繊毛と呼ばれるアンテナ状の構造物を通して信号を伝達する、その独特の形態によるものであることを突き止めた。一次繊毛は、運動繊毛とは異なる器官で、後者は指のような突起物で細胞のコンベヤー・ベルトのような働きをしており、肺や気管のゴミを排出する機能を持っている。
不動性の一次繊毛は、虫垂のように進化の痕跡のようなものと考えられたこともあったが、過去10年、UCSFその他の研究機関の研究で、この一次繊毛が身体の様々な種類のホルモン信号伝達に重要な役割を果たしていることが明らかにされてきた。2018年1月8日付Nature Genetics オンライン版に掲載されたUCSFの新しい研究で、一次繊毛が脳内の信号伝達に重要な役割を果たしていることが示されている。この論文は、「Subcellular Localization of MC4R with ADCY3 at Neuronal Primary Cilia Underlies a Common Pathway for Genetic Predisposition to Obesity (神経細胞の一次繊毛でのMC4RとADCY3の細胞内局在が肥満の遺伝的素因の一般的経路の背景)」と題されている。神経科学者は、脳の信号伝達というとシナプスと呼ばれる部位におけるニューロン間の直接的な化学的または電気的なコミュニケーションと考えることになれてしまっているが、この新しい研究結果では一次繊毛における化学的信号伝達も重要な役割を果たしていることが示されており、このことはこれまで見過ごされてきた。研究者は、さらに、この研究結果から世界的に拡大している肥満傾向に対する新しい治療法の可
University of California-San Francisco (UCSF) の研究チームは、脳が体重を調節する能力は、脳の「飢餓回路」が神経細胞の一次繊毛と呼ばれるアンテナ状の構造物を通して信号を伝達する、その独特の形態によるものであることを突き止めた。一次繊毛は、運動繊毛とは異なる器官で、後者は指のような突起物で細胞のコンベヤー・ベルトのような働きをしており、肺や気管のゴミを排出する機能を持っている。
不動性の一次繊毛は、虫垂のように進化の痕跡のようなものと考えられたこともあったが、過去10年、UCSFその他の研究機関の研究で、この一次繊毛が身体の様々な種類のホルモン信号伝達に重要な役割を果たしていることが明らかにされてきた。2018年1月8日付Nature Genetics オンライン版に掲載されたUCSFの新しい研究で、一次繊毛が脳内の信号伝達に重要な役割を果たしていることが示されている。この論文は、「Subcellular Localization of MC4R with ADCY3 at Neuronal Primary Cilia Underlies a Common Pathway for Genetic Predisposition to Obesity (神経細胞の一次繊毛でのMC4RとADCY3の細胞内局在が肥満の遺伝的素因の一般的経路の背景)」と題されている。神経科学者は、脳の信号伝達というとシナプスと呼ばれる部位におけるニューロン間の直接的な化学的または電気的なコミュニケーションと考えることになれてしまっているが、この新しい研究結果では一次繊毛における化学的信号伝達も重要な役割を果たしていることが示されており、このことはこれまで見過ごされてきた。研究者は、さらに、この研究結果から世界的に拡大している肥満傾向に対する新しい治療法の可
マイクロ流体工学と音波を組み合わせてエキソソームを血液から分離。臨床現場での利用を目指す
 細胞は、エキソソームと呼ばれる膜を持った超微小な包みを分泌し、この包みは体の一箇所から他の箇所に重要なメッセージを運ぶことができる。MITその他の研究機関の研究者らがこのメッセージを捕捉する手法を開発した。この手法はがんや胎児異常などの問題の診断にも用いることができ、そのための新開発の装置はマイクロ流体工学と音波を組み合わせてエキソソームを血液から分離するようになっている。
同グループでは、この技術を携帯できる大きさの装置に組み込むことで臨床現場で患者の血液サンプルを分析し、その場で診断が出せるようにしたいと考えており、そうなれば現在使われている、扱いが難しく、しかも時間のかかる超遠心分離法を必要としなくなる。2017年9月18日付のPNASに掲載された研究論文の首席著者の一人で、MITのDepartment of Materials Science and Engineeringの主任科学研究員、Dr. Ming Daoは、「このエキソソームは、身体に異常があった場合にその異常に固有の物質を含んでいることが多い。そのエキソソームを分離すれば生物学的解析にかけることで、その異常をつきとめることができる」と述べている。この論文の他の首席著者として、シンガポールのNanyang Technological Universityの次期大学総長で、かつてMITのEngineering学部長を務め、現在はMITでVannevar Bush Professor of Engineering Emeritusを務めるDr. Subra Suresh、Duke UniversityのMechanical Engineering and Materials Science教授を務めるDr. Tony Jun Huang、ピッツバーグ市にあるMagee-Women’s Research
細胞は、エキソソームと呼ばれる膜を持った超微小な包みを分泌し、この包みは体の一箇所から他の箇所に重要なメッセージを運ぶことができる。MITその他の研究機関の研究者らがこのメッセージを捕捉する手法を開発した。この手法はがんや胎児異常などの問題の診断にも用いることができ、そのための新開発の装置はマイクロ流体工学と音波を組み合わせてエキソソームを血液から分離するようになっている。
同グループでは、この技術を携帯できる大きさの装置に組み込むことで臨床現場で患者の血液サンプルを分析し、その場で診断が出せるようにしたいと考えており、そうなれば現在使われている、扱いが難しく、しかも時間のかかる超遠心分離法を必要としなくなる。2017年9月18日付のPNASに掲載された研究論文の首席著者の一人で、MITのDepartment of Materials Science and Engineeringの主任科学研究員、Dr. Ming Daoは、「このエキソソームは、身体に異常があった場合にその異常に固有の物質を含んでいることが多い。そのエキソソームを分離すれば生物学的解析にかけることで、その異常をつきとめることができる」と述べている。この論文の他の首席著者として、シンガポールのNanyang Technological Universityの次期大学総長で、かつてMITのEngineering学部長を務め、現在はMITでVannevar Bush Professor of Engineering Emeritusを務めるDr. Subra Suresh、Duke UniversityのMechanical Engineering and Materials Science教授を務めるDr. Tony Jun Huang、ピッツバーグ市にあるMagee-Women’s Research
犬の社会的スキルとオキシトシン感受性
 スエーデンのLinköping Universityの新しい研究によれば、犬が飼い主との接触を求める傾向は、オキシトシン・ホルモン感受性の遺伝的変異と関連しているとのことである。この研究結果はHormones and Behaviorに掲載され、オオカミからペットとしての犬になるまでの過程に新しい知見を加えている。
この記事は、「Intranasal Oxytocin and a Polymorphism in the Oxytocin Receptor Gene Are Associated with Human-Directed Social Behavior in Golden Retriever Dogs (鼻腔内オキシトシンとオキシトシン受容体遺伝子多型がゴールデン・リトリーバーの対人社会行動と関連)」と題されている。野生動物のオオカミから現在のようなペット動物になるまでの過程で犬は人間と協同できる独特な能力を身につけた。その能力の一つの特徴として難しいことが起きた時に「助けを求める」意思のあることが挙げられる。ただし、犬種ごとに大きな違いがあるし、同じ犬種でも個体によって違いがある。Linköping UniversityでProfessor Per Jensenが指導した研究グループは、なぜ犬によって人間と協力関係を結ぶ態度が異なるのかを説明づけられる現象を見つけた。研究グループは、オキシトシン・ホルモンが関わっているのではないかと疑っていた。人間でも動物でも個体の社会性にはオキシトシンが関係していることはよく知られている。オキシトシンの効果は細胞内でオキシトシンと結合している受容体の機能に左右される。これまでの研究で、人間とコミュニケートする犬の能力の違いはオキシトシン受容体のコードを持っている遺伝子の付近の遺伝物質の変異と関連していることが示唆さ
スエーデンのLinköping Universityの新しい研究によれば、犬が飼い主との接触を求める傾向は、オキシトシン・ホルモン感受性の遺伝的変異と関連しているとのことである。この研究結果はHormones and Behaviorに掲載され、オオカミからペットとしての犬になるまでの過程に新しい知見を加えている。
この記事は、「Intranasal Oxytocin and a Polymorphism in the Oxytocin Receptor Gene Are Associated with Human-Directed Social Behavior in Golden Retriever Dogs (鼻腔内オキシトシンとオキシトシン受容体遺伝子多型がゴールデン・リトリーバーの対人社会行動と関連)」と題されている。野生動物のオオカミから現在のようなペット動物になるまでの過程で犬は人間と協同できる独特な能力を身につけた。その能力の一つの特徴として難しいことが起きた時に「助けを求める」意思のあることが挙げられる。ただし、犬種ごとに大きな違いがあるし、同じ犬種でも個体によって違いがある。Linköping UniversityでProfessor Per Jensenが指導した研究グループは、なぜ犬によって人間と協力関係を結ぶ態度が異なるのかを説明づけられる現象を見つけた。研究グループは、オキシトシン・ホルモンが関わっているのではないかと疑っていた。人間でも動物でも個体の社会性にはオキシトシンが関係していることはよく知られている。オキシトシンの効果は細胞内でオキシトシンと結合している受容体の機能に左右される。これまでの研究で、人間とコミュニケートする犬の能力の違いはオキシトシン受容体のコードを持っている遺伝子の付近の遺伝物質の変異と関連していることが示唆さ
カロリー制限がエピジェネティックドリフトを遅らせ、寿命を延ばす可能性が示された
 1世紀近く前、特定動物でカロリー摂取を抑えると寿命が飛躍的に伸びることが突き止められたが、それ以後、数々の研究の積み重ねにもかかわらず、その原因は詳しく解明されていない。Temple University (LKSOM), Lewis Katz School of Medicineの研究グループが難関を乗り越え、解明に向けて一歩を進めた。
2017年9月14日付Nature Communicationsオンライン版に掲載された新研究で、加齢と共にエピゲノムの変化する速度が種全体の寿命と関係があり、カロリー摂取制限でこの変化速度を抑えられることが突き止められ、長寿と関わっている可能性を示しているのである。この研究論文は、「Caloric Restriction Delays Age-Related Methylation Drift (カロリー制限で加齢に伴うメチル化ドリフトを遅らせる)」と題されている。LKSOM のFels Institute for Cancer ResearcのDirectorで、この新研究で主任研究員を務めたJean-Pierre Issa, MDは、「私達の研究で、加齢によるゲノム内のDNAメチル化の得失似独特のパターンを持つエピジェネティックドリフトがヒトよりサルで、またサルよりマウスでより速く進むことが明らかになった」と述べている。この研究結果で、マウスが平均で2,3年しか生きないのに、アカゲザルは約25年、ヒトは70年から80年生きることも説明がつく。DNAメチル化のような化学修飾が哺乳動物の遺伝子を制御しており、遺伝子が起動される時のための目印の役目を果たしており、この現象はエピジェネティックと呼ばれている。Dr. Issaは、「メチル化のパターンは加齢に従って着実にドリフト(漂流)していき、ゲノムの一部ではメチル化が増すのに対して他の部
1世紀近く前、特定動物でカロリー摂取を抑えると寿命が飛躍的に伸びることが突き止められたが、それ以後、数々の研究の積み重ねにもかかわらず、その原因は詳しく解明されていない。Temple University (LKSOM), Lewis Katz School of Medicineの研究グループが難関を乗り越え、解明に向けて一歩を進めた。
2017年9月14日付Nature Communicationsオンライン版に掲載された新研究で、加齢と共にエピゲノムの変化する速度が種全体の寿命と関係があり、カロリー摂取制限でこの変化速度を抑えられることが突き止められ、長寿と関わっている可能性を示しているのである。この研究論文は、「Caloric Restriction Delays Age-Related Methylation Drift (カロリー制限で加齢に伴うメチル化ドリフトを遅らせる)」と題されている。LKSOM のFels Institute for Cancer ResearcのDirectorで、この新研究で主任研究員を務めたJean-Pierre Issa, MDは、「私達の研究で、加齢によるゲノム内のDNAメチル化の得失似独特のパターンを持つエピジェネティックドリフトがヒトよりサルで、またサルよりマウスでより速く進むことが明らかになった」と述べている。この研究結果で、マウスが平均で2,3年しか生きないのに、アカゲザルは約25年、ヒトは70年から80年生きることも説明がつく。DNAメチル化のような化学修飾が哺乳動物の遺伝子を制御しており、遺伝子が起動される時のための目印の役目を果たしており、この現象はエピジェネティックと呼ばれている。Dr. Issaは、「メチル化のパターンは加齢に従って着実にドリフト(漂流)していき、ゲノムの一部ではメチル化が増すのに対して他の部
新テクノロジーでカビのゲノムを解析し、新薬候補を判定
 カビ類は創薬にとって天然分子の豊かな宝庫ではあるが、様々な困難もあり、製薬会社もこの宝庫に手を付けることをためらってきた。ところが現在、研究者はゲノム解析、データ解析を用いてカビが産生する分子を効率的に選別し、新しい医薬、あるいは新世代のペニシリンをさえ見つける手がかりを見つける技術を開発した。
Northwestern University、University of Wisconsin-Madison、それにバイオテック会社のIntact Genomicsの研究者らが共同で行った研究結果が2017年6月12日付Nature Chemical Biologyオンライン版に掲載されている。この論文は、「A Scalable Platform to Identify Fungal Secondary Metabolites and Their Gene Clusters (カビの二次代謝産物とその遺伝子クラスターを同定するためのスケーラブル・プラットフォーム)」と題されている。Proteomics Center of ExcellenceのDirector、Weinberg College of Arts and SciencesおよびDivision of Hematology and Oncologyの教授を兼任するNeil Kelleher (写真), PhDは、「創薬は自然に還るべきだし、カビは新薬の宝庫だ。私達の研究でも、新薬の無尽蔵の源泉を提供するために工業レベルにまでスケールアップ可能な新しいプラットフォームを樹立した。私達の手法は、ペニシリンは新しく再発見する代わりに、体系的に新しく貴重な化合物を探しだし、その化合物を産んだ遺伝子を突き止めることだ。そこからさらに深く追究することができる」と述べている。研究者達は、何千あるいは何百万という数のカビ由来の
カビ類は創薬にとって天然分子の豊かな宝庫ではあるが、様々な困難もあり、製薬会社もこの宝庫に手を付けることをためらってきた。ところが現在、研究者はゲノム解析、データ解析を用いてカビが産生する分子を効率的に選別し、新しい医薬、あるいは新世代のペニシリンをさえ見つける手がかりを見つける技術を開発した。
Northwestern University、University of Wisconsin-Madison、それにバイオテック会社のIntact Genomicsの研究者らが共同で行った研究結果が2017年6月12日付Nature Chemical Biologyオンライン版に掲載されている。この論文は、「A Scalable Platform to Identify Fungal Secondary Metabolites and Their Gene Clusters (カビの二次代謝産物とその遺伝子クラスターを同定するためのスケーラブル・プラットフォーム)」と題されている。Proteomics Center of ExcellenceのDirector、Weinberg College of Arts and SciencesおよびDivision of Hematology and Oncologyの教授を兼任するNeil Kelleher (写真), PhDは、「創薬は自然に還るべきだし、カビは新薬の宝庫だ。私達の研究でも、新薬の無尽蔵の源泉を提供するために工業レベルにまでスケールアップ可能な新しいプラットフォームを樹立した。私達の手法は、ペニシリンは新しく再発見する代わりに、体系的に新しく貴重な化合物を探しだし、その化合物を産んだ遺伝子を突き止めることだ。そこからさらに深く追究することができる」と述べている。研究者達は、何千あるいは何百万という数のカビ由来の
脂肪組織が様々な形でがんの進行に影響と結論
 ある研究チームが総合的なレビューを行い、身体の脂肪組織が、その脂肪のタイプや体内の位置により、様々な形でがんの進行に影響しているようだと報告している。このレビューはAmerican Association for Cancer Research (AACR) のジャーナル、Cancer Prevention Researchの2017年9月号に掲載されている。この論文は、「Signals from the Adipose Microenvironment and the Obesity-Cancer Link—A Systematic Review (脂肪組織の微小環境からの信号と肥満-がんの関係—システマティック・レビュー)」と題されている。
このレビューはソルト・レーク・シティのUniversity of Utah, Huntsman Cancer Institute, Population SciencesのSenior Director, Cornelia M. Ulrich, PhDが首席著者を務めた。Dr. Ulrichは、「肥満体は世界中で急激に増えており、がんの主要リスク要因の一つと認識されるようになっている。事実、16種のがんが肥満と結びついている。肥満とがんとの間に潜む機序を突き止めることが喫緊の重要事だ」と述べている。また、「以前の研究で、脂肪がいくつかの形でがん発生の一因になっていることが示されている」と述べている。たとえば、肥満が炎症のリスクを増大させるが、その炎症はかなり前からがんと関連があるとされている。さらに、肥満は、がん細胞代謝や免疫クリアランスに影響すると考えられており、いずれもがんの進行とひろがりを促進する可能性がある。また、Dr. Ulrichは、「脂肪とがん化の関係は、『シグナル混信』、つまり、2つの異なるタイプの細胞の間で複数の
ある研究チームが総合的なレビューを行い、身体の脂肪組織が、その脂肪のタイプや体内の位置により、様々な形でがんの進行に影響しているようだと報告している。このレビューはAmerican Association for Cancer Research (AACR) のジャーナル、Cancer Prevention Researchの2017年9月号に掲載されている。この論文は、「Signals from the Adipose Microenvironment and the Obesity-Cancer Link—A Systematic Review (脂肪組織の微小環境からの信号と肥満-がんの関係—システマティック・レビュー)」と題されている。
このレビューはソルト・レーク・シティのUniversity of Utah, Huntsman Cancer Institute, Population SciencesのSenior Director, Cornelia M. Ulrich, PhDが首席著者を務めた。Dr. Ulrichは、「肥満体は世界中で急激に増えており、がんの主要リスク要因の一つと認識されるようになっている。事実、16種のがんが肥満と結びついている。肥満とがんとの間に潜む機序を突き止めることが喫緊の重要事だ」と述べている。また、「以前の研究で、脂肪がいくつかの形でがん発生の一因になっていることが示されている」と述べている。たとえば、肥満が炎症のリスクを増大させるが、その炎症はかなり前からがんと関連があるとされている。さらに、肥満は、がん細胞代謝や免疫クリアランスに影響すると考えられており、いずれもがんの進行とひろがりを促進する可能性がある。また、Dr. Ulrichは、「脂肪とがん化の関係は、『シグナル混信』、つまり、2つの異なるタイプの細胞の間で複数の
Linus Paulingは今も生きている – ビタミンCが幹細胞機能を調節し、白血病の進行を抑制することが突き止められる
 幹細胞代謝についてはよく知られていないが、University of Texas (UT) Southwestern (CRI) のChildren’s Medical Center Research Institute の新しい研究で、幹細胞が異常に高いレベルのビタミンCを吸収し、そのビタミンCが幹細胞の機能を調節し、また、白血病の進行を抑制することが突き止められている。CRIのDirectorを務めるDr. Sean Morrison は、「体のアスコルビン酸塩 (ビタミンC) 量が少ないとがん発症リスクが高まることは知られていたが、その理由についてはよく分かっていなかった。今回の研究で少なくとも造血系については幾分か解明することができた」と述べている。代謝分析にはかなりの数の細胞を必要とするが、一方で組織内の幹細胞の数は非常に少ないことから、これまで幹細胞代謝の研究は困難だった。
2017年8月21日付Nature誌オンライン版で発表された研究の過程で開発されたテクニックにより、幹細胞のように非常に数の少ない細胞でもごく普通に代謝量を測定することが可能になった。このテクニックの採用により、骨髄の全てのタイプの造血細胞がそれぞれ独特の代謝特性を持っており、栄養の摂取と利用に違いのあることが突き止められた。幹細胞の主要な代謝特性の一つとして、並外れて多量のアスコルビン酸塩を吸収することが挙げられる。研究チームは、幹細胞の機能にアスコルビン酸塩が重要なのかどうかを突き止めるため、グロノラクトン・オキシダーゼ (Gulo) 欠乏症のマウスを使って調べた。Guloは、人間を除き、マウスを含めたほとんどの哺乳動物が体内でアスコルビン酸塩を合成するために必要とする酵素である。この酵素を持たないGulo欠乏マウスは、人間の場合と同じようにアスコルビン酸塩を食物を通して外から摂取し
幹細胞代謝についてはよく知られていないが、University of Texas (UT) Southwestern (CRI) のChildren’s Medical Center Research Institute の新しい研究で、幹細胞が異常に高いレベルのビタミンCを吸収し、そのビタミンCが幹細胞の機能を調節し、また、白血病の進行を抑制することが突き止められている。CRIのDirectorを務めるDr. Sean Morrison は、「体のアスコルビン酸塩 (ビタミンC) 量が少ないとがん発症リスクが高まることは知られていたが、その理由についてはよく分かっていなかった。今回の研究で少なくとも造血系については幾分か解明することができた」と述べている。代謝分析にはかなりの数の細胞を必要とするが、一方で組織内の幹細胞の数は非常に少ないことから、これまで幹細胞代謝の研究は困難だった。
2017年8月21日付Nature誌オンライン版で発表された研究の過程で開発されたテクニックにより、幹細胞のように非常に数の少ない細胞でもごく普通に代謝量を測定することが可能になった。このテクニックの採用により、骨髄の全てのタイプの造血細胞がそれぞれ独特の代謝特性を持っており、栄養の摂取と利用に違いのあることが突き止められた。幹細胞の主要な代謝特性の一つとして、並外れて多量のアスコルビン酸塩を吸収することが挙げられる。研究チームは、幹細胞の機能にアスコルビン酸塩が重要なのかどうかを突き止めるため、グロノラクトン・オキシダーゼ (Gulo) 欠乏症のマウスを使って調べた。Guloは、人間を除き、マウスを含めたほとんどの哺乳動物が体内でアスコルビン酸塩を合成するために必要とする酵素である。この酵素を持たないGulo欠乏マウスは、人間の場合と同じようにアスコルビン酸塩を食物を通して外から摂取し
2017年Lasker-DeBakey Clinical Medical Research Award は、HPVによって引き起こされる子宮頸がんなど、がん予防のためのHPVワクチンの開発を可能にした技術的革新を果たしたNCIのDouglas R. LowyとJohn T. Schillerに贈られた
 2017年Lasker-DeBakey Clinical Medical Research Awardは、子宮頸がんその他のがんを予防するヒト・パピローマウイルス (HPV) ワクチン開発を可能にする技術の進歩に携わった2人の科学者を顕彰した。Dr. Douglas R. LowyとDr. John T. Schiller (いずれもNational Cancer Institute所属) は、大きな公衆衛生問題に取り組み、大胆ながら計算されたアプローチで圧倒的な困難を乗り越えた。
2人は、女性のがんとしては世界的にも発生率第4位の子宮頸がんや、HPVによって引き起こされる他の悪性腫瘍、疾患の発生率と死亡率を引き下げる安全で効果的なワクチンの設計図をいくつか開発した。毎年新しく50万人を超える女性が子宮頸がんと診断され、毎年25万人を超える女性がこの悪性腫瘍のために亡くなっている。2008年にノーベル生理学・医学賞を受賞したDr. Harald zur Hausenは、1980年代にこの疾患と特定タイプのHPVの感染との関係を突き止めている。その結果、子宮頸がんの70%程度がHPV16とHPV18によるものと判明しており、残り30%は10種の他のタイプのHPVによるものと突き止められている。さらに、HPV16、HPV18,その他の「ハイリスク」HPVは、外陰部、膣、陰茎、肛門、咽喉などのがんの原因になっている。 他のHPVファミリーには陰部疣贅の原因になるものもあり、HPVウイルスは性行為によって伝染するが、通常、感染症状そのものは自然に治る。ところが、中にはしつこいものもあり、また、ハイリスクHPVはがん遺伝子を持っており、その活動が宿主細胞の無制限の増殖につながる。正常細胞ががん細胞に変化するには少なくとも15年、通常はそれ以上の年月がかかる。1990年代初め頃
2017年Lasker-DeBakey Clinical Medical Research Awardは、子宮頸がんその他のがんを予防するヒト・パピローマウイルス (HPV) ワクチン開発を可能にする技術の進歩に携わった2人の科学者を顕彰した。Dr. Douglas R. LowyとDr. John T. Schiller (いずれもNational Cancer Institute所属) は、大きな公衆衛生問題に取り組み、大胆ながら計算されたアプローチで圧倒的な困難を乗り越えた。
2人は、女性のがんとしては世界的にも発生率第4位の子宮頸がんや、HPVによって引き起こされる他の悪性腫瘍、疾患の発生率と死亡率を引き下げる安全で効果的なワクチンの設計図をいくつか開発した。毎年新しく50万人を超える女性が子宮頸がんと診断され、毎年25万人を超える女性がこの悪性腫瘍のために亡くなっている。2008年にノーベル生理学・医学賞を受賞したDr. Harald zur Hausenは、1980年代にこの疾患と特定タイプのHPVの感染との関係を突き止めている。その結果、子宮頸がんの70%程度がHPV16とHPV18によるものと判明しており、残り30%は10種の他のタイプのHPVによるものと突き止められている。さらに、HPV16、HPV18,その他の「ハイリスク」HPVは、外陰部、膣、陰茎、肛門、咽喉などのがんの原因になっている。 他のHPVファミリーには陰部疣贅の原因になるものもあり、HPVウイルスは性行為によって伝染するが、通常、感染症状そのものは自然に治る。ところが、中にはしつこいものもあり、また、ハイリスクHPVはがん遺伝子を持っており、その活動が宿主細胞の無制限の増殖につながる。正常細胞ががん細胞に変化するには少なくとも15年、通常はそれ以上の年月がかかる。1990年代初め頃
Johns Hopkins病院の研究: 早期膵臓がんの液相生検で、がん固有のDNAとタンパク質マーカーを検出
 Johns Hopkins病院の研究チームは、早期膵臓がんのがん固有のDNAとタンパク質バイオマーカーを検出する血液検査法の開発を発表した。複合「液相生検」で、早期膵臓がん患者221人の血液サンプルのバイオマーカーを検出したのである。
2017年9月4日付PNAS誌オンライン版に論文が掲載されたこの研究で、DNAとDNAの産物であるタンパク質との双方のマーカーの検出で疾患を判定する方法は、DNAのみの検出よりも2倍も正確であることを示している。そのような液相生検は、血液中を無数の正常なDNAが流れる中からがん固有のDNA分子を拾い上げることを狙いとしている。がんはその突然変異したDNAを血流中に放出する傾向があるため、ゲノム・シーケンシング・ツールを使って血液をふるいにかけると、そのようながん固有のDNAを見つけることができる。Johns Hopkins University School of MedicineのAssistant Professor of Surgeryを務めるJin He, MDは、「早期膵臓がんは、ほとんどの場合イメージング・スキャンの際に偶然発見されるだけで通常は何の症状も見せない。その結果、しばしばかなり進行してから発見されるため、切除、手術を行うことが難しい状態になっている」と述べている。Dr. Heは、「過去30年間、切除可能な段階でがんを発見することに関してはほとんど進歩を見せていない。この検査法の効力がもっと大規模な研究で確かめられれば、早期の症候を見せない膵臓がんの発見に用いることができるようになる」と述べている。また、研究チームは、「この検査法はまだ研究室の外に持ち出せる段階ではないが、がんから血液中に放出されるタイプの突然変異DNAはきわめてがん固有のものだ」としている。ジョンズ・ホプキンス・キンメルがんセンターのルードヴィヒ・セ
Johns Hopkins病院の研究チームは、早期膵臓がんのがん固有のDNAとタンパク質バイオマーカーを検出する血液検査法の開発を発表した。複合「液相生検」で、早期膵臓がん患者221人の血液サンプルのバイオマーカーを検出したのである。
2017年9月4日付PNAS誌オンライン版に論文が掲載されたこの研究で、DNAとDNAの産物であるタンパク質との双方のマーカーの検出で疾患を判定する方法は、DNAのみの検出よりも2倍も正確であることを示している。そのような液相生検は、血液中を無数の正常なDNAが流れる中からがん固有のDNA分子を拾い上げることを狙いとしている。がんはその突然変異したDNAを血流中に放出する傾向があるため、ゲノム・シーケンシング・ツールを使って血液をふるいにかけると、そのようながん固有のDNAを見つけることができる。Johns Hopkins University School of MedicineのAssistant Professor of Surgeryを務めるJin He, MDは、「早期膵臓がんは、ほとんどの場合イメージング・スキャンの際に偶然発見されるだけで通常は何の症状も見せない。その結果、しばしばかなり進行してから発見されるため、切除、手術を行うことが難しい状態になっている」と述べている。Dr. Heは、「過去30年間、切除可能な段階でがんを発見することに関してはほとんど進歩を見せていない。この検査法の効力がもっと大規模な研究で確かめられれば、早期の症候を見せない膵臓がんの発見に用いることができるようになる」と述べている。また、研究チームは、「この検査法はまだ研究室の外に持ち出せる段階ではないが、がんから血液中に放出されるタイプの突然変異DNAはきわめてがん固有のものだ」としている。ジョンズ・ホプキンス・キンメルがんセンターのルードヴィヒ・セ
唾液タンパク質 (MUC7) の進化史から、現生人類と古代のゴースト人類との同系交配を示唆。MUC7が口腔マイクロバイオーム組成のカギ
 唾液の分析から、サブサハラ・アフリカに生活する現生人類の先祖の遺伝物質に今は絶滅した古代の「ゴースト」人類の片鱗を発見。また、その研究から、異なる古代人類の間の性的接触もまれではなかったことを示す証拠がさらに付け加えられた。
これまでの研究で、アジア、ヨーロッパの現生人類の祖先がネアンデルタールやデニソワ人など旧人類と同系交配していたと判断されている。最近の遺伝子解析で古代アフリカ人が他の初期ヒト科人類と交雑していたことを示す証拠が次々と見つかっているが、この新研究もその一つである。University at Buffalo (UB), College of Arts and SciencesでAssistant Professor of Biological Sciencesを務めるOmer Gokcumen, PhDは、「初期ヒト科人類の間で同系交配は例外ではなく、普通のことだったようだ。私達の研究では、唾液に含まれているMUC7と呼ばれる重要なムチン・タンパク質の進化を調べた。そのタンパク質のコードを持っている遺伝子の履歴を重点に調べた結果、現代のサブサハラ・アフリカン人に古代人類の混合物の存在が確認できた」と述べている。この研究論文は、2017年7月21日付Molecular Biology and Evolutionオンライン版に掲載されている。Dr. Gokcumen と、UBのSchool of Dental MedicineでProfessor of Oral Biologyを務めるStefan Ruhl, DDS, PhD.がその研究を指導した。このオープンアクセス論文は、「Archaic Hominin Introgression in Africa Contributes to Functional Salivary MUC7 Genetic Var
唾液の分析から、サブサハラ・アフリカに生活する現生人類の先祖の遺伝物質に今は絶滅した古代の「ゴースト」人類の片鱗を発見。また、その研究から、異なる古代人類の間の性的接触もまれではなかったことを示す証拠がさらに付け加えられた。
これまでの研究で、アジア、ヨーロッパの現生人類の祖先がネアンデルタールやデニソワ人など旧人類と同系交配していたと判断されている。最近の遺伝子解析で古代アフリカ人が他の初期ヒト科人類と交雑していたことを示す証拠が次々と見つかっているが、この新研究もその一つである。University at Buffalo (UB), College of Arts and SciencesでAssistant Professor of Biological Sciencesを務めるOmer Gokcumen, PhDは、「初期ヒト科人類の間で同系交配は例外ではなく、普通のことだったようだ。私達の研究では、唾液に含まれているMUC7と呼ばれる重要なムチン・タンパク質の進化を調べた。そのタンパク質のコードを持っている遺伝子の履歴を重点に調べた結果、現代のサブサハラ・アフリカン人に古代人類の混合物の存在が確認できた」と述べている。この研究論文は、2017年7月21日付Molecular Biology and Evolutionオンライン版に掲載されている。Dr. Gokcumen と、UBのSchool of Dental MedicineでProfessor of Oral Biologyを務めるStefan Ruhl, DDS, PhD.がその研究を指導した。このオープンアクセス論文は、「Archaic Hominin Introgression in Africa Contributes to Functional Salivary MUC7 Genetic Var
短くなったテロメアの修復を促すTERRA RNA
 Institute of Molecular Biology (IMB) と Johannes Gutenberg University Mainz (JGU) の研究チームが、染色体の末端を保護しているテロメアの秘密をさらに明らかにした。TERRAと呼ばれる種類のRNA分子が、極端に短くなり、壊れたりしたテロメアを、補修するように機能することを発見したのである。2017年6月29日付Cell誌に掲載された研究論文は、加齢やがんにおける細胞の老化や生存を調整する細胞内のプロセスへの理解をさらに深めている。
この論文は、「Telomere Length Determines TERRA and R-1 Loop Regulation Through the Cell Cycle (細胞周期を通じてテロメア長がTERRAとR-Loopの調整を規定)」と題されている。靴紐の両端のプラスチック・チューブが紐の撚りのほぐれるのを防いでいるように、テロメアも染色体の端末を保護している。ところが細胞の全寿命を通じてテロメアは細胞分裂のつど短くなり、末端保護も次第に効果が薄れていく。テロメアが短くなりすぎると、細胞はそれを遺伝物質が損なわれた信号と受け取り、それ以上分裂しなくなる。テロメアの短縮と細胞分裂減少は加齢の明確な特徴であり、加齢化の一因とも考えられている。同時に、テロメアの短縮はがんに対する防御機序とも考えられる。なぜなら、きわめて増殖力の強いがん細胞はテロメアが短くならなければ分裂する一方だからである。したがって、テロメアの短縮は両刃の剣であり、加齢とがん防止の間で微妙なバランスを取らなければならないのである。細胞の寿命が尽きる前に不用意な原因でテロメアが短くなった場合、テロメアを修復しないと細胞の老化が早まってしまう。JGU Institute for Develop
Institute of Molecular Biology (IMB) と Johannes Gutenberg University Mainz (JGU) の研究チームが、染色体の末端を保護しているテロメアの秘密をさらに明らかにした。TERRAと呼ばれる種類のRNA分子が、極端に短くなり、壊れたりしたテロメアを、補修するように機能することを発見したのである。2017年6月29日付Cell誌に掲載された研究論文は、加齢やがんにおける細胞の老化や生存を調整する細胞内のプロセスへの理解をさらに深めている。
この論文は、「Telomere Length Determines TERRA and R-1 Loop Regulation Through the Cell Cycle (細胞周期を通じてテロメア長がTERRAとR-Loopの調整を規定)」と題されている。靴紐の両端のプラスチック・チューブが紐の撚りのほぐれるのを防いでいるように、テロメアも染色体の端末を保護している。ところが細胞の全寿命を通じてテロメアは細胞分裂のつど短くなり、末端保護も次第に効果が薄れていく。テロメアが短くなりすぎると、細胞はそれを遺伝物質が損なわれた信号と受け取り、それ以上分裂しなくなる。テロメアの短縮と細胞分裂減少は加齢の明確な特徴であり、加齢化の一因とも考えられている。同時に、テロメアの短縮はがんに対する防御機序とも考えられる。なぜなら、きわめて増殖力の強いがん細胞はテロメアが短くならなければ分裂する一方だからである。したがって、テロメアの短縮は両刃の剣であり、加齢とがん防止の間で微妙なバランスを取らなければならないのである。細胞の寿命が尽きる前に不用意な原因でテロメアが短くなった場合、テロメアを修復しないと細胞の老化が早まってしまう。JGU Institute for Develop
瞑想やヨガがストレス遺伝子の発現を変化させるとの新研究論文
 瞑想、ヨガ、太極拳など心身介入療法 (MBI) は単に心身をリラックスさせてくれるだけではない。Coventry、Radboud両大学の研究によれば、病気やうつ病を引き起こすDNAの分子反応を逆転させてくれるらしいのである。2017年6月16日付Frontiers in Immunologyオンライン版に掲載されたレビュー論文は、マインドフルネスやヨガなど様々なMBIが遺伝子の挙動に与える影響について過去10年間の研究をレビューしている。
このオープンアクセス・レビュー論文は、「What Is the Molecular Signature of Mind–Body Interventions? A Systematic Review of Gene Expression Changes Induced by Meditation and Related Practices (心身介入療法の分子指標は何か。瞑想その他関連実践による遺伝子発現の変化の体系的な考察)」と題されている。両大学の研究者は、846人の被験者を対象にした過去11年間の18件の研究をすべて調べた結果、MBIの実践の結果、体内で一定パターンの分子レベルの変化が起きており、その分子レベルの変化が心身の健康に利益をもたらす仕組みがつかめたとしている。研究チームは、遺伝子発現、つまり、身体、脳、免疫系などの生体的な構成を左右するタンパク質を産生する遺伝子がどのように影響を受けるかということに注目した。
人が強いストレス状況にさらされると、闘争逃走反応を司る交感神経系 (SNS) が刺激され、これが、遺伝子発現を調節する核内因子カッパB (NF-kB) という分子の産生を増やす。NF-kBはストレスに対応し、細胞レベルで炎症を引き起こすサイトカインと呼ばれるタンパク質を産生する遺伝子を起動する。この反応は短時間
瞑想、ヨガ、太極拳など心身介入療法 (MBI) は単に心身をリラックスさせてくれるだけではない。Coventry、Radboud両大学の研究によれば、病気やうつ病を引き起こすDNAの分子反応を逆転させてくれるらしいのである。2017年6月16日付Frontiers in Immunologyオンライン版に掲載されたレビュー論文は、マインドフルネスやヨガなど様々なMBIが遺伝子の挙動に与える影響について過去10年間の研究をレビューしている。
このオープンアクセス・レビュー論文は、「What Is the Molecular Signature of Mind–Body Interventions? A Systematic Review of Gene Expression Changes Induced by Meditation and Related Practices (心身介入療法の分子指標は何か。瞑想その他関連実践による遺伝子発現の変化の体系的な考察)」と題されている。両大学の研究者は、846人の被験者を対象にした過去11年間の18件の研究をすべて調べた結果、MBIの実践の結果、体内で一定パターンの分子レベルの変化が起きており、その分子レベルの変化が心身の健康に利益をもたらす仕組みがつかめたとしている。研究チームは、遺伝子発現、つまり、身体、脳、免疫系などの生体的な構成を左右するタンパク質を産生する遺伝子がどのように影響を受けるかということに注目した。
人が強いストレス状況にさらされると、闘争逃走反応を司る交感神経系 (SNS) が刺激され、これが、遺伝子発現を調節する核内因子カッパB (NF-kB) という分子の産生を増やす。NF-kBはストレスに対応し、細胞レベルで炎症を引き起こすサイトカインと呼ばれるタンパク質を産生する遺伝子を起動する。この反応は短時間
ブロッコリ抽出物が2型糖尿病の血糖値コントロールを改善
 ある研究チームが、ブロッコリに多く含まれている抗酸化物質が抗糖尿病物質でもあることを突き止めた。糖尿病患者を対象とした研究で、参加者にスルフォラファンを多く含むブロッコリ抽出物を食べさせたところ、血糖値が大幅に低下したということだ。スエーデンのUniversity of Gothenburg, Metabolic Physiology講師を務め、Lund University Diabetes Centreに所属するDr. Anders Rosengrenは、「これが既存の治療薬に対する貴重なサプリメントになる可能性がある」と述べている。
2017年6月14日付Science Translational Medicineに掲載された研究論文は、Sahlgrenska Academy、University of Gothenburg、Lund UniversityのFaculty of Medicineが共同で長年研究を続けてきた成果である。オープンアクセスとして掲載されたこの研究論文は、「Sulforaphane Reduces Hepatic Glucose Production and Improves Glucose Control in Patients with Type 2 Diabetes (スルフォラファンが2型糖尿病患者の肝糖産生を抑え、血糖抑制改善)」と題されている。この研究の目的は、2型糖尿病の重大なメカニズムである肝臓のブドウ糖産生亢進を抑制する、新しい治療薬の発見にあった。標準的な治療薬のmetforminもまさしくその薬効を持っているが、消化器系の副作用を引き起こしやすく、また腎機能が甚だしく衰えている場合には投与できないため、この薬剤を使えない糖尿病患者も多い。研究チームは、まず糖尿病患者の肝臓の遺伝子変化のマッピングから始めた。
マッピン
ある研究チームが、ブロッコリに多く含まれている抗酸化物質が抗糖尿病物質でもあることを突き止めた。糖尿病患者を対象とした研究で、参加者にスルフォラファンを多く含むブロッコリ抽出物を食べさせたところ、血糖値が大幅に低下したということだ。スエーデンのUniversity of Gothenburg, Metabolic Physiology講師を務め、Lund University Diabetes Centreに所属するDr. Anders Rosengrenは、「これが既存の治療薬に対する貴重なサプリメントになる可能性がある」と述べている。
2017年6月14日付Science Translational Medicineに掲載された研究論文は、Sahlgrenska Academy、University of Gothenburg、Lund UniversityのFaculty of Medicineが共同で長年研究を続けてきた成果である。オープンアクセスとして掲載されたこの研究論文は、「Sulforaphane Reduces Hepatic Glucose Production and Improves Glucose Control in Patients with Type 2 Diabetes (スルフォラファンが2型糖尿病患者の肝糖産生を抑え、血糖抑制改善)」と題されている。この研究の目的は、2型糖尿病の重大なメカニズムである肝臓のブドウ糖産生亢進を抑制する、新しい治療薬の発見にあった。標準的な治療薬のmetforminもまさしくその薬効を持っているが、消化器系の副作用を引き起こしやすく、また腎機能が甚だしく衰えている場合には投与できないため、この薬剤を使えない糖尿病患者も多い。研究チームは、まず糖尿病患者の肝臓の遺伝子変化のマッピングから始めた。
マッピン
出生時のDNAメチル化 (エピジェネティック) 変化が後の素行問題に影響か
 King's College LondonとUniversity of Bristolの研究チームの新研究によれば、耽溺的な性格や攻撃的な性格と関わる遺伝子に出産時に起きるエピジェネティックな変化が、児童の素行問題と関わっている可能性が示されている。イギリスでは、児童治療専門家に紹介状が送られるもっとも多い理由は、ケンカ、ウソ、盗みなどの素行問題 (Conduct problems : CP) であり、その損失は莫大である。
10歳未満で素行問題を引き起こす (早発性CPと呼ばれる) 児童は、生涯にわたる重大で慢性的な反社会的行動のリスクもはるかに高く、犯罪、福祉依存、医療ニーズなど大きな社会コストにつながる。素行問題には遺伝因子が大きく影響していることはよく知られており、問題を起こす児童と起こさない児童の違いの50%から80%程が遺伝因子によるものと考えられている。しかし、遺伝因子と環境的影響が、特に胎児の発育期において、どのようにからみあって成長後の素行問題リスクを高めるのかということについてはほとんど分かっていない。DNAメチル化で起きている変化は、遺伝子スイッチのオン・オフを決めるエピジェネティックなプロセスであり、それを理解することが成長後の素行問題の効果的な予防法を開発する手がかりになる可能性がある。2017年6月12日付Development & Psychopathologyオンライン版で発表されたこの研究論文は、BristolのAvon Longitudinal Study of Parents and Children (ALSPAC) のデータを用いて、出生時のDNAメチル化と4歳から13歳までの児童の素行問題との関連を調べている。また、研究チームはそれまで早発性の素行問題と関係があるとされていた妊婦の食生活、喫煙、飲酒、日常的なストレ
King's College LondonとUniversity of Bristolの研究チームの新研究によれば、耽溺的な性格や攻撃的な性格と関わる遺伝子に出産時に起きるエピジェネティックな変化が、児童の素行問題と関わっている可能性が示されている。イギリスでは、児童治療専門家に紹介状が送られるもっとも多い理由は、ケンカ、ウソ、盗みなどの素行問題 (Conduct problems : CP) であり、その損失は莫大である。
10歳未満で素行問題を引き起こす (早発性CPと呼ばれる) 児童は、生涯にわたる重大で慢性的な反社会的行動のリスクもはるかに高く、犯罪、福祉依存、医療ニーズなど大きな社会コストにつながる。素行問題には遺伝因子が大きく影響していることはよく知られており、問題を起こす児童と起こさない児童の違いの50%から80%程が遺伝因子によるものと考えられている。しかし、遺伝因子と環境的影響が、特に胎児の発育期において、どのようにからみあって成長後の素行問題リスクを高めるのかということについてはほとんど分かっていない。DNAメチル化で起きている変化は、遺伝子スイッチのオン・オフを決めるエピジェネティックなプロセスであり、それを理解することが成長後の素行問題の効果的な予防法を開発する手がかりになる可能性がある。2017年6月12日付Development & Psychopathologyオンライン版で発表されたこの研究論文は、BristolのAvon Longitudinal Study of Parents and Children (ALSPAC) のデータを用いて、出生時のDNAメチル化と4歳から13歳までの児童の素行問題との関連を調べている。また、研究チームはそれまで早発性の素行問題と関係があるとされていた妊婦の食生活、喫煙、飲酒、日常的なストレ
ハンチントン病の致命的タンパク質蓄積を減少させるターゲット候補が明らかに
 アルツハイマー、ハンチントン、パーキンソン、この3人の人名は、いずれも脳のニューロンを損壊させ、その部位全体を萎縮させた上に死に至らしめる病気の名前として永久に記憶されることになる。この3つの病気だけでなく、神経変性疾患と呼ばれる病気のほとんどが、有毒タンパク質の蓄積で最終的にニューロンが死滅すると関連して捉えられている。
しかし、Gladstone Institutesの研究者チームが、この種の病気の進行は有毒物質の蓄積が原因なのではなく、個々のニューロンが毒素を排出できなくなるところに原因があることを突き止めた。さらに、同チームは、ニューロンの毒素を排出する能力を増強し、それによって、疾患の致命的な影響から脳を守る治療ターゲットを突き止めている。2013年7月21日付オンライン版「Nature Chemical Biology」に掲載された記事で、Gladstone研究室の同研究チームの一人で研究員のSteve Finkbeiner, M.D., Ph.D.は、新しく開発された技術で初めて、個々のニューロンが有毒なタンパク質の蓄積に対処する様子を見ることができたと述べている。グループは研究対象をハンチントン病のモデルに絞り、脳内の異なるタイプのニューロンがそれぞれ毒素の蓄積に異なる反応を示し、うまく対応できるニューロンもあればできないニューロンもあることを観察した。その成果は、ハンチントン病によってある部位のニューロンは死滅し、他の部位のニューロンは生き延びるということが起きるのはなぜかという問題にヒントを与えてくれている。GladstoneのTaube-Koret Center for Neurodegenerative Disease Researchの長を務めるDr. Finkbeinerは、「ハンチントン病は、遺伝性の致命的な疾患で、筋肉協調、認識力、人
アルツハイマー、ハンチントン、パーキンソン、この3人の人名は、いずれも脳のニューロンを損壊させ、その部位全体を萎縮させた上に死に至らしめる病気の名前として永久に記憶されることになる。この3つの病気だけでなく、神経変性疾患と呼ばれる病気のほとんどが、有毒タンパク質の蓄積で最終的にニューロンが死滅すると関連して捉えられている。
しかし、Gladstone Institutesの研究者チームが、この種の病気の進行は有毒物質の蓄積が原因なのではなく、個々のニューロンが毒素を排出できなくなるところに原因があることを突き止めた。さらに、同チームは、ニューロンの毒素を排出する能力を増強し、それによって、疾患の致命的な影響から脳を守る治療ターゲットを突き止めている。2013年7月21日付オンライン版「Nature Chemical Biology」に掲載された記事で、Gladstone研究室の同研究チームの一人で研究員のSteve Finkbeiner, M.D., Ph.D.は、新しく開発された技術で初めて、個々のニューロンが有毒なタンパク質の蓄積に対処する様子を見ることができたと述べている。グループは研究対象をハンチントン病のモデルに絞り、脳内の異なるタイプのニューロンがそれぞれ毒素の蓄積に異なる反応を示し、うまく対応できるニューロンもあればできないニューロンもあることを観察した。その成果は、ハンチントン病によってある部位のニューロンは死滅し、他の部位のニューロンは生き延びるということが起きるのはなぜかという問題にヒントを与えてくれている。GladstoneのTaube-Koret Center for Neurodegenerative Disease Researchの長を務めるDr. Finkbeinerは、「ハンチントン病は、遺伝性の致命的な疾患で、筋肉協調、認識力、人
日本の研究者、アレルギー喘息とCOPDの炎症に関わるOn/Offスイッチ突き止める
 日本の研究チームが、慢性閉塞性肺疾患 (COPD) とアレルギー喘息の激しい炎症を解明し、その治療法を発見する上でさらに一歩を進めたとの研究論文が、「The FASEB Journal」2013年8月号に掲載された。その論文では、「ロイコトリエン B4と呼ばれる炎症制御分子の2種類の受容体が、アレルギー喘息やCOPDの炎症のオン/オフ・スイッチで正反対の機能を果たしている」と述べている。
研究チームは、この受容体の一つは「BLT1」と呼ばれ、炎症を促進する働きがあり、もう一つの受容体は「BLT2」と呼ばれ、アレルギー反応時に炎症を弱める働きがあることを突き止めた。これまで、BLT2が炎症反応を憎悪させると思われていただけに、これは重要な発見である。研究チームを指導した鹿児島大学大学院医歯学総合研究科呼吸器内科学の井上博雅 (M.D.) 教授は、「喘息やCOPDの患者の気道中ではロイコトリエン B4量が増えており、一方、アレルギー炎症でBLT1とBLT2が正反対の機能を持っていることから、医薬開発においてはBLT1とBLT2をそれぞれ別個のターゲットにしなければならない。将来、さらに優れた抗喘息薬、抗COPD薬が開発され、何百万人という数の患者を激しい喘息やCOPDの発作から救えることを希望している」と述べている。
この発見のあった研究では、研究者はBLT2遺伝子欠損マウスと正常なマウスのアレルギー反応を比較し、その後でアレルゲンを吸入させ、アレルギー喘息反応を起こさせた。そうすると、BLT2遺伝子欠損マウスでは、正常なマウスに比べると炎症を起こしている肺細胞の数が多かった。BLT2遺伝子のないマウスの肺のアレルギー炎症は、正常なマウスの場合より強かったのである。また、BLT2遺伝子のないマウス・グループでは、T白血球からアレルギー炎症の細胞間情報伝達をするインター
日本の研究チームが、慢性閉塞性肺疾患 (COPD) とアレルギー喘息の激しい炎症を解明し、その治療法を発見する上でさらに一歩を進めたとの研究論文が、「The FASEB Journal」2013年8月号に掲載された。その論文では、「ロイコトリエン B4と呼ばれる炎症制御分子の2種類の受容体が、アレルギー喘息やCOPDの炎症のオン/オフ・スイッチで正反対の機能を果たしている」と述べている。
研究チームは、この受容体の一つは「BLT1」と呼ばれ、炎症を促進する働きがあり、もう一つの受容体は「BLT2」と呼ばれ、アレルギー反応時に炎症を弱める働きがあることを突き止めた。これまで、BLT2が炎症反応を憎悪させると思われていただけに、これは重要な発見である。研究チームを指導した鹿児島大学大学院医歯学総合研究科呼吸器内科学の井上博雅 (M.D.) 教授は、「喘息やCOPDの患者の気道中ではロイコトリエン B4量が増えており、一方、アレルギー炎症でBLT1とBLT2が正反対の機能を持っていることから、医薬開発においてはBLT1とBLT2をそれぞれ別個のターゲットにしなければならない。将来、さらに優れた抗喘息薬、抗COPD薬が開発され、何百万人という数の患者を激しい喘息やCOPDの発作から救えることを希望している」と述べている。
この発見のあった研究では、研究者はBLT2遺伝子欠損マウスと正常なマウスのアレルギー反応を比較し、その後でアレルゲンを吸入させ、アレルギー喘息反応を起こさせた。そうすると、BLT2遺伝子欠損マウスでは、正常なマウスに比べると炎症を起こしている肺細胞の数が多かった。BLT2遺伝子のないマウスの肺のアレルギー炎症は、正常なマウスの場合より強かったのである。また、BLT2遺伝子のないマウス・グループでは、T白血球からアレルギー炎症の細胞間情報伝達をするインター
腸内細菌が人間の摂食行動と食餌選択を支配との研究結果
 まるでSF話のようだが、人間の体内にいて数では人体細胞の100倍もの数になる腸内細胞が、人間の食欲などに影響し、腸内細胞自身の食べたい物を人間が欲するように仕向けている上に人間の肥満をもたらしているのではないかという研究結果が出されている。2014年8月7日付BioEssaysオンライン版に掲載された研究論文で、University of California-San Francisco, (UCSF)、Arizona State University、University of New Mexicoの研究チームは、最近の科学文献のレビューを行い、「腸内細菌は、人間が自分の選択で摂る栄養物を何でも受け身で吸収するのではなく、細菌自体の繁殖に適した栄養素を取るよう人間の摂食行動や食餌選択に影響を与えていると考えられる」との結論を下した。必要とする栄養素は細菌種ごとに異なる。
たとえば脂肪を好む細菌、ショ糖を好む細菌などがある。論文の筆頭著者でUCSFのHelen Diller Family Comprehensive Cancer Center内Center for Evolution and Cancer共同設立者のAthena Aktipis, Ph.D.によると、「ことなる細菌種は、食餌を求め、細菌の生態系である人間の消化器官の中でそれぞれの棲息場所を確保するために互いに競争するだけでなく、人間の行動についても、人間自身の思惑とは異なる目的を持っていること」も多い。その正確な機序はまだ明らかではないが、研究チームは、全体として腸内微生物叢と呼ばれるこの多彩な微生物の社会は、信号分子を腸内に放出することで人間の選択に影響を与えているのではないかと考えている。腸は免疫系、内分泌系、神経系などとリンクしており、放出された信号分子が人間の生理的な反応、行動的な反応を左右
まるでSF話のようだが、人間の体内にいて数では人体細胞の100倍もの数になる腸内細胞が、人間の食欲などに影響し、腸内細胞自身の食べたい物を人間が欲するように仕向けている上に人間の肥満をもたらしているのではないかという研究結果が出されている。2014年8月7日付BioEssaysオンライン版に掲載された研究論文で、University of California-San Francisco, (UCSF)、Arizona State University、University of New Mexicoの研究チームは、最近の科学文献のレビューを行い、「腸内細菌は、人間が自分の選択で摂る栄養物を何でも受け身で吸収するのではなく、細菌自体の繁殖に適した栄養素を取るよう人間の摂食行動や食餌選択に影響を与えていると考えられる」との結論を下した。必要とする栄養素は細菌種ごとに異なる。
たとえば脂肪を好む細菌、ショ糖を好む細菌などがある。論文の筆頭著者でUCSFのHelen Diller Family Comprehensive Cancer Center内Center for Evolution and Cancer共同設立者のAthena Aktipis, Ph.D.によると、「ことなる細菌種は、食餌を求め、細菌の生態系である人間の消化器官の中でそれぞれの棲息場所を確保するために互いに競争するだけでなく、人間の行動についても、人間自身の思惑とは異なる目的を持っていること」も多い。その正確な機序はまだ明らかではないが、研究チームは、全体として腸内微生物叢と呼ばれるこの多彩な微生物の社会は、信号分子を腸内に放出することで人間の選択に影響を与えているのではないかと考えている。腸は免疫系、内分泌系、神経系などとリンクしており、放出された信号分子が人間の生理的な反応、行動的な反応を左右
新生児の無脾症に関連する遺伝子が初めて発見される
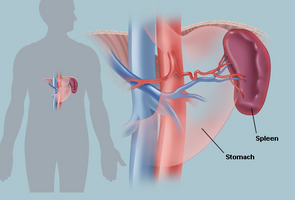 ニューヨーク市にある、ワイルコーネル医科大とロックフェラー大学の研究チームが、脾臓を欠いて生まれてくる無脾症に関連する遺伝子を、初めて同定した。無脾症は感染に対する抵抗が極めて弱いため、この疾患を持った子供達は感染症による死の危険に晒されているのだ。遺伝子Nkx2.5は、マウスにおいては、発生初期の段階で脾臓の創生関与している事が実証された。
この研究はDevelopmental Cell誌の2012年5月3日号オンライン版に発表されたが、簡単な血液検査でNkx2.5の変異を調べることにより、生まれてくる赤ん坊が無脾症である可能性を予測できるというのだ。確定診断はスキャン画像によって行なわれる。「近年では適切な抗生物質の使用により、無脾症の子供達が死に至る事はありません。この診断は予め不慮の死を防ごうとするものなのです。」と主席研究者であり、ワイルコーネル医科大の細胞・発生生物学准教である、リシア・セレリ博士は語る。感染を防御する機構の一部は脾臓が担っているので、無脾症の子供には一生を通して抗生物質の投与計画を建てねばならない。しかし残念な事に現実にはほとんどの場合、致命的な感染症に罹患して肺炎や髄膜炎を起こし、あっと言う間に亡くなった後の剖検で、この先天性無脾症候群である事が判明するのである。「そういう訳ですから、この症候群は極めて稀だとは言っていられないのです。それに、感染症で亡くなった子供が全ケース剖検されるわけではありません。」とセレリ博士は話す。先天性無脾症候群の患者は、脾臓を欠損するという一つの異常だけを有するのが普通だが、時には心臓や血管に異常を有する場合もある。そのような症例は散発的に見受けられ、遺伝性ではないと考えられる。この疾病の1形態として孤立性先天性脾欠損症(ICA)が知られており、これは脾臓の欠損以外に発生学的な異常は無いのが特徴である。そ
ニューヨーク市にある、ワイルコーネル医科大とロックフェラー大学の研究チームが、脾臓を欠いて生まれてくる無脾症に関連する遺伝子を、初めて同定した。無脾症は感染に対する抵抗が極めて弱いため、この疾患を持った子供達は感染症による死の危険に晒されているのだ。遺伝子Nkx2.5は、マウスにおいては、発生初期の段階で脾臓の創生関与している事が実証された。
この研究はDevelopmental Cell誌の2012年5月3日号オンライン版に発表されたが、簡単な血液検査でNkx2.5の変異を調べることにより、生まれてくる赤ん坊が無脾症である可能性を予測できるというのだ。確定診断はスキャン画像によって行なわれる。「近年では適切な抗生物質の使用により、無脾症の子供達が死に至る事はありません。この診断は予め不慮の死を防ごうとするものなのです。」と主席研究者であり、ワイルコーネル医科大の細胞・発生生物学准教である、リシア・セレリ博士は語る。感染を防御する機構の一部は脾臓が担っているので、無脾症の子供には一生を通して抗生物質の投与計画を建てねばならない。しかし残念な事に現実にはほとんどの場合、致命的な感染症に罹患して肺炎や髄膜炎を起こし、あっと言う間に亡くなった後の剖検で、この先天性無脾症候群である事が判明するのである。「そういう訳ですから、この症候群は極めて稀だとは言っていられないのです。それに、感染症で亡くなった子供が全ケース剖検されるわけではありません。」とセレリ博士は話す。先天性無脾症候群の患者は、脾臓を欠損するという一つの異常だけを有するのが普通だが、時には心臓や血管に異常を有する場合もある。そのような症例は散発的に見受けられ、遺伝性ではないと考えられる。この疾病の1形態として孤立性先天性脾欠損症(ICA)が知られており、これは脾臓の欠損以外に発生学的な異常は無いのが特徴である。そ
6種のMicroRNAのグループがリンパ腫の引き金に
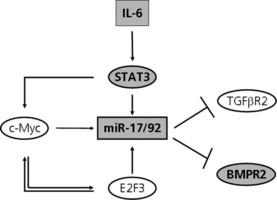 The Scripps Research Institute (TSRI) の研究者が主導して行った新しい研究によると、免疫を制御している数種の小分子があって、それらが少しでも過剰生産されるとリンパ腫と呼ばれる血液がんの引き金になることが突き止められた。リンパ腫その他の何種類かのがんで6種のmicroRNA分子が過剰生産されることはすでに知られているが、これまでその6種のmicroRNA分子のグループこそがそのタイプのがんで主要原因になることは知られていなかった。
その研究では、microRNAががん成長を引き起こし、持続させる主要な生体パスウエーも突き止められている。TSRIのAssistant Professor Changchun Xiaoは、「このmicroRNAのクラスターががん成長を促す仕組みを実証することができたので、今はこのクラスターの影響を抑える治療法を考えるときではないか」と述べている。Dr. Xiaoは、European Molecular Biology Organization の出版物、2013年8月6日付EMBO Journalに掲載されたこの研究で主任研究員を務めている。1990年代に発見されたばかりのmicroRNAは、何種類ものごく短い分子でおよそすべての動物植物の細胞中で活動している。このmicroRNAは、いずれも遺伝子の「照明の光量スイッチ」のような機能を持っており、各遺伝子の複製に付着して、遺伝子がタンパク質に翻訳されないよう効果的に抑制している。このようにしてmicroRNAは、様々な細胞のプロセスを調整することができる。この研究の焦点になったのは、13番染色体のたった一つの遺伝子でエンコードされる、miR-17~92と呼ばれる6種のmicroRNAのクラスターであった。Dr. Xiaoのラボの研究を含め、miR-17~
The Scripps Research Institute (TSRI) の研究者が主導して行った新しい研究によると、免疫を制御している数種の小分子があって、それらが少しでも過剰生産されるとリンパ腫と呼ばれる血液がんの引き金になることが突き止められた。リンパ腫その他の何種類かのがんで6種のmicroRNA分子が過剰生産されることはすでに知られているが、これまでその6種のmicroRNA分子のグループこそがそのタイプのがんで主要原因になることは知られていなかった。
その研究では、microRNAががん成長を引き起こし、持続させる主要な生体パスウエーも突き止められている。TSRIのAssistant Professor Changchun Xiaoは、「このmicroRNAのクラスターががん成長を促す仕組みを実証することができたので、今はこのクラスターの影響を抑える治療法を考えるときではないか」と述べている。Dr. Xiaoは、European Molecular Biology Organization の出版物、2013年8月6日付EMBO Journalに掲載されたこの研究で主任研究員を務めている。1990年代に発見されたばかりのmicroRNAは、何種類ものごく短い分子でおよそすべての動物植物の細胞中で活動している。このmicroRNAは、いずれも遺伝子の「照明の光量スイッチ」のような機能を持っており、各遺伝子の複製に付着して、遺伝子がタンパク質に翻訳されないよう効果的に抑制している。このようにしてmicroRNAは、様々な細胞のプロセスを調整することができる。この研究の焦点になったのは、13番染色体のたった一つの遺伝子でエンコードされる、miR-17~92と呼ばれる6種のmicroRNAのクラスターであった。Dr. Xiaoのラボの研究を含め、miR-17~
「Urzyme」新発見、生命の起源「RNA世界」説に挑戦
 地上に生命体が現れる前には混沌とした液状の分子が漂っていた。これを「原始スープ」という。ある時、ごく少数の特殊な分子が自己複製を始めた。この自己複製が生化学的過程の始まりで遂には最初の生命体が出現することになるという仮説については科学者の支持で一致している。しかし、どのようにして分子の自己複製が始まったのかということは科学界にとって永遠の謎の一つだ。
しかし、2013年9月13日付「Journal of Biological Chemistry」誌に掲載された研究論文で、University of North Carolina (UNC) School of Medicineの生化学者、Charles Carter, Ph.D.と同僚研究者らが、生命体の発生について興味深い仮説を提出している。この論文はJBCの、「今週の論文」の一つに選ばれた。Dr. Carterチームの研究は、地上で生命が発生する上で重要な役割を果たしたのではないかと考えられる原始的なタンパク酵素を再現した実験結果に基づいている。Dr. Carterの発見は、これまで一般的に考えられていたような、「リボ核酸 (RNA) が単純なタンパク質の力を借りずに自己複製し、現在知られているような生命体にまで行き着いた」という説を真っ向から脅かすものだった。1980年代初め、研究チームは、ribozymes、つまりRNA酵素が触媒として作用することを突き止めた。RNAが青写真の役目をすると同時に、その青写真を複製する化学触媒の役割も果たすことができるという証拠だった。この発見が、「RNA世界」仮説に結びついた。この説では、RNAが単独で分子の海から生命が浮かび上がってくる引き金になったとしている。しかし、この仮説が正しいとするためには、古代のRNA触媒が、現在の酵素と同じようにほぼ正確に複数のRNA青写真を複
地上に生命体が現れる前には混沌とした液状の分子が漂っていた。これを「原始スープ」という。ある時、ごく少数の特殊な分子が自己複製を始めた。この自己複製が生化学的過程の始まりで遂には最初の生命体が出現することになるという仮説については科学者の支持で一致している。しかし、どのようにして分子の自己複製が始まったのかということは科学界にとって永遠の謎の一つだ。
しかし、2013年9月13日付「Journal of Biological Chemistry」誌に掲載された研究論文で、University of North Carolina (UNC) School of Medicineの生化学者、Charles Carter, Ph.D.と同僚研究者らが、生命体の発生について興味深い仮説を提出している。この論文はJBCの、「今週の論文」の一つに選ばれた。Dr. Carterチームの研究は、地上で生命が発生する上で重要な役割を果たしたのではないかと考えられる原始的なタンパク酵素を再現した実験結果に基づいている。Dr. Carterの発見は、これまで一般的に考えられていたような、「リボ核酸 (RNA) が単純なタンパク質の力を借りずに自己複製し、現在知られているような生命体にまで行き着いた」という説を真っ向から脅かすものだった。1980年代初め、研究チームは、ribozymes、つまりRNA酵素が触媒として作用することを突き止めた。RNAが青写真の役目をすると同時に、その青写真を複製する化学触媒の役割も果たすことができるという証拠だった。この発見が、「RNA世界」仮説に結びついた。この説では、RNAが単独で分子の海から生命が浮かび上がってくる引き金になったとしている。しかし、この仮説が正しいとするためには、古代のRNA触媒が、現在の酵素と同じようにほぼ正確に複数のRNA青写真を複
日光に当たらないと膵臓がんリスクが上昇?
 2015年4月9日付Journal of Steroid Biochemistry and Molecular Biologyオンライン版に掲載された「172か国における曇天下のUV-B照射と膵臓がん」と題された研究論文で、UC San Diego School of Medicineの研究グループが日射量の最も低い国で膵臓がん発症率が最高になっていると報告している。 日射量の低さは雲が厚いことと高緯度が関わっている。
第一著者、UC San Diego Moores Cancer Centerのメンバーで、Adjunct Professor in the Department of Family Medicine and Public Healthを務めるCedric F. Garland, DPHは、「高緯度や曇天の多い地域の住民は、1年のうち、ビタミンDを十分に作ることができない時期が長い。そのため、膵臓がんのリスクが通常より高くなる。赤道に近い晴天の多い地域の住民は、赤道から遠い地域の人に比べ、年齢で調整した後の膵臓がん発生率がわずか6分の1である。日照不足の影響の大きさから、ビタミンD欠乏症が膵臓がんのリスクを高めている可能性があることが示唆されているが、まだ証明されていない」と述べている。
ごくわずかな種類の食品に天然のビタミンDが含まれている。サケやマグロなど脂の多い魚はビタミンDの豊かな食品だし、牛レバー、チーズ、卵黄などにも少量ながら含まれている。また、牛乳、シリアル、ジュースなどにも栄養強化として添加されることもあるが、専門家は、皮膚が日光にさらされた時、特に紫外線のUV-Bという波長領域にさられた場合に自分の体でビタミンDが自分の体内で作り出されなければならないと考えている。屋内でも窓ガラスを通して日光を受けた場合にはビタミンDが作られない
2015年4月9日付Journal of Steroid Biochemistry and Molecular Biologyオンライン版に掲載された「172か国における曇天下のUV-B照射と膵臓がん」と題された研究論文で、UC San Diego School of Medicineの研究グループが日射量の最も低い国で膵臓がん発症率が最高になっていると報告している。 日射量の低さは雲が厚いことと高緯度が関わっている。
第一著者、UC San Diego Moores Cancer Centerのメンバーで、Adjunct Professor in the Department of Family Medicine and Public Healthを務めるCedric F. Garland, DPHは、「高緯度や曇天の多い地域の住民は、1年のうち、ビタミンDを十分に作ることができない時期が長い。そのため、膵臓がんのリスクが通常より高くなる。赤道に近い晴天の多い地域の住民は、赤道から遠い地域の人に比べ、年齢で調整した後の膵臓がん発生率がわずか6分の1である。日照不足の影響の大きさから、ビタミンD欠乏症が膵臓がんのリスクを高めている可能性があることが示唆されているが、まだ証明されていない」と述べている。
ごくわずかな種類の食品に天然のビタミンDが含まれている。サケやマグロなど脂の多い魚はビタミンDの豊かな食品だし、牛レバー、チーズ、卵黄などにも少量ながら含まれている。また、牛乳、シリアル、ジュースなどにも栄養強化として添加されることもあるが、専門家は、皮膚が日光にさらされた時、特に紫外線のUV-Bという波長領域にさられた場合に自分の体でビタミンDが自分の体内で作り出されなければならないと考えている。屋内でも窓ガラスを通して日光を受けた場合にはビタミンDが作られない
エクソーム解析で子宮内膜症の異常変異体を判別
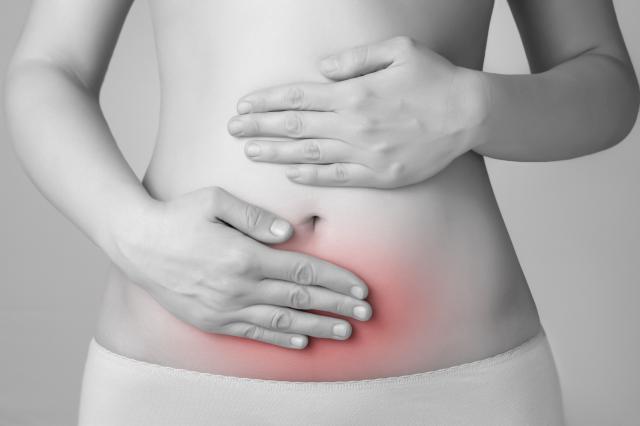 Johns Hopkins MedicineとUniversity of British Columbiaの研究者は、遺伝子シーケンシング・ツールを使い、子宮の外で子宮内膜状の組織が増殖し、ひどい痛みを伴う良性子宮内膜症患者24人の組織サンプルから一組の遺伝子変異体を発見した。2017年5月11日付New England Journal of Medicineに掲載されたこの発見により、いつか、侵襲性の強い子宮内膜症と臨床的に緩慢な非侵襲性子宮内膜症とを判別する分子レベルのテストを開発できる可能性がある。
NEJMの研究論文は、「Cancer-Associated Mutations in Endometriosis without Cancer (非がん性子宮内膜症中のがん関連遺伝子変異体)」と題されており、Johns Hopkins University School of MedicineのDepartment of Gynecology & ObstetricsでRichard W. TeLinde Distinguished ProfessorとJohns Hopkins Kimmel Cancer CenterでBreast and Ovarian Cancer ProgramのCo-Directorを務めるIe-Ming Shih, MD, PhD.は、「私達の研究での変異体の発見は、積極的治療を必要としているか、そうでないかを現場の医師が判定するために、子宮内膜症を分類する遺伝学ベースの検査法開発の第一歩ではないか」と述べている。子宮内膜症は、子宮内の粘膜が子宮の外、特に腹部内に形成増殖される疾患であり、月経閉止前の女性の約10%がこの疾患にかかり、そのうち半数が腹痛や不妊に悩まされている。1920年代、Johns Hopkinsの卒業生で婦人科医
Johns Hopkins MedicineとUniversity of British Columbiaの研究者は、遺伝子シーケンシング・ツールを使い、子宮の外で子宮内膜状の組織が増殖し、ひどい痛みを伴う良性子宮内膜症患者24人の組織サンプルから一組の遺伝子変異体を発見した。2017年5月11日付New England Journal of Medicineに掲載されたこの発見により、いつか、侵襲性の強い子宮内膜症と臨床的に緩慢な非侵襲性子宮内膜症とを判別する分子レベルのテストを開発できる可能性がある。
NEJMの研究論文は、「Cancer-Associated Mutations in Endometriosis without Cancer (非がん性子宮内膜症中のがん関連遺伝子変異体)」と題されており、Johns Hopkins University School of MedicineのDepartment of Gynecology & ObstetricsでRichard W. TeLinde Distinguished ProfessorとJohns Hopkins Kimmel Cancer CenterでBreast and Ovarian Cancer ProgramのCo-Directorを務めるIe-Ming Shih, MD, PhD.は、「私達の研究での変異体の発見は、積極的治療を必要としているか、そうでないかを現場の医師が判定するために、子宮内膜症を分類する遺伝学ベースの検査法開発の第一歩ではないか」と述べている。子宮内膜症は、子宮内の粘膜が子宮の外、特に腹部内に形成増殖される疾患であり、月経閉止前の女性の約10%がこの疾患にかかり、そのうち半数が腹痛や不妊に悩まされている。1920年代、Johns Hopkinsの卒業生で婦人科医
運動不足のマウスのランニング持久力を強化する化合物
 ランニングの健康効果については毎週のように新しい話題が現れる。それ自体は素晴らしいことだが、走れない人にとっては何の意味もない。高齢者、肥満者、その他、運動機能に支障のある人にとっては有酸素運動の効果というのは望んでも得られないことだった。Salk Instituteの研究チームは、ランニングによって起動される遺伝子経路を突き止めた過去の研究を基礎にして、化合物によって運動不足のマウスの経路を完全に起動する手段を見つけ、脂肪燃焼効率やスタミナを高めるなど運動の健康効果を再現することができた。
2017年5月2日付のCell Metabolismに掲載されたこの研究論文は、有酸素運動持久力への理解を深めただけでなく、心臓障害、呼吸器系疾患、2型糖尿病その他健康障害のある人々にも薬剤で同じ健康効果が得られるようになる希望を与えている。このオープンアクセス論文は、「PPARδ Promotes Running Endurance by Preserving Glucose (PPARδは、ブドウ糖を保存することでランニング持久力を増進)」と題されている。筆頭著者のRonald Evans は、Molecular and DevelopmentalでSalkのMarch of Dimes Chair の地位にあり、またBiology Howard Hughes Medical Instituteのinvestigatorでもある。彼はこの論文で、「トレーニングで有酸素運動持久力を増進させられることはよく知られているが、私達の疑問は、持久力はどのように機能するのか、また、科学をよく理解できればトレーニングを薬剤で代用することができるのか?、ということだった」と述べている。持久力を増進するというのは有酸素運動をより長時間持続できるようになるということである。体がフィットしてくると、筋
ランニングの健康効果については毎週のように新しい話題が現れる。それ自体は素晴らしいことだが、走れない人にとっては何の意味もない。高齢者、肥満者、その他、運動機能に支障のある人にとっては有酸素運動の効果というのは望んでも得られないことだった。Salk Instituteの研究チームは、ランニングによって起動される遺伝子経路を突き止めた過去の研究を基礎にして、化合物によって運動不足のマウスの経路を完全に起動する手段を見つけ、脂肪燃焼効率やスタミナを高めるなど運動の健康効果を再現することができた。
2017年5月2日付のCell Metabolismに掲載されたこの研究論文は、有酸素運動持久力への理解を深めただけでなく、心臓障害、呼吸器系疾患、2型糖尿病その他健康障害のある人々にも薬剤で同じ健康効果が得られるようになる希望を与えている。このオープンアクセス論文は、「PPARδ Promotes Running Endurance by Preserving Glucose (PPARδは、ブドウ糖を保存することでランニング持久力を増進)」と題されている。筆頭著者のRonald Evans は、Molecular and DevelopmentalでSalkのMarch of Dimes Chair の地位にあり、またBiology Howard Hughes Medical Instituteのinvestigatorでもある。彼はこの論文で、「トレーニングで有酸素運動持久力を増進させられることはよく知られているが、私達の疑問は、持久力はどのように機能するのか、また、科学をよく理解できればトレーニングを薬剤で代用することができるのか?、ということだった」と述べている。持久力を増進するというのは有酸素運動をより長時間持続できるようになるということである。体がフィットしてくると、筋
茶樹のゲノム解読完了。お茶の風味とカフェイン生合成の独立進化の解明へ
 一般的な茶にも紅茶、緑茶、烏龍茶、白茶、チャイなど様々な種類があるが、いずれもCamellia sinensis、一般的には茶樹と呼ばれる常緑低木の葉を原料としている。茶は文化的にも経済的にも重要でありながら、茶の葉の木についてはあまりよく知られていない。2017年5月1日付Molecular Plant誌オンライン版に掲載された茶樹のゲノム解析初稿を読めば、なぜ茶の葉には抗酸化物質やカフェインが豊富に含まれているのかが想像できるのではないか。
このオープンアクセス論文は、「The Tea Tree Genome Provides Insights into Tea Flavor and Independent Evolution of Caffeine Biosynthesis (茶樹のゲノムが茶の風味とカフェイン生合成の独立進化解明の手がかりに)」と題されている。茶樹が近縁種と遺伝学的にどう違うのかを理解すれば、茶園経営者もCamellia sinensisの葉はなぜユニークなのかということが分かるのではないか。このCamellia属には100を超える種があり、その中には庭木として栽培される種もいくつかあり、さらに、茶油を採るC. oleiferaがあり、茶の原料として商業的に栽培されているのは主として2種 (C. sinensis. var. assamicaおよびC. sinensis var. sinensis) があるだけである。中国Kunming Institute of Botany (中国科学院昆明植物研究所) の植物遺伝学者、Li-Zhi Gao (高立志), PhDは、「茶には様々な風味があるが、茶の風味を決めているのはどの遺伝子かと言うことは謎だ」と述べている。
これまでの研究で、茶の風味はフラボノイドと呼ばれる抗酸化物質のグループによるも
一般的な茶にも紅茶、緑茶、烏龍茶、白茶、チャイなど様々な種類があるが、いずれもCamellia sinensis、一般的には茶樹と呼ばれる常緑低木の葉を原料としている。茶は文化的にも経済的にも重要でありながら、茶の葉の木についてはあまりよく知られていない。2017年5月1日付Molecular Plant誌オンライン版に掲載された茶樹のゲノム解析初稿を読めば、なぜ茶の葉には抗酸化物質やカフェインが豊富に含まれているのかが想像できるのではないか。
このオープンアクセス論文は、「The Tea Tree Genome Provides Insights into Tea Flavor and Independent Evolution of Caffeine Biosynthesis (茶樹のゲノムが茶の風味とカフェイン生合成の独立進化解明の手がかりに)」と題されている。茶樹が近縁種と遺伝学的にどう違うのかを理解すれば、茶園経営者もCamellia sinensisの葉はなぜユニークなのかということが分かるのではないか。このCamellia属には100を超える種があり、その中には庭木として栽培される種もいくつかあり、さらに、茶油を採るC. oleiferaがあり、茶の原料として商業的に栽培されているのは主として2種 (C. sinensis. var. assamicaおよびC. sinensis var. sinensis) があるだけである。中国Kunming Institute of Botany (中国科学院昆明植物研究所) の植物遺伝学者、Li-Zhi Gao (高立志), PhDは、「茶には様々な風味があるが、茶の風味を決めているのはどの遺伝子かと言うことは謎だ」と述べている。
これまでの研究で、茶の風味はフラボノイドと呼ばれる抗酸化物質のグループによるも
新イメージング法で、がん免疫療法の反応を早期に予測
 非侵襲性のPETイメージング法は、免疫細胞ががん細胞を殺すために放出するグランザイムB (写真) というタンパク質を測定する方法で、マウスと人間で、治療の初期に免疫チェックポイント阻害薬に反応するがんと、反応しないがんを判別することができた。その研究結果はCancer Research の2017年5月号に掲載されている。
この論文は、「Granzyme B PET Imaging as a Predictive Biomarker of Immunotherapy Response (免疫療法反応の予測バイオマーカーとしてのグランザイムB PETイメージング法)」と題されており、マサチューセッツ州ボストン市、Harvard Medical School のProfessor of Radiology と、Massachusetts General Hospital (MGH), Athinoula A. Martinos Center for Biomedical Imaging, Division of Precision MedicineのDirectorを務めるUmar Mahmood, MD, PhDがこの論文の首席著者になっている。Dr. Mahmoodは、「チェックポイント阻害薬のような免疫療法は革命的ながん治療法になったが、この治療法が有効な患者は少数であり、大多数の患者にとっては何の益もないだけでなく、大きな副作用の危険があり、しかも他の治療法を試す時間を失うことにもなりかねない」と述べている。免疫療法への反応は、がんのサイズを測定するCTスキャンやMRIスキャンのようにがんの細胞を測定する従来の方法でも、FDG PETのようにがんのブドウ糖取込量を測定する方法でも、免疫細胞が映り込んだり、ブドウ糖取込量が増加してがん細胞が大きく映るため、がん初期には免
非侵襲性のPETイメージング法は、免疫細胞ががん細胞を殺すために放出するグランザイムB (写真) というタンパク質を測定する方法で、マウスと人間で、治療の初期に免疫チェックポイント阻害薬に反応するがんと、反応しないがんを判別することができた。その研究結果はCancer Research の2017年5月号に掲載されている。
この論文は、「Granzyme B PET Imaging as a Predictive Biomarker of Immunotherapy Response (免疫療法反応の予測バイオマーカーとしてのグランザイムB PETイメージング法)」と題されており、マサチューセッツ州ボストン市、Harvard Medical School のProfessor of Radiology と、Massachusetts General Hospital (MGH), Athinoula A. Martinos Center for Biomedical Imaging, Division of Precision MedicineのDirectorを務めるUmar Mahmood, MD, PhDがこの論文の首席著者になっている。Dr. Mahmoodは、「チェックポイント阻害薬のような免疫療法は革命的ながん治療法になったが、この治療法が有効な患者は少数であり、大多数の患者にとっては何の益もないだけでなく、大きな副作用の危険があり、しかも他の治療法を試す時間を失うことにもなりかねない」と述べている。免疫療法への反応は、がんのサイズを測定するCTスキャンやMRIスキャンのようにがんの細胞を測定する従来の方法でも、FDG PETのようにがんのブドウ糖取込量を測定する方法でも、免疫細胞が映り込んだり、ブドウ糖取込量が増加してがん細胞が大きく映るため、がん初期には免
抗生物質の効力を高めるメープルシロップ抽出物
 抗生物質によって救われる命が日々ある中、その功罪併せ持つ特性こそが欠点となることもある。高用量では感染を引き起こす細菌とともに健康な細胞も破壊し、既知の抗生物質がもはや効果をもたない「スーパーバグ」を創り出すことになるからだ。しかし、抗生物質の効力を劇的に高めるメープルシロップ抽出物が発見されたことにより、抗生物質の使用量を自然に減らすことが可能になるかもしれない。
この研究は4月2日、第253回アメリカ外科学会議(ACS)の全国会議博覧会において発表された。世界最大の科学会であるACSは4月2日から6日までサンフランシスコにて年次総会を開催し、14,000件以上の多種多様なプレゼンテーションが行われた。「カナダの先住民は昔からメープルシロップを感染症の薬として使用してきました。私は常々、この民間療法がどのようなサイエンスに基づくのか興味を持っていたのです。」と、カナダのMcGill大学のNathalie Tufenkji博士は述べる。クランベリー抽出物の抗菌効果を研究していたTufenkji博士はフェノールメープルシロップ抽出物の抗がん効果を知り、本プロジェクトを始動した。「これをきっかけに、この物質の抗菌効果も調べる価値があると思い、研究員にメープルシロップを買いに走らせたのです。」研究チームは既存の抽出法を用いてシロップのフェノール化合物から砂糖と水を分離した。これこそがメープルシロップのあの黄金色の素である。
初期試験では病原菌の菌株をいくつか抽出物に暴露したが、効果はほとんど見られなかった。そこで Tufenkji博士は、この抽出物が一般的に使用されている抗生物質シプロフロキサシンとカルベニシリンの抗菌力を高める効果があるかどうかを確認することにした。そしてフェノール抽出物をこれらの薬のいずれかと混合した結果、実際に相乗効果を見出したのである。その効果は、最大
抗生物質によって救われる命が日々ある中、その功罪併せ持つ特性こそが欠点となることもある。高用量では感染を引き起こす細菌とともに健康な細胞も破壊し、既知の抗生物質がもはや効果をもたない「スーパーバグ」を創り出すことになるからだ。しかし、抗生物質の効力を劇的に高めるメープルシロップ抽出物が発見されたことにより、抗生物質の使用量を自然に減らすことが可能になるかもしれない。
この研究は4月2日、第253回アメリカ外科学会議(ACS)の全国会議博覧会において発表された。世界最大の科学会であるACSは4月2日から6日までサンフランシスコにて年次総会を開催し、14,000件以上の多種多様なプレゼンテーションが行われた。「カナダの先住民は昔からメープルシロップを感染症の薬として使用してきました。私は常々、この民間療法がどのようなサイエンスに基づくのか興味を持っていたのです。」と、カナダのMcGill大学のNathalie Tufenkji博士は述べる。クランベリー抽出物の抗菌効果を研究していたTufenkji博士はフェノールメープルシロップ抽出物の抗がん効果を知り、本プロジェクトを始動した。「これをきっかけに、この物質の抗菌効果も調べる価値があると思い、研究員にメープルシロップを買いに走らせたのです。」研究チームは既存の抽出法を用いてシロップのフェノール化合物から砂糖と水を分離した。これこそがメープルシロップのあの黄金色の素である。
初期試験では病原菌の菌株をいくつか抽出物に暴露したが、効果はほとんど見られなかった。そこで Tufenkji博士は、この抽出物が一般的に使用されている抗生物質シプロフロキサシンとカルベニシリンの抗菌力を高める効果があるかどうかを確認することにした。そしてフェノール抽出物をこれらの薬のいずれかと混合した結果、実際に相乗効果を見出したのである。その効果は、最大
蜂毒から作る血液脳関門通過薬
 血液脳関門(BBB : blood-brain barrier)は循環系と脳脊髄液を隔てる選択的を有する膜で、医薬品のほとんどはこのBBBを通過することが出来ない。しかし、動物の毒液中にある特定のペプチドはBBBを通過して損傷を与えることがある。そこで現在、蜂毒ペプチドであるアパミン(apamin)に基づいた薬剤BBB通過戦略に注目する研究グループがある。
この研究は4月2日に開催された第253回全米科学会(ACS : the American Chemical Society)の全国総会(2017年)で発表された。世界最大の科学会であるACSは、サンフランシスコで4月2日から4月6日まで開催され、14,000件以上の多種多様な科学分野におけるプレゼンテーションが行われた。スペイン・バルセロナのInstitute for Research in Biomedicine のErnest Giralt博士はこう語る。「一部の動物の毒は中枢神経系にダメージを与えるため、これらはBBBを通過する能力をもち、薬を運ぶ役割も担えるのではないかと考えたのです。」アパミンはミツバチに刺されたヒトの中枢神経系に蓄積することが知られているが、アパミンペプチド自体を使用する事に関してはいくつかの欠点が存在した。
「毒性があるため、アパミンを直接使用することができないことを私たちは知っていました。しかし、毒性の起源もよくわかっていたので、毒性のみ排除しつつトランスポーターとしての機能は失わないようアパミンを改変することが出来るかもしれないと考えたのです。」と、Giralt博士は説明する。アパミンの毒性は、神経細胞中のカリウムチャネルとの相互作用に起因する。陽電気を帯びたアパミン分子基はカリウムイオンを模倣し、結合するとカリウムチャネルを遮断する。毒性を排除するために、Giralt博士率い
血液脳関門(BBB : blood-brain barrier)は循環系と脳脊髄液を隔てる選択的を有する膜で、医薬品のほとんどはこのBBBを通過することが出来ない。しかし、動物の毒液中にある特定のペプチドはBBBを通過して損傷を与えることがある。そこで現在、蜂毒ペプチドであるアパミン(apamin)に基づいた薬剤BBB通過戦略に注目する研究グループがある。
この研究は4月2日に開催された第253回全米科学会(ACS : the American Chemical Society)の全国総会(2017年)で発表された。世界最大の科学会であるACSは、サンフランシスコで4月2日から4月6日まで開催され、14,000件以上の多種多様な科学分野におけるプレゼンテーションが行われた。スペイン・バルセロナのInstitute for Research in Biomedicine のErnest Giralt博士はこう語る。「一部の動物の毒は中枢神経系にダメージを与えるため、これらはBBBを通過する能力をもち、薬を運ぶ役割も担えるのではないかと考えたのです。」アパミンはミツバチに刺されたヒトの中枢神経系に蓄積することが知られているが、アパミンペプチド自体を使用する事に関してはいくつかの欠点が存在した。
「毒性があるため、アパミンを直接使用することができないことを私たちは知っていました。しかし、毒性の起源もよくわかっていたので、毒性のみ排除しつつトランスポーターとしての機能は失わないようアパミンを改変することが出来るかもしれないと考えたのです。」と、Giralt博士は説明する。アパミンの毒性は、神経細胞中のカリウムチャネルとの相互作用に起因する。陽電気を帯びたアパミン分子基はカリウムイオンを模倣し、結合するとカリウムチャネルを遮断する。毒性を排除するために、Giralt博士率い
パーキンソン病におけるプレシジョンメディシンの未来:腫瘍学的アプローチの必要性
 パーキンソン病の定義、研究、および治療への転換的アプローチが発表された。これを概説している2つの文献はNature Reviews Neurology and Movement Disorders誌にオンライン掲載されている。共にシンシナティ大学(UC)Gardner Neuroscience Instituteの研究者が共同執筆者として携わっている。パーキンソン病を単一の実体として治療するのではなく、特定の症状または分子的特徴に基づいて、患者の異なる「ノードまたはクラスター」への治療を目的とするべきだと、この国際研究グループは主張する。
「私たちが何をすべきかを問い直す時が来ているのです。医科学は、パーキンソン病の進行を遅らせることを目標とし、その治療研究に230億ドルの世界的投資をしてきました。そして行われた17ものⅢ臨床試験は、残念ながらほとんど成果を上げていません。こんなにも結果が出ないのは、単一疾患・単一目的のアプローチで治療法を確立しようとしているからではないでしょうか。」と、本研究の筆頭著者であるAlberto Espay医師は説明する。Espay博士はUC医科大学の神経学准教授であり、James J. and Joan A. Gardner Family Center for Parkinson's Disease and Movement Disordersのディレクターも務める。パーキンソン病は単一の疾患ではなく、遺伝的および分子的な観点から考えるといくつかの病気の集まりである、とEspay博士らは考える。彼らは、パーキンソン病をドーパミンニューロン変性を主な原因とする単一障害として見ることは、大多数の患者が抱える震えや不安定な歩行などといった症状に対する治療法の開発に有用であったことを認めている。同時に、この見解は、パーキンソン病の進行を遅らせ、修正
パーキンソン病の定義、研究、および治療への転換的アプローチが発表された。これを概説している2つの文献はNature Reviews Neurology and Movement Disorders誌にオンライン掲載されている。共にシンシナティ大学(UC)Gardner Neuroscience Instituteの研究者が共同執筆者として携わっている。パーキンソン病を単一の実体として治療するのではなく、特定の症状または分子的特徴に基づいて、患者の異なる「ノードまたはクラスター」への治療を目的とするべきだと、この国際研究グループは主張する。
「私たちが何をすべきかを問い直す時が来ているのです。医科学は、パーキンソン病の進行を遅らせることを目標とし、その治療研究に230億ドルの世界的投資をしてきました。そして行われた17ものⅢ臨床試験は、残念ながらほとんど成果を上げていません。こんなにも結果が出ないのは、単一疾患・単一目的のアプローチで治療法を確立しようとしているからではないでしょうか。」と、本研究の筆頭著者であるAlberto Espay医師は説明する。Espay博士はUC医科大学の神経学准教授であり、James J. and Joan A. Gardner Family Center for Parkinson's Disease and Movement Disordersのディレクターも務める。パーキンソン病は単一の疾患ではなく、遺伝的および分子的な観点から考えるといくつかの病気の集まりである、とEspay博士らは考える。彼らは、パーキンソン病をドーパミンニューロン変性を主な原因とする単一障害として見ることは、大多数の患者が抱える震えや不安定な歩行などといった症状に対する治療法の開発に有用であったことを認めている。同時に、この見解は、パーキンソン病の進行を遅らせ、修正
テロメアの長さが石灰化大動脈弁疾患のリスクまたは耐性に関与していることが判明
 サンフランシスコのグラッドストーン研究所の科学者達は、マウスがヒトの老化疾患を発症するのを防ぐ重要なメカニズムを発見し、ヒトでよく見られる広範囲の疾患の重症度を説明した。どちらの局面も、年齢とともに浸食される染色体末端の保護キャップとしての役割を担うテロメアと関連している。テロメアの侵食と老化の疾患の関連性は長く知られているが、テロメアの長さがヒトの病気にどのように影響を与えるかは謎とされてきた。
しかし今、科学者達によって、心臓病に関連したヒトの遺伝子変異を有するマウスのテロメアを短くすると心臓弁および血管にカルシウムが致命的な量に蓄積することが見出されている。これによって、石灰化大動脈弁疾患(calcific aortic valve disease; CAVD)の有望な新薬開発の実験系の構築が期待され、ヒトにおける様々な老化疾患の研究をマウスモデル化する道が開けた。CAVDでは、心臓弁および血管にカルシウムが蓄積し骨のように硬化する。治療としては心臓手術によって弁を置換する他なく、疾患率は75歳以上の成人の3%である。CAVDは年齢と共に発症し、2つあるNOTCH1遺伝子のコピーの一つに突然変異が起こることが起因とされる。
ヒトは通常、各遺伝子のコピーを2つ有する。 コピーの1つが失われた場合、残りの遺伝子では、正常な機能を維持するのに十分なタンパク質を産生しきれないことがある。たんぱく質の産生量が半減すればヒトでは疾患を引き起こすのに対し、同じ変異を持つマウスは疾患から保護されることが多いが、この理由については明確にされていない。グラッドストーン研究所の科学者らは、テロメアの長さがこの種の疾患のリスクまたは耐性と関連している、と2017年3月27日付けでJournal of Clinical Investigationにオンラインで公開した。実験用マウスは
サンフランシスコのグラッドストーン研究所の科学者達は、マウスがヒトの老化疾患を発症するのを防ぐ重要なメカニズムを発見し、ヒトでよく見られる広範囲の疾患の重症度を説明した。どちらの局面も、年齢とともに浸食される染色体末端の保護キャップとしての役割を担うテロメアと関連している。テロメアの侵食と老化の疾患の関連性は長く知られているが、テロメアの長さがヒトの病気にどのように影響を与えるかは謎とされてきた。
しかし今、科学者達によって、心臓病に関連したヒトの遺伝子変異を有するマウスのテロメアを短くすると心臓弁および血管にカルシウムが致命的な量に蓄積することが見出されている。これによって、石灰化大動脈弁疾患(calcific aortic valve disease; CAVD)の有望な新薬開発の実験系の構築が期待され、ヒトにおける様々な老化疾患の研究をマウスモデル化する道が開けた。CAVDでは、心臓弁および血管にカルシウムが蓄積し骨のように硬化する。治療としては心臓手術によって弁を置換する他なく、疾患率は75歳以上の成人の3%である。CAVDは年齢と共に発症し、2つあるNOTCH1遺伝子のコピーの一つに突然変異が起こることが起因とされる。
ヒトは通常、各遺伝子のコピーを2つ有する。 コピーの1つが失われた場合、残りの遺伝子では、正常な機能を維持するのに十分なタンパク質を産生しきれないことがある。たんぱく質の産生量が半減すればヒトでは疾患を引き起こすのに対し、同じ変異を持つマウスは疾患から保護されることが多いが、この理由については明確にされていない。グラッドストーン研究所の科学者らは、テロメアの長さがこの種の疾患のリスクまたは耐性と関連している、と2017年3月27日付けでJournal of Clinical Investigationにオンラインで公開した。実験用マウスは
100以上の記憶関連遺伝子が同定される
 ヒトの記憶に重要な遺伝子が100以上も同定された。しかも、初めて記憶処理中の遺伝子データと脳活動との相関関係が明らかになったのである。これにより、ヒトの記憶というものに新たな可能性が出てきた。
「これらの遺伝子と行動の関係を特定することで、記憶機能や機能障害といった局面における遺伝子の役割を研究することが可能になります。これは非常にエキサイティングなことです。なぜなら、人の記憶を支える分子メカニズムの解明に一歩近づけたということですから。これを基に様々な記憶問題に役立てることができるでしょう。」と、サウスウェスタン・テキサス大学(UT)のGenevieve Konopka博士は語る。研究発表は2017年3月26日サンフランシスコで開催されたCognitive Neuroscience Society (CNS)年次学会で行われた。本研究は、脳の解剖学および機能の変化に遺伝的変異を関連付けることを目的とした「遺伝子イメージング」である。比較的新しい分野だが、今まさに成長拡大している分野でもある。
CNS学会の遺伝子イメージングシンポジウムの委員長も務める、ハーバード大学医学部とマサチューセッツ総合病院のEvelina Fedorenko博士は「遺伝子は脳の解剖学的構造と機能的組織を形作っています。これらの脳の構造的および機能的特徴が、行動の様式を決定するのです。遺伝子と脳との関係を調べることは、ヒトの認知・神経構造を十分に理解する可能性があります。動物界における人間の独自性についての洞察を含んでいます。」と述べている。遺伝子と行動の関連性を解明しようと試みたこれまでの研究では、肝心の神経マーカーが欠けていたが、今回の研究はこの二つを関連付けることができた。CNS年次学会の「これからの遺伝学と認知神経科学」シンポジウムでKonopka博士とFedorenko博士の二人が研究
ヒトの記憶に重要な遺伝子が100以上も同定された。しかも、初めて記憶処理中の遺伝子データと脳活動との相関関係が明らかになったのである。これにより、ヒトの記憶というものに新たな可能性が出てきた。
「これらの遺伝子と行動の関係を特定することで、記憶機能や機能障害といった局面における遺伝子の役割を研究することが可能になります。これは非常にエキサイティングなことです。なぜなら、人の記憶を支える分子メカニズムの解明に一歩近づけたということですから。これを基に様々な記憶問題に役立てることができるでしょう。」と、サウスウェスタン・テキサス大学(UT)のGenevieve Konopka博士は語る。研究発表は2017年3月26日サンフランシスコで開催されたCognitive Neuroscience Society (CNS)年次学会で行われた。本研究は、脳の解剖学および機能の変化に遺伝的変異を関連付けることを目的とした「遺伝子イメージング」である。比較的新しい分野だが、今まさに成長拡大している分野でもある。
CNS学会の遺伝子イメージングシンポジウムの委員長も務める、ハーバード大学医学部とマサチューセッツ総合病院のEvelina Fedorenko博士は「遺伝子は脳の解剖学的構造と機能的組織を形作っています。これらの脳の構造的および機能的特徴が、行動の様式を決定するのです。遺伝子と脳との関係を調べることは、ヒトの認知・神経構造を十分に理解する可能性があります。動物界における人間の独自性についての洞察を含んでいます。」と述べている。遺伝子と行動の関連性を解明しようと試みたこれまでの研究では、肝心の神経マーカーが欠けていたが、今回の研究はこの二つを関連付けることができた。CNS年次学会の「これからの遺伝学と認知神経科学」シンポジウムでKonopka博士とFedorenko博士の二人が研究
NAD+ "ブースター"が持つ絶大なアンチエイジング効果
 オーストラリアのニューサウスウェールズ大学(UNSW)の研究者らは、実際に老化を逆行させ、DNA修復を改善し、NASAの火星任務をも可能にするであろう革新的な薬物を発見した。2017年3月23日のScience誌に発表された論文は「老化中のタンパク質-タンパク質相互作用を調節する保存されたNAD+結合ポケット(“A Conserved NAD+ Binding Pocket That Regulates Protein-Protein Interactions During Aging.”)」と題され、研究者チームは細胞が損傷したDNAを修復できるようにする分子プロセスの重要なステップを特定したことを記している。
本チームによるマウス実験では、老化と放射線によるDNA損傷の修復が可能であることを示唆している。このアンチエイジング効果はNASAが火星ミッションに使用できると注目するほど有望である。人間の細胞はDNA損傷を修復する先天的な能力を持ってはいるが、この能力は年を取るにつれて低下するものである。研究チームは体内のあらゆる細胞に存在する代謝物であるNAD+が、このDNA修復を制御するタンパク質間相互作用の調節因子として重要な役割を担っていることを特定した。 NMN と呼ばれるNAD+前駆体(「ブースター」)でマウスを治療することにより、放射線曝露または老化によるDNA損傷を修復する細胞の能力が向上したのである。
「老齢マウスの細胞が、わずか1週間の治療後には、若いマウスのものと区別がつかないほどになったのです。」と、UNSW医科大学のハーバード・メディカルスクールのDavid Sinclair教授は語る。 NMN療法のヒト試験は6ヶ月以内に開始される。「これは安全で効果的なアンチエイジング薬に今最も近いものです。治験がうまくいけば、市場に出るのは3〜5年後にな
オーストラリアのニューサウスウェールズ大学(UNSW)の研究者らは、実際に老化を逆行させ、DNA修復を改善し、NASAの火星任務をも可能にするであろう革新的な薬物を発見した。2017年3月23日のScience誌に発表された論文は「老化中のタンパク質-タンパク質相互作用を調節する保存されたNAD+結合ポケット(“A Conserved NAD+ Binding Pocket That Regulates Protein-Protein Interactions During Aging.”)」と題され、研究者チームは細胞が損傷したDNAを修復できるようにする分子プロセスの重要なステップを特定したことを記している。
本チームによるマウス実験では、老化と放射線によるDNA損傷の修復が可能であることを示唆している。このアンチエイジング効果はNASAが火星ミッションに使用できると注目するほど有望である。人間の細胞はDNA損傷を修復する先天的な能力を持ってはいるが、この能力は年を取るにつれて低下するものである。研究チームは体内のあらゆる細胞に存在する代謝物であるNAD+が、このDNA修復を制御するタンパク質間相互作用の調節因子として重要な役割を担っていることを特定した。 NMN と呼ばれるNAD+前駆体(「ブースター」)でマウスを治療することにより、放射線曝露または老化によるDNA損傷を修復する細胞の能力が向上したのである。
「老齢マウスの細胞が、わずか1週間の治療後には、若いマウスのものと区別がつかないほどになったのです。」と、UNSW医科大学のハーバード・メディカルスクールのDavid Sinclair教授は語る。 NMN療法のヒト試験は6ヶ月以内に開始される。「これは安全で効果的なアンチエイジング薬に今最も近いものです。治験がうまくいけば、市場に出るのは3〜5年後にな
タンパク質間相互作用を安定化する天然分子が軸索再生を刺激。脊髄損傷や卒中の標的候補になり得るか?
 ある研究者の植物生物学への取り組みによって、天然分子が軸索(ニューロン間で電気信号を運ぶ糸状突起物)の修復を刺激促進することが発見された。脊髄損傷や卒中などの障害症状を引き起こす主な原因はこの軸索損傷である。
マギル大学(カナダ)のモントリオール神経学研究所病院に所属するAndrew Kaplan博士は、Alyson Fournier博士(Neurology and Neurosurgery教授)の研究室が調べていた神経保護機能を持つ14-3-3タンパク質ファミリーに注目し、軸索再生の薬理学的な研究文献を探していた。その検索中に植物が特定タイプの真菌感染にどう反応するかを記述した研究を見つけた。真菌類の特定の種が産生するfusicoccin-Aという低分子物質にさらされると、植物の葉はしぼむが根は長く伸びるようになる。fusicoccin-Aは、14-3-3タンパク質と他のタンパク質との相互作用を安定化させることで、14-3-3タンパク質の活動に影響を与える働きがある。Kaplan博士は、「この現象では14-3-3タンパク質の存在が共通しているが、この反応に関わっている他のタンパク質や反応の結果の生物活性は植物動物の間ではそれぞれに異なっている」と述べている。彼は、軸索再生には、fusicoccin-Aを用いて14-3-3タンパク質を活動させるのがもっとも効果的なのではないかという仮説を立てた。
この説を実証するため、彼の研究チームは物理的な損傷を与えたニューロンを培養基に入れ、天然分子で処理した上でその結果を観察した。Kaplan博士は、「翌日、顕微鏡を覗いてみると、軸索が雑草のように伸びていた。fusicoccin-Aが損傷した神経系の中で軸索修復を刺激促進できると決定するに至った素晴らしい結果だった。2017年3月8日付Neuron誌オンライン版に掲載されたこの論
ある研究者の植物生物学への取り組みによって、天然分子が軸索(ニューロン間で電気信号を運ぶ糸状突起物)の修復を刺激促進することが発見された。脊髄損傷や卒中などの障害症状を引き起こす主な原因はこの軸索損傷である。
マギル大学(カナダ)のモントリオール神経学研究所病院に所属するAndrew Kaplan博士は、Alyson Fournier博士(Neurology and Neurosurgery教授)の研究室が調べていた神経保護機能を持つ14-3-3タンパク質ファミリーに注目し、軸索再生の薬理学的な研究文献を探していた。その検索中に植物が特定タイプの真菌感染にどう反応するかを記述した研究を見つけた。真菌類の特定の種が産生するfusicoccin-Aという低分子物質にさらされると、植物の葉はしぼむが根は長く伸びるようになる。fusicoccin-Aは、14-3-3タンパク質と他のタンパク質との相互作用を安定化させることで、14-3-3タンパク質の活動に影響を与える働きがある。Kaplan博士は、「この現象では14-3-3タンパク質の存在が共通しているが、この反応に関わっている他のタンパク質や反応の結果の生物活性は植物動物の間ではそれぞれに異なっている」と述べている。彼は、軸索再生には、fusicoccin-Aを用いて14-3-3タンパク質を活動させるのがもっとも効果的なのではないかという仮説を立てた。
この説を実証するため、彼の研究チームは物理的な損傷を与えたニューロンを培養基に入れ、天然分子で処理した上でその結果を観察した。Kaplan博士は、「翌日、顕微鏡を覗いてみると、軸索が雑草のように伸びていた。fusicoccin-Aが損傷した神経系の中で軸索修復を刺激促進できると決定するに至った素晴らしい結果だった。2017年3月8日付Neuron誌オンライン版に掲載されたこの論
褐色脂肪組織を活性化する肥満・糖尿病薬に期待が集まる
 白色脂肪に比べると、褐色脂肪はかなりの速さで燃焼し、エネルギーに変わるが、これまで人体の褐色脂肪の比率はかなり小さいものと思われていた。ところが、ドイツのTechnical University of Munich (TUM) 研究チームの研究で、人体中の褐色脂肪の量はこれまで考えられていたよりも3倍も多いことが分かった。そのことから、褐色脂肪組織を活性化する新しいタイプの肥満・糖尿病薬がより効果的ではないかと期待されている。
Journal of Nuclear Medicineに掲載されたこの研究では、1,644人の患者の3,000件近いPETスキャンが分析されている。PETは、「Positron Eemission Tomography陽電子放出断層撮影」」の頭字語であり、がん医療で広く用いられている。このPETスキャンは、体内の代謝活動を画像化することができる。腫瘍組織は、健康な組織とは違ったエネルギー代謝をしていることが多く、転移があればPETスキャンで検出することもできる。TUMのElse-Kröner-Fresenius Center所属のDr .Tobias Frommeは、「PETスキャン技術の副産物として、活性な褐色脂肪組織を画像化することもできた。褐色脂肪組織は多量の糖を吸収するため、スキャンでこの活動を観察することができるのである」と述べている。たとえば、薬剤で褐色脂肪の活性を高めることで糖尿病患者の高すぎる血糖値を引き下げることも考えられる。また、肥満患者が、エネルギー燃焼量の高い褐色脂肪を利用して余分な体重をエネルギーとして燃やしてしまうことも考えられる。少なくともある程度までは可能だろう。
Dr .Tobias Frommeは、「いずれにしろ、褐色脂肪組織に対する薬剤の効力を引き上げることは可能だ」と述べている。PETスキャンの分析か
白色脂肪に比べると、褐色脂肪はかなりの速さで燃焼し、エネルギーに変わるが、これまで人体の褐色脂肪の比率はかなり小さいものと思われていた。ところが、ドイツのTechnical University of Munich (TUM) 研究チームの研究で、人体中の褐色脂肪の量はこれまで考えられていたよりも3倍も多いことが分かった。そのことから、褐色脂肪組織を活性化する新しいタイプの肥満・糖尿病薬がより効果的ではないかと期待されている。
Journal of Nuclear Medicineに掲載されたこの研究では、1,644人の患者の3,000件近いPETスキャンが分析されている。PETは、「Positron Eemission Tomography陽電子放出断層撮影」」の頭字語であり、がん医療で広く用いられている。このPETスキャンは、体内の代謝活動を画像化することができる。腫瘍組織は、健康な組織とは違ったエネルギー代謝をしていることが多く、転移があればPETスキャンで検出することもできる。TUMのElse-Kröner-Fresenius Center所属のDr .Tobias Frommeは、「PETスキャン技術の副産物として、活性な褐色脂肪組織を画像化することもできた。褐色脂肪組織は多量の糖を吸収するため、スキャンでこの活動を観察することができるのである」と述べている。たとえば、薬剤で褐色脂肪の活性を高めることで糖尿病患者の高すぎる血糖値を引き下げることも考えられる。また、肥満患者が、エネルギー燃焼量の高い褐色脂肪を利用して余分な体重をエネルギーとして燃やしてしまうことも考えられる。少なくともある程度までは可能だろう。
Dr .Tobias Frommeは、「いずれにしろ、褐色脂肪組織に対する薬剤の効力を引き上げることは可能だ」と述べている。PETスキャンの分析か
ssODNライブラリーで血漿エキソソームから乳がんを検出
 プレシジョンメディシンの実現に専念する分子科学分野の先進企業、Caris Life Sciences® は、2017年2月21日付けで、同社のADAPT Biotargeting System™ で、血漿中のエキソソームの低侵襲性液相生検で乳がんを検出し、乳がんの有無を判別できることが実証されたと発表した。この研究論文は、「Plasma Exosome Profiling of Cancer Patients by a Next Generation Systems Biology Approach (次世代システムの生体的アプローチによるがん患者の血漿エキソソーム・プロファイル化)」と題するオープンアクセス論文として、2月20日付Nature’s Scientific Reportsに掲載された。
University of Tennessee Health Science Center, Division of Hematology/Oncologyの長を務めるDr. Lee Schwartzberg (この研究には関わっていない) は、「幅広い種類のバイオマーカーを対象とする低侵襲性血液検査法で乳がんを正確に検出できれば、乳がん診断と患者管理の面で大きな進歩をもたらすことと考えられる。この研究の成果は、将来的に、現在の乳房撮影法その他の画像技術による標準的な検査法の欠陥を解消する可能性が開けており、また、現行の標準診断法でははっきりした結果が出ないために患者がさらに侵襲的な組織生検を受けなければならなくなることも多い」と述べている。ADAPT Biotargeting Systemは、個別または複合ターゲットに結合する1本鎖オリゴデオキシヌクレオチド(ssODN) アプタマーを搭載した非常に複雑なライブラリーを用い、生体系全体にわたって生体サンプルのプロファイ
プレシジョンメディシンの実現に専念する分子科学分野の先進企業、Caris Life Sciences® は、2017年2月21日付けで、同社のADAPT Biotargeting System™ で、血漿中のエキソソームの低侵襲性液相生検で乳がんを検出し、乳がんの有無を判別できることが実証されたと発表した。この研究論文は、「Plasma Exosome Profiling of Cancer Patients by a Next Generation Systems Biology Approach (次世代システムの生体的アプローチによるがん患者の血漿エキソソーム・プロファイル化)」と題するオープンアクセス論文として、2月20日付Nature’s Scientific Reportsに掲載された。
University of Tennessee Health Science Center, Division of Hematology/Oncologyの長を務めるDr. Lee Schwartzberg (この研究には関わっていない) は、「幅広い種類のバイオマーカーを対象とする低侵襲性血液検査法で乳がんを正確に検出できれば、乳がん診断と患者管理の面で大きな進歩をもたらすことと考えられる。この研究の成果は、将来的に、現在の乳房撮影法その他の画像技術による標準的な検査法の欠陥を解消する可能性が開けており、また、現行の標準診断法でははっきりした結果が出ないために患者がさらに侵襲的な組織生検を受けなければならなくなることも多い」と述べている。ADAPT Biotargeting Systemは、個別または複合ターゲットに結合する1本鎖オリゴデオキシヌクレオチド(ssODN) アプタマーを搭載した非常に複雑なライブラリーを用い、生体系全体にわたって生体サンプルのプロファイ
人の脳で両親の遺伝子の発現に差があることが判明
 過去100年以上の間、人体の細胞は、おおむね生涯にわたってほぼ平等に両親の染色体の遺伝子を発現するものと思われていた。しかし、両親の特定遺伝子の活性を測定する検査法を発明した研究グループが、生命体というのはもう少し微妙なものだと研究論文で述べている。同研究グループは、2017年2月23日付Neuron誌に掲載された研究論文で、げっ歯類、サル、ヒトの脳で個別ニューロンまたは特定タイプのニューロンが片方の親の遺伝子を抑制することも珍しくないと報告している。
この論文は、「Diverse Non-genetic, Allele-Specific Expression Effects Shape Genetic Architecture at the Cellular Level in the Mammalian Brain (哺乳動物の脳において細胞レベルで遺伝的構造を形成する多様な非遺伝性対立遺伝子固有の発現の効果)」と題されている。驚いたことには、母親と父親の遺伝子コピーの活性化差異は、ほとんどの場合、発達中の脳に見られ、約85%の遺伝子がその影響を受けている。脳が成熟するにつれてニューロンは両親の遺伝子を平等に発現するようになる。しかし、成人の脳でも両親の遺伝子コピーの少なくとも10%で発現差異が見られ、脳のかなりの数の遺伝子が、その個体の生涯にわたってこのアンバランスを維持している。
この論文の首席著者であり、University of Utah School of Medicine所属の神経生物学者であり、New York Stem Cell FoundationのRobertson Investigatorの肩書きを持つDr. Christopher Greggは、「この話は、なぜ生物が有性生殖をするのかという理由に関わっている。有性生殖は、2組の遺伝子コピ
過去100年以上の間、人体の細胞は、おおむね生涯にわたってほぼ平等に両親の染色体の遺伝子を発現するものと思われていた。しかし、両親の特定遺伝子の活性を測定する検査法を発明した研究グループが、生命体というのはもう少し微妙なものだと研究論文で述べている。同研究グループは、2017年2月23日付Neuron誌に掲載された研究論文で、げっ歯類、サル、ヒトの脳で個別ニューロンまたは特定タイプのニューロンが片方の親の遺伝子を抑制することも珍しくないと報告している。
この論文は、「Diverse Non-genetic, Allele-Specific Expression Effects Shape Genetic Architecture at the Cellular Level in the Mammalian Brain (哺乳動物の脳において細胞レベルで遺伝的構造を形成する多様な非遺伝性対立遺伝子固有の発現の効果)」と題されている。驚いたことには、母親と父親の遺伝子コピーの活性化差異は、ほとんどの場合、発達中の脳に見られ、約85%の遺伝子がその影響を受けている。脳が成熟するにつれてニューロンは両親の遺伝子を平等に発現するようになる。しかし、成人の脳でも両親の遺伝子コピーの少なくとも10%で発現差異が見られ、脳のかなりの数の遺伝子が、その個体の生涯にわたってこのアンバランスを維持している。
この論文の首席著者であり、University of Utah School of Medicine所属の神経生物学者であり、New York Stem Cell FoundationのRobertson Investigatorの肩書きを持つDr. Christopher Greggは、「この話は、なぜ生物が有性生殖をするのかという理由に関わっている。有性生殖は、2組の遺伝子コピ
スクリプス研究所が腸の脂肪を燃やす脳ホルモン (FLP-7) を発見
 スクリプス研究所(The Scripps Research Institute) の生物学者グループがお腹の脂肪を燃やす引き金とみられる脳ホルモンを突き止めた。動物モデル研究での発見だが、将来の医薬開発にも役立つ可能性がある。2017年1月27日付Nature Communications誌オンライン版で発表されたこの研究論文の首席筆者を務めたスクリプス研究所の准教授、Supriya Srinivasan, Ph.D.は、「この研究は興味深い謎を解く基礎科学研究だ」と述べている。
オープンアクセスとして発表されたこの論文は、「A Tachykinin-Like Neuroendocrine Signalling Axis Couples Central Serotonin Action and Nutrient Sensing with Peripheral Lipid Metabolism (中枢セロトニン活動や栄養感知を末梢脂肪代謝と結合するタキキニン様神経内分泌物信号伝達軸索)」と題されている。過去の研究で神経伝達物質のセロトニンが脂肪減量効果があることは知られていた。しかし、その正確な機序を分かっていなかった。その疑問に答えるため、Dr. Srinivasanの研究グループは、生物学でよくモデル生物として利用されるC. elegansという線虫で研究した。
この線虫は人間よりも単純な代謝系を持っているが、その脳では、人間の脳と同じ信号伝達分子が多数生成されるため、C. elegansでの研究結果は人間にも応用できると考えている研究者は多い。まず、研究グループは、C. elegansの遺伝子を取り除き、脳セロトニンと脂肪燃焼の間の経路が切断できるかどうかを調べた。遺伝子を一つずつ順番に取り除いていけば脂肪燃焼を起こしている遺伝子が見つかると期待した。この消去
スクリプス研究所(The Scripps Research Institute) の生物学者グループがお腹の脂肪を燃やす引き金とみられる脳ホルモンを突き止めた。動物モデル研究での発見だが、将来の医薬開発にも役立つ可能性がある。2017年1月27日付Nature Communications誌オンライン版で発表されたこの研究論文の首席筆者を務めたスクリプス研究所の准教授、Supriya Srinivasan, Ph.D.は、「この研究は興味深い謎を解く基礎科学研究だ」と述べている。
オープンアクセスとして発表されたこの論文は、「A Tachykinin-Like Neuroendocrine Signalling Axis Couples Central Serotonin Action and Nutrient Sensing with Peripheral Lipid Metabolism (中枢セロトニン活動や栄養感知を末梢脂肪代謝と結合するタキキニン様神経内分泌物信号伝達軸索)」と題されている。過去の研究で神経伝達物質のセロトニンが脂肪減量効果があることは知られていた。しかし、その正確な機序を分かっていなかった。その疑問に答えるため、Dr. Srinivasanの研究グループは、生物学でよくモデル生物として利用されるC. elegansという線虫で研究した。
この線虫は人間よりも単純な代謝系を持っているが、その脳では、人間の脳と同じ信号伝達分子が多数生成されるため、C. elegansでの研究結果は人間にも応用できると考えている研究者は多い。まず、研究グループは、C. elegansの遺伝子を取り除き、脳セロトニンと脂肪燃焼の間の経路が切断できるかどうかを調べた。遺伝子を一つずつ順番に取り除いていけば脂肪燃焼を起こしている遺伝子が見つかると期待した。この消去
幹細胞エキソソームが網膜神経節細胞の生存を高める。緑内障治療にも応用可能か
 最近のラットを対象にした研究で、幹細胞から放出される特定の小胞 (Exosome:エキソソーム) が、眼球底部の感光組織、網膜の細胞を保護するらしいことが確かめられた。この研究論文は、2017年1月26日付Stem Cells Translational Medicineに掲載されており、アメリカで最大の失明の原因である緑内障の治療法への応用を示唆している。
この研究は、National Institutes of Health内のNational Eye Institute (NEI) の研究グループが実施し、論文は、「Bone Marrow-Derived Mesenchymal Stem Cells-Derived Exosomes Promote Survival of Retinal Ganglion Cells Through miRNA-Dependent Mechanisms (骨髄間葉系幹細胞由来のエキソソームが、miRNA依存メカニズムにより網膜神経節細胞の生存率を高める)」と題されている。エキソソームは膜に包まれた小さな袋で、細胞内で形成され、細胞外に放出される。長年、エキソソームは細胞からの廃棄メカニズムの一部と考えられていたが、比較的最近になってエキソソームにはタンパク質、脂質、遺伝子調節RNAなどが含まれていることが明らかになった。いくつかの研究で、細胞から放出されたエキソソームが他の細胞の細胞膜と融合して取り込まれ、その細胞を刺激して新しいタンパク質を生成させることが突き止められた。さらには、エキソソームが細胞同士の相互作用を仲介したり、信号を伝達したりするなどの役割を持っていることも明らかになり、エキソソームの治療効果を探る研究が進められた。現在の研究では、NEIのポスドク研究員、Ben Mead, Ph.D.が、網膜細胞の一種で、眼
最近のラットを対象にした研究で、幹細胞から放出される特定の小胞 (Exosome:エキソソーム) が、眼球底部の感光組織、網膜の細胞を保護するらしいことが確かめられた。この研究論文は、2017年1月26日付Stem Cells Translational Medicineに掲載されており、アメリカで最大の失明の原因である緑内障の治療法への応用を示唆している。
この研究は、National Institutes of Health内のNational Eye Institute (NEI) の研究グループが実施し、論文は、「Bone Marrow-Derived Mesenchymal Stem Cells-Derived Exosomes Promote Survival of Retinal Ganglion Cells Through miRNA-Dependent Mechanisms (骨髄間葉系幹細胞由来のエキソソームが、miRNA依存メカニズムにより網膜神経節細胞の生存率を高める)」と題されている。エキソソームは膜に包まれた小さな袋で、細胞内で形成され、細胞外に放出される。長年、エキソソームは細胞からの廃棄メカニズムの一部と考えられていたが、比較的最近になってエキソソームにはタンパク質、脂質、遺伝子調節RNAなどが含まれていることが明らかになった。いくつかの研究で、細胞から放出されたエキソソームが他の細胞の細胞膜と融合して取り込まれ、その細胞を刺激して新しいタンパク質を生成させることが突き止められた。さらには、エキソソームが細胞同士の相互作用を仲介したり、信号を伝達したりするなどの役割を持っていることも明らかになり、エキソソームの治療効果を探る研究が進められた。現在の研究では、NEIのポスドク研究員、Ben Mead, Ph.D.が、網膜細胞の一種で、眼
TGenが膠芽腫の治療に有望な化合物を突き止める
 成人の脳腫瘍で最も一般的で致命的なタイプの膠芽腫(グリオブラストーマ)に対する効果的な治療法の開発は遅々として進まないが、アリゾナ州のTranslational Genomics Research Institute (TGen) の研究者の率いる研究グループが「効果的な阻害物質」を発見した。2017年1月17日付の学術誌「Oncotarget」オンライン版に掲載されたTGen率いる研究チームの論文によると、ある種の化学的なカスケード反応で膠芽腫細胞が正常な脳組織に侵入し、化学療法に対しても放射線療法に対しても耐性を持つようになるが、研究室の実験で、アウリントリカルボン酸 (ATA) がこのカスケード反応を阻止することが示された。
この論文は、「Identification of Aurintricarboxylic Acid As a Selective Inhibitor of the TWEAK-Fn14 Signaling Pathway in Glioblastoma Cells (膠芽腫細胞中のTWEAK-Fn14シグナル経路の選択的阻害物質アウリントリカルボン酸の判定)」と題されている。この論文の筆頭著者で、TGen, Cancer and Cell Biology Divisionの准教授を務めるDr. Harshil Dhruvは、「この研究成果は、多形性膠芽腫 (GBM) の効果的な長期治療法を探す私たちの努力に対して明るい見通しを与えてくれた」と述べている。
膠芽腫の初期治療としては、腫瘍の外科的切除、放射線療法やtemozolomide (TMZ) を用いた化学療法が行われている。しかし、膠芽腫は周辺脳組織に浸潤するという厄介な傾向があり、腫瘍細胞を全て外科的に取り除くことは難しい。加えて、浸潤性膠芽腫はTMZへの耐性も示し、最終的に、それ
成人の脳腫瘍で最も一般的で致命的なタイプの膠芽腫(グリオブラストーマ)に対する効果的な治療法の開発は遅々として進まないが、アリゾナ州のTranslational Genomics Research Institute (TGen) の研究者の率いる研究グループが「効果的な阻害物質」を発見した。2017年1月17日付の学術誌「Oncotarget」オンライン版に掲載されたTGen率いる研究チームの論文によると、ある種の化学的なカスケード反応で膠芽腫細胞が正常な脳組織に侵入し、化学療法に対しても放射線療法に対しても耐性を持つようになるが、研究室の実験で、アウリントリカルボン酸 (ATA) がこのカスケード反応を阻止することが示された。
この論文は、「Identification of Aurintricarboxylic Acid As a Selective Inhibitor of the TWEAK-Fn14 Signaling Pathway in Glioblastoma Cells (膠芽腫細胞中のTWEAK-Fn14シグナル経路の選択的阻害物質アウリントリカルボン酸の判定)」と題されている。この論文の筆頭著者で、TGen, Cancer and Cell Biology Divisionの准教授を務めるDr. Harshil Dhruvは、「この研究成果は、多形性膠芽腫 (GBM) の効果的な長期治療法を探す私たちの努力に対して明るい見通しを与えてくれた」と述べている。
膠芽腫の初期治療としては、腫瘍の外科的切除、放射線療法やtemozolomide (TMZ) を用いた化学療法が行われている。しかし、膠芽腫は周辺脳組織に浸潤するという厄介な傾向があり、腫瘍細胞を全て外科的に取り除くことは難しい。加えて、浸潤性膠芽腫はTMZへの耐性も示し、最終的に、それ
細胞コレステロールの役割解明に一歩迫る
 長年、科学者はコレステロールについて頭をひねっていた。コレステロールは生体に必須の物質であり、同時にはっきりと有害な物質だが、細胞でコレステロールがもっとも集中している細胞膜でのその働きを誰も知らない。イリノイ州シカゴ市のUniversity of Illinois at Chicago (UIC) の研究チームは、先駆的な光学画像技術を用い、世界で初めて細胞膜内でのコレステロールの位置と動きを正確に追跡した。その結果、コレステロールは様々な生体的役割の他に、細胞膜内で情報を伝達する信号分子の役割という意外な発見があった。
この研究論文は、2016年12月26日付Nature Chemical Biologyオンライン版に掲載され、「Orthogonal Lipid Sensors Identify Transbilayer Asymmetry of Plasma Membrane Cholesterol (直交脂質センサーで形質膜コレステロールの二重層間非対称性突き止める)」と題されている。この研究を指導したUICの化学教授、Wonhwa Cho, Ph.D.は、「コレステロールという脂質は循環器系疾患との関連で悪者扱いされている。かなり研究はされてきたが、細胞内での機能については余り知られていない。その役割は何か? 悪玉脂質なのか? 絶対にそんなことはない。たとえば、脳は約半分が脂質であり、脳の中でもっとも量の多い脂質はコレステロールだ」と述べている。コレステロール欠乏症で何種類かの疾患が起きるし、体内で12種ほどのステロイド・ホルモンをつくるのもコレステロールが出発物質になっている。Dr. Choの以前の研究で、コレステロールが様々な調節分子、特に細胞タンパク質と相互作用していることは突き止められていたが、コレステロール自体が調節分子とは考えられていなかった。Dr.
長年、科学者はコレステロールについて頭をひねっていた。コレステロールは生体に必須の物質であり、同時にはっきりと有害な物質だが、細胞でコレステロールがもっとも集中している細胞膜でのその働きを誰も知らない。イリノイ州シカゴ市のUniversity of Illinois at Chicago (UIC) の研究チームは、先駆的な光学画像技術を用い、世界で初めて細胞膜内でのコレステロールの位置と動きを正確に追跡した。その結果、コレステロールは様々な生体的役割の他に、細胞膜内で情報を伝達する信号分子の役割という意外な発見があった。
この研究論文は、2016年12月26日付Nature Chemical Biologyオンライン版に掲載され、「Orthogonal Lipid Sensors Identify Transbilayer Asymmetry of Plasma Membrane Cholesterol (直交脂質センサーで形質膜コレステロールの二重層間非対称性突き止める)」と題されている。この研究を指導したUICの化学教授、Wonhwa Cho, Ph.D.は、「コレステロールという脂質は循環器系疾患との関連で悪者扱いされている。かなり研究はされてきたが、細胞内での機能については余り知られていない。その役割は何か? 悪玉脂質なのか? 絶対にそんなことはない。たとえば、脳は約半分が脂質であり、脳の中でもっとも量の多い脂質はコレステロールだ」と述べている。コレステロール欠乏症で何種類かの疾患が起きるし、体内で12種ほどのステロイド・ホルモンをつくるのもコレステロールが出発物質になっている。Dr. Choの以前の研究で、コレステロールが様々な調節分子、特に細胞タンパク質と相互作用していることは突き止められていたが、コレステロール自体が調節分子とは考えられていなかった。Dr.
新ツール「オプトドロップレット」で生細胞内のタンパク質凝集と相転移に光を当てる
 生細胞の中のタンパク質がどのように液体やゲル状固体と言った異なる状態に組み立てられるかを理解するために、光で物質を操作するツールが用いられ始めた。細胞は驚異的な複雑さで数千もの化学反応を同時にこなしており、いくつかの反応はオルガネラと呼ばれる特殊なコンパートメント内で行われている。
しかし、あるオルガネラは、細胞内に浮遊する物質を取り除く膜を欠いている。 これら膜のないオルガネラは何らかの形で、タンパク質・核酸等の分子が浮かぶ細胞の海の真っただなかで自己完結型構造として存続している。プリンストン大学の科学者は、膜のないオルガネラが機能する化学作用の理解へ、これまでにない道筋を提供する新しいツール「オプトドロップレット」を開発した。 「このオプトドロップレットは、膜のないオルガネラの自己組織化を支配する物理学的・化学的規則を理解することを可能にする。このプロセスの根底にある基本的なメカニズムはほとんど理解されておらず、我々の取り組みによって、ALSのようなタンパク質凝集を伴う病気の治療法を開発できる希望があるかもしれない。」 と2016年12月29日にCellにオンラインで掲載された論文の上級著者であるプリンストン大学の化学生物学の助教授、Clifford Brangwynne博士は述べている。Cellの論文は、「Spatiotemporal Control of Intracellular Phase Transitions Using Light-Activated optoDroplets.(光作動オプトドロップレットを用いた細胞内相転移の時空間制御)」と題されている。以前の研究では、相転移プロセスによって膜のないオルガネラが細胞内で組み立てられることを示した。Brangwynne博士らによるこの数年間の研究では、特定のタンパク質の濃度を変更したり、構造を変更し
生細胞の中のタンパク質がどのように液体やゲル状固体と言った異なる状態に組み立てられるかを理解するために、光で物質を操作するツールが用いられ始めた。細胞は驚異的な複雑さで数千もの化学反応を同時にこなしており、いくつかの反応はオルガネラと呼ばれる特殊なコンパートメント内で行われている。
しかし、あるオルガネラは、細胞内に浮遊する物質を取り除く膜を欠いている。 これら膜のないオルガネラは何らかの形で、タンパク質・核酸等の分子が浮かぶ細胞の海の真っただなかで自己完結型構造として存続している。プリンストン大学の科学者は、膜のないオルガネラが機能する化学作用の理解へ、これまでにない道筋を提供する新しいツール「オプトドロップレット」を開発した。 「このオプトドロップレットは、膜のないオルガネラの自己組織化を支配する物理学的・化学的規則を理解することを可能にする。このプロセスの根底にある基本的なメカニズムはほとんど理解されておらず、我々の取り組みによって、ALSのようなタンパク質凝集を伴う病気の治療法を開発できる希望があるかもしれない。」 と2016年12月29日にCellにオンラインで掲載された論文の上級著者であるプリンストン大学の化学生物学の助教授、Clifford Brangwynne博士は述べている。Cellの論文は、「Spatiotemporal Control of Intracellular Phase Transitions Using Light-Activated optoDroplets.(光作動オプトドロップレットを用いた細胞内相転移の時空間制御)」と題されている。以前の研究では、相転移プロセスによって膜のないオルガネラが細胞内で組み立てられることを示した。Brangwynne博士らによるこの数年間の研究では、特定のタンパク質の濃度を変更したり、構造を変更し
アルツハイマー病を治療できる可能性がある新しい分子の研究
 最近、アルツハイマー病を治療する可能性がある新しい分子について、2つの重要な研究成果が発表された。 両研究の主任研究員は、モスクワ物理技術研究所(MIPT:Moscow Institute of Physics and Technology)の医化学生命情報学研究所の所長Yan Ivanenkov博士である。 2つの新しい分子の論文は、Molecular Pharmaceutics and Current Alzheimer Researchに掲載された。 別のMIPT研究者Mark Veselovも第2の研究に参加した。
両論文は、5-HT6R受容体に対する神経保護物質 -アンタゴニストの研究をカバーしている。 最新の研究では、この標的がアルツハイマー病において高い治療可能性を有することが確認されている。 動物実験による前臨床試験は、研究した2つの化合物が高い選択性を有することを示した。アルツハイマー病は、高齢者において最も広範な疾患の1つである。 60歳以上の人はこの疾患を発症するリスクが最も高いが、若年でも起こる可能性がある。 患者は記憶および認知機能の喪失に苦しんでいる。 彼らは社会から切り離されて孤立し、体は適切に機能しなくなり、必然的に死に至る。 医療統計によると、アルツハイマー病は、高齢者の認知症の3症例のうち2症例を占める原因であり、先進国では大きな経済的問題となっているが、科学者はまだアルツハイマー病の有効な治療法を見つけるに至っておらず、疾患の発症に関して多くのことが分かっているとは言え解決には程遠い。 この疾患の症状を軽減するために、医薬品研究が行われている。論文では、Alla Chem LLC、Avineuro Pharmaceuticals Inc.、およびR-Pharm Overseas Inc.(すべての米国企業)の専門家Alexand
最近、アルツハイマー病を治療する可能性がある新しい分子について、2つの重要な研究成果が発表された。 両研究の主任研究員は、モスクワ物理技術研究所(MIPT:Moscow Institute of Physics and Technology)の医化学生命情報学研究所の所長Yan Ivanenkov博士である。 2つの新しい分子の論文は、Molecular Pharmaceutics and Current Alzheimer Researchに掲載された。 別のMIPT研究者Mark Veselovも第2の研究に参加した。
両論文は、5-HT6R受容体に対する神経保護物質 -アンタゴニストの研究をカバーしている。 最新の研究では、この標的がアルツハイマー病において高い治療可能性を有することが確認されている。 動物実験による前臨床試験は、研究した2つの化合物が高い選択性を有することを示した。アルツハイマー病は、高齢者において最も広範な疾患の1つである。 60歳以上の人はこの疾患を発症するリスクが最も高いが、若年でも起こる可能性がある。 患者は記憶および認知機能の喪失に苦しんでいる。 彼らは社会から切り離されて孤立し、体は適切に機能しなくなり、必然的に死に至る。 医療統計によると、アルツハイマー病は、高齢者の認知症の3症例のうち2症例を占める原因であり、先進国では大きな経済的問題となっているが、科学者はまだアルツハイマー病の有効な治療法を見つけるに至っておらず、疾患の発症に関して多くのことが分かっているとは言え解決には程遠い。 この疾患の症状を軽減するために、医薬品研究が行われている。論文では、Alla Chem LLC、Avineuro Pharmaceuticals Inc.、およびR-Pharm Overseas Inc.(すべての米国企業)の専門家Alexand
ハーバード大学の研究チームが多域Brain-on-a-Chipを新開発
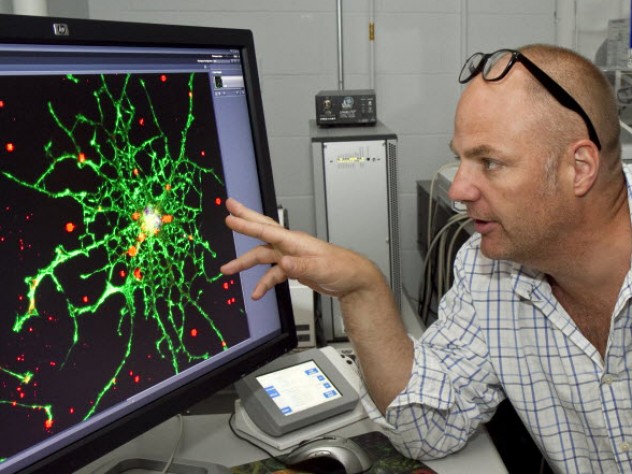 ハーバード大学の研究チームは、脳の3つの領域の間の接続性をモデルとする多域brain-on-a-chipを新しく開発した。その過程で、脳の異なる領域のニューロンの違いを詳しく調べ、領域間の接続性を再現する目的でin vitroモデルが用いられた。
このハーバード大学の研究論文は、2016年12月28日付The Journal of Neurophysiology誌オンライン版に掲載され、「Neurons Derived from Different Brain Regions Are Inherently Different in Vitro: A Novel Multiregional Brain-On-A-Chip (In Vitroで、脳の領域ごとにニューロンが本質的に異なることを解明:新しい発想の多域Brain-On-A-Chip)」と題されている。共同第一著者を務めた、Harvard John A. Paulson School of Engineering and Applied Sciences (SEAS), Disease Biophysics Groupのポスドク研究員のBen Maoz, Ph.D.は、「脳は個別ニューロンの集まり以上のものだ。様々なタイプの細胞があり、異なる領域間が接続されている」と述べている。脳をモデル化する場合、領域間の接続を攻撃する様々な疾患があるため、研究ではその接続性を再現できなければならない。ハーバード大学 Wyss Institute for Biologically Inspired EngineeringのCore Faculty Member であり、SEAS, Bioengineering and Applied Physics BuildingのTarr Family Professorを務めるKit Par
ハーバード大学の研究チームは、脳の3つの領域の間の接続性をモデルとする多域brain-on-a-chipを新しく開発した。その過程で、脳の異なる領域のニューロンの違いを詳しく調べ、領域間の接続性を再現する目的でin vitroモデルが用いられた。
このハーバード大学の研究論文は、2016年12月28日付The Journal of Neurophysiology誌オンライン版に掲載され、「Neurons Derived from Different Brain Regions Are Inherently Different in Vitro: A Novel Multiregional Brain-On-A-Chip (In Vitroで、脳の領域ごとにニューロンが本質的に異なることを解明:新しい発想の多域Brain-On-A-Chip)」と題されている。共同第一著者を務めた、Harvard John A. Paulson School of Engineering and Applied Sciences (SEAS), Disease Biophysics Groupのポスドク研究員のBen Maoz, Ph.D.は、「脳は個別ニューロンの集まり以上のものだ。様々なタイプの細胞があり、異なる領域間が接続されている」と述べている。脳をモデル化する場合、領域間の接続を攻撃する様々な疾患があるため、研究ではその接続性を再現できなければならない。ハーバード大学 Wyss Institute for Biologically Inspired EngineeringのCore Faculty Member であり、SEAS, Bioengineering and Applied Physics BuildingのTarr Family Professorを務めるKit Par
T細胞活性の違いに関連したクロマチンアクセシビリティのゲノムワイド変化
 La Jolla Institute for Allergy and Immunologyの研究チームは、T細胞活性をコントロールする遺伝子発現パターンをさらに良く理解するため、急性、慢性のウイルス感染に対してT細胞が反応する際のゲノムワイドにおけるクロマチンアクセシビリティの変化をマップ化した。2016年12月20日付Immunityオンライン版に掲載されたこの研究結果は、Tリンパ球の処分を決める分子メカニズムに光を当て、さらにT細胞活性を調節し、免疫機能改善のための臨床介入方法に新しい道を開くもので、研究論文は、「Genome-Wide Changes in Chromatin Accessibility in CD8 T Cells During Viral Infection (ウイルス感染時のCD8 T細胞のゲノムワイドのクロマチンアクセシビリティの変化)」と題されている。
Division of Signaling and Gene Expressionの教授を務めるAnjana Rao, Ph.D.の研究室のポスドク研究員、Dr. James Scott-Browneがこの論文の第一著者を務めており、論文中、「T細胞の状態とそれに伴うT細胞の機能を決定する複数の因子を判定することは、そのT細胞がウイルス感染や腫瘍増殖と戦えるかどうか、また、長期的に防御機能を持つかどうかを知る手がかりになる。T細胞表現型を疲弊から回復し、腫瘍や、HIVのような慢性ウイルス感染とよく戦えるようにしたり、ワクチンに応答してより優れた記憶細胞を生成できるようにしたりすることも可能になるかも知れない」と述べている。
ウイルスが侵入してきたり、細胞が悪性になったりすると、免疫系は、未感作の未熟なCD8 T細胞の小群を動員する。この細胞群はウイルス感染した細胞やがん化した細胞を死滅させ
La Jolla Institute for Allergy and Immunologyの研究チームは、T細胞活性をコントロールする遺伝子発現パターンをさらに良く理解するため、急性、慢性のウイルス感染に対してT細胞が反応する際のゲノムワイドにおけるクロマチンアクセシビリティの変化をマップ化した。2016年12月20日付Immunityオンライン版に掲載されたこの研究結果は、Tリンパ球の処分を決める分子メカニズムに光を当て、さらにT細胞活性を調節し、免疫機能改善のための臨床介入方法に新しい道を開くもので、研究論文は、「Genome-Wide Changes in Chromatin Accessibility in CD8 T Cells During Viral Infection (ウイルス感染時のCD8 T細胞のゲノムワイドのクロマチンアクセシビリティの変化)」と題されている。
Division of Signaling and Gene Expressionの教授を務めるAnjana Rao, Ph.D.の研究室のポスドク研究員、Dr. James Scott-Browneがこの論文の第一著者を務めており、論文中、「T細胞の状態とそれに伴うT細胞の機能を決定する複数の因子を判定することは、そのT細胞がウイルス感染や腫瘍増殖と戦えるかどうか、また、長期的に防御機能を持つかどうかを知る手がかりになる。T細胞表現型を疲弊から回復し、腫瘍や、HIVのような慢性ウイルス感染とよく戦えるようにしたり、ワクチンに応答してより優れた記憶細胞を生成できるようにしたりすることも可能になるかも知れない」と述べている。
ウイルスが侵入してきたり、細胞が悪性になったりすると、免疫系は、未感作の未熟なCD8 T細胞の小群を動員する。この細胞群はウイルス感染した細胞やがん化した細胞を死滅させ
グリオーマのための新しいバイオマーカーを発見
 テキサス大学 南西部医療センターの研究者は、脳腫瘍の一般的なタイプであるグリオーマ(神経膠腫)の新しいバイオマーカーを発見した。このバイオマーカーは、医師がどれほど活動的な癌であるかを決定することや、治療方針を決める上で助けになるという。 Harold C. Simmons Comprehensive Cancer Centerの研究者は、SHOX2と呼ばれる遺伝子の高発現が中等度のグリオーマにおける生存率の低下を予測できることを発見した。
「独立したバイオマーカーとして、SHOX2の発現は、IDH変異として知られている現在最も広く使用されているマーカーほど強力です。」とNancy B. and Jake L. Hamon Center for Therapeutic Oncologyの病理学教授であり、Simmons Cancer CenterのメンバーでもあるAdi Gazdar博士(写真)は述べている。
アメリカ国立がん研究所(NCI)によると、脳や神経系の癌は毎年約24,000人の人々に影響を与えている。 2013年には、米国で脳やその他の神経系がんに罹患している人は152,751人と推定されており、5年生存率は33.8%である。 個々の患者の生存状況の可能性を知ることは、医師が最良の治療法を選択するのに役立つ。 IDH変異またはいくつかの他のバイオマーカーと組み合わせることで、SHOX2発現は、他のバイオマーカーが不良な予後を予測したにもかかわらず、良好な予後を有する患者のサブグループを同定することができた。「私たちの発見は、これまでに発表された研究の分析に基づいています。 それらは将来の研究で確認されなければならず、その臨床的貢献と使用方法は未だこれからです。」とテキサス大学 南西部医療センターのW. Ray Wallace in Molecular
テキサス大学 南西部医療センターの研究者は、脳腫瘍の一般的なタイプであるグリオーマ(神経膠腫)の新しいバイオマーカーを発見した。このバイオマーカーは、医師がどれほど活動的な癌であるかを決定することや、治療方針を決める上で助けになるという。 Harold C. Simmons Comprehensive Cancer Centerの研究者は、SHOX2と呼ばれる遺伝子の高発現が中等度のグリオーマにおける生存率の低下を予測できることを発見した。
「独立したバイオマーカーとして、SHOX2の発現は、IDH変異として知られている現在最も広く使用されているマーカーほど強力です。」とNancy B. and Jake L. Hamon Center for Therapeutic Oncologyの病理学教授であり、Simmons Cancer CenterのメンバーでもあるAdi Gazdar博士(写真)は述べている。
アメリカ国立がん研究所(NCI)によると、脳や神経系の癌は毎年約24,000人の人々に影響を与えている。 2013年には、米国で脳やその他の神経系がんに罹患している人は152,751人と推定されており、5年生存率は33.8%である。 個々の患者の生存状況の可能性を知ることは、医師が最良の治療法を選択するのに役立つ。 IDH変異またはいくつかの他のバイオマーカーと組み合わせることで、SHOX2発現は、他のバイオマーカーが不良な予後を予測したにもかかわらず、良好な予後を有する患者のサブグループを同定することができた。「私たちの発見は、これまでに発表された研究の分析に基づいています。 それらは将来の研究で確認されなければならず、その臨床的貢献と使用方法は未だこれからです。」とテキサス大学 南西部医療センターのW. Ray Wallace in Molecular
狼瘡進行のバイオマーカーとして尿中の上皮成長因子を研究
 慢性的な自己免疫疾患である狼瘡(ループス)は、炎症、痛み、皮膚、関節、および臓器の損傷を介して、冒された人の身体を破壊する可能性がある病気である。 ミシガン大学の研究者らは、腎臓のバイオマーカーが狼瘡の進行と合併症の徴候を示すかどうかを調べた。
「狼瘡患者は、腎臓の関与のリスクが高いため、透析または移植を必要とする末期腎疾患になる可能性があります。」とミシガン大学の環境健康科学と産科医学およびInstitute for Healthcare Policy and Innovationのメンバーである、内科(リウマチ学)准教授のEmily Somers, Ph.D., Sc.M.は述べている。「さらに、バイオマーカーが早期に腎臓の関与を検出し、進行を監視することには、大きなニーズがあります。」 Somers博士は狼瘡の結果を研究し、ミシガン南東部の650人以上の狼瘡患者および対照のコホートおよびバイオリポジトリレジストリを含むMILES(the Michigan Lupus Epidemiology and Surveillance: ミシガン狼瘡疫学および監視)プログラムを指揮している。「狼瘡は、主に女性に影響を与える疾患であり、多くの場合、すばらしい人生に襲いかかります。」「MILESプログラムを通じて、私たちはこれまでに、狼瘡に冒されている黒人女性について、狼瘡のリスクが20代で最も高いことを示しました。狼瘡の黒人女性の40%が腎臓の関与を有し、15%が腎疾患でした。」とDr. Somersは語っている。
11月に米国腎臓学会の腎臓週間2016会議で発表された新しい研究では、ミシガン大学の同僚であるWenjun Ju、Ph.D.、Associate Research Scientist、Matthias Kretzler、MD、Nephrology教授とチームを組ん
慢性的な自己免疫疾患である狼瘡(ループス)は、炎症、痛み、皮膚、関節、および臓器の損傷を介して、冒された人の身体を破壊する可能性がある病気である。 ミシガン大学の研究者らは、腎臓のバイオマーカーが狼瘡の進行と合併症の徴候を示すかどうかを調べた。
「狼瘡患者は、腎臓の関与のリスクが高いため、透析または移植を必要とする末期腎疾患になる可能性があります。」とミシガン大学の環境健康科学と産科医学およびInstitute for Healthcare Policy and Innovationのメンバーである、内科(リウマチ学)准教授のEmily Somers, Ph.D., Sc.M.は述べている。「さらに、バイオマーカーが早期に腎臓の関与を検出し、進行を監視することには、大きなニーズがあります。」 Somers博士は狼瘡の結果を研究し、ミシガン南東部の650人以上の狼瘡患者および対照のコホートおよびバイオリポジトリレジストリを含むMILES(the Michigan Lupus Epidemiology and Surveillance: ミシガン狼瘡疫学および監視)プログラムを指揮している。「狼瘡は、主に女性に影響を与える疾患であり、多くの場合、すばらしい人生に襲いかかります。」「MILESプログラムを通じて、私たちはこれまでに、狼瘡に冒されている黒人女性について、狼瘡のリスクが20代で最も高いことを示しました。狼瘡の黒人女性の40%が腎臓の関与を有し、15%が腎疾患でした。」とDr. Somersは語っている。
11月に米国腎臓学会の腎臓週間2016会議で発表された新しい研究では、ミシガン大学の同僚であるWenjun Ju、Ph.D.、Associate Research Scientist、Matthias Kretzler、MD、Nephrology教授とチームを組ん
牛の研究から哺乳動物のクローンが失敗し易い理由を解明
 スコットランドでクローン羊のドリーが生まれて20年経つが、哺乳動物のクローンをつくることは未だに困難であり、アメリカとフランスの研究チームが行ったクローン成長の遺伝子発現に関する新研究で、なぜクローン胚が失敗しやすいかが示されている。ドリーは、「体細胞核移植」と呼ばれるテクニックを使ってクローン化された。このテクニックは、成体細胞の細胞核を、細胞核を取り除いた未受精卵に移植し、電気ショックを与えて細胞成長を引き起こすというもの。
その後、胚を受容母体に移植し、クローン胎児は出産まで母体内で成長する。牛のクローニングは農業にとって重要な技術であり、哺乳動物の成長の研究にも用いることができるが、成功率は非常に低く、クローン胚の出産までの生存率は一般に10%以下とされる。その失敗の大部分はクローン胚移植時の失敗や胎盤の不具合などで胚が死滅するためだった。2016年12月8日付PNASオンライン版に掲載された研究論文で、UC Davis Department of Evolution and Ecologyの教授、Harris Lewin, Ph.D.と、フランス、アメリカの研究者チームは、クローンの妊娠失敗率の高さの原因となる分子機序をさらに深く理解するため、RNAシーケンシングを用いて移植中のクローン牛の遺伝子発現を調べた。この研究は、クローニングと生殖生物学の分野で優れたフランスの研究チームと機能ゲノミクスの分野で優れたアメリカの研究チームの12年間におよぶ協同作業と協力の成果である。このPNAS掲載の論文は、「Massive Dysregulation of Genes Involved in Cell Signaling and Placental Development in Cloned Cattle Conceptus and Maternal Endome
スコットランドでクローン羊のドリーが生まれて20年経つが、哺乳動物のクローンをつくることは未だに困難であり、アメリカとフランスの研究チームが行ったクローン成長の遺伝子発現に関する新研究で、なぜクローン胚が失敗しやすいかが示されている。ドリーは、「体細胞核移植」と呼ばれるテクニックを使ってクローン化された。このテクニックは、成体細胞の細胞核を、細胞核を取り除いた未受精卵に移植し、電気ショックを与えて細胞成長を引き起こすというもの。
その後、胚を受容母体に移植し、クローン胎児は出産まで母体内で成長する。牛のクローニングは農業にとって重要な技術であり、哺乳動物の成長の研究にも用いることができるが、成功率は非常に低く、クローン胚の出産までの生存率は一般に10%以下とされる。その失敗の大部分はクローン胚移植時の失敗や胎盤の不具合などで胚が死滅するためだった。2016年12月8日付PNASオンライン版に掲載された研究論文で、UC Davis Department of Evolution and Ecologyの教授、Harris Lewin, Ph.D.と、フランス、アメリカの研究者チームは、クローンの妊娠失敗率の高さの原因となる分子機序をさらに深く理解するため、RNAシーケンシングを用いて移植中のクローン牛の遺伝子発現を調べた。この研究は、クローニングと生殖生物学の分野で優れたフランスの研究チームと機能ゲノミクスの分野で優れたアメリカの研究チームの12年間におよぶ協同作業と協力の成果である。このPNAS掲載の論文は、「Massive Dysregulation of Genes Involved in Cell Signaling and Placental Development in Cloned Cattle Conceptus and Maternal Endome
CRISPR/Cas9に天然オフスイッチ発見。ゲノム編集の制御が可能に。
 CRISPR/Cas9ゲノム編集で、生物医学研究の変革が急速に進んでいるが、この新技術はまだ正確さに欠ける。この技術では、誤ってゲノムの変更をやり過ぎたり、望まない変更をしてしまったりして目的外の変異を起こすことがあるため、治療技術として安全性と有効性に欠ける面がある。2016年12月8日付Cell誌オンライン版に掲載された新研究論文によると、University of Massachusetts (UMass) Medical SchoolとUniversity of Torontoの研究チームが、初めてCRISPR/Cas9の「オフスイッチ」を発見しており、それによってゲノム編集の制御がはるかにやりやすくなる。
Cell誌に掲載されたこの論文は、「Naturally Occurring Off-Switches for CRISPR-Cas9 (CRISPR-Cas9に天然のオフスイッチ)」の表題で発表されている。UMass Medical School, RNA Therapeutics Instituteの教授、Erik J. Sontheimer, Ph.D. (写真)、Professor of Molecular GeneticsのAlan Davidson, Ph.D.、University of TorontoのAssistant Professor of Biochemistry、Karen Maxwell, Ph.D.は、Cas9酵素作用を阻害する3種の天然タンパク質を突き止めた。CRISPR抗体として知られるこの3種のタンパク質は、Cas9ヌクレアーゼによるDNA切断を阻止する能力がある。Dr. Sontheimerは、「CRISPR/Cas9そのものは特定の染色体の切断を引き起こすものであり、ゲノム編集に使える有用なものではあるが、染色体の切
CRISPR/Cas9ゲノム編集で、生物医学研究の変革が急速に進んでいるが、この新技術はまだ正確さに欠ける。この技術では、誤ってゲノムの変更をやり過ぎたり、望まない変更をしてしまったりして目的外の変異を起こすことがあるため、治療技術として安全性と有効性に欠ける面がある。2016年12月8日付Cell誌オンライン版に掲載された新研究論文によると、University of Massachusetts (UMass) Medical SchoolとUniversity of Torontoの研究チームが、初めてCRISPR/Cas9の「オフスイッチ」を発見しており、それによってゲノム編集の制御がはるかにやりやすくなる。
Cell誌に掲載されたこの論文は、「Naturally Occurring Off-Switches for CRISPR-Cas9 (CRISPR-Cas9に天然のオフスイッチ)」の表題で発表されている。UMass Medical School, RNA Therapeutics Instituteの教授、Erik J. Sontheimer, Ph.D. (写真)、Professor of Molecular GeneticsのAlan Davidson, Ph.D.、University of TorontoのAssistant Professor of Biochemistry、Karen Maxwell, Ph.D.は、Cas9酵素作用を阻害する3種の天然タンパク質を突き止めた。CRISPR抗体として知られるこの3種のタンパク質は、Cas9ヌクレアーゼによるDNA切断を阻止する能力がある。Dr. Sontheimerは、「CRISPR/Cas9そのものは特定の染色体の切断を引き起こすものであり、ゲノム編集に使える有用なものではあるが、染色体の切
Menaタンパク質バイオマーカーで、トリプル・ネガティブ乳がんの治療ガイドラインを支援
 MITの研究チームは、特に浸潤性の強い乳がん患者の場合に、もっとも一般的な抗がん剤の一つ、paclitaxel (商品名はTaxol) の治療効果の有無を判定する新しいバイオマーカーを突き止めた。このタイプの乳がんは、エストロゲン受容体、プロゲステロン受容体、Her2タンパクという3種のもっとも一般的な乳がんマーカーを欠いているため、「トリプル・ネガティブ」と呼ばれており、医師が乳がんの治療で抗がん剤を選ぶ際にこの研究成果が大いに役立つことになる。
このバイオマーカーは、Menaと呼ばれるタンパク質でがん細胞が体内に広がるのを助けることが突き止められている。しかも、paclitaxelにMenaの効果を阻害する薬剤を合わせて投与すればpaclitaxel単独よりも効果があることも突き止めた。MIT Professor of Biologyを務め、Koch Institute for Integrative Cancer ResearchのメンバーでもあるDr. Frank Gertlerは、「経路を標的とする薬剤がMenaを発現する細胞のpaclitaxel感受性を回復するためだ。さらに、研究の結果、治療中はMenaのレベルをモニターしておいた方がいいということも分かった。もしレベルが上がっていくようなら、他の治療法に切り替えた方がいいようだ」と述べている。Dr. Gertlerは、この研究の首席著者であり、論文は2016年11月3日付Molecular Cancer Therapeuticsオンライン版に、「Mena Confers Resistance to Paclitaxel in Triple-Negative Breast Cancer (トリプル・ネガティブ乳がんがMenaによってPaclitaxel耐性獲得)」の表題で掲載されている。この論文の筆頭著者はK
MITの研究チームは、特に浸潤性の強い乳がん患者の場合に、もっとも一般的な抗がん剤の一つ、paclitaxel (商品名はTaxol) の治療効果の有無を判定する新しいバイオマーカーを突き止めた。このタイプの乳がんは、エストロゲン受容体、プロゲステロン受容体、Her2タンパクという3種のもっとも一般的な乳がんマーカーを欠いているため、「トリプル・ネガティブ」と呼ばれており、医師が乳がんの治療で抗がん剤を選ぶ際にこの研究成果が大いに役立つことになる。
このバイオマーカーは、Menaと呼ばれるタンパク質でがん細胞が体内に広がるのを助けることが突き止められている。しかも、paclitaxelにMenaの効果を阻害する薬剤を合わせて投与すればpaclitaxel単独よりも効果があることも突き止めた。MIT Professor of Biologyを務め、Koch Institute for Integrative Cancer ResearchのメンバーでもあるDr. Frank Gertlerは、「経路を標的とする薬剤がMenaを発現する細胞のpaclitaxel感受性を回復するためだ。さらに、研究の結果、治療中はMenaのレベルをモニターしておいた方がいいということも分かった。もしレベルが上がっていくようなら、他の治療法に切り替えた方がいいようだ」と述べている。Dr. Gertlerは、この研究の首席著者であり、論文は2016年11月3日付Molecular Cancer Therapeuticsオンライン版に、「Mena Confers Resistance to Paclitaxel in Triple-Negative Breast Cancer (トリプル・ネガティブ乳がんがMenaによってPaclitaxel耐性獲得)」の表題で掲載されている。この論文の筆頭著者はK
循環腫瘍細胞とエキソソームの両方を捕捉する新チップで液体生検が可能に。
 マサチューセッツ州ウスター工科大学(Worcester Polytechnic Institute、WPI)の機械技術者によって開発されたチップは、がん患者から採取された少量の血中の転移性がん細胞を捕捉し同定することができる。この画期的な技術は、多くの既存のデバイスで採用されているマイクロフルイディクスによるアプローチよりもがん細胞の捕捉に効果的な簡便な機械的方法を採用している。
WPIの開発したデバイスは、カーボンナノチューブアレイのウェルの底に抗体を固定している。 がん細胞は、表面マーカーに基づき選択的に抗体に結合する(他のデバイスとは異なり、がん細胞によって産生されるエキソソームを捕捉することもできる)。Journal Nanotechnology最新号に掲載されたこの「液体生検(liquid biopsy)」は、転移の早期徴候を迅速に検出し、医師が特定のがん細胞を標的とする治療法を選択するのを助ける、簡便なラボテストとなりえる。転移は、がんがある臓器から体の他の部分に、大抵は血流に入ることによって広がる過程である。 異なるタイプの腫瘍は、特定の臓器および組織に対する嗜好を示す(循環乳がん細胞は、例えば、骨、肺、および脳に根付く可能性が高い)。 転移性がん(ステージIVがんとも呼ばれる)の予後は一般的に不良であるため、遠隔部位で腫瘍が新しいコロニーを形成する前に、これらの循環腫瘍細胞(CTCs:circulating tumor cells)を検出できる技術が、患者の生存率を大幅に上昇させる可能性がある。WPIの機械工学准教授であるスモールシステム研究室長Balaji Panchapakesan博士は、「循環腫瘍細胞を捕らえることは非常に困難な課題です。干し草の中で針を探すのとは比べ物になりません。数十億の赤血球、数万の白血球の中に浮遊している腫瘍細胞はほんの少しし
マサチューセッツ州ウスター工科大学(Worcester Polytechnic Institute、WPI)の機械技術者によって開発されたチップは、がん患者から採取された少量の血中の転移性がん細胞を捕捉し同定することができる。この画期的な技術は、多くの既存のデバイスで採用されているマイクロフルイディクスによるアプローチよりもがん細胞の捕捉に効果的な簡便な機械的方法を採用している。
WPIの開発したデバイスは、カーボンナノチューブアレイのウェルの底に抗体を固定している。 がん細胞は、表面マーカーに基づき選択的に抗体に結合する(他のデバイスとは異なり、がん細胞によって産生されるエキソソームを捕捉することもできる)。Journal Nanotechnology最新号に掲載されたこの「液体生検(liquid biopsy)」は、転移の早期徴候を迅速に検出し、医師が特定のがん細胞を標的とする治療法を選択するのを助ける、簡便なラボテストとなりえる。転移は、がんがある臓器から体の他の部分に、大抵は血流に入ることによって広がる過程である。 異なるタイプの腫瘍は、特定の臓器および組織に対する嗜好を示す(循環乳がん細胞は、例えば、骨、肺、および脳に根付く可能性が高い)。 転移性がん(ステージIVがんとも呼ばれる)の予後は一般的に不良であるため、遠隔部位で腫瘍が新しいコロニーを形成する前に、これらの循環腫瘍細胞(CTCs:circulating tumor cells)を検出できる技術が、患者の生存率を大幅に上昇させる可能性がある。WPIの機械工学准教授であるスモールシステム研究室長Balaji Panchapakesan博士は、「循環腫瘍細胞を捕らえることは非常に困難な課題です。干し草の中で針を探すのとは比べ物になりません。数十億の赤血球、数万の白血球の中に浮遊している腫瘍細胞はほんの少しし
ヒトマイクロバイオームのゲノムデータから新しい抗生物質を発見
 現在使われている抗生物質のほとんどが細菌の産生する天然物質を基礎としており、現在、細菌が抗生物耐性を獲得する速さを考えると、より新しい抗生物質の開発を進めなければならない。しかし、細菌に新しい抗生物質を産生させるのは少々厄介である。ほとんどの細菌は研究室では培養できない。
また、たとえ培養できたとしても、細菌が抗生物質としての特性を備えた物質をつくり出す遺伝子が起動することはない。しかし、ロックフェラー大学の研究チームは、この問題を回避する方法を発見した。微生物のゲノムを調べ、計算的手法を用いてどの遺伝子が抗生物質特性を持った物質をつくり出すかを判定し、その化合物を自分たちで合成したのである。その結果、細菌を培養することなく、効果が予想される新しい抗生物質を2種発見することができた。ロックフェラー大学Laboratory of Genetically Encoded Small MoleculesのDr. Sean Brady率いる研究チームは、まず人体に棲む細菌(ヒトマイクロバイオーム)のゲノムの公開データベースを徹底的に調べることから始めた。次に、フミマイシンを発見した実績を有する専用コンピュータ・ソフトウエアで何百というゲノムをスキャンし、多くの抗生物質の基礎を形成している非リボソーム・ペプチドと呼ばれる物質を産生すると考えられる遺伝子クラスターを探した。さらに、同じソフトウエアを用い、その遺伝子クラスターが産生すると考えられる分子の化学構造式を予想した。
研究チームはこのソフトウエアにより、さらに有望な遺伝子クラスターを57種見つけ、それを30種にまで絞り込んだ。そこでペプチド固相合成法という方法を用いて25種類の化合物をつくった。その25種をヒト病原菌で試験し、構造の似た2種の抗生物質を見つけることができた。その2種はフミマイシンA、フミマイシンBと名付
現在使われている抗生物質のほとんどが細菌の産生する天然物質を基礎としており、現在、細菌が抗生物耐性を獲得する速さを考えると、より新しい抗生物質の開発を進めなければならない。しかし、細菌に新しい抗生物質を産生させるのは少々厄介である。ほとんどの細菌は研究室では培養できない。
また、たとえ培養できたとしても、細菌が抗生物質としての特性を備えた物質をつくり出す遺伝子が起動することはない。しかし、ロックフェラー大学の研究チームは、この問題を回避する方法を発見した。微生物のゲノムを調べ、計算的手法を用いてどの遺伝子が抗生物質特性を持った物質をつくり出すかを判定し、その化合物を自分たちで合成したのである。その結果、細菌を培養することなく、効果が予想される新しい抗生物質を2種発見することができた。ロックフェラー大学Laboratory of Genetically Encoded Small MoleculesのDr. Sean Brady率いる研究チームは、まず人体に棲む細菌(ヒトマイクロバイオーム)のゲノムの公開データベースを徹底的に調べることから始めた。次に、フミマイシンを発見した実績を有する専用コンピュータ・ソフトウエアで何百というゲノムをスキャンし、多くの抗生物質の基礎を形成している非リボソーム・ペプチドと呼ばれる物質を産生すると考えられる遺伝子クラスターを探した。さらに、同じソフトウエアを用い、その遺伝子クラスターが産生すると考えられる分子の化学構造式を予想した。
研究チームはこのソフトウエアにより、さらに有望な遺伝子クラスターを57種見つけ、それを30種にまで絞り込んだ。そこでペプチド固相合成法という方法を用いて25種類の化合物をつくった。その25種をヒト病原菌で試験し、構造の似た2種の抗生物質を見つけることができた。その2種はフミマイシンA、フミマイシンBと名付
マウス脊髄神経細胞の再生を増大する新たなアプローチ
 テキサス大学サウスウェスタンメディカルセンターの研究チームは、成体ほ乳類の脊髄の成熟神経細胞再生の増大に成功した。いつかこの成果を脊髄損傷患者治療の改善に応用できるようになるかも知れない。
この研究論文の首席著者で、テキサス大学サウスウェスタンのAssociate Professor of Molecular Biologyを務めるDr. Chun-Li Zhangは、「この研究で脊髄損傷再生治療の基礎ができた。再生過程に関わっている経路の分子レベルと細胞レベルの重要なチェックポイントを突き止めた。脊髄損傷には、これを操作して神経細胞再生を増大させることも考えられる」と述べているが、Cell Reportsに掲載されたこのマウスでの研究は初期の実験段階であり、まだ臨床に応用できる段階ではないと慎重に語っている。この論文の筆頭著者、Dr. Zhang研究室ポスドク研究員のDr. Lei-Lei Wangが行ったいくつものin vivoスクリーニングが今回の発見につながったのだが、論文で、「脊髄損傷は致命傷になることもあり、また重度の障害をもたらすこともある。また、生存者も身体のマヒに悩み、生活の質が下がり、経済的にも精神的にも大きな負担に悩むことが多い」と述べている。2016年10月11日付Cell Reportsのオープンアクセスに掲載されたこの論文は、「The p53 Pathway Controls SOX2-Mediated Reprogramming in the Adult Mouse Spinal Cord (p53経路で、SOX2仲介による成体マウスの脊髄のリプログラミングを制御)」と題されている。
脊髄負傷は回復不可能な神経ネットワークの損傷につながり、究極的には瘢痕と合わさって運動機能、感覚機能の障害になることがある。Biomedical Resear
テキサス大学サウスウェスタンメディカルセンターの研究チームは、成体ほ乳類の脊髄の成熟神経細胞再生の増大に成功した。いつかこの成果を脊髄損傷患者治療の改善に応用できるようになるかも知れない。
この研究論文の首席著者で、テキサス大学サウスウェスタンのAssociate Professor of Molecular Biologyを務めるDr. Chun-Li Zhangは、「この研究で脊髄損傷再生治療の基礎ができた。再生過程に関わっている経路の分子レベルと細胞レベルの重要なチェックポイントを突き止めた。脊髄損傷には、これを操作して神経細胞再生を増大させることも考えられる」と述べているが、Cell Reportsに掲載されたこのマウスでの研究は初期の実験段階であり、まだ臨床に応用できる段階ではないと慎重に語っている。この論文の筆頭著者、Dr. Zhang研究室ポスドク研究員のDr. Lei-Lei Wangが行ったいくつものin vivoスクリーニングが今回の発見につながったのだが、論文で、「脊髄損傷は致命傷になることもあり、また重度の障害をもたらすこともある。また、生存者も身体のマヒに悩み、生活の質が下がり、経済的にも精神的にも大きな負担に悩むことが多い」と述べている。2016年10月11日付Cell Reportsのオープンアクセスに掲載されたこの論文は、「The p53 Pathway Controls SOX2-Mediated Reprogramming in the Adult Mouse Spinal Cord (p53経路で、SOX2仲介による成体マウスの脊髄のリプログラミングを制御)」と題されている。
脊髄負傷は回復不可能な神経ネットワークの損傷につながり、究極的には瘢痕と合わさって運動機能、感覚機能の障害になることがある。Biomedical Resear
単一がん細胞の質量変化でがんの薬剤感受性を迅速に判別。患者個人に最適な薬剤の選択が可能に。
 がん患者個人に最適な治療薬の選択は往々にして正確性に欠ける。ある患者に有効な薬剤も他の患者には効かないということもあり、腫瘍初期には有効だった薬剤も後には耐性が生まれることもある。MITとDana-Farber Cancer Instituteの研究チームは、さらに個別化した治療法を編成するため、がんの薬剤感受性の新検査法開発した。
これは計器を使って単一細胞の質量を測定し、一つの薬剤が細胞の成長率に与える影響を見ることでその薬剤の効果を予測するというもの。研究チームは、膠芽腫と呼ばれる非常に侵襲性の強い脳腫瘍と急性リンパ性白血病と呼ばれる血液がんの一種を対象にしてこの手法をテストし、成功した。この研究成果は、2016年10月10日付Nature Biotechnologyオンライン版に掲載された。この論文は、「Drug Sensitivity of Single Cancer Cells Is Predicted by Changes in Mass Accumulation Rate (単一がん細胞の薬剤感受性を細胞の質量蓄積率変化で推定する)」と題されている。 MIT Departments of Biological Engineering and Mechanical EngineeringのAndrew (1956) and Erna Viterbi Professorを務め、MITのKoch Institute for Integrative Cancer Researchのメンバーでもあり、またこの論文の主席著者の一人でもあるScott Manalis, Ph.D.は、「私達の研究では、シーケンシングなど下流解析の可能性の残したまま、薬剤に対する個別細胞の反応を測定できる機能アッセイを開発した」と述べている。Dana-Farber Cancer In
がん患者個人に最適な治療薬の選択は往々にして正確性に欠ける。ある患者に有効な薬剤も他の患者には効かないということもあり、腫瘍初期には有効だった薬剤も後には耐性が生まれることもある。MITとDana-Farber Cancer Instituteの研究チームは、さらに個別化した治療法を編成するため、がんの薬剤感受性の新検査法開発した。
これは計器を使って単一細胞の質量を測定し、一つの薬剤が細胞の成長率に与える影響を見ることでその薬剤の効果を予測するというもの。研究チームは、膠芽腫と呼ばれる非常に侵襲性の強い脳腫瘍と急性リンパ性白血病と呼ばれる血液がんの一種を対象にしてこの手法をテストし、成功した。この研究成果は、2016年10月10日付Nature Biotechnologyオンライン版に掲載された。この論文は、「Drug Sensitivity of Single Cancer Cells Is Predicted by Changes in Mass Accumulation Rate (単一がん細胞の薬剤感受性を細胞の質量蓄積率変化で推定する)」と題されている。 MIT Departments of Biological Engineering and Mechanical EngineeringのAndrew (1956) and Erna Viterbi Professorを務め、MITのKoch Institute for Integrative Cancer Researchのメンバーでもあり、またこの論文の主席著者の一人でもあるScott Manalis, Ph.D.は、「私達の研究では、シーケンシングなど下流解析の可能性の残したまま、薬剤に対する個別細胞の反応を測定できる機能アッセイを開発した」と述べている。Dana-Farber Cancer In
がん治療の流れを変えるか、免疫療法 (ニボルマブ) で再発頭頸部扁平上皮がん生存率を2倍に
 再発頭頸部がんは非常に治療が難しいとされるがんだが、免疫療法薬剤で患者の生存率を飛躍的に向上させたことから、がん治療の流れを変える医薬として注目されている。ニボルマブ(Nivolumab、商品名:オプジーボ)は、化学療法に反応しなかった頭頸部がん患者を対象に行った第3相臨床試験で初めて生存率を引き延ばすことができた。しかも、従来の治療法に比べて副作用も少なかった。
2016年10月9日付New England Journal of Medicineオンライン版に掲載された研究論文で報告されている大規模な国際的治験で、ニボルマブ投与を受けた患者の1年後の生存率が化学療法治療の患者に比べ、2倍以上の高率になった。NEJMのオープン・アクセスで発表されたこの論文は、「Nivolumab for Recurrent Squamous-Cell Carcinoma of the Head and Neck (再発頭頸部がん上皮扁平細胞悪性腫瘍にニボルマブを投与)」と題されている。現在のところ、再発・転移したシスプラチン耐性頭頸部がん患者の生存率を向上させる治療法は他にない。この疾患の患者の期待余命は6か月未満とされている。この試験は、イギリスではロンドンのThe Institute of Cancer ResearchとThe Royal Marsden NHS Foundation Trust所属のProfessor Kevin Harringtonが指導し、世界各国の20の研究機関が参加して行われた。また、研究にはBristol Myers Squibbが出資した。研究に参加した361人の患者のうち、再発または転移性の頭頸部がんの240人はニボルマブの投与を受け、121人は3種のうちの1種の化学療法を受けた。
研究に参加したイギリスの患者は化学療法薬剤のdocetaxelの投
再発頭頸部がんは非常に治療が難しいとされるがんだが、免疫療法薬剤で患者の生存率を飛躍的に向上させたことから、がん治療の流れを変える医薬として注目されている。ニボルマブ(Nivolumab、商品名:オプジーボ)は、化学療法に反応しなかった頭頸部がん患者を対象に行った第3相臨床試験で初めて生存率を引き延ばすことができた。しかも、従来の治療法に比べて副作用も少なかった。
2016年10月9日付New England Journal of Medicineオンライン版に掲載された研究論文で報告されている大規模な国際的治験で、ニボルマブ投与を受けた患者の1年後の生存率が化学療法治療の患者に比べ、2倍以上の高率になった。NEJMのオープン・アクセスで発表されたこの論文は、「Nivolumab for Recurrent Squamous-Cell Carcinoma of the Head and Neck (再発頭頸部がん上皮扁平細胞悪性腫瘍にニボルマブを投与)」と題されている。現在のところ、再発・転移したシスプラチン耐性頭頸部がん患者の生存率を向上させる治療法は他にない。この疾患の患者の期待余命は6か月未満とされている。この試験は、イギリスではロンドンのThe Institute of Cancer ResearchとThe Royal Marsden NHS Foundation Trust所属のProfessor Kevin Harringtonが指導し、世界各国の20の研究機関が参加して行われた。また、研究にはBristol Myers Squibbが出資した。研究に参加した361人の患者のうち、再発または転移性の頭頸部がんの240人はニボルマブの投与を受け、121人は3種のうちの1種の化学療法を受けた。
研究に参加したイギリスの患者は化学療法薬剤のdocetaxelの投
ドナー由来セルフリーDNAの測定で臓器移植の結果観察を改善。拒絶反応の早期発見と抗拒絶反応治療の進捗を監視。
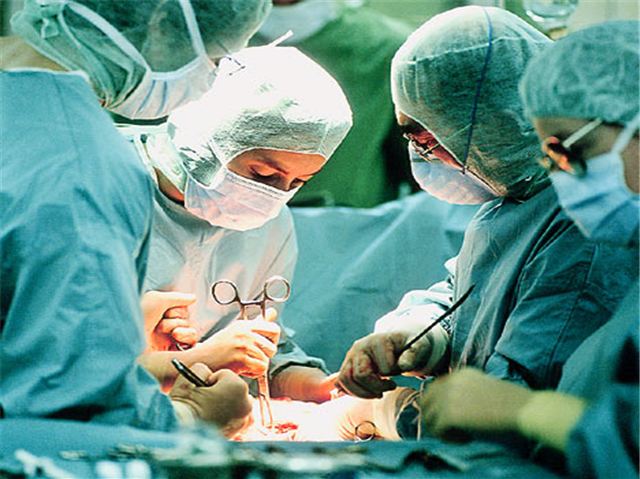 実質臓器移植を受けた患者は生涯免疫抑制療法を続けなければならない。薬剤療法が不十分なために移植拒絶反応が起きるリスクは、過剰な免疫抑制が原因で感染やがんを引き起こすリスクとのバランスが問題になる。移植レシピエントの予後、特に能動的傷害や拒絶反応の早期発見を監視する非侵襲性診断ツールには膨大なニーズがあるがまだ十分に満たされていない。
2016年10月7日付The Journal of Molecular Diagnosticsオンライン版に掲載された研究論文は、血漿中のドナー由来セルフリーDNA (dd-cfDNA) を測定する臨床グレード非侵襲性検査の検証を報告している。これが成功すれば合併症や拒絶反応を減らし、移植レシピエントの予後を改善することもできるようになる。この論文はJournal of Molecular Diagnosticsのオープンアクセス論文として掲載されており、「Validation of a Clinical-Grade Assay to Measure Donor-Derived Cell-Free DNA in Solid Organ Transplant Recipients (実質臓器移植レシピエントのドナー由来セルフリーDNA測定臨床グレード・アッセイの検証)」と題されている。
この研究の研究責任者でCareDx, Inc. (Brisbane, California), R&D Associate DirectorのMarica Grskovic, Ph.D.は、「dd-cfDNAは移植臓器損傷のバイオマーカーとして認識され始めており、移植患者の予後改善に向けて、このバイオマーカーを発展させるためにも、臨床グレードの分析的検証済みアッセイの存在は重要である」と述べている。血漿cfDNAは産前検査、がん、臓器移植の検査でのバイ
実質臓器移植を受けた患者は生涯免疫抑制療法を続けなければならない。薬剤療法が不十分なために移植拒絶反応が起きるリスクは、過剰な免疫抑制が原因で感染やがんを引き起こすリスクとのバランスが問題になる。移植レシピエントの予後、特に能動的傷害や拒絶反応の早期発見を監視する非侵襲性診断ツールには膨大なニーズがあるがまだ十分に満たされていない。
2016年10月7日付The Journal of Molecular Diagnosticsオンライン版に掲載された研究論文は、血漿中のドナー由来セルフリーDNA (dd-cfDNA) を測定する臨床グレード非侵襲性検査の検証を報告している。これが成功すれば合併症や拒絶反応を減らし、移植レシピエントの予後を改善することもできるようになる。この論文はJournal of Molecular Diagnosticsのオープンアクセス論文として掲載されており、「Validation of a Clinical-Grade Assay to Measure Donor-Derived Cell-Free DNA in Solid Organ Transplant Recipients (実質臓器移植レシピエントのドナー由来セルフリーDNA測定臨床グレード・アッセイの検証)」と題されている。
この研究の研究責任者でCareDx, Inc. (Brisbane, California), R&D Associate DirectorのMarica Grskovic, Ph.D.は、「dd-cfDNAは移植臓器損傷のバイオマーカーとして認識され始めており、移植患者の予後改善に向けて、このバイオマーカーを発展させるためにも、臨床グレードの分析的検証済みアッセイの存在は重要である」と述べている。血漿cfDNAは産前検査、がん、臓器移植の検査でのバイ
癌の予後不良に関連する遺伝的シグネチャーを同定
 ケンブリッジ大学(英国)の医療研究評議会(MRC : Medical Research Council)がんユニットの研究者らは、患者予後不良に関連する代謝に関連する遺伝的特徴を同定した。 8161個の組織サンプルを分析した結果、臨床医は将来、患者を治療する最良の方法を決定し、新たな標的治療の開発を支援することができる可能性がある。 がん細胞が増殖し広がるには複雑な代謝変換を受ける。 これにより、がん細胞が増殖するエネルギー需要を満たすことが可能になる。
代謝経路の変化を支える遺伝子の理解を深めていくことで、体内に癌が広がる事象をさらに深く知ることができる。 この目的のために、MRCがんユニットのプログラムリーダーであるクリスチャン・フレッツァ博士とエドアード・ガデ(Edoardo Gaude)博士課程学生は、Cancer Genome Atlas(TCGA)で保有されている8,161の腫瘍および非癌性のサンプルから20種類の固形癌タイプにわたる代謝遺伝子の発現を分析した。
研究者らは、酸化的リン酸化(OXPHOS)経路(細胞にエネルギーを供給するミトコンドリアにおける代謝経路)に関連する遺伝子が、臨床転帰が不良な患者由来の腫瘍細胞において有意にダウンレギュレートされることを見出した。 さらに、OXPHOS遺伝子の抑制は、がんが身体の他の部分に広がり、さらに予後不良につながる転移に関連していることが分かった。「癌は、組織特異的な代謝再編を受け、共通の代謝環境に収束することが分かっています。 注目すべきことに、ミトコンドリア遺伝子のダウンレギュレーションは、すべての癌タイプにわたる最悪の臨床結果と関連し、浸潤性および転移性癌の特徴である上皮 - 間葉移行遺伝子シグネチャーの発現と相関しています」と著者らは書いている。 OXPHOS遺伝子と癌生存との間の関連は、この段階での
ケンブリッジ大学(英国)の医療研究評議会(MRC : Medical Research Council)がんユニットの研究者らは、患者予後不良に関連する代謝に関連する遺伝的特徴を同定した。 8161個の組織サンプルを分析した結果、臨床医は将来、患者を治療する最良の方法を決定し、新たな標的治療の開発を支援することができる可能性がある。 がん細胞が増殖し広がるには複雑な代謝変換を受ける。 これにより、がん細胞が増殖するエネルギー需要を満たすことが可能になる。
代謝経路の変化を支える遺伝子の理解を深めていくことで、体内に癌が広がる事象をさらに深く知ることができる。 この目的のために、MRCがんユニットのプログラムリーダーであるクリスチャン・フレッツァ博士とエドアード・ガデ(Edoardo Gaude)博士課程学生は、Cancer Genome Atlas(TCGA)で保有されている8,161の腫瘍および非癌性のサンプルから20種類の固形癌タイプにわたる代謝遺伝子の発現を分析した。
研究者らは、酸化的リン酸化(OXPHOS)経路(細胞にエネルギーを供給するミトコンドリアにおける代謝経路)に関連する遺伝子が、臨床転帰が不良な患者由来の腫瘍細胞において有意にダウンレギュレートされることを見出した。 さらに、OXPHOS遺伝子の抑制は、がんが身体の他の部分に広がり、さらに予後不良につながる転移に関連していることが分かった。「癌は、組織特異的な代謝再編を受け、共通の代謝環境に収束することが分かっています。 注目すべきことに、ミトコンドリア遺伝子のダウンレギュレーションは、すべての癌タイプにわたる最悪の臨床結果と関連し、浸潤性および転移性癌の特徴である上皮 - 間葉移行遺伝子シグネチャーの発現と相関しています」と著者らは書いている。 OXPHOS遺伝子と癌生存との間の関連は、この段階での
併用化学療法第3相試験で早期膵がん手術後の5年生存率が上昇
 膵がん治療薬の試験としてはかなり大きな規模で行われた第3相試験で、gemcitabineと経口抗がん剤のcapecitabineを併用することで毒性を増すことなく生存率を引き上げることができることが示された。現在、gemcitabineは、膵がん摘出手術後の標準的な補助化学療法として世界的に用いられている。
この研究は、2016年6月3日の記者会見で発表されており、また、2016年6月3日から7日までアメリカ合衆国イリノイ州シカゴ市で開催された2016 American Society of Clinical Oncology (ASCO) Annual Meetingにおいても発表された。論文の筆頭著者で、イギリスのリヴァプール大学, Department of Molecular and Clinical Cancer MedicineのChair of Surgeryを務めるJohn P. Neoptolemos, M.A., M.B., B.Chir., M.D., F.Med.Sci.は、「残念ながら、ほとんどの膵がん患者は、がんと診断された時には手術は不可能だ。しかし、手術が可能な患者は、2種の一般的な抗がん剤を併用することで生存率が高められたという研究成果は大きい」と述べている。
European Study Group for Pancreatic Cancer (ESPAC) 4試験は、732人の患者を対象にして行われており、膵がん手術を受けた患者で行われた臨床試験としては歴史的に2番目の規模である。手術後12週間以内の早期膵管腺がん患者はランダムに選別され、24週間にわたって、gemcitabineのみまたは、gemcitabineとcapecitabineとの双方を与えられた。メディアン生存率は、併用化学療法で28か月、gemcitabine
膵がん治療薬の試験としてはかなり大きな規模で行われた第3相試験で、gemcitabineと経口抗がん剤のcapecitabineを併用することで毒性を増すことなく生存率を引き上げることができることが示された。現在、gemcitabineは、膵がん摘出手術後の標準的な補助化学療法として世界的に用いられている。
この研究は、2016年6月3日の記者会見で発表されており、また、2016年6月3日から7日までアメリカ合衆国イリノイ州シカゴ市で開催された2016 American Society of Clinical Oncology (ASCO) Annual Meetingにおいても発表された。論文の筆頭著者で、イギリスのリヴァプール大学, Department of Molecular and Clinical Cancer MedicineのChair of Surgeryを務めるJohn P. Neoptolemos, M.A., M.B., B.Chir., M.D., F.Med.Sci.は、「残念ながら、ほとんどの膵がん患者は、がんと診断された時には手術は不可能だ。しかし、手術が可能な患者は、2種の一般的な抗がん剤を併用することで生存率が高められたという研究成果は大きい」と述べている。
European Study Group for Pancreatic Cancer (ESPAC) 4試験は、732人の患者を対象にして行われており、膵がん手術を受けた患者で行われた臨床試験としては歴史的に2番目の規模である。手術後12週間以内の早期膵管腺がん患者はランダムに選別され、24週間にわたって、gemcitabineのみまたは、gemcitabineとcapecitabineとの双方を与えられた。メディアン生存率は、併用化学療法で28か月、gemcitabine
二重幹細胞移植でハイリスク神経芽細胞腫の小児患者の治療が向上
 従来、ハイリスク神経芽細胞腫小児患者の診断後5年以上の生存率は50%未満である。National Cancer Institute (NCI) の研究資金を受けてChildren’s Oncology Groupsコンソーシアムが実施した第3相試験で、標準的な治療に加え、第二の自己幹細胞移植 (ASCT、患者自身の幹細胞を移植) を行うことで治療効果の向上が見られた。3年後、二重移植を受けた患者の無疾患生存率が61.4%だったのに比して単一移植の患者の無疾患生存率は48.4%だった。また、副作用は単一移植も二重移植もほぼ同じだった。
6月3日より7日までアメリカ合衆国イリノイ州シカゴ市で開かれた2016 American Society of Clinical Oncology (ASCO) Annual Meetingで発表された5,000件を超えるアブストラクトのうちでも、患者医療に大きな影響を与えると考えられた4件が6月5日 (日曜) の本会議で発表された。研究論文筆頭著者で、ワシントン州シアトル市、Seattle Children’s Hospitalの医局員とUniversity of Washington School of MedicineのPediatrics教授を兼任するJulie R. Park, M.D.は、「この研究結果により、北米ではハイリスク神経芽細胞腫小児患者の治療法を変えることになるだろう。この疾患は依然として大勢の幼い命を奪っており、治療法の向上は喫緊の問題である。しかしながら、ハイリスク神経芽細胞腫に対して用いているレジメンは、小児がん患者に用いる医薬としては侵襲性と毒性がもっとも強いレジメンである。そのような理由から、これからの研究は、現行治療法の晩期障害を探ることと、さらに新しい毒性の低い治療法を開発することを重点にしなければならな
従来、ハイリスク神経芽細胞腫小児患者の診断後5年以上の生存率は50%未満である。National Cancer Institute (NCI) の研究資金を受けてChildren’s Oncology Groupsコンソーシアムが実施した第3相試験で、標準的な治療に加え、第二の自己幹細胞移植 (ASCT、患者自身の幹細胞を移植) を行うことで治療効果の向上が見られた。3年後、二重移植を受けた患者の無疾患生存率が61.4%だったのに比して単一移植の患者の無疾患生存率は48.4%だった。また、副作用は単一移植も二重移植もほぼ同じだった。
6月3日より7日までアメリカ合衆国イリノイ州シカゴ市で開かれた2016 American Society of Clinical Oncology (ASCO) Annual Meetingで発表された5,000件を超えるアブストラクトのうちでも、患者医療に大きな影響を与えると考えられた4件が6月5日 (日曜) の本会議で発表された。研究論文筆頭著者で、ワシントン州シアトル市、Seattle Children’s Hospitalの医局員とUniversity of Washington School of MedicineのPediatrics教授を兼任するJulie R. Park, M.D.は、「この研究結果により、北米ではハイリスク神経芽細胞腫小児患者の治療法を変えることになるだろう。この疾患は依然として大勢の幼い命を奪っており、治療法の向上は喫緊の問題である。しかしながら、ハイリスク神経芽細胞腫に対して用いているレジメンは、小児がん患者に用いる医薬としては侵襲性と毒性がもっとも強いレジメンである。そのような理由から、これからの研究は、現行治療法の晩期障害を探ることと、さらに新しい毒性の低い治療法を開発することを重点にしなければならな
双生児の研究で遺伝子が脳の構造発達に及ぼす影響が調査される
 65歳以上の健康な双生児を対象に行われた国際的にも重要な研究で、遺伝子が脳の灰白質構造の発達に及ぼす影響を知る重要な手がかりが明らかにされ、人間の脳の遺伝的青写真解明に道を開いた。オーストラリアのUniversity of New South Wales (UNSW) Medicineの研究者を中心とする研究チームは、Older Australian Twins Study (オーストラリアの高齢双生児研究) の対象となった322人のMRIスキャンを分析した。
この研究の目的は、脳の皮質および皮質下の構造の遺伝的関連性 (または遺伝率) をマッピングすることにあった。この部分の構造は、記憶、視覚処理、運動制御など様々な機能を司っている部分である。この新研究論文は、2016年9月6日付でScientific Reportsオンライン版に、「Distinct Genetic Influences on Cortical and Subcortical Brain Structures (脳の皮質および皮質下構造に明らかな遺伝子の影響)」の表題でオープンアクセス論文として掲載されている。研究主任を務めたUNSW, Centre for Healthy Brain Ageing (CHeBA) のAssociate Professor Wei Wenは、「遺伝子が脳の発達に関わっていることは知られている。しかし、どの遺伝子が関わっているのか、異なる脳の構造に対する関わり方などはまだ分かっていない。脳の発達に関わる遺伝子を突き止めるためには、まず、特定の遺伝子が脳の複数の構造に関わっているのか、それとも一つの構造だけに関わっているのかを知らなければならない。今回の研究は、双生児を使い、脳の全構造の間の遺伝的相関性を調べた初めての試みだ」と述べている。
研究チームは、93組の
65歳以上の健康な双生児を対象に行われた国際的にも重要な研究で、遺伝子が脳の灰白質構造の発達に及ぼす影響を知る重要な手がかりが明らかにされ、人間の脳の遺伝的青写真解明に道を開いた。オーストラリアのUniversity of New South Wales (UNSW) Medicineの研究者を中心とする研究チームは、Older Australian Twins Study (オーストラリアの高齢双生児研究) の対象となった322人のMRIスキャンを分析した。
この研究の目的は、脳の皮質および皮質下の構造の遺伝的関連性 (または遺伝率) をマッピングすることにあった。この部分の構造は、記憶、視覚処理、運動制御など様々な機能を司っている部分である。この新研究論文は、2016年9月6日付でScientific Reportsオンライン版に、「Distinct Genetic Influences on Cortical and Subcortical Brain Structures (脳の皮質および皮質下構造に明らかな遺伝子の影響)」の表題でオープンアクセス論文として掲載されている。研究主任を務めたUNSW, Centre for Healthy Brain Ageing (CHeBA) のAssociate Professor Wei Wenは、「遺伝子が脳の発達に関わっていることは知られている。しかし、どの遺伝子が関わっているのか、異なる脳の構造に対する関わり方などはまだ分かっていない。脳の発達に関わる遺伝子を突き止めるためには、まず、特定の遺伝子が脳の複数の構造に関わっているのか、それとも一つの構造だけに関わっているのかを知らなければならない。今回の研究は、双生児を使い、脳の全構造の間の遺伝的相関性を調べた初めての試みだ」と述べている。
研究チームは、93組の
スクリプス研究所の研究者ら、動物モデルでアルコール依存症の消滅に成功
 カリフォルニア州のスクリプス研究所(The Scripps Research Institute)の研究者が中心になって進めた動物モデルでの新しい研究の結果、強迫性飲酒の衝動を止める方法が見つかるかもしれない。この研究を指導したスクリプス研究所のAssistant Professor、Olivier George, Ph.D.は、「神経回路網を標的にする研究でアルコール依存症を完全に消滅させることができた」と述べている。
2016年9月7日付The Journal of Neuroscienceに掲載されたこの新研究は、頻繁な飲酒で特定ニューロン・グループが活性化されるという過去の研究結果に基づいており、論文は、「Recruitment of a Neuronal Ensemble in the Central Nucleus of the Amygdala Is Required for Alcohol Dependence (アルコール依存症に必要とされる扁桃体中心核の神経アンサンブルの漸増)」と題されている。アルコールは飲めば飲むほど神経回路の活性化を強化し、それがさらにアルコール飲用をうながし、依存症へと進む。いわば、脳がアルコールと報酬の間の特別な経路を深く刻んでいくようなのである。この新しい研究で、研究チームは、このような回路を形成する特定ニューロンにだけ影響する方法があるかどうかを調べた。人間でもラットでも、このようなニューロンは、脳の扁桃体中心核のニューロンの5%程度を占めているに過ぎないこの研究の第一著者を務めたスクリプス研究所のResearch Associate、Giordano de Guglielmo, Ph.D.は、アルコール依存症のラット・モデルでの研究を指導したが、このラットはアルコールで活性化されたニューロンだけを識別する特殊なタン
カリフォルニア州のスクリプス研究所(The Scripps Research Institute)の研究者が中心になって進めた動物モデルでの新しい研究の結果、強迫性飲酒の衝動を止める方法が見つかるかもしれない。この研究を指導したスクリプス研究所のAssistant Professor、Olivier George, Ph.D.は、「神経回路網を標的にする研究でアルコール依存症を完全に消滅させることができた」と述べている。
2016年9月7日付The Journal of Neuroscienceに掲載されたこの新研究は、頻繁な飲酒で特定ニューロン・グループが活性化されるという過去の研究結果に基づいており、論文は、「Recruitment of a Neuronal Ensemble in the Central Nucleus of the Amygdala Is Required for Alcohol Dependence (アルコール依存症に必要とされる扁桃体中心核の神経アンサンブルの漸増)」と題されている。アルコールは飲めば飲むほど神経回路の活性化を強化し、それがさらにアルコール飲用をうながし、依存症へと進む。いわば、脳がアルコールと報酬の間の特別な経路を深く刻んでいくようなのである。この新しい研究で、研究チームは、このような回路を形成する特定ニューロンにだけ影響する方法があるかどうかを調べた。人間でもラットでも、このようなニューロンは、脳の扁桃体中心核のニューロンの5%程度を占めているに過ぎないこの研究の第一著者を務めたスクリプス研究所のResearch Associate、Giordano de Guglielmo, Ph.D.は、アルコール依存症のラット・モデルでの研究を指導したが、このラットはアルコールで活性化されたニューロンだけを識別する特殊なタン
腸に届く善玉細菌の生存率を6倍以上にする技術をMITのチームが開発
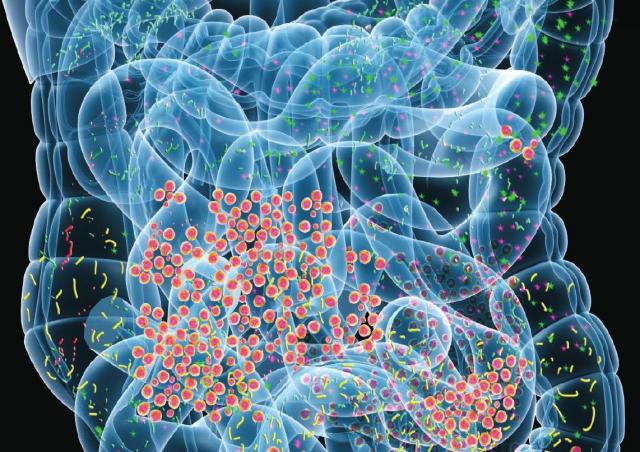 人間の消化器官には兆を数える細菌が棲み着いており、その多くが食物の消化を助けると共に有害な細菌と戦う役目を果たしている。最近の研究でそのような消化器官の細菌が糖尿病、心臓病、がんなどの人間の疾患に対して良いようにも悪いようにも影響していることが突き止められている。これらの細菌について解明を進めてきた研究者は、マイクロバイオームと呼ばれるこのような細菌群を利用して人間の健康改善に役立てることができるのではないかと考え始めている。
そのような将来を予想し、MITの研究チームは大量の善玉細菌を人間の腸に送り込む方法を開発してきた。2016年9月12日付Advanced Materialsオンライン版に掲載された論文はそのような方法について述べており、論文首席著者の一人で、MITのKoch Institute for Integrative Cancer Researchの博士研究員、Ana Jaklenec, Ph.D.は、「マイクロバイオームの理解が進めば、この輸送手段を用い、特定領域を標的にして、特定の細菌種を送り込むことができるようになる」と述べている。この論文は、「Layer-by-Layer Encapsulation of Probiotics for Delivery to the Microbiome (プロバイオティクスの交互積層カプセル化でマイクロバイオームに輸送)」と題されている。
Dr. Jaklenecの研究チームは、細菌をポリマー層でコーティングし、消化器官の胃酸や胆汁酸塩から細菌を保護する方法を開発した。細菌が腸に達すると、その細菌群は腸内壁に付着し、増殖を始める。論文第一著者でKoch Instituteのポスドク研究員、Aaron Anselmo, Ph.D.は、「細菌は腸内壁に届き、そこに付着するが、ポリマー・コーティングしない場合よりは
人間の消化器官には兆を数える細菌が棲み着いており、その多くが食物の消化を助けると共に有害な細菌と戦う役目を果たしている。最近の研究でそのような消化器官の細菌が糖尿病、心臓病、がんなどの人間の疾患に対して良いようにも悪いようにも影響していることが突き止められている。これらの細菌について解明を進めてきた研究者は、マイクロバイオームと呼ばれるこのような細菌群を利用して人間の健康改善に役立てることができるのではないかと考え始めている。
そのような将来を予想し、MITの研究チームは大量の善玉細菌を人間の腸に送り込む方法を開発してきた。2016年9月12日付Advanced Materialsオンライン版に掲載された論文はそのような方法について述べており、論文首席著者の一人で、MITのKoch Institute for Integrative Cancer Researchの博士研究員、Ana Jaklenec, Ph.D.は、「マイクロバイオームの理解が進めば、この輸送手段を用い、特定領域を標的にして、特定の細菌種を送り込むことができるようになる」と述べている。この論文は、「Layer-by-Layer Encapsulation of Probiotics for Delivery to the Microbiome (プロバイオティクスの交互積層カプセル化でマイクロバイオームに輸送)」と題されている。
Dr. Jaklenecの研究チームは、細菌をポリマー層でコーティングし、消化器官の胃酸や胆汁酸塩から細菌を保護する方法を開発した。細菌が腸に達すると、その細菌群は腸内壁に付着し、増殖を始める。論文第一著者でKoch Instituteのポスドク研究員、Aaron Anselmo, Ph.D.は、「細菌は腸内壁に届き、そこに付着するが、ポリマー・コーティングしない場合よりは
老化のトランスポゾン原因説を裏付ける新研究
 新研究で、老化とトランスポゾンの動きの関係として唱えられている「老化のトランスポゾン原因説」がさらに強く裏付けられた。トランスポゾンは転移因子とも呼ばれ、老化した細胞中で一部の塩基配列がDNAからはぐれたもので、ゲノムの他の部位に自分自身を転写し、組織の遺伝子構成を撹乱し、生物の寿命を縮める可能性もある。
過去の研究から、細胞が老化すると堅く巻きついていたヘテロクロマチンがゆるみ、その中に閉じ込められていたトランスポゾンが染色体の所定の位置から抜け出して新しい位置に移動し、正常な細胞機能を混乱させることが明らかになっている。一方、これまでの研究で、研究動物のカロリー摂取量を制限したり、特定遺伝子を組み換えることで大幅に寿命を伸ばせることが示されており、そのことと関連している可能性がある。2016年8月24日付PNASオンライン版に掲載された新研究論文の主席著者で、ブラウン大学のprofessor of biologyを務めるDr. Stephen Helfandは、「この研究で、真の因果関係の可能性の解明に向けて大きく踏み出した」と述べている。この論文はオープン・アクセス論文として掲載され、「An Accelerated Assay for the Identification of Lifespan-Extending Interventions in Drosophila melanogaster (キイロショウジョウバエの寿命を引き延ばす介入の判定のための加速アッセイ)」と題されている。Dr. Stephen Helfandは、「これまで、連想や示唆は何度も言われており、いずれも十分に根拠のあるものだったが、科学の世界では仮説を裏付けるデータが揃っていなければならない」と述べている。Faculty investigatorのDr. Jason Woodをリーダーとす
新研究で、老化とトランスポゾンの動きの関係として唱えられている「老化のトランスポゾン原因説」がさらに強く裏付けられた。トランスポゾンは転移因子とも呼ばれ、老化した細胞中で一部の塩基配列がDNAからはぐれたもので、ゲノムの他の部位に自分自身を転写し、組織の遺伝子構成を撹乱し、生物の寿命を縮める可能性もある。
過去の研究から、細胞が老化すると堅く巻きついていたヘテロクロマチンがゆるみ、その中に閉じ込められていたトランスポゾンが染色体の所定の位置から抜け出して新しい位置に移動し、正常な細胞機能を混乱させることが明らかになっている。一方、これまでの研究で、研究動物のカロリー摂取量を制限したり、特定遺伝子を組み換えることで大幅に寿命を伸ばせることが示されており、そのことと関連している可能性がある。2016年8月24日付PNASオンライン版に掲載された新研究論文の主席著者で、ブラウン大学のprofessor of biologyを務めるDr. Stephen Helfandは、「この研究で、真の因果関係の可能性の解明に向けて大きく踏み出した」と述べている。この論文はオープン・アクセス論文として掲載され、「An Accelerated Assay for the Identification of Lifespan-Extending Interventions in Drosophila melanogaster (キイロショウジョウバエの寿命を引き延ばす介入の判定のための加速アッセイ)」と題されている。Dr. Stephen Helfandは、「これまで、連想や示唆は何度も言われており、いずれも十分に根拠のあるものだったが、科学の世界では仮説を裏付けるデータが揃っていなければならない」と述べている。Faculty investigatorのDr. Jason Woodをリーダーとす
大規模なゲノム解析で液体生検(ctDNA)と腫瘍組織生検の整合性を確認
 大規模なゲノム解析で、血液サンプル (液体生検 : liquid biopsy) で検出される遺伝子変化のパターンが、従来の腫瘍組織生検で判定される遺伝子変化のパターンとかなり厳密に一致することが突き止められた。15,000人を超える患者と50種のがん種の血液サンプルを調べたこの研究は、過去有数の規模のがんゲノミクス研究である。
この研究は2016年6月4日の記者会見で発表され、また、アメリカ合衆国イリノイ州シカゴ市で6月3日より7日まで開かれた2016年American Society of Clinical Oncology (ASCO) 年次会議でもプレゼンテーションがあった。University of California Davis Comprehensive Cancer CenterのMolecular Pharmacology教授とDirectorを兼任するPhilip Mack, Ph.D.がプレゼンテーションを行い、「これらの発見から、液体生検と呼ばれる患者の血液に含まれる腫瘍DNA(ctDNA)の解析は、組織生検が遺伝子タイピングには不十分であったり、安全に採取することができない場合に、侵襲性も低く、非常に情報量の多い代替検査になりえる。しかも、Guardant360と呼ばれるこの検査法は、がんが時間の経過とともに進行していく変化をモニターする重要な手段にもなる。このことは、継続的にがんを抑える治療を続ける際に患者と医師が話し合う上で大切であろう」と述べている。
現在のところ、医師は、がんの治療に際して、抗がん剤で対処できる特定の遺伝子変異があるかどうかを判断するためにはもっぱら腫瘍組織生検に頼っている。腫瘍組織生検は外科的処置を伴うが、患者はそれに耐えられるほど健康とは限らず、また、頻繁に繰り返すことにも無理がある。腫瘍細胞は微細な遺伝物質
大規模なゲノム解析で、血液サンプル (液体生検 : liquid biopsy) で検出される遺伝子変化のパターンが、従来の腫瘍組織生検で判定される遺伝子変化のパターンとかなり厳密に一致することが突き止められた。15,000人を超える患者と50種のがん種の血液サンプルを調べたこの研究は、過去有数の規模のがんゲノミクス研究である。
この研究は2016年6月4日の記者会見で発表され、また、アメリカ合衆国イリノイ州シカゴ市で6月3日より7日まで開かれた2016年American Society of Clinical Oncology (ASCO) 年次会議でもプレゼンテーションがあった。University of California Davis Comprehensive Cancer CenterのMolecular Pharmacology教授とDirectorを兼任するPhilip Mack, Ph.D.がプレゼンテーションを行い、「これらの発見から、液体生検と呼ばれる患者の血液に含まれる腫瘍DNA(ctDNA)の解析は、組織生検が遺伝子タイピングには不十分であったり、安全に採取することができない場合に、侵襲性も低く、非常に情報量の多い代替検査になりえる。しかも、Guardant360と呼ばれるこの検査法は、がんが時間の経過とともに進行していく変化をモニターする重要な手段にもなる。このことは、継続的にがんを抑える治療を続ける際に患者と医師が話し合う上で大切であろう」と述べている。
現在のところ、医師は、がんの治療に際して、抗がん剤で対処できる特定の遺伝子変異があるかどうかを判断するためにはもっぱら腫瘍組織生検に頼っている。腫瘍組織生検は外科的処置を伴うが、患者はそれに耐えられるほど健康とは限らず、また、頻繁に繰り返すことにも無理がある。腫瘍細胞は微細な遺伝物質
ホオズキが昆虫から身を守る防御化合物を逆に利用する蛾がいた
 植物の中には、生き延びる仕組みとして、草食生物を遠ざける毒性物質や抑制物質をつくって身を守るものも多い。また、昆虫の中には進化の過程で宿主植物の防御化合物に適応し、植物の防御機能をかいくぐることに成功したものもたくさんいる。ところが、植物も負けずにその防御系をさらに適応させ、敵に対する防御機能を強化し、昆虫の適応進化に対抗するようになってきた。生物学者はこれを植物と昆虫の間の「進化の軍備競争」と呼んでいる。多種の昆虫が植物害虫であり、「単食性・狭食性」と「広食性」とに分けることができる。広食性昆虫は何種類もの植物を食べることができるが、単食性・狭食性昆虫は単一または少数のごく近い種の植物しか食べることができない。この新研究で分析された蛾の一種、Heliothis subflexaは、そのようなただ一種の宿主植物しか食べない単食性昆虫である。研究チームは、単食性のHeliothis subflexaと広食性のHeliothis virescensという2種の蛾の相対的体重増加、生存率、免疫状態に対するウィタノリドの効果を測定比較した。以前の研究から、単食性の蛾は、非常に近い種ながら広食性の蛾と比べると免疫反応が弱いことが突き止められている。この研究を指導したMax Planck Institute for Chemical EcologyのHanna M. Heidel-Fischer, Ph.D.は、「ウィタノリドには、Heliothis subflexaだけに幼虫の成長や免疫系活動を高めるという効果があるが、近い種のHeliothis virescensにはそのような効果が見られなかったので、私達も驚いた」と述べている。この研究論文は、2016年8月26日付Nature Communicationsオンライン版に掲載され、「Immune Modulation Enable
植物の中には、生き延びる仕組みとして、草食生物を遠ざける毒性物質や抑制物質をつくって身を守るものも多い。また、昆虫の中には進化の過程で宿主植物の防御化合物に適応し、植物の防御機能をかいくぐることに成功したものもたくさんいる。ところが、植物も負けずにその防御系をさらに適応させ、敵に対する防御機能を強化し、昆虫の適応進化に対抗するようになってきた。生物学者はこれを植物と昆虫の間の「進化の軍備競争」と呼んでいる。多種の昆虫が植物害虫であり、「単食性・狭食性」と「広食性」とに分けることができる。広食性昆虫は何種類もの植物を食べることができるが、単食性・狭食性昆虫は単一または少数のごく近い種の植物しか食べることができない。この新研究で分析された蛾の一種、Heliothis subflexaは、そのようなただ一種の宿主植物しか食べない単食性昆虫である。研究チームは、単食性のHeliothis subflexaと広食性のHeliothis virescensという2種の蛾の相対的体重増加、生存率、免疫状態に対するウィタノリドの効果を測定比較した。以前の研究から、単食性の蛾は、非常に近い種ながら広食性の蛾と比べると免疫反応が弱いことが突き止められている。この研究を指導したMax Planck Institute for Chemical EcologyのHanna M. Heidel-Fischer, Ph.D.は、「ウィタノリドには、Heliothis subflexaだけに幼虫の成長や免疫系活動を高めるという効果があるが、近い種のHeliothis virescensにはそのような効果が見られなかったので、私達も驚いた」と述べている。この研究論文は、2016年8月26日付Nature Communicationsオンライン版に掲載され、「Immune Modulation Enable
ホルモン療法10年で生活の質を落とさずに乳がん再発率を減少
 無作為化第3相臨床試験MA.17Rで、letrozole (商品名Femara) を使ったアロマターゼ阻害薬 (AI) 療法を5年から10年に引き延ばすことで閉経後の早期乳がんに対する治療効果が高まることを突き止めた。以前にtamoxifenを投与されたことがあり、その後5年間のAI療法を受けた乳がん患者は、さらに5年間のletrozole投与を受けることで、プラセボ投与患者に比べて再発率を34%引き下げることができた。
この試験はCanadian Cancer Trials Groupが主導し、Canadian Cancer Trials Groupの参加で行われた。この研究成果は、イリノイ州シカゴ市で開催された2016 American Society of Clinical Oncology (ASCO) 年次総会 (6月3日-7日) の6月5日 (日曜日) の本会議において、同年次総会で発表された5,000件を超えるアブストラクトのうち、治療行為でもっとも大きな影響を与えることになると評価された4件の研究の一つとして発表された。この研究論文の筆頭著者で、マサチューセッツ州ボストン市のMassachusetts General Hospital, Breast Cancer ResearchのDirectorとHarvard Medical SchoolのProfessor of Medicineを兼任するPaul Goss, M.D., F.R.C.P., Ph.D.は、「ホルモン受容体陽性の早期乳がん患者は不明な再発リスクを負っている。この研究で、アロマターゼ阻害薬療法を引き延ばすことにより、乳がん再発リスクをさらに引き下げられることを実証し、患者や医師に治療の方向性を与えることができた。また、AI療法を延長することで、反対側の健康な乳房に対してもかなり乳
無作為化第3相臨床試験MA.17Rで、letrozole (商品名Femara) を使ったアロマターゼ阻害薬 (AI) 療法を5年から10年に引き延ばすことで閉経後の早期乳がんに対する治療効果が高まることを突き止めた。以前にtamoxifenを投与されたことがあり、その後5年間のAI療法を受けた乳がん患者は、さらに5年間のletrozole投与を受けることで、プラセボ投与患者に比べて再発率を34%引き下げることができた。
この試験はCanadian Cancer Trials Groupが主導し、Canadian Cancer Trials Groupの参加で行われた。この研究成果は、イリノイ州シカゴ市で開催された2016 American Society of Clinical Oncology (ASCO) 年次総会 (6月3日-7日) の6月5日 (日曜日) の本会議において、同年次総会で発表された5,000件を超えるアブストラクトのうち、治療行為でもっとも大きな影響を与えることになると評価された4件の研究の一つとして発表された。この研究論文の筆頭著者で、マサチューセッツ州ボストン市のMassachusetts General Hospital, Breast Cancer ResearchのDirectorとHarvard Medical SchoolのProfessor of Medicineを兼任するPaul Goss, M.D., F.R.C.P., Ph.D.は、「ホルモン受容体陽性の早期乳がん患者は不明な再発リスクを負っている。この研究で、アロマターゼ阻害薬療法を引き延ばすことにより、乳がん再発リスクをさらに引き下げられることを実証し、患者や医師に治療の方向性を与えることができた。また、AI療法を延長することで、反対側の健康な乳房に対してもかなり乳
RNAを標的とする新CRISPRシステム「C2c2」の特徴を解明
 ハーバード大学とマサチューセッツ工科大学が共同で運営する研究施設Broad Institute of MIT and Harvard、マサチューセッツ工科大学、アメリカ国立衛生研究所、ラトガース大学ニューブランズウィック校、そしてロシアのスコルコボ科学工科大学の研究者グループは、DNAの代わりにRNAを標的とする新しいCRISPRシステムの特徴を明らかにした。
この新しいアプローチにより、パワフルな細胞操作技術が実現する可能性がある。DNA編集は細胞のゲノムを永久的に変更してしまうのに対して、CRISPRベースのRNAを標的とする手法は、調節自由な一時的変更が可能であり、かつ従来のRNA干渉法に比べて特異性と機能性が高いという特長がある。Broad Institute of MITとMcGovern Institute for Brain ResearchのFeng Zhang, Ph.D.、同僚研究者で共同著者でもあるNIHのEugene Koonin, Ph.D.と、同僚研究者のラトガース大学ニューブランズウィック校とスコルコボ科学工科大学のKonstantin Severinov, Ph.D.は、RNAを標的として分解する能力のあるRNA誘導型酵素、C2c2を同定し、その機能的特徴を明らかにした。
2016年6月2日付Science誌オンライン版に掲載されたこの研究論文は、「C2c2 Is a Single-Component Programmable RNA-Guided RNA-Targeting CRISPR Effector (C2c2は単一成分型プログラマブルRNA誘導RNA標的CRISPRエフェクター)」と題されている。2015年10月、この共同研究グループは、自然界に存在するC2c2を発見、同定したが、これはRNAのみを標的とする天然のCRISPRシ
ハーバード大学とマサチューセッツ工科大学が共同で運営する研究施設Broad Institute of MIT and Harvard、マサチューセッツ工科大学、アメリカ国立衛生研究所、ラトガース大学ニューブランズウィック校、そしてロシアのスコルコボ科学工科大学の研究者グループは、DNAの代わりにRNAを標的とする新しいCRISPRシステムの特徴を明らかにした。
この新しいアプローチにより、パワフルな細胞操作技術が実現する可能性がある。DNA編集は細胞のゲノムを永久的に変更してしまうのに対して、CRISPRベースのRNAを標的とする手法は、調節自由な一時的変更が可能であり、かつ従来のRNA干渉法に比べて特異性と機能性が高いという特長がある。Broad Institute of MITとMcGovern Institute for Brain ResearchのFeng Zhang, Ph.D.、同僚研究者で共同著者でもあるNIHのEugene Koonin, Ph.D.と、同僚研究者のラトガース大学ニューブランズウィック校とスコルコボ科学工科大学のKonstantin Severinov, Ph.D.は、RNAを標的として分解する能力のあるRNA誘導型酵素、C2c2を同定し、その機能的特徴を明らかにした。
2016年6月2日付Science誌オンライン版に掲載されたこの研究論文は、「C2c2 Is a Single-Component Programmable RNA-Guided RNA-Targeting CRISPR Effector (C2c2は単一成分型プログラマブルRNA誘導RNA標的CRISPRエフェクター)」と題されている。2015年10月、この共同研究グループは、自然界に存在するC2c2を発見、同定したが、これはRNAのみを標的とする天然のCRISPRシ
HER2陽性乳がん細胞のHER2をシャットオフするアンキリン反復改変タンパク質を開発
 毎年、スイスでは5,700人の女性が新しく乳がんと診断され、また1,400人近い女性がこの疾患で亡くなっている。浸潤性がきわめて強い乳がんでは、細胞の表面に受容体HER2が過剰に存在しているタイプが多い。これが細胞の無制限な増殖につながっている。これまで乳がんの治療にはTrastuzumabやpertuzumabなど、HER2受容体を認識する抗体が何年も用いられてきた。
しかし、このような抗体もがん細胞そのものを殺すわけではない。がん細胞は不活性化されるだけであり、いつでも活性を取り戻すことができるのである。
受容体HER2は、同時にいくつかの信号経路を用い、細胞の増殖と分裂の指令情報を送る。しかし、これまでに見つかっている抗体は一つの信号経路をブロックするだけであり、他の信号経路はすべてアクティブなままである。この開かれた状態の経路のうちもっとも重要な経路がRASと呼ばれるcentral hubを通っている。初めて詳細が解き明かされたこのメカニズムについて、Dr. Plue(umlaut)ckthunは、「HER2受容体が発信する増殖信号を再活性化するのがこのタンパク質だ。抗体はその効力を失い、がん細胞が再び増殖を続けるようになる」と説明している。
University of Zurich, Department of Biochemistry のDirectorを務めるAndreas Plue(umlaut)ckthun, Ph.D.が指導し、ポスドク研究員のRastik Tamaskovic、博士課程のMartin Schwillも加わった研究の論文が、2016年6月3日付のNature Communicationsオンライン版オープンアクセス論文として掲載されており、なぜ、これらの抗体が単にがん進行を遅らせるだけで、がん細胞を殺さないのか、その研究結果を
毎年、スイスでは5,700人の女性が新しく乳がんと診断され、また1,400人近い女性がこの疾患で亡くなっている。浸潤性がきわめて強い乳がんでは、細胞の表面に受容体HER2が過剰に存在しているタイプが多い。これが細胞の無制限な増殖につながっている。これまで乳がんの治療にはTrastuzumabやpertuzumabなど、HER2受容体を認識する抗体が何年も用いられてきた。
しかし、このような抗体もがん細胞そのものを殺すわけではない。がん細胞は不活性化されるだけであり、いつでも活性を取り戻すことができるのである。
受容体HER2は、同時にいくつかの信号経路を用い、細胞の増殖と分裂の指令情報を送る。しかし、これまでに見つかっている抗体は一つの信号経路をブロックするだけであり、他の信号経路はすべてアクティブなままである。この開かれた状態の経路のうちもっとも重要な経路がRASと呼ばれるcentral hubを通っている。初めて詳細が解き明かされたこのメカニズムについて、Dr. Plue(umlaut)ckthunは、「HER2受容体が発信する増殖信号を再活性化するのがこのタンパク質だ。抗体はその効力を失い、がん細胞が再び増殖を続けるようになる」と説明している。
University of Zurich, Department of Biochemistry のDirectorを務めるAndreas Plue(umlaut)ckthun, Ph.D.が指導し、ポスドク研究員のRastik Tamaskovic、博士課程のMartin Schwillも加わった研究の論文が、2016年6月3日付のNature Communicationsオンライン版オープンアクセス論文として掲載されており、なぜ、これらの抗体が単にがん進行を遅らせるだけで、がん細胞を殺さないのか、その研究結果を
デューク大学で新しいクラスの鎮痛剤候補化合物を発見
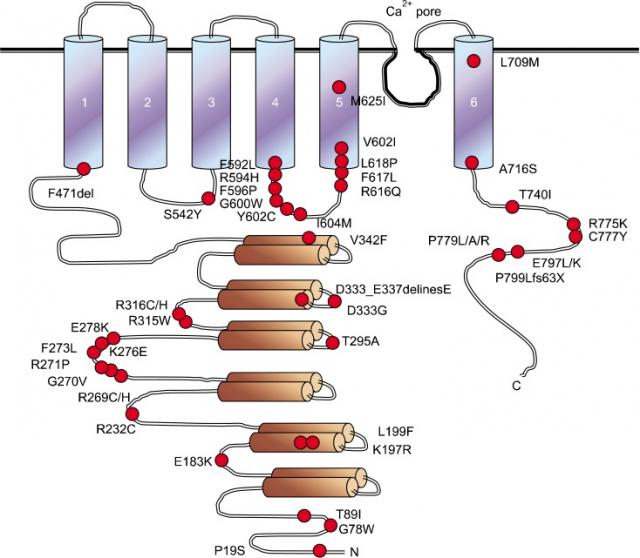 デューク大学の研究チームと同僚研究者が、痛みの治療で焦点になっていた2つの標的を同時にブロックする有望な新しいクラスの低分子薬剤を発見した。この概念実証実験は、皮膚の刺激感やかゆみ、頭痛、顎痛、膵臓や結腸を原因とする腹痛などの症状を緩和する新薬の開発に結びつく可能性がある。
2016年6月1日付Scientific Reportsオンライン版に掲載されたオープンアクセスのこの研究論文は、「Small Molecule Dual-Inhibitors of TRPV4 and TRPA1 for Attenuation of Inflammation and Pain (TRPV4とTRPA1の低分子二重阻害剤で炎症と痛みを緩和)」と題されている。Institute of Medicineの報告によると、アメリカでは1億人以上の人が慢性的な痛みに悩んでおり、新しい医薬を是非とも必要としている。デューク大学医学部の神経学、麻酔学、神経生物学教授を務めるWolfgang Liedtke, M.D., Ph.D.は、頭痛、顔面痛その他の感覚障害患者の治療にあたっており、「非常に有望な話の第一章ともいうべきこの展開をうれしく思う。この化合物を人間や動物の臨床治療に使えるようにしたい」と述べている。
同研究チームのこれまでの研究で、TRPV4 (写真) という分子が日焼けに伴う皮膚の不快感、頭や顔からの痛覚を伝達することを突き止めており、今回の研究ではそのTRPV4をより効果的に阻害する物質の開発を目指していた。Dr. Liedtkeと、彼のデューク大学での共同研究者、Farshid Guilakが行った2009年の研究では、TRPV4阻害剤のプロトタイプを用い、その後、さらに効果の高い化合物の開発に進んだ。プロトタイプと比べると、「16-8」と呼ばれる新しい候補薬物は、骨関節症の
デューク大学の研究チームと同僚研究者が、痛みの治療で焦点になっていた2つの標的を同時にブロックする有望な新しいクラスの低分子薬剤を発見した。この概念実証実験は、皮膚の刺激感やかゆみ、頭痛、顎痛、膵臓や結腸を原因とする腹痛などの症状を緩和する新薬の開発に結びつく可能性がある。
2016年6月1日付Scientific Reportsオンライン版に掲載されたオープンアクセスのこの研究論文は、「Small Molecule Dual-Inhibitors of TRPV4 and TRPA1 for Attenuation of Inflammation and Pain (TRPV4とTRPA1の低分子二重阻害剤で炎症と痛みを緩和)」と題されている。Institute of Medicineの報告によると、アメリカでは1億人以上の人が慢性的な痛みに悩んでおり、新しい医薬を是非とも必要としている。デューク大学医学部の神経学、麻酔学、神経生物学教授を務めるWolfgang Liedtke, M.D., Ph.D.は、頭痛、顔面痛その他の感覚障害患者の治療にあたっており、「非常に有望な話の第一章ともいうべきこの展開をうれしく思う。この化合物を人間や動物の臨床治療に使えるようにしたい」と述べている。
同研究チームのこれまでの研究で、TRPV4 (写真) という分子が日焼けに伴う皮膚の不快感、頭や顔からの痛覚を伝達することを突き止めており、今回の研究ではそのTRPV4をより効果的に阻害する物質の開発を目指していた。Dr. Liedtkeと、彼のデューク大学での共同研究者、Farshid Guilakが行った2009年の研究では、TRPV4阻害剤のプロトタイプを用い、その後、さらに効果の高い化合物の開発に進んだ。プロトタイプと比べると、「16-8」と呼ばれる新しい候補薬物は、骨関節症の
適量の赤ワインが2型糖尿病の健康管理に役立つ可能性
 イスラエルのBen-Gurion University of the Negev (BGU) 所属の研究者らが2年をかけて行った無作為化比較試験の結果によれば、2型糖尿病患者が、毎晩グラス1杯の赤ワインを摂取することでコレステロールと心臓の健康管理を増進できる可能性が示され、またワインは赤白とも、個々人のアルコール代謝率を示す遺伝子プロフィール次第で糖コントロールを改善できるかもしれない。
糖尿病患者のアルコールの影響を調べた初めての試みとなるこの長期的な研究の成果は、2015年10月13日付Annals of Internal Medicineオンライン版に掲載された。この研究では適量のアルコール摂取が糖尿病患者に与える効果と安全性を評価し、ワインのタイプで異なる結果が出るかどうかも判定することが目的だった。この研究論文は、「Effects of Initiating Moderate Alcohol Intake on Cardiometabolic Risk in Adults With Type 2 Diabetes: A 2-Year Randomized, Controlled Trial (2型糖尿病成人患者の心血管代謝リスクに対する適量のアルコール摂取の効果: 2年にわたる無作為化比較試験)」と題されている。糖尿病患者は、健康な人口と比べると、循環器系疾患にかかりやすく、また、「善玉」コレステロール量も低い。膨大な数の観察研究が行われてきたが、適量のアルコール摂取を臨床的に勧めていいかどうかはまだ議論の分かれるところであり、特に糖尿病患者の場合には反対も大きい。それというのも、根拠に基づく医療にとって至上の理想とされる長期的な無作為化比較試験が欠けているからである。
研究チームは、「赤ワインは、脂質プロフィールをわずかに改善し、また善玉 (HDL) コレ
イスラエルのBen-Gurion University of the Negev (BGU) 所属の研究者らが2年をかけて行った無作為化比較試験の結果によれば、2型糖尿病患者が、毎晩グラス1杯の赤ワインを摂取することでコレステロールと心臓の健康管理を増進できる可能性が示され、またワインは赤白とも、個々人のアルコール代謝率を示す遺伝子プロフィール次第で糖コントロールを改善できるかもしれない。
糖尿病患者のアルコールの影響を調べた初めての試みとなるこの長期的な研究の成果は、2015年10月13日付Annals of Internal Medicineオンライン版に掲載された。この研究では適量のアルコール摂取が糖尿病患者に与える効果と安全性を評価し、ワインのタイプで異なる結果が出るかどうかも判定することが目的だった。この研究論文は、「Effects of Initiating Moderate Alcohol Intake on Cardiometabolic Risk in Adults With Type 2 Diabetes: A 2-Year Randomized, Controlled Trial (2型糖尿病成人患者の心血管代謝リスクに対する適量のアルコール摂取の効果: 2年にわたる無作為化比較試験)」と題されている。糖尿病患者は、健康な人口と比べると、循環器系疾患にかかりやすく、また、「善玉」コレステロール量も低い。膨大な数の観察研究が行われてきたが、適量のアルコール摂取を臨床的に勧めていいかどうかはまだ議論の分かれるところであり、特に糖尿病患者の場合には反対も大きい。それというのも、根拠に基づく医療にとって至上の理想とされる長期的な無作為化比較試験が欠けているからである。
研究チームは、「赤ワインは、脂質プロフィールをわずかに改善し、また善玉 (HDL) コレ
ニューロン活動を撮影する超小型頭部埋込蛍光顕微鏡開発にNIHが230万ドルの助成金
 UCLAの5人の研究者チームが、研究プロジェクトに対してNIHの助成金を受けた。この研究プロジェクトは、脳の神経回路の情報処理、エンコード、保存、読み出しの仕組みに対する理解を深めることになると考えられる。向こう3か年で230万ドルの資金が与えられるこの研究は、動物生体の神経回路網を傷つけることなく、その活動を記録する手法を開発することを目的としている。
この資金は、2013年にバラク・オバマ大統領が発表した、NIHのBRAIN Initiative を通して授与されるものである。UCLAのキャンパスには500人を超える神経学者が在籍しており、同大学はこの分野の研究で大きな役割を果たせる立場にある。この助成金授与については、UCLAの2015年11月4日付プレス・リリースに掲載されている。この研究で、UCLAのAssociate Professor of Neurology and Psychiatryを務めるPeyman Golshani, M.D.に率いられた研究者グループは、マウスの多数の脳細胞の活動を撮影し、操作するため、新世代の超小型蛍光顕微鏡の開発を計画している。このマウスは、自然環境の中で自由に動くまま、その脳細胞の活動を調べられる。頭に埋め込んだ超小型顕微鏡は重さが3グラム未満になる予定で、脳細胞の活動をリアル・タイムでモニターする。
このような技術は過去には不可能だった。この顕微鏡は、特定波長の光をニューロンに照射すると、個々のニューロンがカルシウム依存型のフルオロフォアを発現し、これが光を発するので、個々のニューロンを視覚化するという仕組みになっている。この手法は、ニューロンが発火した時にカルシウム濃度が高まることから、カルシウム濃度の高まった細胞を照らし出すというもの。Dr. Golshaniは、「カルシウム濃度を画像化して、ほんとうに分かる
UCLAの5人の研究者チームが、研究プロジェクトに対してNIHの助成金を受けた。この研究プロジェクトは、脳の神経回路の情報処理、エンコード、保存、読み出しの仕組みに対する理解を深めることになると考えられる。向こう3か年で230万ドルの資金が与えられるこの研究は、動物生体の神経回路網を傷つけることなく、その活動を記録する手法を開発することを目的としている。
この資金は、2013年にバラク・オバマ大統領が発表した、NIHのBRAIN Initiative を通して授与されるものである。UCLAのキャンパスには500人を超える神経学者が在籍しており、同大学はこの分野の研究で大きな役割を果たせる立場にある。この助成金授与については、UCLAの2015年11月4日付プレス・リリースに掲載されている。この研究で、UCLAのAssociate Professor of Neurology and Psychiatryを務めるPeyman Golshani, M.D.に率いられた研究者グループは、マウスの多数の脳細胞の活動を撮影し、操作するため、新世代の超小型蛍光顕微鏡の開発を計画している。このマウスは、自然環境の中で自由に動くまま、その脳細胞の活動を調べられる。頭に埋め込んだ超小型顕微鏡は重さが3グラム未満になる予定で、脳細胞の活動をリアル・タイムでモニターする。
このような技術は過去には不可能だった。この顕微鏡は、特定波長の光をニューロンに照射すると、個々のニューロンがカルシウム依存型のフルオロフォアを発現し、これが光を発するので、個々のニューロンを視覚化するという仕組みになっている。この手法は、ニューロンが発火した時にカルシウム濃度が高まることから、カルシウム濃度の高まった細胞を照らし出すというもの。Dr. Golshaniは、「カルシウム濃度を画像化して、ほんとうに分かる
世界初、ドロップレット・デジタルPCRシステムで胎児の出生前血液検査
 胎児のRh血液型、D抗原 (RHD)、性別、遺伝性障害を判定することのできる簡単で正確で低リスクの血液検査開発研究が2015年11月号Clinical Chemistryに掲載された。この論文は、「Fetal Sex and RHD Genotyping with Digital PCR Demonstrates Greater Sensitivity than Real-time PCR (デジタルPCRの胎児性別、RHD遺伝子判定でリアルタイムのPCRを超える感度を証明)」と題されている。この研究は、イギリスのPlymouth Hospitals NHS TrustとPlymouth Universityの共同で行われた。
NHS(National Health Service)が認めている従来の羊水穿刺は、針を用いる上にわずかながらも流産のリスク(1%)があるのに対して、このDNA検査は、コストが非常に低く、非侵襲的な検査である。新開発のこの検査は、血友病、デュシェンヌ型筋ジストロフィーなどX連鎖劣性遺伝性疾患のリスクのある母体や新生児溶血性疾患のリスクのある母体を対象に実施することができる。また、女性が妊娠初期に初めて一般開業医や助産婦の診察を受けた時の採血を使えるため、何度も予約を取る必要もなく、時間や設備を有効に使うことができる。
この研究の筆頭責任著者で、Plymouth University School of Biomedical and Healthcare SciencesのProfessor of Molecular Diagnostics and Transfusion Medicineを務めるProfessor Neil Avent, Ph.D.は、「母体の血液を使って、胎児の血液型や性別を判定する検査は過去10年行われてきたことが、この検査
胎児のRh血液型、D抗原 (RHD)、性別、遺伝性障害を判定することのできる簡単で正確で低リスクの血液検査開発研究が2015年11月号Clinical Chemistryに掲載された。この論文は、「Fetal Sex and RHD Genotyping with Digital PCR Demonstrates Greater Sensitivity than Real-time PCR (デジタルPCRの胎児性別、RHD遺伝子判定でリアルタイムのPCRを超える感度を証明)」と題されている。この研究は、イギリスのPlymouth Hospitals NHS TrustとPlymouth Universityの共同で行われた。
NHS(National Health Service)が認めている従来の羊水穿刺は、針を用いる上にわずかながらも流産のリスク(1%)があるのに対して、このDNA検査は、コストが非常に低く、非侵襲的な検査である。新開発のこの検査は、血友病、デュシェンヌ型筋ジストロフィーなどX連鎖劣性遺伝性疾患のリスクのある母体や新生児溶血性疾患のリスクのある母体を対象に実施することができる。また、女性が妊娠初期に初めて一般開業医や助産婦の診察を受けた時の採血を使えるため、何度も予約を取る必要もなく、時間や設備を有効に使うことができる。
この研究の筆頭責任著者で、Plymouth University School of Biomedical and Healthcare SciencesのProfessor of Molecular Diagnostics and Transfusion Medicineを務めるProfessor Neil Avent, Ph.D.は、「母体の血液を使って、胎児の血液型や性別を判定する検査は過去10年行われてきたことが、この検査
造血幹細胞前駆細胞 (HSPCs) のゲノム編集技術がさらに前進
 University of Southern CaliforniaとSangamo BioSciencesの研究チームの協同作業のおかげで、造血幹細胞前駆細胞 (HSPCs) のジンク・フィンガー・ヌクレアーゼ・ベースの遺伝子編集技術がさらに前進した。研究論文で、共同第一著者のUSC所属Colin M. Exline, Ph.D.とSangamo BioSciences所属Jianbin Wang, Ph.D.は、造血幹細胞・前駆細胞の遺伝子を効率的に編集する新しい手法を発表している。
2015年11月9日付Nature Biotechnologyオンライン版に掲載されたこの研究論文は、「Homology-Driven Genome Editing in Hematopoietic Stem and Progenitor Cells Using ZFN mRNA and AAV6 Donors (ZFN mRNA and AAV6ドナーを用いた造血幹細胞・前駆細胞 (HSPCs)のホモロジー・タイプのゲノム編集)」と題されている。論文の共同責任著者でUSCにおいてMolecular Microbiology and Immunology、 Pediatrics, Biochemistry and Molecular BiologyおよびStem Cell Biology and Regenerative Medicineの教授を務めるPaula Cannon, Ph.D.は、「HSPCsを用いた遺伝子療法は、HIVその他の血液系、免疫系疾患の治療に大きな可能性を持っている。また、ゲノム編集テクニックによって、疾患を引き起こす、遺伝子の誤植、つまり、遺伝子の突然変異を修復するなどきわめて精密な改変が可能になっている」と述べている。
そのようなターゲット化した遺伝子医療は患
University of Southern CaliforniaとSangamo BioSciencesの研究チームの協同作業のおかげで、造血幹細胞前駆細胞 (HSPCs) のジンク・フィンガー・ヌクレアーゼ・ベースの遺伝子編集技術がさらに前進した。研究論文で、共同第一著者のUSC所属Colin M. Exline, Ph.D.とSangamo BioSciences所属Jianbin Wang, Ph.D.は、造血幹細胞・前駆細胞の遺伝子を効率的に編集する新しい手法を発表している。
2015年11月9日付Nature Biotechnologyオンライン版に掲載されたこの研究論文は、「Homology-Driven Genome Editing in Hematopoietic Stem and Progenitor Cells Using ZFN mRNA and AAV6 Donors (ZFN mRNA and AAV6ドナーを用いた造血幹細胞・前駆細胞 (HSPCs)のホモロジー・タイプのゲノム編集)」と題されている。論文の共同責任著者でUSCにおいてMolecular Microbiology and Immunology、 Pediatrics, Biochemistry and Molecular BiologyおよびStem Cell Biology and Regenerative Medicineの教授を務めるPaula Cannon, Ph.D.は、「HSPCsを用いた遺伝子療法は、HIVその他の血液系、免疫系疾患の治療に大きな可能性を持っている。また、ゲノム編集テクニックによって、疾患を引き起こす、遺伝子の誤植、つまり、遺伝子の突然変異を修復するなどきわめて精密な改変が可能になっている」と述べている。
そのようなターゲット化した遺伝子医療は患
DNA折りたたみ構造の速写で自己免疫疾患等に新しい手がかり
 イギリスのバブラハム研究所とマンチェスター大学の研究者の共同研究で、ゲノムの物理的接続をマップ化し、ゲノム中の自己免疫疾患に関わる部分の解明が前進。研究チームは、Capture Hi-Cと名付けられた、見かけ上かけ離れた位置の遺伝子の発現を調節するノンコーディング配列を判定する新しいテクニックを用いて、遺伝子配列の変化の生体的影響や疾患リスク増加などの理解に新しい手がかりを与えている。
この新研究は、2015年11月30日付Nature Communicationsオンライン版オープン・アクセス論文として掲載され「Capture Hi-C Reveals Novel Candidate Genes and Complex Long-Range Interactions with Related Autoimmune Risk Loci (Capture Hi-Cが明かす新発見の候補遺伝子と関連自己免疫リスク遺伝子座との間の複雑な長距離相互作用)」と題されている。
Human Genome ProjectはヒトDNAコードの大部分を明らかにし、さらに大規模な人口を対象とした調査では、がん、循環器系疾患、免疫系疾患など様々な疾患と関連しているDNA配列の変化が突き止められている。このような変化の多くが、ゲノム中のタンパク質コード遺伝子を含んでいる部位の外にあるため、この遺伝子変化の生体への影響の理解も、その領域に関連している遺伝子を判定する作業はめくらめっぽうというに等しかった。しかし、このような関連を理解するというのは、遺伝子的な病因を明らかにするカギとなるものである。バブラハム研究所の研究チームが開発した新テクニックは、ゲノムの画像の「一コマを凍結」し、その立体的な構造をそのまま捉え、一見離れて見える領域が、DNAの折り畳み構造のために実際にはすぐ隣り合わせになることを
イギリスのバブラハム研究所とマンチェスター大学の研究者の共同研究で、ゲノムの物理的接続をマップ化し、ゲノム中の自己免疫疾患に関わる部分の解明が前進。研究チームは、Capture Hi-Cと名付けられた、見かけ上かけ離れた位置の遺伝子の発現を調節するノンコーディング配列を判定する新しいテクニックを用いて、遺伝子配列の変化の生体的影響や疾患リスク増加などの理解に新しい手がかりを与えている。
この新研究は、2015年11月30日付Nature Communicationsオンライン版オープン・アクセス論文として掲載され「Capture Hi-C Reveals Novel Candidate Genes and Complex Long-Range Interactions with Related Autoimmune Risk Loci (Capture Hi-Cが明かす新発見の候補遺伝子と関連自己免疫リスク遺伝子座との間の複雑な長距離相互作用)」と題されている。
Human Genome ProjectはヒトDNAコードの大部分を明らかにし、さらに大規模な人口を対象とした調査では、がん、循環器系疾患、免疫系疾患など様々な疾患と関連しているDNA配列の変化が突き止められている。このような変化の多くが、ゲノム中のタンパク質コード遺伝子を含んでいる部位の外にあるため、この遺伝子変化の生体への影響の理解も、その領域に関連している遺伝子を判定する作業はめくらめっぽうというに等しかった。しかし、このような関連を理解するというのは、遺伝子的な病因を明らかにするカギとなるものである。バブラハム研究所の研究チームが開発した新テクニックは、ゲノムの画像の「一コマを凍結」し、その立体的な構造をそのまま捉え、一見離れて見える領域が、DNAの折り畳み構造のために実際にはすぐ隣り合わせになることを
MRgFUSとナノ粒子抗がん剤でマウスの乳がんを根絶
 MRgFUS (MRガイド下集束超音波)による熱アブレーションは、線維腫やがんの非侵襲的治療法である。University of California, Davis (UC-Davis) の新しい研究は、このテクニックをナノ粒子を用いた化学療法と併用することでマウスのがんを根絶できることを示した。MRgFUSは、超音波ビームで組織を熱して破壊する手法を磁気共鳴映像法 (MRI) と組み合わせ、MRIによってビームを誘導し、同時に治療の効果をモニターすることができる。
さらに、この治療法では、がん周辺部の正常組織や重要な構造に損害を与えないよう、また微小がん組織転移部分だけを破壊するよう、その効果を絞り込むことができる。The Journal of Clinical Investigationオンライン版に掲載されたオープン・アクセス論文で、UC-DavisのDistinguished Professor of Biomedical Engineeringを務めるKatherine W. Ferrara, Ph.D. (写真) と同僚研究者は、がん周辺部の組織を熱破壊せず、がんだけを完全に破壊する治療法について報告している。
同研究チームは、MRgFUS熱アブレーション治療を行った数種のがん組織で抗がん剤濃度が急激に上昇することを突き止めた。2015年11月23日付のこの研究論文は、「Ultrasound Ablation Enhances Drug Accumulation and Survival in Mammary Carcinoma Models (超音波アブレーションによる乳がんマウス・モデルの薬剤集中と生存率を強化)」と題されており、第一著者を務めたUC Davis Physician Scientist Training Program大学院生のAndre
MRgFUS (MRガイド下集束超音波)による熱アブレーションは、線維腫やがんの非侵襲的治療法である。University of California, Davis (UC-Davis) の新しい研究は、このテクニックをナノ粒子を用いた化学療法と併用することでマウスのがんを根絶できることを示した。MRgFUSは、超音波ビームで組織を熱して破壊する手法を磁気共鳴映像法 (MRI) と組み合わせ、MRIによってビームを誘導し、同時に治療の効果をモニターすることができる。
さらに、この治療法では、がん周辺部の正常組織や重要な構造に損害を与えないよう、また微小がん組織転移部分だけを破壊するよう、その効果を絞り込むことができる。The Journal of Clinical Investigationオンライン版に掲載されたオープン・アクセス論文で、UC-DavisのDistinguished Professor of Biomedical Engineeringを務めるKatherine W. Ferrara, Ph.D. (写真) と同僚研究者は、がん周辺部の組織を熱破壊せず、がんだけを完全に破壊する治療法について報告している。
同研究チームは、MRgFUS熱アブレーション治療を行った数種のがん組織で抗がん剤濃度が急激に上昇することを突き止めた。2015年11月23日付のこの研究論文は、「Ultrasound Ablation Enhances Drug Accumulation and Survival in Mammary Carcinoma Models (超音波アブレーションによる乳がんマウス・モデルの薬剤集中と生存率を強化)」と題されており、第一著者を務めたUC Davis Physician Scientist Training Program大学院生のAndre
脳のバイオマーカーで3種の精神病バイオタイプを特定
 University of Texas Southwestern Medical Center (UT Southwestern) の研究者を中心とする研究コンソーシアムは、精神病の診断と治療に役立てられる包括的なバイオマーカーの組み合わせを経験的に証明した。従来、精神病診断の基本は臨床観察で、患者を統合失調症、分裂情動、双極性障害などに分類することだった。
しかし、Bipolar-Schizophrenia Network on Intermediate Phenotypes (B-SNIP、中間表現型の双極性障害・統合失調症ネットワーク) と名付けられたこの新しい研究で、神経生物学的に独特な3種のバイオタイプを突き止めた。この3種は従来の臨床所見と必ずしも一致しない。アメリカ国民の推定6%が統合失調症、分裂情動、双極性障害を患っている。言い替えれば1,900万人のアメリカ国民がこれらの障害に悩んでいるということになる。この研究コンソーシアムを率いたUT SouthwesternのChair of Psychiatry and Professor of Psychiatryを務めるCarol Tamminga, M.D.は、「ある意味で、この研究はこれまでの精神病診断の基礎を完全に解体し、再考したといえる。
診断を現象本位でなく、生物学的に構築し直すことにより、これらの脳障害の生物学的な基礎を、障害の定義と新しい治療法のための分子標的として際立たせることが可能になった」と述べている。他にもHarvard University、Yale University、the University of Chicago、University of Georgiaが参加したこのB-SNIPコンソーシアムの研究論文は、2015年12月8日付American Journal of Ps
University of Texas Southwestern Medical Center (UT Southwestern) の研究者を中心とする研究コンソーシアムは、精神病の診断と治療に役立てられる包括的なバイオマーカーの組み合わせを経験的に証明した。従来、精神病診断の基本は臨床観察で、患者を統合失調症、分裂情動、双極性障害などに分類することだった。
しかし、Bipolar-Schizophrenia Network on Intermediate Phenotypes (B-SNIP、中間表現型の双極性障害・統合失調症ネットワーク) と名付けられたこの新しい研究で、神経生物学的に独特な3種のバイオタイプを突き止めた。この3種は従来の臨床所見と必ずしも一致しない。アメリカ国民の推定6%が統合失調症、分裂情動、双極性障害を患っている。言い替えれば1,900万人のアメリカ国民がこれらの障害に悩んでいるということになる。この研究コンソーシアムを率いたUT SouthwesternのChair of Psychiatry and Professor of Psychiatryを務めるCarol Tamminga, M.D.は、「ある意味で、この研究はこれまでの精神病診断の基礎を完全に解体し、再考したといえる。
診断を現象本位でなく、生物学的に構築し直すことにより、これらの脳障害の生物学的な基礎を、障害の定義と新しい治療法のための分子標的として際立たせることが可能になった」と述べている。他にもHarvard University、Yale University、the University of Chicago、University of Georgiaが参加したこのB-SNIPコンソーシアムの研究論文は、2015年12月8日付American Journal of Ps
食事と運動で減量した乳がん生存者ではテロメアの短縮過程に遅延がみられた
 健康的な食事と運動が、がんの予防と管理に重要であることはかなり研究され、論文も出ているが、その正確な機序についてはまだ明らかになっていない。しかし、Yale Cancer Centerの研究チームは、テロメア (写真で赤の部分) と呼ばれる染色体の小さな保護端にその謎を解く可能性を突き止めた。
この研究結果は、2015年12月8日から12日まで開かれていた2015 San Antonio Breast Cancer Symposiumで公式プレゼンテーションされた。研究チームは、以前に発表されていたLEANと名付けられたYaleでの減量介入研究の成果を踏まえ、減量試験に参加した乳がん生存者の生活習慣改良による体脂肪と体重減少がテロメアの長さとどう関わっているかを調べた。テロメアは、細胞分裂に伴って短くなり、短くなったテロメアは老化や乳がん死亡率上昇に関わっていることが知られている。乳がん生存者の減量とテロメアの長さとの関係を調べた少数の研究と同じように、Yaleの研究も食事と運動で減量した乳がん生存者ではテロメア短縮過程が遅くなることを突き止めている。
研究論文の第一著者で、Assistant Professor of Medical OncologyのTara Sanft, M.D.は、「何人かの場合にはテロメア短縮過程が逆転していた」と述べている。 Dr. Sanftは、「この研究結果から、体脂肪率の高さがテロメアの短縮と関連しており、減量がテロメアの長さの増加と関連していることが示される。また、そのことから、テロメアの長さは、肥満と乳がんリスクや死亡率との間を仲介するメカニズムかも知れない」と述べている。また、この研究論文の筆頭著者、Melinda Liggett Irwin, Ph.D., MPH (写真) は、「健康的な体重と運動の維持などの健康的な生活
健康的な食事と運動が、がんの予防と管理に重要であることはかなり研究され、論文も出ているが、その正確な機序についてはまだ明らかになっていない。しかし、Yale Cancer Centerの研究チームは、テロメア (写真で赤の部分) と呼ばれる染色体の小さな保護端にその謎を解く可能性を突き止めた。
この研究結果は、2015年12月8日から12日まで開かれていた2015 San Antonio Breast Cancer Symposiumで公式プレゼンテーションされた。研究チームは、以前に発表されていたLEANと名付けられたYaleでの減量介入研究の成果を踏まえ、減量試験に参加した乳がん生存者の生活習慣改良による体脂肪と体重減少がテロメアの長さとどう関わっているかを調べた。テロメアは、細胞分裂に伴って短くなり、短くなったテロメアは老化や乳がん死亡率上昇に関わっていることが知られている。乳がん生存者の減量とテロメアの長さとの関係を調べた少数の研究と同じように、Yaleの研究も食事と運動で減量した乳がん生存者ではテロメア短縮過程が遅くなることを突き止めている。
研究論文の第一著者で、Assistant Professor of Medical OncologyのTara Sanft, M.D.は、「何人かの場合にはテロメア短縮過程が逆転していた」と述べている。 Dr. Sanftは、「この研究結果から、体脂肪率の高さがテロメアの短縮と関連しており、減量がテロメアの長さの増加と関連していることが示される。また、そのことから、テロメアの長さは、肥満と乳がんリスクや死亡率との間を仲介するメカニズムかも知れない」と述べている。また、この研究論文の筆頭著者、Melinda Liggett Irwin, Ph.D., MPH (写真) は、「健康的な体重と運動の維持などの健康的な生活
Life Science News from Around the Globe
Edited by Michael D. O'Neill

バイオクイックニュースは、サイエンスライターとして30年以上の豊富な経験があるマイケルD. オニールによって発行されている独立系科学ニュースメディアです。世界中のバイオニュース(生命科学・医学研究の動向)をタイムリーにお届けします。バイオクイックニュースは、現在160カ国以上に読者がおり、2010年から6年連続で米国APEX Award for Publication Excellenceを受賞しました。
BioQuick is a trademark of Michael D. O'Neill