St. Jude Children's Research Hospital研究チームが主導して行った研究で、2種のiPS細胞を「三次元n培養」し、それぞれの網膜細胞形成能力を調べた結果、うち一つが特に優れていることを突き止めた。この研究では、網膜変性治療でiPS細胞のタイプによって効果に優劣がある可能性を示しただけでなく、その効果の標準定量化法も提案している。この研究は、St. Jude Department of Developmental Neurobiologyのメンバーであり、Howard Hughes Medical Institute (HHMI) の治験責任医を務めるMichael Dyer, Ph.D.が指導して行われた。
本研究結果は、2015年7月2日付Cell Stem Cell誌に、「Quantification of Retinogenesis in 3D Cultures Reveals Epigenetic Memory and Higher Efficiency in iPSCs Derived from Rod Photoreceptors (三次元培養における網膜形成の定量化で、桿体細胞由来iPS細胞のエピジェネティック記憶と高効率が明らかに)」の表題で掲載されている。
幹細胞は未成熟な細胞であり、体内で特定機能を持った細胞に分化することができる。現在、初期臨床試験で、加齢黄斑変性、網膜変性症、シュタルガルト病などの疾患で欠陥を持ち、死滅する細胞に代わって、この幹細胞が分化し、新しい細胞になることができるかどうかを調べている。そのような細胞の変性が失明の主要原因になっており、アメリカでは1,000万人を超える患者がこの障害に悩んでいるが、この数字は白内障と緑内障を合わせてよりもまだ多いのである。この臨床試験の初期の成果は希望が持てるものだったが、まだまだ科学的に解明しなければならない疑問も多い。
Dr. Dyerは、「重要な疑問の一つは、幹細胞を取り出す部位によって違いがあるのかということで、この研究では、その答を探り、幹細胞の生体活動をさらに深く調べていきたい」と述べている。研究チームは、成体細胞から造り出した2つのタイプの人工多能性幹細胞 (iPS細胞)を比較した。ここで研究対象とした2つの幹細胞タイプは、皮膚から得た線維芽細胞由来のiPS細胞と、桿体細胞と呼ばれる成熟した眼細胞由来のiPS細胞である。それまで、p53と呼ばれる主要調節遺伝子をオフする変異を起こさせずに成体ニューロンからiPS細胞を造ることは不可能と考えられていた。Dr. Dyerの研究室では、p53を不活性化せずにニューロンからiPS細胞をつくる新手法を開発した。この三次元培養技術は、リプログラミングするニューロンを正常な網膜のニューロンで囲み、より自然な環境で幹細胞をつくるという手法だった。これまでの一般的な培養法は培養器の層の中で細胞を成長させるというもので、この研究で扱った幹細胞ではうまく成長しなかったが、研究チームが開発した手法で格段に進歩した。
一旦幹細胞ができると、三次元培養で幹細胞から網膜細胞をつくることが試みられた。また、三次元培養技術に加えて、STEM-RETと呼ばれる測定法を用いられた。この測定法は、異なるタイプの幹細胞が網膜細胞を生成する率を正確に定量化することができた。STEM-RET解析の結果、網膜細胞生成率は、桿体細胞由来の幹細胞が線維芽細胞由来の幹細胞を上回っていることが明らかになった。また線維芽細胞由来の網膜細胞は、網膜として十全に機能するために必要な特定タイプの細胞が欠けていた。Dr. Dyerの研究チームは、幹細胞のこの2つのタイプの網膜細胞生成の効果の違いを説明できるような生体的な違いを探し、特に、2つのタイプのエピジェネティックな調節機構の違いを分析した。細胞のこのエピジェネティックな機構は、細胞の遺伝子を調節する生物学的なスイッチでできており、細胞の遺伝子のDNA構造に組み込まれている遺伝子調節機構とはまったく異なるものである。
研究者は、異なるタイプの幹細胞がそれぞれ「エピジェネティックな記憶」、つまり、成熟したタイプの細胞からリプログラムされた場合でも、過去のエピジェネティック・スイッチの設定を保持しているのではないか、と考えている。この「記憶」が、幹細胞が異なる細胞タイプを生成する時に影響することが考えられる。研究チームは、網膜細胞を分析する過程で、CTCFと呼ばれるタイプのエピジェネティック・スイッチが桿体細胞由来の幹細胞のエピジェネティックな記憶に関わっていることを突き止めた。
このエピジェネティック・スイッチが、網膜細胞生成のためには桿体細胞由来の幹細胞の方が優れているという結果になるのではないかと考えられるのである。Dr. Dyerは、「STEM-RETの幹細胞評価は、網膜幹細胞治療にどの幹細胞を使うべきかを決める上で重要な手がかりになっている。幹細胞分化の定量化測定をどう標準化するかは、この分野で長年議論が続けられてきたが、私達の開発したSTEM-RET法でその標準化が可能だ。この標準化でそれぞれのラボが互いに実験結果を正確に比較し、幹細胞系同士を比較することができるのだ。また、この手法を広く採用することが可能だと思う」と述べている。
このような幹細胞のエピジェネティック解析は、異なるタイプの幹細胞のそれぞれの特徴を解明した「エピジェネティック指紋」データにも発展する。Dr. Dyerは、「医療目的で網膜細胞、骨髄細胞その他の成熟細胞を再生する際にそういった指紋データと照合すればどの幹細胞系が適しているかが分かるようになる」と述べている。三次元培養技術とSTEM-RET測定プロトコールを利用すれば、幹細胞を遺伝子操作し、医療目的には医薬を用いて幹細胞を機能的な成熟細胞にリプログラムする最適な方法を見つけることもできるようになる。
この研究論文の他の著者としては、St. JudeのDaniel Hiler、Jiakun Zhang、Jongrye Jeon、Lyra Griffiths、Xiang Chen、Chunxu Qu、Beisi Xu、David Finkelstein、Sharon Frase各氏、University of Tennessee Health Science CenterのDianna Johnson氏、The Scripps Research InstituteのJennifer Hazen、Robert Eisenman、Kristin Baldwin、Sergey Kupriyanov、Alberto Rodriguez、Greg Martinの各氏、Fred Hutchinson Cancer Research CenterのPatrick Carroll氏が名を連ねている。
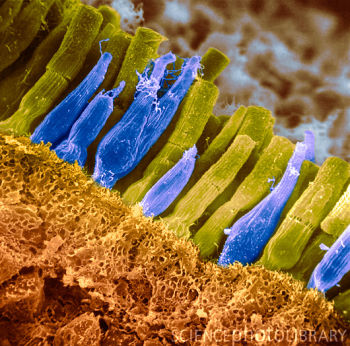
画像は網膜の桿体細胞と錐体細胞を示す。
原著へのリンクは英語版をご覧ください
iPSCs Derived from Rod Photoreceptors Better Than Fibroblast iPSCs at Producing Retinal Cells to Treat Retinal Degeneration; Epigenetic Switch May Play Important Role