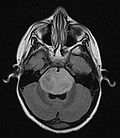
小児脳腫瘍の中には、稀に脳幹に発生し致死性が高い症例がある。この腫瘍を研究しているグループが、この小児脳腫瘍症例のほぼ80%に共通して見受けられる遺伝子の変異を明らかにしたが、その遺伝子は、これまで腫瘍とは関連していないと考えられてきたものだった。この遺伝子の変異は、他の悪性小児脳腫瘍にも積極的に関与していることが、初めて明らかになってきた。この新たな知見は、聖ユダ子供病院研究所で実施されている、ワシントン大学小児腫瘍遺伝子研究プロジェクト(PCGP)の研究結果である。
2年以内に患者の90%以上が死亡するこの脳腫瘍については、まだほとんど研究が進んでいなかったが、ようやく重要な研究結果が得られたことになる。この、びまん性内在性橋グリオーマ(以下DIPG)の発生は、ほぼ児童期に限定され、脳や中枢神経系に生じる腫瘍の10-15%を占める。「これらの変異を同定することによって、これまでは外科的治療しかなく、効果的な治療法がなかったDIPGに対して、新たな選択的治療ターゲットが見つかる可能性があるのです。」と聖ユダ神経生物学と脳腫瘍プログラムの共同指導教官で、聖ユダ発達神経学部研究員である、スザンヌ・ベーカー博士は話す。
同博士は、2012年1月29日のNature Genetics誌のオンライン版に発表された本研究の責任著者である。DIPGは、呼吸や頭蓋の底部に位置しており、呼吸や心拍などの生命活動の根幹を司る脳幹部に発生する、大変浸潤性が高い腫瘍である。DIPGは外科的治療では治癒しないが、侵襲性の無い画像装置によって正確に診断される。それが理由でアメリカでは、DIPGのバイオプシが行なわれる事は極めて稀であり、結果として研究が進んでいなかった。
腫瘍の発生は、遺伝子の正常な活動が阻害された場合に発生し、細胞増殖が野放しとなり、全身に広がって死をもたらす。DNAを細胞内に収納する役割を司る2種類のタンパクを産生するように、指示を出す遺伝子がある。本研究で研究チームはDIPGの78%に、この遺伝子の1箇所か2箇所に変異があることを明らかにした。この2種類のタンパクはヒストンH3ファミリーに属する。DNAはヒストンタンパクに巻きついており、それによって核内に収納されるサイズに調整されている。
ヒストンタンパクによるDNAのパッケージング化は、どの遺伝子活性をON/OFFするかを決めたり、DNA損傷や変異を修復したり、DNAを安定化されたりするために重要な役割を担っている。これらのプロセスのどれが阻害されても、腫瘍の発生に繋がるのである。研究チームは、この遺伝子変異こそ、予後の悪い小児脳腫瘍に大きく関与していると考えている。
「この特定の腫瘍タイプが、生体分子の“動かぬ証拠”によって同定されるのは大変興味深いことです。つまりこれらの変異こそが、この脳腫瘍の高速増殖に関与していると考えられるのです。今回の成果は、がん患者の遺伝子を研究する者が誰でも期待する、典型的な結果を示しています。」と、セントルイスにあるワシントン大学医学部の遺伝子研究所長で、本論文の責任著者の一人でもある、リチャード・K・ウィルソン博士は説明する。これまでほとんど研究が進んでいなかったDIPGについて、児童の健常症例と疾患症例合計で600人もの症例を集めて行なわれた、将に待ち望まれた大規模な研究の3年間の最終結果が、今回の成果なのである。ヒトゲノムには、人間の生命活動を調整し保持するために必要な、完全な情報セットが含まれている。なぜ腫瘍が発生し、転移し、人を死に至らせるのかを明確に説明することが目的である。
研究チームは、今回の成果により、診断・治療・予防などに新しい方法を開発する基礎が出来たと確信している。本研究では、DIPG 7症例の患者から得た、腫瘍組織のゲノムと正常組織のゲノムの全シーケンスが、比較解析された。「DIPG 7症例の患者から得た腫瘍組織のゲノムには、高い頻度で変異が観察され、DIPGの他の多くの症例で同様の変異が確認できます。」とベイカー博士は話す。
研究チームが、更に43症例のDIPG患者のヒストンH3タンパクバリアントに密接に関連する16個の遺伝子配列を解析した結果、多くの腫瘍組織で共通する変異が観察されたのは、このうち2個の遺伝子であった。総計50症例のDIPG腫瘍組織が本研究で解析され、H3F3A遺伝子に1箇所変異を有するケースが60%に観察された。変異遺伝子がタンパクに翻訳された場合、点変異によってヒストンH3タンパクの27番目のアミノ酸が、メチオニンからリジンに置き換わる。それ以外で18%に相当するDIPG患者の症例では、他の遺伝子HIST1H3Bに同様の変異が見受けられた。研究チームは現在、H3F3AとHIST1H3Bの変異が、細胞機能にどのような影響を与え、腫瘍形成に関与するのかを解明するための研究に従事している。初期段階の研究であっても、大きな手掛かりを与えてくれる。
変異体であるリジンは、ヒストンH3内の他のタンパクと親和性を有する酵素から相互作用を受ける標的となる。そして本来の標的以外のタンパクと相互作用を有する事により、遺伝子発現のスイッチングにどのように影響するかが問題になるのだと、ベイカー博士は説明する。他の腫瘍の場合では、ヒストンH3を標的とする酵素のバリアントが同定されているが、本件は、腫瘍組織におけるヒストンタンパクが特異的な変異を受けている事を示した、初めての論文である。2012年1月29日付けNature誌オンライン版に発表された、児童期の脳腫瘍におけるヒストンの変異についての独自の研究結果は、注目に値し、これはBioQuick Newsの別のニュース記事「小児脳腫瘍における遺伝子技術による画期的進展」に紹介されている。
H3F3AとHIST1H3Bは、他の悪性小児脳腫瘍であるグリア芽腫−これは脳幹の外部に増殖する−においても変異している。本研究にはグリア芽腫36症例も組み込まれ、遺伝子の36%に明白な点変異が見つかった。H3F3Aに他の1つの変異が見つかったが、これはDIPGには観察されなかった。しかし、ヒストンH3遺伝子の変異は、本研究で調査した他の252例の他の小児腫瘍組織には観察されなかった。それらの腫瘍には?・?グレードのグリオーマ、髄芽細胞腫、上衣細胞腫そして脳腫瘍や中枢神経系以外の腫瘍が含まれている。H3のバリアントは、成人期のグリオーマを含む他の腫瘍ではいずれも報告が無い。「これら特徴的な変異は、生育中の脳幹の腫瘍では顕著に現われるが、生育中の脳ではそれほど目立たないと言う、選択性を有しています。ここに、小児期の脳腫瘍は予後が大変悪く、成人期のそれはそうでは無い要因があります。」とベイカー博士は言う。
「今回の発見は、小児腫瘍遺伝子プロジェクトによるバイアスの無い研究無しでは、得られなかった結果です。変異については他のどの腫瘍においても過去に報告されていなかったので、DIPGについても、変異を追いかけようとはしませんでした。しかし現在では、遺伝子変異がこの特徴的な腫瘍の形成に重要な役割を担うことが、明らかになったのです。」とベイカー博士は述懐する。
[BioQuick News: Histone Mutations Associated with Aggressive Childhood Brain Tumors"> [Press release"> [Nature Genetics abstract"> [Nature abstract"> [Nature blog">