まるでマジシャンが奇術を見せるように、mitoNEETタンパク質(糖尿病や癌、そして老化において重要な役割をもつ、まだ謎の多い物質)は、1カ所で動きを見せたかと思うと、より重要な活動を別の箇所で行っていたりするのである。このタンパク質が鉄や硫黄など、有毒な物質の構造部をどのようにコントロールしているのかを理解するため、ライス大学およびサンディエゴ、カリフォルニア大学(UCSD)の研究チームは室内実験とコンピューターモデリングを駆使し、mitoNEETの活動の一部を解読した。
この研究は2012年1月23日付けのPNAS誌に記載された。「我々は特殊な方法を使ってタンパク質を精査するのです。」と、ライス大学Harry C. and Olga K. Wiessの物理学と天文学の教授であり、理論生物物理学センターの共同代表であるジョゼ・オニュキック博士は語った「我々は生物物理学を用いて生物学を行ないます。これは実験において認められている、いないに関わりません。そして、これらのロジックが生物学的に重要であるかどうかを問うのです。」と、本研究のリーダー、UCSD生物化学科教授のパトリシア・ジェニングス博士は語る。ジェニングス博士はオニュキック博士と15年に渡り共同研究を行ってきているが、構造生物物理学で研究を進めることで、大幅に時間を短縮してきたと説明している。
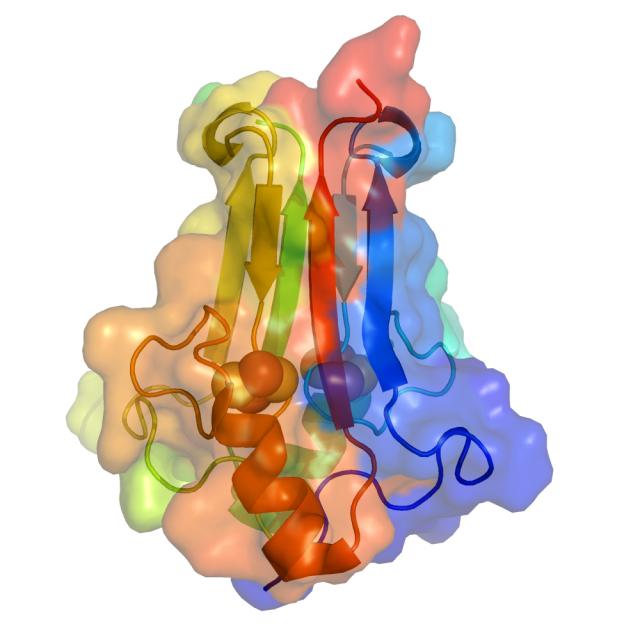
例えば、ジェニングス博士の研究室では5年ほど以前に、mitoNEETが特殊な折りたたみ構造を有していることを明らかにした。それ以降、彼女の研究室では、タンパクの統計学的そして動力学的スナップショットから得られる情報を用いて、生物学研究と生化学研究を行なってきた。「タンパクとは動く部品で構成された機会であることを、みなさんは忘れているようです。私たちは統計学的スナップショットを開始し、機能的な動きをモデル化しました。」とUCSDの大学院生でオニュキック博士とジェニングス博士の指導の下で研究を司り、本論文の筆頭著者であるエリザベス・ベクスター氏は語る。
糖尿病の薬であるアクトスに結合するMitoNEETは、その発見と同時に多くの研究者の注目の的となっている。それが有する特殊な機能は、鉄の活性を基盤とする分子を、鉄と硫黄の構造中に取り込むことだ。
全ての生物にとって鉄は重要な成分であるが、強い毒性も有している。そしてmitoNEETは鉄を取り扱う唯一のタンパクで、細胞の主要構成物であるミトコンドリアの膜の上に存在することが知られている。このタンパクの機能は依然不明な点も多いが、興味深いことに、mitoNEETはミトコンドリアの外膜上に存在し、有毒性の鉄−硫黄構造部を、細胞内を満たすゲル状の細胞質側に向けていることが、研究によって明らかになっている。
このタンパクの鉄−硫黄構造部が有する特殊な結合様相を探索することで、ジェニングス博士の研究チームは、その構造がミトコンドリア内に導かれることを明らかにした。更には、mitoNEETの娘タンパクが、アポトーシス(不要になった細胞が自死するプロセス)に関与するタンパク類と相互作用を有することが判った。
「おそらく、mitoNEETはあなたにとって最も大事な友達でもあり、最悪の敵でもあるのです。それは酸化ストレスのセンサーとして働き、その環境下では、毒性を有する鉄−硫黄構造を失うことが実証されています。その鉄が結局はどこに行くかによっては、細胞内の根本的な問題となります。」とジェニングス博士は語る。タンパクとはアミノ酸が連なって出来たものであり、DNAの青写真から産生されるが、その立体構造に重要な機能を発揮する鍵がある。mitoNEETがどのようにして自らの鉄−硫黄構造をコントロールしたり放出したりするのかは、その立体構造に答えがある。
バクスター博士はコンピューターシミュレーションを用いて、どのようにタンパク立体構造が折りたたまれるのか、そして類似した2通りの構造が生物学的にどのように重要な機能を発揮するのかを研究した。そのうちの一つの構造では、若干絡み合うように2本の腕のような構造部が、鉄−硫黄ポケットから伸びていることが判った。もう一つの構造では、この2本の腕構造が、伸びてはいるが、絡み合っていない事が判った。
バクスター博士は両方の構造ともに物理的に可能であることを確認した。
また同博士は、このタンパクは「紐構造の交換形式」と「紐構造の非交換形式」の2種類の構造を取りうるが、完全に折りたたみ構造は開かないことも明らかにした。更に、この絡み合う腕構造の変化は、鉄−硫黄構造を保持するポケットの構造を変化させ、腕構造が絡み合っていないときに、ポケットからの出入りが行われ易くなることを示した。
マジシャンがトリックを使うように、鉄−硫黄構造がグリップを失うメカニズムは巧妙に設計されており、腕構造の動きが少し変わって発生する。ジェニングス博士は、もし鉄−硫黄構造部にだけ注目していたら、簡単に見落としていただろうと述懐する。オニュキック博士は「私たちのアプローチが良かったのは、関連する生物物理的要素が、離れた場所の機能部位をコントロールする−mitoNEETの紐交換構造のように−を探索できたからです。通常の方法を採用していたら、容易に見落としていたと思います。」と語る。
[BioQuick News: Probe of Mysterious Protein Involved in Diabetes, Cancer, and Aging"> [Press release"> [PNAS article