コモドドラゴンの進化した歯:恐竜の生態系を解き明かす鍵
 トロント動物園のコモドドラゴンのキラットが2024年2月に亡くなりました。彼の種(バラヌス・コモドエンシス)の他のメンバーと同様に、コモドドラゴンと呼ばれるにふさわしい存在でした。その印象的なサイズと、あなたを見つめ、あなたの一挙手一投足を追跡する様子は、獰猛な獣脚類恐竜のような頂点捕食者であることを実感させました。ですから、彼の飼育施設を見回すと、恐竜時代の獣脚類恐竜を探しているときによく見つかる、地面に輝く落ち歯があるのを見つけるのも驚くことではありません。この現象は、この魅力的な捕食者の歯と食事行動を研究するきっかけとなりました。
トロント動物園チームは親切にも多くの落ち歯を集め、研究を行うことを許可しました。またロイヤルオンタリオ博物館の骨格コレクションの頭蓋骨の利用も許可しました。
以前の研究ではコモドドラゴンのユニークな食事行動に焦点を当てていましたが、そのユニークな歯の形態、発達、そして交換については関連付けていませんでした。したがって、私たちは成体と幼体の歯と顎を組織学的分析とCTスキャンの組み合わせで調査しました。
大人のコモドの歯は驚くほど獣脚類恐竜の歯に似ており、大人の強く反り返った歯は歯髄芯によって強化された鋸歯状の切断縁を持っていることがわかりました。
「この発見には非常に興奮しました。なぜなら、コモドは絶滅した獣脚類恐竜の生活史と食性戦略の研究にとって理想的な生きたモデル生物となるからです」と、PLoS Oneに掲載された論文の筆頭著者であるティー・マホ博士課程学生(Tea Maho, PhD)は言いました。シニア著者はロバート・レイズ博士(Robert Reisz, PhD)です。オープンアクセス論文のタイトルは「Exceptionally Rapid Tooth Development and Ontogenetic Change
トロント動物園のコモドドラゴンのキラットが2024年2月に亡くなりました。彼の種(バラヌス・コモドエンシス)の他のメンバーと同様に、コモドドラゴンと呼ばれるにふさわしい存在でした。その印象的なサイズと、あなたを見つめ、あなたの一挙手一投足を追跡する様子は、獰猛な獣脚類恐竜のような頂点捕食者であることを実感させました。ですから、彼の飼育施設を見回すと、恐竜時代の獣脚類恐竜を探しているときによく見つかる、地面に輝く落ち歯があるのを見つけるのも驚くことではありません。この現象は、この魅力的な捕食者の歯と食事行動を研究するきっかけとなりました。
トロント動物園チームは親切にも多くの落ち歯を集め、研究を行うことを許可しました。またロイヤルオンタリオ博物館の骨格コレクションの頭蓋骨の利用も許可しました。
以前の研究ではコモドドラゴンのユニークな食事行動に焦点を当てていましたが、そのユニークな歯の形態、発達、そして交換については関連付けていませんでした。したがって、私たちは成体と幼体の歯と顎を組織学的分析とCTスキャンの組み合わせで調査しました。
大人のコモドの歯は驚くほど獣脚類恐竜の歯に似ており、大人の強く反り返った歯は歯髄芯によって強化された鋸歯状の切断縁を持っていることがわかりました。
「この発見には非常に興奮しました。なぜなら、コモドは絶滅した獣脚類恐竜の生活史と食性戦略の研究にとって理想的な生きたモデル生物となるからです」と、PLoS Oneに掲載された論文の筆頭著者であるティー・マホ博士課程学生(Tea Maho, PhD)は言いました。シニア著者はロバート・レイズ博士(Robert Reisz, PhD)です。オープンアクセス論文のタイトルは「Exceptionally Rapid Tooth Development and Ontogenetic Change
エクソソームと超音波を利用した革新的な脳卒中治療法への挑戦
 時には「ノー」という回答が、別の面で「イエス」を見つけるきっかけとなります。それは、ジョージア医科大学オーガスタ大学の生化学および分子生物学部門の教授であり、長年にわたって乳がんの研究に従事してきたアリ・アルバブ博士(Ali Arbab, MD)にも当てはまるケースです。乳がん治療のために提案した方法が補助金を得られなかった際、アルバブ博士は他の病気に焦点を移し、その方法を脳卒中の患者を助けるためにカスタマイズできることを発見しました。その結果、アルバブ博士は国立衛生研究所(NIH)の一部である国立神経障害および脳卒中研究所(NINDS)から423,500ドルの補助金を受け取ることになりました。
アルバブ博士は次のように述べています。「私はキャリアの大部分を乳がんの研究に費やしてきましたが、がん治療のためのこの新技術を開発したとき、それが他の疾患の治療にも使用できることを知っていました。その知識を活かし、この技術がどのようにして脳卒中の患者を治療するために使用できるかに焦点を当て直し、この補助金を確保することができました。」
アルバブ博士と彼のチームの研究者のサワイズ・カシフ氏(Sawaiz Kashif)と大学院研究アシスタントのマヒリマ・パービン氏(Mahrima Parvin)らは、特定の細胞を標的とし、治療ペイロードを搭載できる非腫瘍性HEK293細胞を使用してエンジニアリングされたエクソソームを作製するDNA技術プラットフォームを開発しました。
アルバブ博士は、狂犬病ウイルス由来の特定の細胞標的化ペプチド、特にニューロン特異的狂犬病ウイルスグリコプロテイン(RVG)およびニューログロビン(Ngb)を使用しています。Ngbは、虚血性脳卒中後の低酸素/虚血および酸化ストレス関連の侮辱からニューロンを保護する治療プローブ/ペイロードです。
しかし、乗り越える
時には「ノー」という回答が、別の面で「イエス」を見つけるきっかけとなります。それは、ジョージア医科大学オーガスタ大学の生化学および分子生物学部門の教授であり、長年にわたって乳がんの研究に従事してきたアリ・アルバブ博士(Ali Arbab, MD)にも当てはまるケースです。乳がん治療のために提案した方法が補助金を得られなかった際、アルバブ博士は他の病気に焦点を移し、その方法を脳卒中の患者を助けるためにカスタマイズできることを発見しました。その結果、アルバブ博士は国立衛生研究所(NIH)の一部である国立神経障害および脳卒中研究所(NINDS)から423,500ドルの補助金を受け取ることになりました。
アルバブ博士は次のように述べています。「私はキャリアの大部分を乳がんの研究に費やしてきましたが、がん治療のためのこの新技術を開発したとき、それが他の疾患の治療にも使用できることを知っていました。その知識を活かし、この技術がどのようにして脳卒中の患者を治療するために使用できるかに焦点を当て直し、この補助金を確保することができました。」
アルバブ博士と彼のチームの研究者のサワイズ・カシフ氏(Sawaiz Kashif)と大学院研究アシスタントのマヒリマ・パービン氏(Mahrima Parvin)らは、特定の細胞を標的とし、治療ペイロードを搭載できる非腫瘍性HEK293細胞を使用してエンジニアリングされたエクソソームを作製するDNA技術プラットフォームを開発しました。
アルバブ博士は、狂犬病ウイルス由来の特定の細胞標的化ペプチド、特にニューロン特異的狂犬病ウイルスグリコプロテイン(RVG)およびニューログロビン(Ngb)を使用しています。Ngbは、虚血性脳卒中後の低酸素/虚血および酸化ストレス関連の侮辱からニューロンを保護する治療プローブ/ペイロードです。
しかし、乗り越える
レトロウイルス統合の最近の稀なケース: 感染性テナガザル白血病ウイルスがニューギニアのげっ歯類のゲノムに定着
 レトロウイルスは、その遺伝子を宿主細胞のゲノムに組み込むことで増殖するウイルスです。感染した細胞が生殖細胞である場合、レトロウイルスは次世代に「内在性」レトロウイルス(ERV)として受け継がれ、その宿主種のゲノムの一部として広がることができます。脊椎動物では、ERVは普遍的に存在し、時には宿主ゲノムの10パーセントを占めることもあります。しかし、ほとんどのレトロウイルスの統合は非常に古く、既に劣化しているため不活性であり、その初期の宿主への影響は、数百万年の進化によって最小限に抑えられています。
ドイツのリープニッツ動物園・野生動物研究所(Leibniz-IZW)が率いる研究チームは、ニューギニアの齧歯類である白腹モザイクテールラットにおけるレトロウイルスの最近の症例を発見しました。PNASに掲載された論文では、この新しいウイルス統合のモデルを説明しています。このプロセスに関する観察は、レトロウイルスが宿主のゲノムをどのように書き換えるかについての理解を深めるのに役立ちます。
2024年2月1日に公開されたこの論文は、「A Recent Gibbon Ape Leukemia Virus Germline Integration in a Rodent from New Guinea」(ニューギニアの齧歯類における最近のGibbon ape白血病ウイルスの生殖系統への統合)と題されています。
レトロウイルスは、AIDS(HIV-1)の原因となる病原体など、ライフサイクル中に感染した宿主細胞のゲノムに組み込まれます。これが宿主の生殖細胞(卵細胞や精子を生産する細胞)で起こると、レトロウイルスは実際に宿主自身の遺伝子になることがあります。このプロセスは一般的であり、ほとんどの脊椎動物のゲノムの最大10パーセントが、このような古代の感染の残骸で構成されています。
この
レトロウイルスは、その遺伝子を宿主細胞のゲノムに組み込むことで増殖するウイルスです。感染した細胞が生殖細胞である場合、レトロウイルスは次世代に「内在性」レトロウイルス(ERV)として受け継がれ、その宿主種のゲノムの一部として広がることができます。脊椎動物では、ERVは普遍的に存在し、時には宿主ゲノムの10パーセントを占めることもあります。しかし、ほとんどのレトロウイルスの統合は非常に古く、既に劣化しているため不活性であり、その初期の宿主への影響は、数百万年の進化によって最小限に抑えられています。
ドイツのリープニッツ動物園・野生動物研究所(Leibniz-IZW)が率いる研究チームは、ニューギニアの齧歯類である白腹モザイクテールラットにおけるレトロウイルスの最近の症例を発見しました。PNASに掲載された論文では、この新しいウイルス統合のモデルを説明しています。このプロセスに関する観察は、レトロウイルスが宿主のゲノムをどのように書き換えるかについての理解を深めるのに役立ちます。
2024年2月1日に公開されたこの論文は、「A Recent Gibbon Ape Leukemia Virus Germline Integration in a Rodent from New Guinea」(ニューギニアの齧歯類における最近のGibbon ape白血病ウイルスの生殖系統への統合)と題されています。
レトロウイルスは、AIDS(HIV-1)の原因となる病原体など、ライフサイクル中に感染した宿主細胞のゲノムに組み込まれます。これが宿主の生殖細胞(卵細胞や精子を生産する細胞)で起こると、レトロウイルスは実際に宿主自身の遺伝子になることがあります。このプロセスは一般的であり、ほとんどの脊椎動物のゲノムの最大10パーセントが、このような古代の感染の残骸で構成されています。
この
女性が自己免疫疾患になりやすい理由を解明:X染色体の秘密
 なぜ女性は自己免疫疾患にかかりやすいのか、その謎を解明する研究結果が発表されました: すべての女性細胞にあるX染色体によって作られる分子が、女性自身の組織に対する抗体を生成する可能性があるとのことです。
2400万人から5000万人のアメリカ人が自己免疫疾患を患っています。そのうちの5人に4人は女性です。関節リウマチ、多発性硬化症、強皮症は、男女比が逆転している自己免疫疾患の例であります。スタンフォード大学の研究者らは、この格差を、生物学的に雌の哺乳類と雄の哺乳類を区別する最も基本的な特徴にまでさかのぼりました。
「私は臨床医として、多くの全身性エリテマトーデスや強皮症の患者を診察します。これらの自己免疫疾患は皮膚に現れるためです。これらの患者の大多数は女性です。」とハワード・ヒューズ医学研究所の皮膚科および遺伝学教授のハワード・チャン博士(Howard Chang, MD, PhD)は述べています。
チャン博士は、この研究の主要著者であるスタンフォード基礎生命研究科学者のダイアナ・ドゥー博士(Diana Dou, PhD)と共に、2024年2月1日に「Cell」誌に掲載された研究を主導しました。このオープンアクセス論文は「Xist Ribonucleoproteins Promote Female Sex-Biased Autoimmunity.(Xistリボ核タンパク質は女性性バイアスの自己免疫性を促進する)」と題されています。
第二のX染色体の沈黙
女性は良いものを持ちすぎている:それはX染色体と呼ばれます。
哺乳類界では、生物学的性別は、すべての雌細胞に2本のX染色体が存在するかどうかで決まります。雄の細胞にはX染色体が1本だけ存在し、Y染色体と呼ばれるもっと短い染色体と対になっています。
Y染色体は活動的な遺伝子をほんの一握りしか含んでいま
なぜ女性は自己免疫疾患にかかりやすいのか、その謎を解明する研究結果が発表されました: すべての女性細胞にあるX染色体によって作られる分子が、女性自身の組織に対する抗体を生成する可能性があるとのことです。
2400万人から5000万人のアメリカ人が自己免疫疾患を患っています。そのうちの5人に4人は女性です。関節リウマチ、多発性硬化症、強皮症は、男女比が逆転している自己免疫疾患の例であります。スタンフォード大学の研究者らは、この格差を、生物学的に雌の哺乳類と雄の哺乳類を区別する最も基本的な特徴にまでさかのぼりました。
「私は臨床医として、多くの全身性エリテマトーデスや強皮症の患者を診察します。これらの自己免疫疾患は皮膚に現れるためです。これらの患者の大多数は女性です。」とハワード・ヒューズ医学研究所の皮膚科および遺伝学教授のハワード・チャン博士(Howard Chang, MD, PhD)は述べています。
チャン博士は、この研究の主要著者であるスタンフォード基礎生命研究科学者のダイアナ・ドゥー博士(Diana Dou, PhD)と共に、2024年2月1日に「Cell」誌に掲載された研究を主導しました。このオープンアクセス論文は「Xist Ribonucleoproteins Promote Female Sex-Biased Autoimmunity.(Xistリボ核タンパク質は女性性バイアスの自己免疫性を促進する)」と題されています。
第二のX染色体の沈黙
女性は良いものを持ちすぎている:それはX染色体と呼ばれます。
哺乳類界では、生物学的性別は、すべての雌細胞に2本のX染色体が存在するかどうかで決まります。雄の細胞にはX染色体が1本だけ存在し、Y染色体と呼ばれるもっと短い染色体と対になっています。
Y染色体は活動的な遺伝子をほんの一握りしか含んでいま
交尾のために48時間時計で動く甲虫、自然界に48時間周期の手がかりがないため謎に包まれる
 地球上の生き物は24時間周期で動いていますが、ある甲虫は自然界の他の生物と同期していません。新しい研究では、独自の48時間周期を持つ甲虫に注目しています。2023年1月18日にCurrent Biologyに掲載されたこのオープンアクセス論文は「Circabidian Rhythm of Sex Pheromone Reception in a Scarab Beetle(スカラベ甲虫における性フェロモン受信のサーカビディアンリズム)」と題されています。
大きな黒いチャファー甲虫、Holotrichia parallelaは、アジアの農業害虫です。雌甲虫は隔夜、土から出てきて宿主植物を登り、雄を引き寄せるフェロモンを放出します。
雌甲虫の交尾行動は、48時間、または概日リズムの制御下にあり、その理由は不明のままです。カリフォルニア大学デービス校の分子・細胞生物学教授であるウォルター・リアル博士(Walter Leal, PhD)と、中国農業科学院北京のジャオ・イン博士(Jiao Yin, PhD)が率いるチームは、雄甲虫が雌を嗅ぎ分ける能力も48時間周期であるかどうかを知りたがっていました。
リアル博士のラボは、昆虫の化学感覚を研究しています。蛾から蚊までの多くの昆虫は、配偶者を引き寄せるために匂いを使います。昆虫は、空中を漂う特定の化学物質に反応する特殊な受容体を含む触角で「匂い」を嗅ぎます。
フェロモンに従う
チームの最初のステップは、雌のフェロモンに反応する受容体の遺伝子を大型黒チャファーで特定することでした。このフェロモンはL-アイソロイシンメチルエステル、またはLIMEという名前が付けられています。
研究者たちは当初、14の候補遺伝子をクローニングしました。一連の実験により、彼らはHparOR14遺伝子を性フェロモン受容体として特定しました。
地球上の生き物は24時間周期で動いていますが、ある甲虫は自然界の他の生物と同期していません。新しい研究では、独自の48時間周期を持つ甲虫に注目しています。2023年1月18日にCurrent Biologyに掲載されたこのオープンアクセス論文は「Circabidian Rhythm of Sex Pheromone Reception in a Scarab Beetle(スカラベ甲虫における性フェロモン受信のサーカビディアンリズム)」と題されています。
大きな黒いチャファー甲虫、Holotrichia parallelaは、アジアの農業害虫です。雌甲虫は隔夜、土から出てきて宿主植物を登り、雄を引き寄せるフェロモンを放出します。
雌甲虫の交尾行動は、48時間、または概日リズムの制御下にあり、その理由は不明のままです。カリフォルニア大学デービス校の分子・細胞生物学教授であるウォルター・リアル博士(Walter Leal, PhD)と、中国農業科学院北京のジャオ・イン博士(Jiao Yin, PhD)が率いるチームは、雄甲虫が雌を嗅ぎ分ける能力も48時間周期であるかどうかを知りたがっていました。
リアル博士のラボは、昆虫の化学感覚を研究しています。蛾から蚊までの多くの昆虫は、配偶者を引き寄せるために匂いを使います。昆虫は、空中を漂う特定の化学物質に反応する特殊な受容体を含む触角で「匂い」を嗅ぎます。
フェロモンに従う
チームの最初のステップは、雌のフェロモンに反応する受容体の遺伝子を大型黒チャファーで特定することでした。このフェロモンはL-アイソロイシンメチルエステル、またはLIMEという名前が付けられています。
研究者たちは当初、14の候補遺伝子をクローニングしました。一連の実験により、彼らはHparOR14遺伝子を性フェロモン受容体として特定しました。
血流中の腫瘍DNAを検出するための革新的アプローチ
 リキッドバイオプシーの進歩により、血液サンプル中の循環腫瘍DNAの検出が容易になり、がんの早期診断や治療の指針となる可能性があります。がん患者の血流中に一時的に循環し、すぐに分解される死んだ細胞からのDNA、つまり腫瘍DNAを捉え出すことができる血液検査を開発した企業があります。しかし、常に循環している腫瘍DNAの量は非常に少なく、この微小なシグナルを検出するのに十分な感度を持つテストを開発することは困難でした。
MITとハーバード大学のブロード研究所の研究チームは、血流中の腫瘍DNAのクリアランスを一時的に遅らせることで、そのシグナルを大幅に増幅する方法を考案しました。研究者たちは、体が血流中の腫瘍DNAを除去する能力に一時的に干渉することができる「プライミングエージェント」と呼ばれる2種類の注射可能な分子を開発しました。マウスを用いた研究では、これらのエージェントがDNAレベルを十分に高め、早期の肺転移が検出可能な割合を10%未満から75%以上に跳ね上げることを示しました。
このアプローチにより、がんの早期診断だけでなく、治療をガイドするために使用できる腫瘍変異のより敏感な検出、およびがん再発の改善された検出が可能になるかもしれません。
サンギータ・バティア博士(Sangeeta Bhatia, MD, PhD)は、「血液採取の1時間前にこれらのエージェントのいずれかを投与することで、以前は見えなかったものが見えるようになります。これは、液体生検を行っている全員に、これまで以上に多くの分子を提供できることを意味します」と述べています。
バティア博士は、新しい研究の共同上級著者の一人であり、MITのジョン・アンド・ドロシー・ウィルソン健康科学技術教授および電気工学コンピュータ科学教授、MITのコッホ統合がん研究所および医学工学科学研究所のメンバーです。
バテ
リキッドバイオプシーの進歩により、血液サンプル中の循環腫瘍DNAの検出が容易になり、がんの早期診断や治療の指針となる可能性があります。がん患者の血流中に一時的に循環し、すぐに分解される死んだ細胞からのDNA、つまり腫瘍DNAを捉え出すことができる血液検査を開発した企業があります。しかし、常に循環している腫瘍DNAの量は非常に少なく、この微小なシグナルを検出するのに十分な感度を持つテストを開発することは困難でした。
MITとハーバード大学のブロード研究所の研究チームは、血流中の腫瘍DNAのクリアランスを一時的に遅らせることで、そのシグナルを大幅に増幅する方法を考案しました。研究者たちは、体が血流中の腫瘍DNAを除去する能力に一時的に干渉することができる「プライミングエージェント」と呼ばれる2種類の注射可能な分子を開発しました。マウスを用いた研究では、これらのエージェントがDNAレベルを十分に高め、早期の肺転移が検出可能な割合を10%未満から75%以上に跳ね上げることを示しました。
このアプローチにより、がんの早期診断だけでなく、治療をガイドするために使用できる腫瘍変異のより敏感な検出、およびがん再発の改善された検出が可能になるかもしれません。
サンギータ・バティア博士(Sangeeta Bhatia, MD, PhD)は、「血液採取の1時間前にこれらのエージェントのいずれかを投与することで、以前は見えなかったものが見えるようになります。これは、液体生検を行っている全員に、これまで以上に多くの分子を提供できることを意味します」と述べています。
バティア博士は、新しい研究の共同上級著者の一人であり、MITのジョン・アンド・ドロシー・ウィルソン健康科学技術教授および電気工学コンピュータ科学教授、MITのコッホ統合がん研究所および医学工学科学研究所のメンバーです。
バテ
1975年から2019年の乳がん死亡率の顕著な減少:スクリーニングと治療の進歩による影響
 1975年から2019年の間に乳がんによる死亡率が58%減少したことが、スタンフォード大学医学部の臨床医および生物医学データ科学者が主導する新たな多施設研究により明らかになりました。この減少のほぼ3分の1(29%)は、体の他の部位に広がったメタスタティック(転移性)乳がん、すなわちステージ4の乳がんや再発性がんの治療の進歩によるものです。これらの進行がんは治癒不可能と見なされているものの、メタスタティックがんを患う女性はこれまで以上に長生きしています。この分析により、がん研究者は将来の努力と資源をどこに集中させるべきかを評価するのに役立ちます。
「乳がんによる死亡が過去数十年間減少していることはわかっていましたが、どの介入が最も成功しているのか、またその程度を定量化することは困難であるいは不可能でした」と、スタンフォード大学医学部の医学部助教授であるジェニファー・キャスウェル=ジン博士(Jennifer Caswell-Jin, MD)は述べています。「この種の研究により、どの取り組みが最も影響を与えているか、そしてどこで改善が必要かを見ることができます。」
キャスウェル=ジン博士と元研究アシスタントのリヤン・サン(Liyang Sun)は、2024年1月16日にJournal of the American Medical Association (JAMA)に発表されたこの研究の共同第一著者です。生物医学データ科学の教授兼学部長であるシルヴィア・プレヴリティス博士(Sylvia Plevritis, PhD)と、医学および疫学・人口健康学の教授であるアリソン・クリアン博士(MD, MSc)が共同上級著者です。論文の題名は「Analysis of Breast Cancer Mortality in the US—1975 to 2019」です。
この研究は、CIS
1975年から2019年の間に乳がんによる死亡率が58%減少したことが、スタンフォード大学医学部の臨床医および生物医学データ科学者が主導する新たな多施設研究により明らかになりました。この減少のほぼ3分の1(29%)は、体の他の部位に広がったメタスタティック(転移性)乳がん、すなわちステージ4の乳がんや再発性がんの治療の進歩によるものです。これらの進行がんは治癒不可能と見なされているものの、メタスタティックがんを患う女性はこれまで以上に長生きしています。この分析により、がん研究者は将来の努力と資源をどこに集中させるべきかを評価するのに役立ちます。
「乳がんによる死亡が過去数十年間減少していることはわかっていましたが、どの介入が最も成功しているのか、またその程度を定量化することは困難であるいは不可能でした」と、スタンフォード大学医学部の医学部助教授であるジェニファー・キャスウェル=ジン博士(Jennifer Caswell-Jin, MD)は述べています。「この種の研究により、どの取り組みが最も影響を与えているか、そしてどこで改善が必要かを見ることができます。」
キャスウェル=ジン博士と元研究アシスタントのリヤン・サン(Liyang Sun)は、2024年1月16日にJournal of the American Medical Association (JAMA)に発表されたこの研究の共同第一著者です。生物医学データ科学の教授兼学部長であるシルヴィア・プレヴリティス博士(Sylvia Plevritis, PhD)と、医学および疫学・人口健康学の教授であるアリソン・クリアン博士(MD, MSc)が共同上級著者です。論文の題名は「Analysis of Breast Cancer Mortality in the US—1975 to 2019」です。
この研究は、CIS
細胞核の力学的構造を初めて可視化する新技術を開発
 細胞核は、重要な細胞内プロセスの制御センターと見なされていますが、その物質的性質は科学者たちを引き続き悩ませています。オーストリアのウィーン医科大学の科学者が率いる国際研究チームは、この制御センターの内部における機械的特性を以前には得られなかった視点から捉える新技術を開発しました。初めて、生きている細胞内で、細胞機能にとって重要と思われるその特異な動的構造特性を時間を追って視覚化することに成功しました。
この研究結果は、2024年1月18日にNature Photonicsに掲載され、生命の基本プロセスのより良い理解に貢献することができます。この論文のタイトルは「Brillouin Light Scattering Anisotropy Microscopy for Imaging the Viscoelastic Anisotropy in Living Cells(生きた細胞内の粘弾性異方性イメージングのためのブリルアン光散乱異方性顕微鏡)」です。
研究者らは長い間、細胞核の機械的特性に関心を持っていました。これらが適切に調節されなければ細胞が正常に機能しないこと、そしてこれらが様々な疾患の過程で変化することが知られています。また、細胞核が液体と固体の両方として振る舞うことができるにもかかわらず、これらの性質が細胞分裂時の核内の再編成や、核の異なる領域のプロセスを迅速かつ非常に効果的に同期させるような重要なプロセスにどのようにつながるかは不明です。
高度に動的な構造を視覚化
ウィーン医科大学の解剖学および細胞生物学センター(ウィーン医科大学のメディカルイメージングクラスターの一部)のカリーム・エルサヤード博士(Kareem Elsayad, PhD)が率いる研究チームは、これらのような疑問に近づくことができました。科学者たちは、時間を追って生きている細胞内の
細胞核は、重要な細胞内プロセスの制御センターと見なされていますが、その物質的性質は科学者たちを引き続き悩ませています。オーストリアのウィーン医科大学の科学者が率いる国際研究チームは、この制御センターの内部における機械的特性を以前には得られなかった視点から捉える新技術を開発しました。初めて、生きている細胞内で、細胞機能にとって重要と思われるその特異な動的構造特性を時間を追って視覚化することに成功しました。
この研究結果は、2024年1月18日にNature Photonicsに掲載され、生命の基本プロセスのより良い理解に貢献することができます。この論文のタイトルは「Brillouin Light Scattering Anisotropy Microscopy for Imaging the Viscoelastic Anisotropy in Living Cells(生きた細胞内の粘弾性異方性イメージングのためのブリルアン光散乱異方性顕微鏡)」です。
研究者らは長い間、細胞核の機械的特性に関心を持っていました。これらが適切に調節されなければ細胞が正常に機能しないこと、そしてこれらが様々な疾患の過程で変化することが知られています。また、細胞核が液体と固体の両方として振る舞うことができるにもかかわらず、これらの性質が細胞分裂時の核内の再編成や、核の異なる領域のプロセスを迅速かつ非常に効果的に同期させるような重要なプロセスにどのようにつながるかは不明です。
高度に動的な構造を視覚化
ウィーン医科大学の解剖学および細胞生物学センター(ウィーン医科大学のメディカルイメージングクラスターの一部)のカリーム・エルサヤード博士(Kareem Elsayad, PhD)が率いる研究チームは、これらのような疑問に近づくことができました。科学者たちは、時間を追って生きている細胞内の
DNAオリガミが解き明かすNotchシグナリング経路の新たな可能性
 カロリンスカ研究所(KI)の研究者たちは、DNAオリガミと呼ばれる技術を使用して、重要な細胞受容体がこれまで知られていなかった方法で活性化されることを示しました。この結果は、Notchシグナリング経路の働きと、それがいくつかの深刻な疾患にどのように関与しているかを理解するための新たな道を開きます。
この研究は、2024年1月18日にNature Communications誌に掲載されました。オープンアクセス論文のタイトルは「Soluble and Multivalent Jag1 DNA Origami Nanopatterns Activate Notch Without Pulling Force(溶解性および多価性のJag1 DNAオリガミナノパターンによる、引っ張り力なしでのNotchの活性化)」です。
Notchは、幅広い生物にとって非常に重要な細胞受容体であり、ハエから人間に至るまでの初期胚発生を含む多くの異なるプロセスで重要な役割を果たします。Notchは、体内の異なる細胞タイプへの幹細胞の発達を調節します。このシグナリング経路の欠陥は、がんを含む深刻な疾患を引き起こす可能性があります。
これまでの受容体の機能に関する主流の見解は、隣接する細胞がそれを引っ張ることによって純粋に機械的に活性化されるというものであり、つまり、シグナリングは細胞間の直接的なコミュニケーションの結果としてのみ発生するというものでした。
DNAを建材として
しかし、カロリンスカ研究所の研究者たちは現在、Jag1と呼ばれるタンパク質の助けを借りて、Notchの活性化も「オンデマンド」で達成できることを報告しています。研究者たちは、このタンパク質をDNAオリガミと呼ばれる技術によって作成されたDNA構造上に配置しました。この技術は、DNAを建材として使用してナノスケールレベ
カロリンスカ研究所(KI)の研究者たちは、DNAオリガミと呼ばれる技術を使用して、重要な細胞受容体がこれまで知られていなかった方法で活性化されることを示しました。この結果は、Notchシグナリング経路の働きと、それがいくつかの深刻な疾患にどのように関与しているかを理解するための新たな道を開きます。
この研究は、2024年1月18日にNature Communications誌に掲載されました。オープンアクセス論文のタイトルは「Soluble and Multivalent Jag1 DNA Origami Nanopatterns Activate Notch Without Pulling Force(溶解性および多価性のJag1 DNAオリガミナノパターンによる、引っ張り力なしでのNotchの活性化)」です。
Notchは、幅広い生物にとって非常に重要な細胞受容体であり、ハエから人間に至るまでの初期胚発生を含む多くの異なるプロセスで重要な役割を果たします。Notchは、体内の異なる細胞タイプへの幹細胞の発達を調節します。このシグナリング経路の欠陥は、がんを含む深刻な疾患を引き起こす可能性があります。
これまでの受容体の機能に関する主流の見解は、隣接する細胞がそれを引っ張ることによって純粋に機械的に活性化されるというものであり、つまり、シグナリングは細胞間の直接的なコミュニケーションの結果としてのみ発生するというものでした。
DNAを建材として
しかし、カロリンスカ研究所の研究者たちは現在、Jag1と呼ばれるタンパク質の助けを借りて、Notchの活性化も「オンデマンド」で達成できることを報告しています。研究者たちは、このタンパク質をDNAオリガミと呼ばれる技術によって作成されたDNA構造上に配置しました。この技術は、DNAを建材として使用してナノスケールレベ
蟻の社会における先進的な創傷ケア:感染した仲間の蟻の傷を自ら生産した抗生物質で治療
 アリの社会行動は長い間、動物界で最も複雑なものの一つとされてきました。最近の研究により、予想外の側面が明らかになりました。それは、アリが互いに抗生物質による創傷ケアを提供しているということです。
アフリカのマタベレアリ(Megaponera analis)は、食餌として唯一シロアリを食べますが、その好戦的な獲物によってしばしば傷つけられます。治療しないと、これらの傷は通常致命的です。しかし、巣の仲間は感染を察知し、彼らのメタプレウラル腺で生産される抗生物質でそれを治療することができます。
この論文は2023年12月29日にNature Communicationsに掲載されました。タイトルは「Targeted Treatment of Injured Nestmates with Antimicrobial Compounds in an Ant Society(アリ社会における傷ついた巣の仲間への抗微生物化合物による標的治療)」です。
マタベレアリはサブサハラアフリカ全域に生息しています。(編集者注:マタベレランドはジンバブエの地域です。)これらのアリは好き嫌いが激しく、シロアリのみを食べます。残念ながら、これらの好まれる獲物は巨大な顎を持ち、巣を積極的に守るため、シロアリ狩りは危険です。探食するマタベレアリの約20%は、一本または二本の足が欠けています。
2018年に発表された論文によると、マタベレアリは傷ついた仲間を巣に運び帰り、その傷を治療すると報告されています。傷は致命的になることがあります。治療されなければ、傷ついたアリの90%が最初の日に死亡します。驚くべきことに、治療により死亡率はわずか22%に低下します。これまで、治療の正確な性質は明らかにされていませんでした。
アリが傷ついた巣の仲間のケアを非常に効果的に行っている理由を調査するために、エリ
アリの社会行動は長い間、動物界で最も複雑なものの一つとされてきました。最近の研究により、予想外の側面が明らかになりました。それは、アリが互いに抗生物質による創傷ケアを提供しているということです。
アフリカのマタベレアリ(Megaponera analis)は、食餌として唯一シロアリを食べますが、その好戦的な獲物によってしばしば傷つけられます。治療しないと、これらの傷は通常致命的です。しかし、巣の仲間は感染を察知し、彼らのメタプレウラル腺で生産される抗生物質でそれを治療することができます。
この論文は2023年12月29日にNature Communicationsに掲載されました。タイトルは「Targeted Treatment of Injured Nestmates with Antimicrobial Compounds in an Ant Society(アリ社会における傷ついた巣の仲間への抗微生物化合物による標的治療)」です。
マタベレアリはサブサハラアフリカ全域に生息しています。(編集者注:マタベレランドはジンバブエの地域です。)これらのアリは好き嫌いが激しく、シロアリのみを食べます。残念ながら、これらの好まれる獲物は巨大な顎を持ち、巣を積極的に守るため、シロアリ狩りは危険です。探食するマタベレアリの約20%は、一本または二本の足が欠けています。
2018年に発表された論文によると、マタベレアリは傷ついた仲間を巣に運び帰り、その傷を治療すると報告されています。傷は致命的になることがあります。治療されなければ、傷ついたアリの90%が最初の日に死亡します。驚くべきことに、治療により死亡率はわずか22%に低下します。これまで、治療の正確な性質は明らかにされていませんでした。
アリが傷ついた巣の仲間のケアを非常に効果的に行っている理由を調査するために、エリ
妊娠中のアセトアミノフェン摂取量の増加が幼児の注意力欠如に関連
 新しい研究によると、妊娠中のアセトアミノフェンの使用増加(特に妊娠の第2期)が、2歳、3歳、4歳の子供たちの注意力と行動の問題のわずかながらも顕著な増加と関連していることが示されました。この研究は、妊娠中のアセトアミノフェンの頻繁な使用が子供の発達問題に関連しているとする証拠が増えていることに新たな情報を加えるものです。
この発見は、2024年1月8日にNeurotoxicology and Teratologyで公開された論文で詳述されています。このオープンアクセスの論文は「The Relationship of Prenatal Acetaminophen Exposure and Attention-Related Behavior in Early Childhood(妊娠中のアセトアミノフェン曝露と幼児期初期の注意関連行動の関係)」と題されています。
この研究は、イリノイ大学(U of I)アーバナ・シャンペーン校におけるIllinois Kids Development Study(IKIDS)の一環であり、環境曝露が子供の発達にどのように影響するかを探求しています。研究では、数百人の子供たちを追跡し、妊娠中の化学物質への曝露データを収集し、2歳、3歳、4歳の時点での行動や特性を介護者に評価してもらいました。
アセトアミノフェンは妊娠中に利用可能な最も安全な鎮痛剤および解熱剤と考えられていますが、以前の研究では、胎児期に薬物に曝露された子供たちに可能性のある様々な否定的な結果が見つかっています。この研究をイリノイ大学で比較生物科学の教授エメリタ、スーザン・シャンツ博士(Susan Schantz, PhD)の指導のもと、大学院生としてリードしたメーガン・ウッドバリー博士(Megan Woodbury, PhD)は述べています。ウッドバリー博士は現在、ボスト
新しい研究によると、妊娠中のアセトアミノフェンの使用増加(特に妊娠の第2期)が、2歳、3歳、4歳の子供たちの注意力と行動の問題のわずかながらも顕著な増加と関連していることが示されました。この研究は、妊娠中のアセトアミノフェンの頻繁な使用が子供の発達問題に関連しているとする証拠が増えていることに新たな情報を加えるものです。
この発見は、2024年1月8日にNeurotoxicology and Teratologyで公開された論文で詳述されています。このオープンアクセスの論文は「The Relationship of Prenatal Acetaminophen Exposure and Attention-Related Behavior in Early Childhood(妊娠中のアセトアミノフェン曝露と幼児期初期の注意関連行動の関係)」と題されています。
この研究は、イリノイ大学(U of I)アーバナ・シャンペーン校におけるIllinois Kids Development Study(IKIDS)の一環であり、環境曝露が子供の発達にどのように影響するかを探求しています。研究では、数百人の子供たちを追跡し、妊娠中の化学物質への曝露データを収集し、2歳、3歳、4歳の時点での行動や特性を介護者に評価してもらいました。
アセトアミノフェンは妊娠中に利用可能な最も安全な鎮痛剤および解熱剤と考えられていますが、以前の研究では、胎児期に薬物に曝露された子供たちに可能性のある様々な否定的な結果が見つかっています。この研究をイリノイ大学で比較生物科学の教授エメリタ、スーザン・シャンツ博士(Susan Schantz, PhD)の指導のもと、大学院生としてリードしたメーガン・ウッドバリー博士(Megan Woodbury, PhD)は述べています。ウッドバリー博士は現在、ボスト
フルーツコウモリが高糖質食にもかかわらず糖尿病にならない秘密を解明
 高糖質の食事は人間にとって悪影響を及ぼし、糖尿病、肥満、さらにはがんを引き起こす可能性があります。しかし、フルーツバット(果物を食べるコウモリ)は、毎日体重の2倍に相当する糖分を含む果物を食べても、生き延び、さらには繁栄しています。現在、カリフォルニア大学サンフランシスコ校の研究者らは、フルーツバットがこれほど多くの糖分を消費できるように進化したと考えられる方法を発見しました。これは、アメリカに住む3700万人の糖尿病患者にとって、潜在的な意味を持ちます。アメリカ合衆国において、糖尿病は死因の第8位であり、疾病対策センター(CDC)によると、毎年2370億ドルの直接医療費用を負担しています。
この発見は、2024年1月9日にNature Communications誌に公開された「Integrative Single-Cell Characterization of a Frugivorous and an Insectivorous Bat Kidney and Pancreas(フルーツを食べるコウモリと昆虫を食べるコウモリの腎臓と膵臓の一体的な単一細胞特性化)」というタイトルのオープンアクセス記事に記載されています。
「糖尿病では、人間の体はインスリンを生産したり検知したりすることができず、血糖をコントロールすることに問題が生じます。しかし、フルーツバットは、血糖をコントロールする遺伝的システムを持っています。私たちはそのシステムから学び、人々のためのより良いインスリンや糖感知療法を作り出したいと考えています。」と、カリフォルニア大学サンフランシスコ校人間遺伝学研究所の所長であり、この論文の共同上級著者であるナダブ・アヒトゥブ博士(Nadav Ahituv, PhD)は述べています。
アヒトゥブ博士のチームは、血糖をコントロールする膵臓と腎臓の進化に焦点を当
高糖質の食事は人間にとって悪影響を及ぼし、糖尿病、肥満、さらにはがんを引き起こす可能性があります。しかし、フルーツバット(果物を食べるコウモリ)は、毎日体重の2倍に相当する糖分を含む果物を食べても、生き延び、さらには繁栄しています。現在、カリフォルニア大学サンフランシスコ校の研究者らは、フルーツバットがこれほど多くの糖分を消費できるように進化したと考えられる方法を発見しました。これは、アメリカに住む3700万人の糖尿病患者にとって、潜在的な意味を持ちます。アメリカ合衆国において、糖尿病は死因の第8位であり、疾病対策センター(CDC)によると、毎年2370億ドルの直接医療費用を負担しています。
この発見は、2024年1月9日にNature Communications誌に公開された「Integrative Single-Cell Characterization of a Frugivorous and an Insectivorous Bat Kidney and Pancreas(フルーツを食べるコウモリと昆虫を食べるコウモリの腎臓と膵臓の一体的な単一細胞特性化)」というタイトルのオープンアクセス記事に記載されています。
「糖尿病では、人間の体はインスリンを生産したり検知したりすることができず、血糖をコントロールすることに問題が生じます。しかし、フルーツバットは、血糖をコントロールする遺伝的システムを持っています。私たちはそのシステムから学び、人々のためのより良いインスリンや糖感知療法を作り出したいと考えています。」と、カリフォルニア大学サンフランシスコ校人間遺伝学研究所の所長であり、この論文の共同上級著者であるナダブ・アヒトゥブ博士(Nadav Ahituv, PhD)は述べています。
アヒトゥブ博士のチームは、血糖をコントロールする膵臓と腎臓の進化に焦点を当
脊椎動物で唯一基準ゲノムを持たない大型系統、ヌタウナギのゲノムを初めて解読
 スペインのマラガ大学(UMA)の研究者、フアン・パスクアル・アナヤ博士(Juan Pascual Anaya, PhD)の指導の下、7つの異なる国から40人以上の著者で構成された国際的な研究チームにより、脊椎動物の大きなグループで唯一、その種の基準ゲノムがまだなかったヌタウナギ(myxini、別名「hagfish」)の初のゲノム配列が決定されました。この発見は、2024年1月12日に「Nature Ecology & Evolution」誌で発表され、「Hagfish Genome Sequence Sheds Light on Early Vertebrate Genome Evolution.(脊椎動物の早期ゲノム進化に光を当てるヌタウナギのゲノム配列)」というタイトルの論文として紹介されました。これにより、脊椎動物の祖先に起こったゲノム重複(ゲノムが完全に複製される回数)の進化史を解読することができました。このグループには人間も含まれています。
「この研究は、脊椎動物の起源とそれらの最もユニークな構造、例えば複雑な脳、顎、および四肢に伴うゲノムの変化を理解するのに役立つため、進化および分子分野で重要な意味を持ちます」と、UMAの動物生物学部門の科学者であるアナヤ博士は説明しています。
この研究は、スペイン、イギリス、日本、中国、イタリア、ノルウェー、アメリカ合衆国を含む30以上の機関が参加する国際コンソーシアムによって行われ、東京大学、理化学研究所、中国科学院、バルセロナのゲノム規制センターなどが含まれています。
エコロジカルリンク
ヌタウナギは深海域に生息する動物群で、脅威を感じたときに放出する粘液の量で知られ、化粧品会社の研究の焦点となっています。また、海底での生態的なリンクとしての役割も持っており、例えば、死んだ後に海底に沈むクジラの死
スペインのマラガ大学(UMA)の研究者、フアン・パスクアル・アナヤ博士(Juan Pascual Anaya, PhD)の指導の下、7つの異なる国から40人以上の著者で構成された国際的な研究チームにより、脊椎動物の大きなグループで唯一、その種の基準ゲノムがまだなかったヌタウナギ(myxini、別名「hagfish」)の初のゲノム配列が決定されました。この発見は、2024年1月12日に「Nature Ecology & Evolution」誌で発表され、「Hagfish Genome Sequence Sheds Light on Early Vertebrate Genome Evolution.(脊椎動物の早期ゲノム進化に光を当てるヌタウナギのゲノム配列)」というタイトルの論文として紹介されました。これにより、脊椎動物の祖先に起こったゲノム重複(ゲノムが完全に複製される回数)の進化史を解読することができました。このグループには人間も含まれています。
「この研究は、脊椎動物の起源とそれらの最もユニークな構造、例えば複雑な脳、顎、および四肢に伴うゲノムの変化を理解するのに役立つため、進化および分子分野で重要な意味を持ちます」と、UMAの動物生物学部門の科学者であるアナヤ博士は説明しています。
この研究は、スペイン、イギリス、日本、中国、イタリア、ノルウェー、アメリカ合衆国を含む30以上の機関が参加する国際コンソーシアムによって行われ、東京大学、理化学研究所、中国科学院、バルセロナのゲノム規制センターなどが含まれています。
エコロジカルリンク
ヌタウナギは深海域に生息する動物群で、脅威を感じたときに放出する粘液の量で知られ、化粧品会社の研究の焦点となっています。また、海底での生態的なリンクとしての役割も持っており、例えば、死んだ後に海底に沈むクジラの死
単一細胞RNAシーケンスとラマン分光法を組み合わせた細胞機能の長期追跡手法をMITの科学者らが開発
 MITの研究者たちは現在、細胞のRNA発現を追跡して、がんの進行や胚発生のような長期的プロセスを調査しています。細胞内のRNAを全てシーケンスすると、その細胞の機能や特定の時点での活動に関する多くの情報が明らかになります。しかし、シーケンスプロセスは細胞を破壊するため、遺伝子発現の継続的な変化を研究することが困難です。
MITで開発された代替手法では、研究者が長期間にわたってこのような変化を追跡できるようになる可能性があります。新しい方法は、細胞に損傷を与えずに繰り返し実行できる非侵襲的なイメージング技術であるラマン分光法に基づいています。この技術を使用して、研究者は数日間にわたって胚性幹細胞が他のいくつかの細胞タイプに分化するのを監視できることを示しました。この技術は、がんの進行や胚発生などの長期的な細胞プロセスの研究を可能にし、将来的にはがんや他の疾患の診断に使用される可能性があります。
「ラマンイメージングでは、がん生物学、発生生物学、および多くの変性疾患の研究に重要かもしれない多くの時間点を測定できます」と、ピーター・ソー博士(Peter So, PhD)は述べています。彼はMITの生物学および機械工学の教授であり、MITのレーザーバイオメディカル研究センターのディレクターであり、論文の著者の一人です。
コセキ・コバヤシ・キルシュビンク博士(Koseki Kobayashi-Kirschvink, PhD)は、MITおよびハーバード大学とMITのブロード研究所のポスドクであり、2024年1月10日にNature Biotechnologyに掲載された研究の筆頭著者です。
このNature Biotechnologyの論文のタイトルは「Prediction of Single-Cell RNA Expression Profiles in Live Cel
MITの研究者たちは現在、細胞のRNA発現を追跡して、がんの進行や胚発生のような長期的プロセスを調査しています。細胞内のRNAを全てシーケンスすると、その細胞の機能や特定の時点での活動に関する多くの情報が明らかになります。しかし、シーケンスプロセスは細胞を破壊するため、遺伝子発現の継続的な変化を研究することが困難です。
MITで開発された代替手法では、研究者が長期間にわたってこのような変化を追跡できるようになる可能性があります。新しい方法は、細胞に損傷を与えずに繰り返し実行できる非侵襲的なイメージング技術であるラマン分光法に基づいています。この技術を使用して、研究者は数日間にわたって胚性幹細胞が他のいくつかの細胞タイプに分化するのを監視できることを示しました。この技術は、がんの進行や胚発生などの長期的な細胞プロセスの研究を可能にし、将来的にはがんや他の疾患の診断に使用される可能性があります。
「ラマンイメージングでは、がん生物学、発生生物学、および多くの変性疾患の研究に重要かもしれない多くの時間点を測定できます」と、ピーター・ソー博士(Peter So, PhD)は述べています。彼はMITの生物学および機械工学の教授であり、MITのレーザーバイオメディカル研究センターのディレクターであり、論文の著者の一人です。
コセキ・コバヤシ・キルシュビンク博士(Koseki Kobayashi-Kirschvink, PhD)は、MITおよびハーバード大学とMITのブロード研究所のポスドクであり、2024年1月10日にNature Biotechnologyに掲載された研究の筆頭著者です。
このNature Biotechnologyの論文のタイトルは「Prediction of Single-Cell RNA Expression Profiles in Live Cel
細胞機能を支えるコートタンパク質複合体II(COPII)の重要性とその最新研究
 雪、雨、暑さ、暗闇の中でも荷物を届ける郵便配達員のように、あらゆる条件下でも細胞が適切に機能するのを助ける哺乳類のタンパク質の重要なグループに焦点を当てて研究が行われました。ウィスコンシン大学マディソン校(UW)の科学者たちは、最先端の細胞イメージングとゲノム編集技術を使用して、このタンパク質コレクションがいかにしてその不可欠なサービスを実行するかを解き明かし始めました。この発見は、がん、糖尿病、免疫機能障害を引き起こす病気などの新しい治療法を理解し、開発するのに役立つかもしれません。
アンジョン・オードヒャ博士(Anjon Audhya, PhD)が率いる研究チームは、コートタンパク質複合体II(COPII)がどのように機能するかをよりよく理解することを目指しました。COPIIは、哺乳類細胞で機能するすべてのタンパク質の約3分の1を輸送する責任を持つ非常に重要なタンパク質群です。
COPIIは、細胞内でタンパク質がどのように分類され、輸送されるかを定義した作業に対して、3人の科学者に与えられた2013年のノーベル生理学・医学賞の主題でした。この新しい研究は、これらの発見のいくつかに基づいて構築されています。
哺乳類細胞内には何百万ものタンパク質があり、それらは様々な役割を果たします。細胞は、タンパク質がそれらの細胞内役割を果たせるように、適切な場所に効率的に移動されることを確実にする必要があります。これは精密さを要求する複雑なタスクです。以前の研究では、COPIIがこのプロセスの不可欠な部分であることが特定されましたが、このタンパク質セットが細胞内の他のタンパク質をどのように包装して輸送するかについては、正確に記録されたことがありませんでした。
そこで、オードヒャ博士と彼の同僚たちは、細胞内のトラフィックフローを制御する個々のタンパク質に、明るい蛍光染料と化学
雪、雨、暑さ、暗闇の中でも荷物を届ける郵便配達員のように、あらゆる条件下でも細胞が適切に機能するのを助ける哺乳類のタンパク質の重要なグループに焦点を当てて研究が行われました。ウィスコンシン大学マディソン校(UW)の科学者たちは、最先端の細胞イメージングとゲノム編集技術を使用して、このタンパク質コレクションがいかにしてその不可欠なサービスを実行するかを解き明かし始めました。この発見は、がん、糖尿病、免疫機能障害を引き起こす病気などの新しい治療法を理解し、開発するのに役立つかもしれません。
アンジョン・オードヒャ博士(Anjon Audhya, PhD)が率いる研究チームは、コートタンパク質複合体II(COPII)がどのように機能するかをよりよく理解することを目指しました。COPIIは、哺乳類細胞で機能するすべてのタンパク質の約3分の1を輸送する責任を持つ非常に重要なタンパク質群です。
COPIIは、細胞内でタンパク質がどのように分類され、輸送されるかを定義した作業に対して、3人の科学者に与えられた2013年のノーベル生理学・医学賞の主題でした。この新しい研究は、これらの発見のいくつかに基づいて構築されています。
哺乳類細胞内には何百万ものタンパク質があり、それらは様々な役割を果たします。細胞は、タンパク質がそれらの細胞内役割を果たせるように、適切な場所に効率的に移動されることを確実にする必要があります。これは精密さを要求する複雑なタスクです。以前の研究では、COPIIがこのプロセスの不可欠な部分であることが特定されましたが、このタンパク質セットが細胞内の他のタンパク質をどのように包装して輸送するかについては、正確に記録されたことがありませんでした。
そこで、オードヒャ博士と彼の同僚たちは、細胞内のトラフィックフローを制御する個々のタンパク質に、明るい蛍光染料と化学
疲弊したミクログリアがアルツハイマー病を引き起こす可能性
 ネズミは約2歳で人間の約80歳に相当する「人生の黄昏期」に達します。研究者がネズミに特定の突然変異を導入し、それらを加齢させると、ネズミは物忘れが悪化し、イライラし始め、最終的には多くの高齢者と似たアルツハイマー病の兆候を示します。最近の研究では、脳の免疫細胞であるミクログリアが、ネズミとヒトの両方でアルツハイマー病が進行するにつれて衰退し、APOE4というアルツハイマー病に関連する重要な遺伝子バリアントがこれらの変化を仲介している可能性があることが示されました。
この新しい研究は、2024年1月9日に「Immunity」誌で「An Exhausted-Like Microglial Population Accumulates in Aged and APOE4 Genotype Alzheimer’s Brains(老化およびAPOE4遺伝子型のアルツハイマー脳に蓄積する疲弊したマイクログリア集団)」というタイトルでオープンアクセス論文として発表されました。
「APOE4バリアントを持つ老齢のネズミは、これらの疲弊し疲労した免疫細胞を脳内に持っており、私たちはヒトのデータセットでも類似の現象を発見しました」と、ロックフェラー大学のレオン・ヘス教授であるソハイル・タヴァゾイエ博士(Sohail Tavazoie MD, PhD)は述べています。
チームは、この新しいクラスの疲弊した細胞をTIM、つまり終末期炎症性ミクログリアと名付けました。TIMは、脳からプラークを効率的に除去する能力を失っており、それによってアルツハイマー病に寄与する可能性があります。
また、この研究は、アルツハイマー病治療薬アデュカヌマブが脳内の免疫細胞とどのように相互作用しているかについても光を当てています。「APOE4バリアントを持つネズミにアデュカヌマブを投与したところ、TIMがある
ネズミは約2歳で人間の約80歳に相当する「人生の黄昏期」に達します。研究者がネズミに特定の突然変異を導入し、それらを加齢させると、ネズミは物忘れが悪化し、イライラし始め、最終的には多くの高齢者と似たアルツハイマー病の兆候を示します。最近の研究では、脳の免疫細胞であるミクログリアが、ネズミとヒトの両方でアルツハイマー病が進行するにつれて衰退し、APOE4というアルツハイマー病に関連する重要な遺伝子バリアントがこれらの変化を仲介している可能性があることが示されました。
この新しい研究は、2024年1月9日に「Immunity」誌で「An Exhausted-Like Microglial Population Accumulates in Aged and APOE4 Genotype Alzheimer’s Brains(老化およびAPOE4遺伝子型のアルツハイマー脳に蓄積する疲弊したマイクログリア集団)」というタイトルでオープンアクセス論文として発表されました。
「APOE4バリアントを持つ老齢のネズミは、これらの疲弊し疲労した免疫細胞を脳内に持っており、私たちはヒトのデータセットでも類似の現象を発見しました」と、ロックフェラー大学のレオン・ヘス教授であるソハイル・タヴァゾイエ博士(Sohail Tavazoie MD, PhD)は述べています。
チームは、この新しいクラスの疲弊した細胞をTIM、つまり終末期炎症性ミクログリアと名付けました。TIMは、脳からプラークを効率的に除去する能力を失っており、それによってアルツハイマー病に寄与する可能性があります。
また、この研究は、アルツハイマー病治療薬アデュカヌマブが脳内の免疫細胞とどのように相互作用しているかについても光を当てています。「APOE4バリアントを持つネズミにアデュカヌマブを投与したところ、TIMがある
アフリカ人の肌色の多様性に光を当てる:色素変異のメカニズムを分子レベルで解明
 アフリカの集団を対象とした新たな共同研究により、肌の色の遺伝子や変異体についての理解が深まり、人類の進化や地域適応についての洞察が得られました。ペンシルバニア大学の研究者らとその同僚は、アフリカ人の肌の色の変異に関する分子基盤の重要な洞察を発見しました。この発見は、2024年1月10日に「Nature Genetics」に掲載され、「Integrative Functional Genomic Analyses Identify Genetic Variants Influencing Skin Pigmentation in Africans(統合的機能ゲノム解析によりアフリカ人の肌の色素沈着に影響を与える遺伝子変異を同定)」と題されています。
この研究は、人類の進化と現代人の肌の色の多様性を支える遺伝学の理解を広げます。「アフリカの人口内で豊富な遺伝的多様性にもかかわらず、遺伝学的研究ではこれまで十分に代表されていませんでした。我々の発見は、肌の色の多様性とその進化的歴史の遺伝的基盤について新しい情報を提供し、人類進化のより明確な描写に貢献します。」と、ペンシルバニア大学ペレルマン医学部および文理学部に所属するペン統合知識大学教授であるサラ・ティシュコフ博士(Sarah Tishkoff, PhD)は述べています。
人類進化の物語は、世界の人口に見られる適応と同じくらい豊かで多様です。ティシュコフ博士は、多くの適応形質の中で、肌の色が最もよく知られたものの一つであると指摘します。赤道地域に多い濃い肌の色は、自然のサンブロックとして機能し、これらの人口を強烈な紫外線から守るために何千年もの間に進化しました。逆に、極地に近い地域の人口に見られるより軽い色素は、紫外線によるビタミンDの生成を最大化し、不十分な日光暴露のリスクを軽減する適応です。
「我々のアプローチに
アフリカの集団を対象とした新たな共同研究により、肌の色の遺伝子や変異体についての理解が深まり、人類の進化や地域適応についての洞察が得られました。ペンシルバニア大学の研究者らとその同僚は、アフリカ人の肌の色の変異に関する分子基盤の重要な洞察を発見しました。この発見は、2024年1月10日に「Nature Genetics」に掲載され、「Integrative Functional Genomic Analyses Identify Genetic Variants Influencing Skin Pigmentation in Africans(統合的機能ゲノム解析によりアフリカ人の肌の色素沈着に影響を与える遺伝子変異を同定)」と題されています。
この研究は、人類の進化と現代人の肌の色の多様性を支える遺伝学の理解を広げます。「アフリカの人口内で豊富な遺伝的多様性にもかかわらず、遺伝学的研究ではこれまで十分に代表されていませんでした。我々の発見は、肌の色の多様性とその進化的歴史の遺伝的基盤について新しい情報を提供し、人類進化のより明確な描写に貢献します。」と、ペンシルバニア大学ペレルマン医学部および文理学部に所属するペン統合知識大学教授であるサラ・ティシュコフ博士(Sarah Tishkoff, PhD)は述べています。
人類進化の物語は、世界の人口に見られる適応と同じくらい豊かで多様です。ティシュコフ博士は、多くの適応形質の中で、肌の色が最もよく知られたものの一つであると指摘します。赤道地域に多い濃い肌の色は、自然のサンブロックとして機能し、これらの人口を強烈な紫外線から守るために何千年もの間に進化しました。逆に、極地に近い地域の人口に見られるより軽い色素は、紫外線によるビタミンDの生成を最大化し、不十分な日光暴露のリスクを軽減する適応です。
「我々のアプローチに
シロシビンを巡る旅:遺伝子から見たマジックマッシュルームの進化
 メソアメリカの先住民文化において数世紀にわたって深い意義を持ってきた「マジックマッシュルーム」として俗に知られるPsilocybe菌類は、1960年代と1970年代に幻覚成分として広く世界の注目を集めた後、現在、これらは悪名高いキノコとして社会問題視されています。一方でPsilocybeのほぼ全種に見られるサイコアクティブ化合物であるシロシビンとシロシンは、PTSD、うつ病、終末期ケアの緩和などの条件の治療に有望であることが示されています。シロシビンを治療薬として利用するためには、この化合物の遺伝学と進化の包括的なロードマップが必要ですが、その情報は存在しません。われわれが持っている限られた知識は、約165種類とされるPsilocybeのごく一部の研究から来ています。ほとんどのシロシビン生成キノコは、発見されて以来研究されていませんでしたが、やっと研究が進みました。
ユタ大学とユタ自然史博物館(NHMU)の科学者が率いる研究チームは、Psilocybe属の最大のゲノム多様性研究を完成させました。52個のPsilocybe標本のゲノム解析には、これまでにシーケンスされたことのない39種が含まれています。
著者らは、Psilocybeが以前に考えられていたよりもはるかに早く、約6500万年前、恐竜を絶滅させた小惑星が大量絶滅イベントを引き起こした頃に出現したと結論付けました。シロシビンは、Psilocybe属のキノコで最初に合成され、4000万年から900万年前に他のキノコに4〜5回の可能性のある水平遺伝子移動があったと確認しました。
彼らの分析は、シロシビンを生産する遺伝子クラスタ内に2つの異なる遺伝子順序を明らかにしました。2つの遺伝子パターンは属内の古代の分裂に対応しており、進化史上においてシロシビンの2回の独立した獲得を示唆しています。この研究は、サイコアクテ
メソアメリカの先住民文化において数世紀にわたって深い意義を持ってきた「マジックマッシュルーム」として俗に知られるPsilocybe菌類は、1960年代と1970年代に幻覚成分として広く世界の注目を集めた後、現在、これらは悪名高いキノコとして社会問題視されています。一方でPsilocybeのほぼ全種に見られるサイコアクティブ化合物であるシロシビンとシロシンは、PTSD、うつ病、終末期ケアの緩和などの条件の治療に有望であることが示されています。シロシビンを治療薬として利用するためには、この化合物の遺伝学と進化の包括的なロードマップが必要ですが、その情報は存在しません。われわれが持っている限られた知識は、約165種類とされるPsilocybeのごく一部の研究から来ています。ほとんどのシロシビン生成キノコは、発見されて以来研究されていませんでしたが、やっと研究が進みました。
ユタ大学とユタ自然史博物館(NHMU)の科学者が率いる研究チームは、Psilocybe属の最大のゲノム多様性研究を完成させました。52個のPsilocybe標本のゲノム解析には、これまでにシーケンスされたことのない39種が含まれています。
著者らは、Psilocybeが以前に考えられていたよりもはるかに早く、約6500万年前、恐竜を絶滅させた小惑星が大量絶滅イベントを引き起こした頃に出現したと結論付けました。シロシビンは、Psilocybe属のキノコで最初に合成され、4000万年から900万年前に他のキノコに4〜5回の可能性のある水平遺伝子移動があったと確認しました。
彼らの分析は、シロシビンを生産する遺伝子クラスタ内に2つの異なる遺伝子順序を明らかにしました。2つの遺伝子パターンは属内の古代の分裂に対応しており、進化史上においてシロシビンの2回の独立した獲得を示唆しています。この研究は、サイコアクテ
光合成能力を持つ新酵母株の開発:バイオエネルギーと進化の新展開
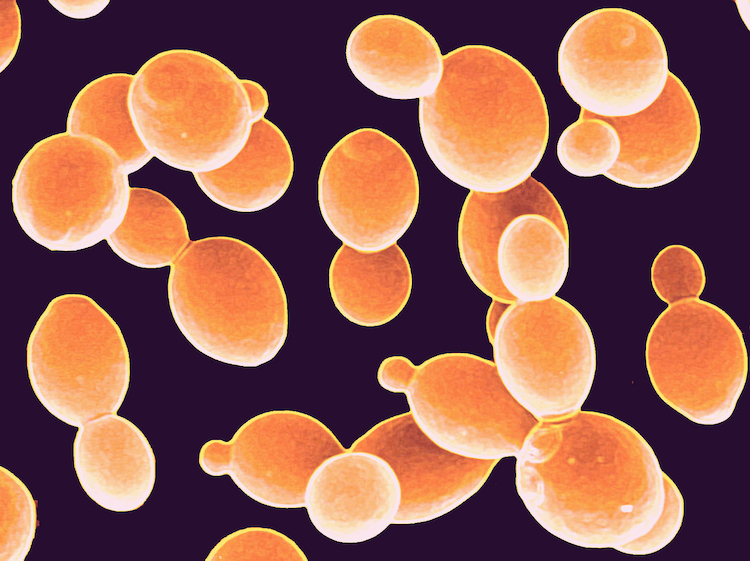 ジョージア工科大学の生物科学部門の研究者らは、光にさらされることで成長が促進される世界初の酵母の株を開発しました。この研究は「Current Biology」誌に2024年1月12日に発表され、論文は「Transforming Yeast into a Facultative Photoheterotroph Via Expression of Vacuolar Rhodopsin(真空ロドプシンの発現による酵母の任意光栄養生物への変換)」と題されています。ジョージア工科大学のアンソニー・バーネッティ博士(Anthony Burnetti, PhD)、ウィリアム・ラットクリフ准教授(William Ratcliff, PhD)の研究室で働く研究者らは、酵母を光合成生物(光からエネルギーを取り入れ利用する生物)に変換することが、いかに簡単であったかについて驚いたと述べています。単一の遺伝子を移動させるだけで、光の中で暗闇よりも2%速く成長しました。細かい調整や慎重な誘導なしに、単純に機能したのです。
このように酵母に進化的に重要な特性を簡単に装備させることは、この特性がどのように起源を追い、バイオ燃料の生産、進化、細胞の老化などの研究にどう利用できるかについての理解を深める上で大きな意味を持ちます。
エネルギーを高めたい
研究チームは、多細胞生命の進化を探求する過去の研究に触発されました。彼らは昨年「Nature」誌にその多細胞性長期進化実験(MuLTEE)の最初の報告を発表し、その単細胞モデル生物「スノーフレーク酵母」が3,000世代にわたり多細胞性を進化させることができたことを明らかにしました。
これらの進化実験を通じて、多細胞進化にとっての大きな制約が一つ現れました。それはエネルギーです。
「酸素は組織の奥深くまで拡散するのが難しく、結果としてエネルギーを
ジョージア工科大学の生物科学部門の研究者らは、光にさらされることで成長が促進される世界初の酵母の株を開発しました。この研究は「Current Biology」誌に2024年1月12日に発表され、論文は「Transforming Yeast into a Facultative Photoheterotroph Via Expression of Vacuolar Rhodopsin(真空ロドプシンの発現による酵母の任意光栄養生物への変換)」と題されています。ジョージア工科大学のアンソニー・バーネッティ博士(Anthony Burnetti, PhD)、ウィリアム・ラットクリフ准教授(William Ratcliff, PhD)の研究室で働く研究者らは、酵母を光合成生物(光からエネルギーを取り入れ利用する生物)に変換することが、いかに簡単であったかについて驚いたと述べています。単一の遺伝子を移動させるだけで、光の中で暗闇よりも2%速く成長しました。細かい調整や慎重な誘導なしに、単純に機能したのです。
このように酵母に進化的に重要な特性を簡単に装備させることは、この特性がどのように起源を追い、バイオ燃料の生産、進化、細胞の老化などの研究にどう利用できるかについての理解を深める上で大きな意味を持ちます。
エネルギーを高めたい
研究チームは、多細胞生命の進化を探求する過去の研究に触発されました。彼らは昨年「Nature」誌にその多細胞性長期進化実験(MuLTEE)の最初の報告を発表し、その単細胞モデル生物「スノーフレーク酵母」が3,000世代にわたり多細胞性を進化させることができたことを明らかにしました。
これらの進化実験を通じて、多細胞進化にとっての大きな制約が一つ現れました。それはエネルギーです。
「酸素は組織の奥深くまで拡散するのが難しく、結果としてエネルギーを
特定の脳細胞を活性化するとマウスの寿命が延びることを発見
 脳細胞は脂肪組織と連絡を取り合って細胞燃料を生産し、老化の影響に対抗している。近年の研究では、体の臓器間の通信路が加齢の主要な調節因子であることが明らかになりつつあります。これらの通信路が開いているとき、体の臓器やシステムはうまく連携して動作します。しかし、年齢と共に通信路は劣化し、臓器は適切に機能するために必要な分子や電気的メッセージを受け取ることができなくなります。
セントルイスにあるワシントン大学医学部の新しい研究では、マウスにおいて、体全体のエネルギー生産に中心的な役割を果たす脳と体の脂肪組織をつなぐ重要な通信経路を特定しました。このフィードバックループの徐々に悪化することが、自然な加齢に伴う増加する健康問題に寄与していることを示唆しています。
この研究は、2024年1月8日に「Cell Metabolism」誌に公開されました。オープンアクセス論文のタイトルは「DMHPpp1r17 Neurons Regulate Aging and Lifespan in Mice Through Hypothalamic-Adipose Inter-Tissue Communication(DMHPpp1r17 ニューロンが、視床下部-脂肪間組織間通信を通じてマウスの老化と寿命を調節する)」です。
研究者らは、活動しているときに体の脂肪組織にエネルギー放出のシグナルを送る、脳の視床下部にある特定のニューロン群を特定し、遺伝的および分子的方法を用いて、特定の年齢に達した後にこの通信経路が常に開かれているようにプログラムされたマウスを研究しました。そして、これらのマウスが、この同じ通信経路が通常の加齢の一部として徐々に遅くなるマウスよりも、より身体的に活動的であり、老化の兆候が遅れ、より長生きしたことを発見しました。
「私たちは、脳の重要な部分を操作することによって、
脳細胞は脂肪組織と連絡を取り合って細胞燃料を生産し、老化の影響に対抗している。近年の研究では、体の臓器間の通信路が加齢の主要な調節因子であることが明らかになりつつあります。これらの通信路が開いているとき、体の臓器やシステムはうまく連携して動作します。しかし、年齢と共に通信路は劣化し、臓器は適切に機能するために必要な分子や電気的メッセージを受け取ることができなくなります。
セントルイスにあるワシントン大学医学部の新しい研究では、マウスにおいて、体全体のエネルギー生産に中心的な役割を果たす脳と体の脂肪組織をつなぐ重要な通信経路を特定しました。このフィードバックループの徐々に悪化することが、自然な加齢に伴う増加する健康問題に寄与していることを示唆しています。
この研究は、2024年1月8日に「Cell Metabolism」誌に公開されました。オープンアクセス論文のタイトルは「DMHPpp1r17 Neurons Regulate Aging and Lifespan in Mice Through Hypothalamic-Adipose Inter-Tissue Communication(DMHPpp1r17 ニューロンが、視床下部-脂肪間組織間通信を通じてマウスの老化と寿命を調節する)」です。
研究者らは、活動しているときに体の脂肪組織にエネルギー放出のシグナルを送る、脳の視床下部にある特定のニューロン群を特定し、遺伝的および分子的方法を用いて、特定の年齢に達した後にこの通信経路が常に開かれているようにプログラムされたマウスを研究しました。そして、これらのマウスが、この同じ通信経路が通常の加齢の一部として徐々に遅くなるマウスよりも、より身体的に活動的であり、老化の兆候が遅れ、より長生きしたことを発見しました。
「私たちは、脳の重要な部分を操作することによって、
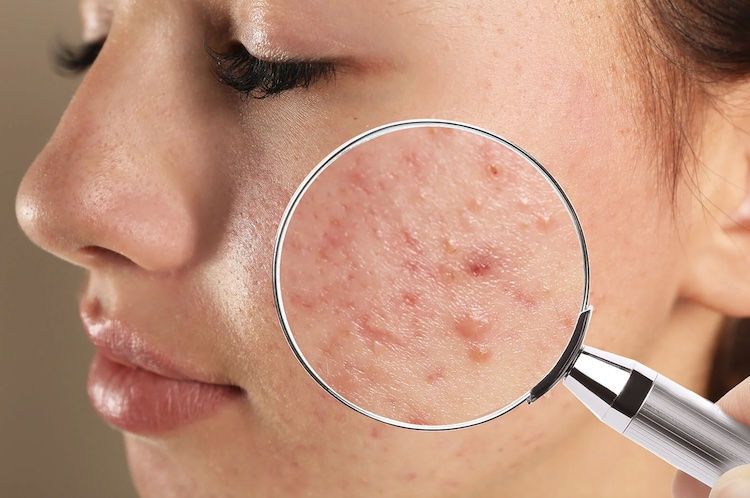
ニキビを治療する分子を産生・分泌する人工皮膚細菌が誕生
 ポンペウ・ファブラ大学のトランスレーショナル合成生物学研究所が主導した実験的研究により、皮膚細菌の一種を効率的に操作して、皮脂産生を調節するタンパク質を産生させることができることが示された。この応用は、追加試験の後、ニキビ治療に使われる可能性がある。国際研究チームが、ポンペウ・ファブラ大学医学・生命科学部のトランスレーショナル・シンセティックバイオロジー研究室の主導で、皮膚細菌の一種であるCutibacterium acnesを効率的に工学的に改変し、ニキビ症状の治療に適した治療用分子を産生・分泌させることに成功しました。このエンジニアリングされた細菌は、皮膚細胞系での有効性が検証され、マウスでの配達も確認されました。この発見は、皮膚の変化や他の疾患を治療するために、従来扱うことができなかった細菌を工学的に改変する道を広げるものです。研究チームは、ベルビチェ生物医学研究所(Idibell)、バルセロナ大学、遺伝子調節センターのプロテインテクノロジーファシリティ、Phenocell SAS、メディツィニシェ・ホッホシューレ・ブランデンブルク・テオドール・フォンターネ、ルンド大学、およびオーフス大学の科学者から成ります。
ニキビは、毛包や脂腺の閉塞や炎症によって引き起こされる一般的な皮膚疾患です。その外見は、白ニキビや黒ニキビから膿疱や結節に至るまで様々で、主に顔、額、胸、上背部、肩に現れます。ニキビは思春期に最も一般的ですが、あらゆる年齢の人々に影響を与える可能性があります。
ニキビの最も重症なケースは、毛包内の細菌を殺すために抗生物質で治療されるか、ビタミンAの誘導体であるイソトレチノイン(アキュテインとして知られています)で治療されます。イソトレチノインは、皮脂を産生する上皮皮膚細胞であるセボサイトの死を誘発することによって皮脂を減少させることが知られています。し
ポンペウ・ファブラ大学のトランスレーショナル合成生物学研究所が主導した実験的研究により、皮膚細菌の一種を効率的に操作して、皮脂産生を調節するタンパク質を産生させることができることが示された。この応用は、追加試験の後、ニキビ治療に使われる可能性がある。国際研究チームが、ポンペウ・ファブラ大学医学・生命科学部のトランスレーショナル・シンセティックバイオロジー研究室の主導で、皮膚細菌の一種であるCutibacterium acnesを効率的に工学的に改変し、ニキビ症状の治療に適した治療用分子を産生・分泌させることに成功しました。このエンジニアリングされた細菌は、皮膚細胞系での有効性が検証され、マウスでの配達も確認されました。この発見は、皮膚の変化や他の疾患を治療するために、従来扱うことができなかった細菌を工学的に改変する道を広げるものです。研究チームは、ベルビチェ生物医学研究所(Idibell)、バルセロナ大学、遺伝子調節センターのプロテインテクノロジーファシリティ、Phenocell SAS、メディツィニシェ・ホッホシューレ・ブランデンブルク・テオドール・フォンターネ、ルンド大学、およびオーフス大学の科学者から成ります。
ニキビは、毛包や脂腺の閉塞や炎症によって引き起こされる一般的な皮膚疾患です。その外見は、白ニキビや黒ニキビから膿疱や結節に至るまで様々で、主に顔、額、胸、上背部、肩に現れます。ニキビは思春期に最も一般的ですが、あらゆる年齢の人々に影響を与える可能性があります。
ニキビの最も重症なケースは、毛包内の細菌を殺すために抗生物質で治療されるか、ビタミンAの誘導体であるイソトレチノイン(アキュテインとして知られています)で治療されます。イソトレチノインは、皮脂を産生する上皮皮膚細胞であるセボサイトの死を誘発することによって皮脂を減少させることが知られています。し
妊娠糖尿病に関連する13の遺伝子領域が特定された
 妊娠糖尿病に関するこれまでで最大の遺伝子研究により、この重篤で一般的な妊娠合併症に関連する9つの新規遺伝子領域が発見されました。この研究は、ヘルシンキ大学の研究者が主導し、マサチューセッツ総合病院およびハーバード大学とMITのブロード研究所の同僚と共に行われました。妊娠糖尿病の遺伝学的背景に関する私たちの理解において重要な進歩を提供します。この病気は、世界中で年間1600万以上の妊娠に影響を与える一般的な妊娠障害であり、母親とその子供たちの健康に重大な影響を及ぼします。妊娠前に糖尿病がなかった妊婦の血糖値が上昇することが特徴です。
妊娠糖尿病が主要な世界的健康問題を構成するにもかかわらず、その分子原因に関する研究は驚くほど少ないです。現在公開されている研究は、これまでで最大のゲノムワイド関連研究(GWAS)であり、フィンランドのゲノミクスイニシアチブFinnGenからの12,000人以上の患者と131,000人の女性の対照群を含んでいます。
2024年1月5日にNature Geneticsに公開されたこの画期的な研究は、妊娠糖尿病に関連する既知の遺伝的領域の数をほぼ3倍に増やし、この状態にリンクされた13の異なる染色体領域を特定しました。
このオープンアクセス論文のタイトルは「Distinct and Shared Genetic Architectures of Gestational Diabetes Mellitus and Type 2 Diabetes.(妊娠糖尿病と2型糖尿病の異なるおよび共有された遺伝的構造)」です。
最近開発された解析方法を使用して、研究者は妊娠糖尿病に関連する遺伝的変異が2つの異なるクラス(2型糖尿病と共有されるものと、主に妊娠形態の糖尿病にのみ関連するもの)に分かれていることを示すことができました。
「私たちの結果は、妊娠
妊娠糖尿病に関するこれまでで最大の遺伝子研究により、この重篤で一般的な妊娠合併症に関連する9つの新規遺伝子領域が発見されました。この研究は、ヘルシンキ大学の研究者が主導し、マサチューセッツ総合病院およびハーバード大学とMITのブロード研究所の同僚と共に行われました。妊娠糖尿病の遺伝学的背景に関する私たちの理解において重要な進歩を提供します。この病気は、世界中で年間1600万以上の妊娠に影響を与える一般的な妊娠障害であり、母親とその子供たちの健康に重大な影響を及ぼします。妊娠前に糖尿病がなかった妊婦の血糖値が上昇することが特徴です。
妊娠糖尿病が主要な世界的健康問題を構成するにもかかわらず、その分子原因に関する研究は驚くほど少ないです。現在公開されている研究は、これまでで最大のゲノムワイド関連研究(GWAS)であり、フィンランドのゲノミクスイニシアチブFinnGenからの12,000人以上の患者と131,000人の女性の対照群を含んでいます。
2024年1月5日にNature Geneticsに公開されたこの画期的な研究は、妊娠糖尿病に関連する既知の遺伝的領域の数をほぼ3倍に増やし、この状態にリンクされた13の異なる染色体領域を特定しました。
このオープンアクセス論文のタイトルは「Distinct and Shared Genetic Architectures of Gestational Diabetes Mellitus and Type 2 Diabetes.(妊娠糖尿病と2型糖尿病の異なるおよび共有された遺伝的構造)」です。
最近開発された解析方法を使用して、研究者は妊娠糖尿病に関連する遺伝的変異が2つの異なるクラス(2型糖尿病と共有されるものと、主に妊娠形態の糖尿病にのみ関連するもの)に分かれていることを示すことができました。
「私たちの結果は、妊娠
悪玉細胞が善玉細胞になるとき:がん治療のために細胞の共食いを利用する
 細胞殺人事件から約 25 年が経ち、科学者らは未解決事件の謎を解明しました。ショウジョウバエからマウス、そしてヒトへと続く証拠の軌跡をたどることで、珍しいヒトの免疫不全症が共食い細胞によって引き起こされる可能性があることが明らかになりました。この発見は、新興のがん治療を強化するための有望な見通しを示しています。「この論文は、ショウジョウバエにおける非常に基本的な細胞生物学から始まり、ヒトの病気を説明し、その知識をがん治療に活用するまでを網羅しています。それぞれのステップが大発見のように感じられますが、ここにはすべてが一つの論文にまとまっています。」とカリフォルニア大学サンタバーバラ校のデニース・モンテル博士(Denise Montell, PhD)は述べています。
モンテル博士の研究室の研究者らは、2023年12月18日に「Hyperactive Rac Stimulates Cannibalism of Living Target Cells and Enhances CAR-M-Mediated Cancer Cell Killing(活性化されたRacが生存する標的細胞の共食いを刺激し、CAR-Mによるがん細胞の殺害を強化する)」と題した論文をPNASに発表し、現在、そのメカニズムと影響について調査しています。この論文はオープンアクセスで公開されています。
古代の遺伝子
この物語の主要な登場人物は、Rac2という遺伝子と、それがコードするタンパク質です。Rac2はヒトのRac遺伝子3つのうちの1つです。「Racは進化の中で非常に古く、基本的な機能を果たしているに違いありません」と、分子、細胞、および発達生物学のダガン教授であり卓越教授であるモンテル博士は述べています。
Racタンパク質は、細胞骨格と呼ばれる細胞の足場を構築するのに役立ちます。細胞骨格は、
細胞殺人事件から約 25 年が経ち、科学者らは未解決事件の謎を解明しました。ショウジョウバエからマウス、そしてヒトへと続く証拠の軌跡をたどることで、珍しいヒトの免疫不全症が共食い細胞によって引き起こされる可能性があることが明らかになりました。この発見は、新興のがん治療を強化するための有望な見通しを示しています。「この論文は、ショウジョウバエにおける非常に基本的な細胞生物学から始まり、ヒトの病気を説明し、その知識をがん治療に活用するまでを網羅しています。それぞれのステップが大発見のように感じられますが、ここにはすべてが一つの論文にまとまっています。」とカリフォルニア大学サンタバーバラ校のデニース・モンテル博士(Denise Montell, PhD)は述べています。
モンテル博士の研究室の研究者らは、2023年12月18日に「Hyperactive Rac Stimulates Cannibalism of Living Target Cells and Enhances CAR-M-Mediated Cancer Cell Killing(活性化されたRacが生存する標的細胞の共食いを刺激し、CAR-Mによるがん細胞の殺害を強化する)」と題した論文をPNASに発表し、現在、そのメカニズムと影響について調査しています。この論文はオープンアクセスで公開されています。
古代の遺伝子
この物語の主要な登場人物は、Rac2という遺伝子と、それがコードするタンパク質です。Rac2はヒトのRac遺伝子3つのうちの1つです。「Racは進化の中で非常に古く、基本的な機能を果たしているに違いありません」と、分子、細胞、および発達生物学のダガン教授であり卓越教授であるモンテル博士は述べています。
Racタンパク質は、細胞骨格と呼ばれる細胞の足場を構築するのに役立ちます。細胞骨格は、
新発見の抗生物質ゾスラバルピン、抗生物質耐性アシネトバクター・バウマニに対する効果を実証
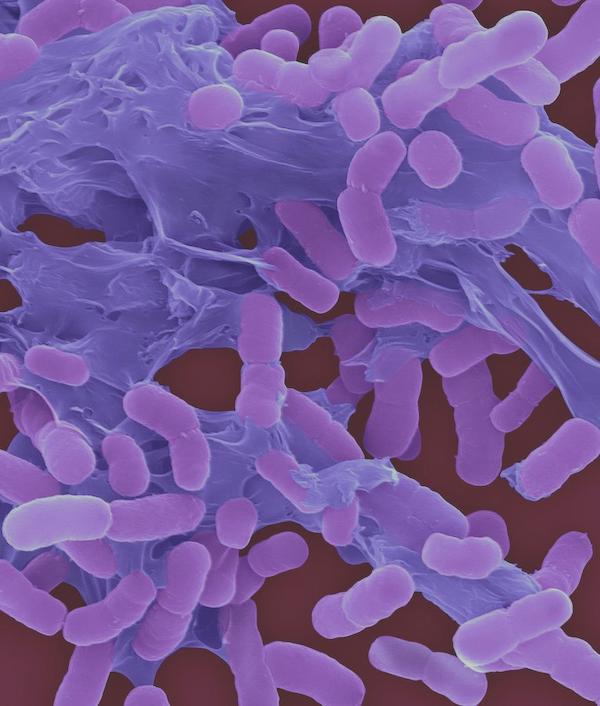 CNNによると、ハーバード大学とホフマン・ラ・ロシュの研究者らは、致死的な抗生物質耐性菌アシネトバクター・バウマニーに効果的な新しい抗生物質を特定したと報道しました。研究者らは、現在の抗生物質のほとんどに耐性を持ち、侵襲性感染症にかかった人の大部分を死に至らしめる菌に対処するための新しいタイプの抗生物質を開発したと述べています。この菌、アシネトバクター・バウマニーは、米国疾病予防管理センター(CDC)によると、肺、尿路、血液の重篤な感染症を引き起こす可能性があります。これは、カルバペネムと呼ばれる広域スペクトラム抗生物質のクラスに対して耐性を持っています。カルバペネム耐性アシネトバクター・バウマニー、またはCRABは、2017年に世界保健機関(WHO)が抗生物質耐性「優先病原体」のリストのトップに挙げられました。米国では、この菌は最新のCDCのデータによると、その年に入院患者に約8,500の感染症と700の死亡を引き起こしたと推定されています。
CRABは、米国の病院で見つかる感染症の約2%を占めます。アジアと中東ではより一般的で、世界中の集中治療室での感染症の最大20%を引き起こします。この菌は、病院や介護施設のような医療環境で繁殖します。感染リスクが最も高いのは、カテーテルを使用している人、人工呼吸器を使用している人、または手術からの開放傷を持つ人です。
この病原体は排除が非常に困難なため、米国食品医薬品局は、50年以上にわたってこれを治療するための新しいクラスの抗生物質を承認していません。研究者らは、Nature誌で公開された2つの研究でこれを指摘しています。
しかし、ハーバード大学とスイスのヘルスケア企業ホフマン・ラ・ロシュの研究者らは、新しい抗生物質ゾスラバルピン(zosurabalpin)がアシネトバクター・バウマニを効果的に殺すことができると言います。
CNNによると、ハーバード大学とホフマン・ラ・ロシュの研究者らは、致死的な抗生物質耐性菌アシネトバクター・バウマニーに効果的な新しい抗生物質を特定したと報道しました。研究者らは、現在の抗生物質のほとんどに耐性を持ち、侵襲性感染症にかかった人の大部分を死に至らしめる菌に対処するための新しいタイプの抗生物質を開発したと述べています。この菌、アシネトバクター・バウマニーは、米国疾病予防管理センター(CDC)によると、肺、尿路、血液の重篤な感染症を引き起こす可能性があります。これは、カルバペネムと呼ばれる広域スペクトラム抗生物質のクラスに対して耐性を持っています。カルバペネム耐性アシネトバクター・バウマニー、またはCRABは、2017年に世界保健機関(WHO)が抗生物質耐性「優先病原体」のリストのトップに挙げられました。米国では、この菌は最新のCDCのデータによると、その年に入院患者に約8,500の感染症と700の死亡を引き起こしたと推定されています。
CRABは、米国の病院で見つかる感染症の約2%を占めます。アジアと中東ではより一般的で、世界中の集中治療室での感染症の最大20%を引き起こします。この菌は、病院や介護施設のような医療環境で繁殖します。感染リスクが最も高いのは、カテーテルを使用している人、人工呼吸器を使用している人、または手術からの開放傷を持つ人です。
この病原体は排除が非常に困難なため、米国食品医薬品局は、50年以上にわたってこれを治療するための新しいクラスの抗生物質を承認していません。研究者らは、Nature誌で公開された2つの研究でこれを指摘しています。
しかし、ハーバード大学とスイスのヘルスケア企業ホフマン・ラ・ロシュの研究者らは、新しい抗生物質ゾスラバルピン(zosurabalpin)がアシネトバクター・バウマニを効果的に殺すことができると言います。
ペスト菌が免疫システムを回避するメカニズムの解明に挑む
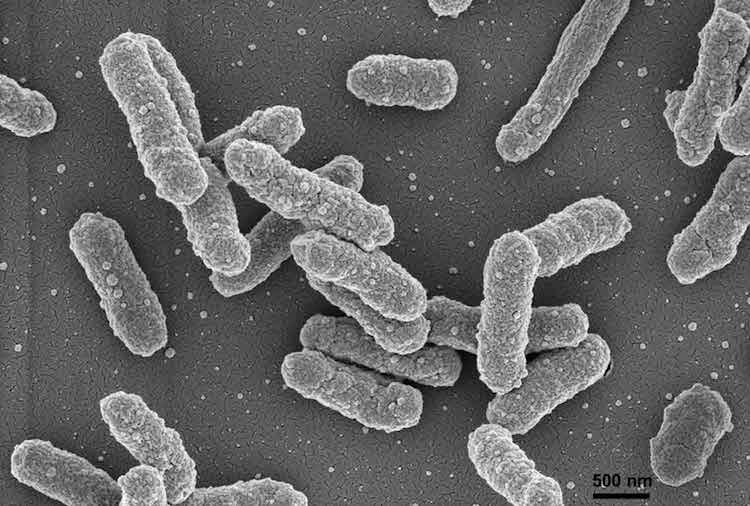 細菌、ウイルス、または有害物質に遭遇した際、固有の免疫細胞である好中球は、侵入者と戦うためにその場所に集結します。しかし、細菌やウイルスにはこれらの防御を避ける方法があります。例えば、ペスト菌(Yersinia pestis)は、免疫システムから隠れることができ、病原体がホストを圧倒するまで体内で無制限に増殖することを許します。この能力により、Y. pestisは14世紀にヨーロッパ全土にペストを広げ、ヨーロッパ人口の3分の1を死に至らしめました。現代ではペストが人間の健康に深刻な脅威をもたらすことはありませんが、ルイビル大学(UofL)の研究者たちは、免疫システムを回避するY. pestisの能力をよりよく理解し、その理解を他の病原体の制御に応用するためにY. pestisを研究しています。
「人間のペストを見ると、感染しているにもかかわらず、細菌が免疫システムから隠れているため、すぐには症状が現れないことがあります。そして突然、大量の細菌が現れ、免疫システムが圧倒され、肺ペストの場合は、個体が肺炎で死亡します」と、UofLの微生物学および免疫学部門の教授であるマシュー・ローレンツ博士(Matthew Lawrenz, PhD)は言いました。
好中球は免疫システムの最初の対応者であり、侵入者を攻撃して破壊するために他の好中球を呼び出す分子を送り出します。好中球によって感染を示す最初の分子の中には、ロイコトリエンB4(LTB4)脂質分子があります。Y. pestisは、LTB4のシグナルを抑制することで免疫応答を妨害します。ローレンツは、Y. pestisがLTB4をブロックする方法を調査するために、国立衛生研究所から新たに290万ドル、4年間の助成金を受け取りました。最終的に、彼はこの理解がY. pestisがシグナルをブロックするのを防ぐ方法につながり、おそらく、そ
細菌、ウイルス、または有害物質に遭遇した際、固有の免疫細胞である好中球は、侵入者と戦うためにその場所に集結します。しかし、細菌やウイルスにはこれらの防御を避ける方法があります。例えば、ペスト菌(Yersinia pestis)は、免疫システムから隠れることができ、病原体がホストを圧倒するまで体内で無制限に増殖することを許します。この能力により、Y. pestisは14世紀にヨーロッパ全土にペストを広げ、ヨーロッパ人口の3分の1を死に至らしめました。現代ではペストが人間の健康に深刻な脅威をもたらすことはありませんが、ルイビル大学(UofL)の研究者たちは、免疫システムを回避するY. pestisの能力をよりよく理解し、その理解を他の病原体の制御に応用するためにY. pestisを研究しています。
「人間のペストを見ると、感染しているにもかかわらず、細菌が免疫システムから隠れているため、すぐには症状が現れないことがあります。そして突然、大量の細菌が現れ、免疫システムが圧倒され、肺ペストの場合は、個体が肺炎で死亡します」と、UofLの微生物学および免疫学部門の教授であるマシュー・ローレンツ博士(Matthew Lawrenz, PhD)は言いました。
好中球は免疫システムの最初の対応者であり、侵入者を攻撃して破壊するために他の好中球を呼び出す分子を送り出します。好中球によって感染を示す最初の分子の中には、ロイコトリエンB4(LTB4)脂質分子があります。Y. pestisは、LTB4のシグナルを抑制することで免疫応答を妨害します。ローレンツは、Y. pestisがLTB4をブロックする方法を調査するために、国立衛生研究所から新たに290万ドル、4年間の助成金を受け取りました。最終的に、彼はこの理解がY. pestisがシグナルをブロックするのを防ぐ方法につながり、おそらく、そ
MIT研究者がAIを駆使してMRSAを殺す新化合物を発見
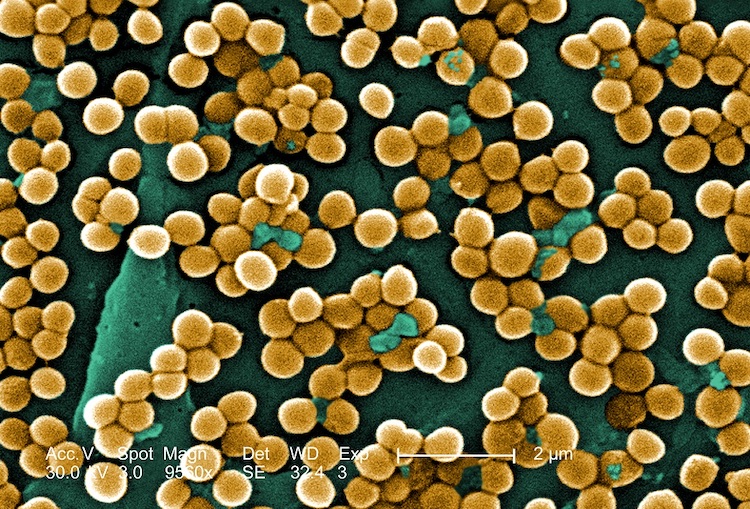 深層学習と呼ばれる人工知能(AI)の一種を用いて、マサチューセッツ工科大学(MIT)の研究者らは、毎年アメリカ合衆国で10,000人以上の死亡を引き起こす耐薬性細菌のクラスを殺すことができる化合物を発見しました。Nature誌の論文で、これらの化合物がメチシリン耐性黄色ブドウ球菌(MRSA)を実験室の培養皿で、そしてMRSA感染のマウスモデル2つで殺すことができることが示されました。これらの化合物は人間の細胞に対して非常に低い毒性を示すため、特に良好な薬剤候補です。12月20日に掲載されたこの論文のタイトルは「Discovery of a Structural Class of Antibiotics with Explainable Deep Learning(説明可能な深層学習による抗生物質の構造クラスの発見)」です。
新しい研究の主な革新点は、研究者らが、深層学習モデルが抗生物質の有効性を予測するために使用している情報の種類を理解できたことです。この知識は、モデルによって同定されたものよりもさらに優れた薬剤を設計するのに役立つ可能性があります。
「ここでの洞察は、モデルが特定の分子が良い抗生物質になるだろうと予測するために何を学んでいるかを見ることができたことでした。私たちの研究は、化学構造の観点から、これまでにない方法で、時間効率良く、リソース効率良く、機構的に洞察に富んだフレームワークを提供します」と、MITの医工学・科学研究所(IMES)および生物工学部門のTermeer医工学・科学教授であるジェームズ・コリンズ博士(James Collins)は述べています。
フェリックス・ウォン博士(Felix Wong)、IMESおよびMITとハーバードのブロード研究所のポスドク、そしてエリカ・ジェン博士(Erica Zheng)、コリンズに指導された元ハーバー
深層学習と呼ばれる人工知能(AI)の一種を用いて、マサチューセッツ工科大学(MIT)の研究者らは、毎年アメリカ合衆国で10,000人以上の死亡を引き起こす耐薬性細菌のクラスを殺すことができる化合物を発見しました。Nature誌の論文で、これらの化合物がメチシリン耐性黄色ブドウ球菌(MRSA)を実験室の培養皿で、そしてMRSA感染のマウスモデル2つで殺すことができることが示されました。これらの化合物は人間の細胞に対して非常に低い毒性を示すため、特に良好な薬剤候補です。12月20日に掲載されたこの論文のタイトルは「Discovery of a Structural Class of Antibiotics with Explainable Deep Learning(説明可能な深層学習による抗生物質の構造クラスの発見)」です。
新しい研究の主な革新点は、研究者らが、深層学習モデルが抗生物質の有効性を予測するために使用している情報の種類を理解できたことです。この知識は、モデルによって同定されたものよりもさらに優れた薬剤を設計するのに役立つ可能性があります。
「ここでの洞察は、モデルが特定の分子が良い抗生物質になるだろうと予測するために何を学んでいるかを見ることができたことでした。私たちの研究は、化学構造の観点から、これまでにない方法で、時間効率良く、リソース効率良く、機構的に洞察に富んだフレームワークを提供します」と、MITの医工学・科学研究所(IMES)および生物工学部門のTermeer医工学・科学教授であるジェームズ・コリンズ博士(James Collins)は述べています。
フェリックス・ウォン博士(Felix Wong)、IMESおよびMITとハーバードのブロード研究所のポスドク、そしてエリカ・ジェン博士(Erica Zheng)、コリンズに指導された元ハーバー
経口ペプチドによる創薬の新時代
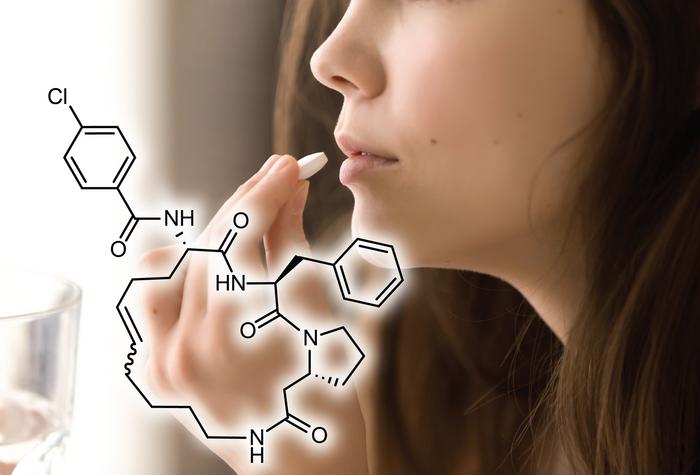 数十年にわたり、さまざまな疾患の治療に不可欠な多くのタンパク質が、経口薬療法の対象となることができずにいました。従来の低分子薬は、平らな表面を持つタンパク質に結合することや、特定のタンパク質ホモログに対する特異性が求められる場合に苦労しがちです。通常、これらのタンパク質を標的とすることができる大きなバイオロジクスは、患者の利便性やアクセス性を制限する注射を必要とします。
2023年12月28日にNature Chemical Biologyに公開された新しい研究では、EPFL(エコール・ポリテクニーク・フェデラル・ド・ローザンヌ)のクリスチャン・ハイニス教授(Christian Heinis)の研究室の研究者らが、薬剤開発における重要なマイルストーンを達成しました。彼らの研究は、製薬業界における長年の課題に対処する、新しいクラスの経口利用可能な薬剤への扉を開きました。このオープンアクセスの記事は「De novo Development of Small Cyclic Peptides That Are Orally Bioavailable(経口生物利用可能な小型環状ペプチドのデ・ノボ開発)」と題されています。
「治療標的が特定されたにもかかわらず、それらに結合し、到達する薬剤を開発できなかった病気は多くあります。そのほとんどががんの種類であり、これらのがんにおける多くの標的は、腫瘍の成長に重要であるが、阻害することができないタンパク質間相互作用です。」とハイニス教授は述べています。
研究は、疾患標的に対して高い親和性と特異性を持つことで知られる、多用途の分子である環状ペプチドに焦点を当てています。しかし、これらを経口薬として開発することは、胃腸管で迅速に消化されたり、吸収が不十分であるため、困難でした。
「環状ペプチドは、従来の方法では薬剤を生成するのが難しかった
数十年にわたり、さまざまな疾患の治療に不可欠な多くのタンパク質が、経口薬療法の対象となることができずにいました。従来の低分子薬は、平らな表面を持つタンパク質に結合することや、特定のタンパク質ホモログに対する特異性が求められる場合に苦労しがちです。通常、これらのタンパク質を標的とすることができる大きなバイオロジクスは、患者の利便性やアクセス性を制限する注射を必要とします。
2023年12月28日にNature Chemical Biologyに公開された新しい研究では、EPFL(エコール・ポリテクニーク・フェデラル・ド・ローザンヌ)のクリスチャン・ハイニス教授(Christian Heinis)の研究室の研究者らが、薬剤開発における重要なマイルストーンを達成しました。彼らの研究は、製薬業界における長年の課題に対処する、新しいクラスの経口利用可能な薬剤への扉を開きました。このオープンアクセスの記事は「De novo Development of Small Cyclic Peptides That Are Orally Bioavailable(経口生物利用可能な小型環状ペプチドのデ・ノボ開発)」と題されています。
「治療標的が特定されたにもかかわらず、それらに結合し、到達する薬剤を開発できなかった病気は多くあります。そのほとんどががんの種類であり、これらのがんにおける多くの標的は、腫瘍の成長に重要であるが、阻害することができないタンパク質間相互作用です。」とハイニス教授は述べています。
研究は、疾患標的に対して高い親和性と特異性を持つことで知られる、多用途の分子である環状ペプチドに焦点を当てています。しかし、これらを経口薬として開発することは、胃腸管で迅速に消化されたり、吸収が不十分であるため、困難でした。
「環状ペプチドは、従来の方法では薬剤を生成するのが難しかった
希少脳細胞を一網打尽 - アルツハイマー病の新たな手掛かり
 一滴の雨は海の中では検出不可能です。塩水の入った桶の中でも見つけられないでしょう。しかし、非常に精密なセンサーを備えた一つの容器で全海水を掬い取れば、突如としてその一滴の雨を特定できるようになります。脳内の希少な細胞種を追跡することも同様に難しい課題でした。しかし、そうした希少細胞の一部に変化があれば、アルツハイマー病をはじめとする様々な疾患に関連している可能性があります。そうした希少細胞を見つけて研究できれば、脳の解析や疾患介入において新たな地平が開けるかもしれません。
2023年11月30日付けのNature Geneticsに掲載された論文で述べられているように、ロックフェラー大学の遺伝学者ジュンユー・カオ博士とその同僚らが、マウス脳全体を一度に走査してこれらの秘密の細胞を見つける、低コストでハイスループットな手法を開発しました。150万個の細胞を捉え、さらに多くの細胞を取り込むことができるこのデジタルの「桶」です。
オープンアクセスの論文タイトルは「A Global View of Aging and Alzheimer's Pathogenesis-Associated Cell Population Dynamics and Molecular Signatures in Human and Mouse Brains」(加齢およびアルツハイマー病の病態発生に関連する細胞集団の動態および分子シグネチャーに関する人間およびマウス脳の全体像)です。
EasySciと呼ばれるこの一種のシングルセル解析法は、システムに取り込まれた全ての細胞のアイデンティティを同時に明らかにすることができます。研究チームはEasySciを用いて、マウスとヒトの脳における年齢、そしてアルツハイマー病に特異的な細胞集団とダイナミクスを明らかにしました。これまで見たことのない細胞サブタイプ
一滴の雨は海の中では検出不可能です。塩水の入った桶の中でも見つけられないでしょう。しかし、非常に精密なセンサーを備えた一つの容器で全海水を掬い取れば、突如としてその一滴の雨を特定できるようになります。脳内の希少な細胞種を追跡することも同様に難しい課題でした。しかし、そうした希少細胞の一部に変化があれば、アルツハイマー病をはじめとする様々な疾患に関連している可能性があります。そうした希少細胞を見つけて研究できれば、脳の解析や疾患介入において新たな地平が開けるかもしれません。
2023年11月30日付けのNature Geneticsに掲載された論文で述べられているように、ロックフェラー大学の遺伝学者ジュンユー・カオ博士とその同僚らが、マウス脳全体を一度に走査してこれらの秘密の細胞を見つける、低コストでハイスループットな手法を開発しました。150万個の細胞を捉え、さらに多くの細胞を取り込むことができるこのデジタルの「桶」です。
オープンアクセスの論文タイトルは「A Global View of Aging and Alzheimer's Pathogenesis-Associated Cell Population Dynamics and Molecular Signatures in Human and Mouse Brains」(加齢およびアルツハイマー病の病態発生に関連する細胞集団の動態および分子シグネチャーに関する人間およびマウス脳の全体像)です。
EasySciと呼ばれるこの一種のシングルセル解析法は、システムに取り込まれた全ての細胞のアイデンティティを同時に明らかにすることができます。研究チームはEasySciを用いて、マウスとヒトの脳における年齢、そしてアルツハイマー病に特異的な細胞集団とダイナミクスを明らかにしました。これまで見たことのない細胞サブタイプ
オルガノイドモデルを用いた膵臓がんの新しい治療法の可能性
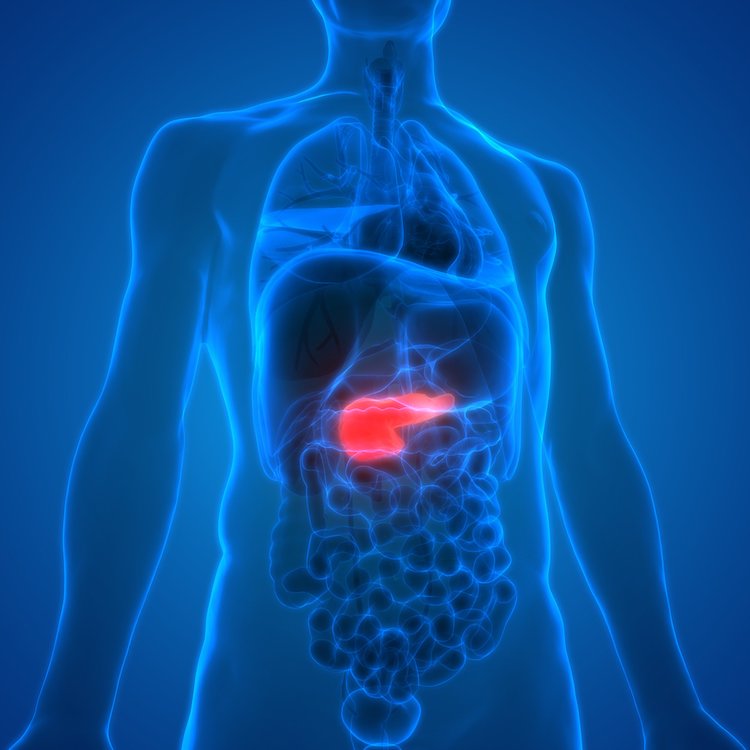 ウェイル・コーネル医学の研究者による新しい研究では、ラボで育てた組織であるオルガノイドを使用してがんをモデル化する薬剤スクリーニングシステムが、将来の膵臓がん治療の有望なターゲットを発見するのに役立ったことが報告されています。
この研究は2023年12月26日に「Cell Stem Cell」に掲載され、科学者らは膵臓腫瘍オルガノイドに6,000以上の化合物をテストしました。これらのオルガノイドには、膵臓がんを引き起こす一般的な変異が含まれています。彼らは、ペルヘキシリンマレイン酸という既存の心臓薬が、オルガノイドの成長を強力に抑制することを発見しました。論文のタイトルは「A Pancreatic Cancer Organoid Platform Identifies an Inhibitor Specific to Mutant KRAS」(膵臓がんオルガノイドプラットフォームは変異KRAS特異的な抑制剤を同定する)です。
研究者らは、オルガノイド内のがんを引き起こす変異が異常に高いコレステロールの産生を強制し、この薬がその作用を大きく逆転することを発見しました。
「私たちの発見は、ほとんどの膵臓がんで標的にできる可能性のある、過剰活性化したコレステロール合成を特定します」と、ウェイル・コーネル医学の外科学研究副部長で、ピーター・I・プレスマンMD外科学教授、およびハートマン治療器官再生研究所のメンバーであるトッド・エヴァンス博士(Todd Evans, PhD)は述べています。
「この研究はまた、遺伝的によく定義されたオルガノイドを使用してがんをモデル化し、新しい治療戦略を発見する価値を強調しています」と、ゲノムヘルスセンターのディレクターで、キルツファミリー外科学教授、およびハートマン治療器官再生研究所のメンバーであるシュイビン・チェン博士(Shuibing
ウェイル・コーネル医学の研究者による新しい研究では、ラボで育てた組織であるオルガノイドを使用してがんをモデル化する薬剤スクリーニングシステムが、将来の膵臓がん治療の有望なターゲットを発見するのに役立ったことが報告されています。
この研究は2023年12月26日に「Cell Stem Cell」に掲載され、科学者らは膵臓腫瘍オルガノイドに6,000以上の化合物をテストしました。これらのオルガノイドには、膵臓がんを引き起こす一般的な変異が含まれています。彼らは、ペルヘキシリンマレイン酸という既存の心臓薬が、オルガノイドの成長を強力に抑制することを発見しました。論文のタイトルは「A Pancreatic Cancer Organoid Platform Identifies an Inhibitor Specific to Mutant KRAS」(膵臓がんオルガノイドプラットフォームは変異KRAS特異的な抑制剤を同定する)です。
研究者らは、オルガノイド内のがんを引き起こす変異が異常に高いコレステロールの産生を強制し、この薬がその作用を大きく逆転することを発見しました。
「私たちの発見は、ほとんどの膵臓がんで標的にできる可能性のある、過剰活性化したコレステロール合成を特定します」と、ウェイル・コーネル医学の外科学研究副部長で、ピーター・I・プレスマンMD外科学教授、およびハートマン治療器官再生研究所のメンバーであるトッド・エヴァンス博士(Todd Evans, PhD)は述べています。
「この研究はまた、遺伝的によく定義されたオルガノイドを使用してがんをモデル化し、新しい治療戦略を発見する価値を強調しています」と、ゲノムヘルスセンターのディレクターで、キルツファミリー外科学教授、およびハートマン治療器官再生研究所のメンバーであるシュイビン・チェン博士(Shuibing
GPCRの構造: 重要な薬物標的の機能の分子的起源を解明
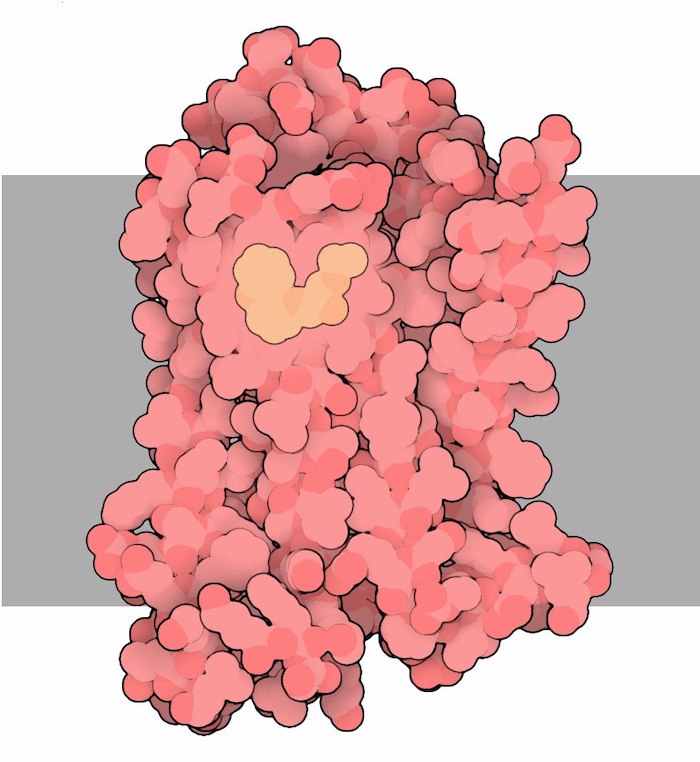 国際共同研究により、セント・ジュード小児研究病院の科学者チームが、データサイエンス、薬理学、構造情報を活用し、アドレナリンと結合するレセプターの各アミノ酸が、この天然リガンドの存在下でレセプター活性にどのように寄与するかを原子レベルで解明しました。
研究チームは、主要な薬理学的特性を制御するアミノ酸を正確に特定しました。研究対象のアドレナリンレセプターは、G タンパク質共役型受容体(GPCR)ファミリーのメンバーで、このファミリーは米国食品医薬品局(FDA)承認薬の3分の1の標的となっています。したがって、GPCRが天然または治療用リガンドにどのように応答するかを理解することは、レセプター活性に正確な効果を持つ新薬の開発に不可欠です。
この研究は2023年12月21日付けのScienceに掲載され、論文タイトルは「Molecular Determinants of Ligand Efficacy and Potency in GPCR Signaling」(GPCRシグナリングにおけるリガンド効力と有効性の分子決定要因)です。
時計の仕組みを理解するには、部品ごとに分解し、各部品が時刻維持機能においてどのような役割を果たしているかを研究するかもしれません。同様に、GPCRなどのタンパク質では、各アミノ酸が外部シグナルに対するタンパク質の応答にそれぞれ異なる役割を果たしている可能性があります。セント・ジュード研究チームは、スタンフォード大学、モントリオール大学、MRC分子生物学研究所、ケンブリッジ大学の科学者と協力し、ひとつずつアミノ酸を置換することで、β2アドレナリン受容体(β2AR)におけるシグナル応答を媒介する各アミノ酸の寄与を理解しようと試みました。
「科学者は遺伝子を一つずつ破壊することで、細胞機能への遺伝子の寄与を学びます。私たちは『なぜ、もう一歩掘り
国際共同研究により、セント・ジュード小児研究病院の科学者チームが、データサイエンス、薬理学、構造情報を活用し、アドレナリンと結合するレセプターの各アミノ酸が、この天然リガンドの存在下でレセプター活性にどのように寄与するかを原子レベルで解明しました。
研究チームは、主要な薬理学的特性を制御するアミノ酸を正確に特定しました。研究対象のアドレナリンレセプターは、G タンパク質共役型受容体(GPCR)ファミリーのメンバーで、このファミリーは米国食品医薬品局(FDA)承認薬の3分の1の標的となっています。したがって、GPCRが天然または治療用リガンドにどのように応答するかを理解することは、レセプター活性に正確な効果を持つ新薬の開発に不可欠です。
この研究は2023年12月21日付けのScienceに掲載され、論文タイトルは「Molecular Determinants of Ligand Efficacy and Potency in GPCR Signaling」(GPCRシグナリングにおけるリガンド効力と有効性の分子決定要因)です。
時計の仕組みを理解するには、部品ごとに分解し、各部品が時刻維持機能においてどのような役割を果たしているかを研究するかもしれません。同様に、GPCRなどのタンパク質では、各アミノ酸が外部シグナルに対するタンパク質の応答にそれぞれ異なる役割を果たしている可能性があります。セント・ジュード研究チームは、スタンフォード大学、モントリオール大学、MRC分子生物学研究所、ケンブリッジ大学の科学者と協力し、ひとつずつアミノ酸を置換することで、β2アドレナリン受容体(β2AR)におけるシグナル応答を媒介する各アミノ酸の寄与を理解しようと試みました。
「科学者は遺伝子を一つずつ破壊することで、細胞機能への遺伝子の寄与を学びます。私たちは『なぜ、もう一歩掘り
古代の遺伝子侵略者(LINE-1)が我々のDNAにどのように入り込んでいるかを解明
 LINE-1は病気や老化に関連するレトロトランスポゾンの一種です。ロックフェラー大学の科学者と共同研究者らは、その主要タンパク質の核心を解明し、治療標的への道を指し示しました。数十億年前に原始的な生命体がより複雑になるにつれて、ある利己的な遺伝子成分がゲノムの植民地化者となったことを説明しています。この有害なコードはコピー&ペーストのメカニズムを使用して、様々なゲノムに何度も複製され挿入されました。時間が経つにつれて、全ての真核生物(ヒトを含む)はこのコードを受け継ぎました。実際、この古代の遺伝子要素はヒトのゲノムの約3分の1を記述しており、比較的最近までジャンクDNAとみなされていました。
この遺伝子成分はLINE-1(long interspersed nuclear element 1)(L1)として知られ、そのゲノムへの攻撃的な侵入は疾患を引き起こす突然変異をもたらす可能性があります。ORF2pと呼ばれる重要なタンパク質がその成功を可能にし、ORF2pの構造と機構を理解することは、様々な疾患に対する新しい潜在的な治療標的を明らかにすることができます。ORF2pはL1レトロトランスポジションに必要なエンドヌクレアーゼと逆転写酵素の活性をコードします。
現在、ロックフェラー大学の研究者らは、12以上の学術および産業グループとの共同研究により、初めてタンパク質のコア構造を高解像度で描出し、LINE-1の主要な病原性メカニズムについての新たな洞察を明らかにしました。
その結果は2023年12月14日にNatureにて公開されました。論文のタイトルは「Structures, Functions, and Adaptations of the Human LINE-1 ORF2 Protein(ヒトのLINE-1 ORF2タンパク質の構造、機能、および適応)」です。
「
LINE-1は病気や老化に関連するレトロトランスポゾンの一種です。ロックフェラー大学の科学者と共同研究者らは、その主要タンパク質の核心を解明し、治療標的への道を指し示しました。数十億年前に原始的な生命体がより複雑になるにつれて、ある利己的な遺伝子成分がゲノムの植民地化者となったことを説明しています。この有害なコードはコピー&ペーストのメカニズムを使用して、様々なゲノムに何度も複製され挿入されました。時間が経つにつれて、全ての真核生物(ヒトを含む)はこのコードを受け継ぎました。実際、この古代の遺伝子要素はヒトのゲノムの約3分の1を記述しており、比較的最近までジャンクDNAとみなされていました。
この遺伝子成分はLINE-1(long interspersed nuclear element 1)(L1)として知られ、そのゲノムへの攻撃的な侵入は疾患を引き起こす突然変異をもたらす可能性があります。ORF2pと呼ばれる重要なタンパク質がその成功を可能にし、ORF2pの構造と機構を理解することは、様々な疾患に対する新しい潜在的な治療標的を明らかにすることができます。ORF2pはL1レトロトランスポジションに必要なエンドヌクレアーゼと逆転写酵素の活性をコードします。
現在、ロックフェラー大学の研究者らは、12以上の学術および産業グループとの共同研究により、初めてタンパク質のコア構造を高解像度で描出し、LINE-1の主要な病原性メカニズムについての新たな洞察を明らかにしました。
その結果は2023年12月14日にNatureにて公開されました。論文のタイトルは「Structures, Functions, and Adaptations of the Human LINE-1 ORF2 Protein(ヒトのLINE-1 ORF2タンパク質の構造、機能、および適応)」です。
「
塩害や干ばつを防ぐと思われていたキヌアの葉の構造が、実は外敵から身を守るためだった。
 地球が温暖化するにつれて、キヌア(Chenopodium quinoa)のような高い耐性を持つ作物がますます注目を集めています。これらの作物は厳しい条件下でも成長することができる特性を持っています。南米アンデス地域原産の古代作物であるキヌアは、非常に塩分と乾燥に強いです。その葉は、表皮塩集積細胞(Epidermal Bladder Cells:EBC)と呼ばれる小さな液体で満たされた風船で覆われていると考えられていましたが、これがストレス耐性の源であるとされてきました。しかし、2023年10月17日に『Current Biology』に発表された研究では、EBCは実際には塩分や乾燥に対して保護するのではなく、昆虫や細菌に対する物理的および化学的保護を提供していることが明らかにされました。EBCは、葉面へのアクセスを遮断するシールドとして機能し、草食昆虫に有毒な化合物、例えばオキサル酸を含んでいます。EBCの機能を理解することは、特定の条件に適応したキヌア品種の育種に役立ちます。この『Current Biology』のオープンアクセス論文は、「Epidermal Bladder Cells As a Herbivore Defense Mechanism」(草食動物の防御機構としての表皮塩集積細胞)と題されています。
EBCは、葉の表面を覆う変化した毛、つまりトリコームです。長い間、それらは塩分や乾燥耐性に関与していると考えられていましたが、最近の研究では、植物が通常草食動物に対する防御に使用する化合物、例えばオキサル酸やサポニンで満たされていることが示されました。
コペンハーゲン大学のマックス・ムーグ博士(Max Moog, PhD)とマイケル・パルムグレン博士(Michael Palmgren, PhD)は、同僚たちと共に、EBCを生成しない突然変異体や、EBCを削除
地球が温暖化するにつれて、キヌア(Chenopodium quinoa)のような高い耐性を持つ作物がますます注目を集めています。これらの作物は厳しい条件下でも成長することができる特性を持っています。南米アンデス地域原産の古代作物であるキヌアは、非常に塩分と乾燥に強いです。その葉は、表皮塩集積細胞(Epidermal Bladder Cells:EBC)と呼ばれる小さな液体で満たされた風船で覆われていると考えられていましたが、これがストレス耐性の源であるとされてきました。しかし、2023年10月17日に『Current Biology』に発表された研究では、EBCは実際には塩分や乾燥に対して保護するのではなく、昆虫や細菌に対する物理的および化学的保護を提供していることが明らかにされました。EBCは、葉面へのアクセスを遮断するシールドとして機能し、草食昆虫に有毒な化合物、例えばオキサル酸を含んでいます。EBCの機能を理解することは、特定の条件に適応したキヌア品種の育種に役立ちます。この『Current Biology』のオープンアクセス論文は、「Epidermal Bladder Cells As a Herbivore Defense Mechanism」(草食動物の防御機構としての表皮塩集積細胞)と題されています。
EBCは、葉の表面を覆う変化した毛、つまりトリコームです。長い間、それらは塩分や乾燥耐性に関与していると考えられていましたが、最近の研究では、植物が通常草食動物に対する防御に使用する化合物、例えばオキサル酸やサポニンで満たされていることが示されました。
コペンハーゲン大学のマックス・ムーグ博士(Max Moog, PhD)とマイケル・パルムグレン博士(Michael Palmgren, PhD)は、同僚たちと共に、EBCを生成しない突然変異体や、EBCを削除
"裸のアサリ"を使い、持続可能な方法で木材を美味しくタンパク質豊富な食品に変える方法
 温室効果ガスの排出量を抑制するために、カーボンフットプリントが低い食品を見つけることが不可欠です。水生環境から得られる「青い食材」は、その解決策の一つを提供するかもしれません。イギリスの研究者らは、フナクイムシの可能性を探っています。これらの歴史的に嫌われてきた生物は、実際にはワームではなく、蛤やムール貝の親戚です。彼らは成長が早く、ビタミンB12が豊富で、廃棄された木材を健康的なタンパク質源に変えることができます。研究者らは彼らを「裸の蛤」と呼び、その結果を2023年11月20日にSustainable Agricultureに報告しました。オープンアクセス論文のタイトルは「Naked Clams to Open a New Sector in Sustainable Nutritious Food Production(裸の蛤で持続可能な栄養食品生産の新しいセクターを開く)」です。フナクイムシ(またはテレドニドワームとも呼ばれる)は、海に浸かった木材を通じてトンネルを掘り、それを彼らの家と食料にします。歴史的には無数の木製船を破壊し、今日でも毎年数十億ドル相当の沿岸インフラストラクチャー、例えば桟橋や防波堤を食い尽くしています。
彼らの名前に反して、彼らはワームではなく、フィルターを通して餌をとる蛤やムール貝の親戚で、彼らの貝殻は小さなものに減少し、木材に穴を開けるドリルビットとして使用され、削り取った削りカスを、鰓にいる細菌性の共生微生物の助けを借りて消化します。
テレドニドワームは、オーストラリアのアボリジニによって養殖されていましたし、東南アジアでは生で食べられたり、カレーにされたりしています。それらは蛤のような味がし、栄養価が高く、成長が早く、養殖が容易です。
低入力でタンパク質豊富な食料源としての潜在的価値を認識して、ケンブリッジ大学のデイビッド・ウ
温室効果ガスの排出量を抑制するために、カーボンフットプリントが低い食品を見つけることが不可欠です。水生環境から得られる「青い食材」は、その解決策の一つを提供するかもしれません。イギリスの研究者らは、フナクイムシの可能性を探っています。これらの歴史的に嫌われてきた生物は、実際にはワームではなく、蛤やムール貝の親戚です。彼らは成長が早く、ビタミンB12が豊富で、廃棄された木材を健康的なタンパク質源に変えることができます。研究者らは彼らを「裸の蛤」と呼び、その結果を2023年11月20日にSustainable Agricultureに報告しました。オープンアクセス論文のタイトルは「Naked Clams to Open a New Sector in Sustainable Nutritious Food Production(裸の蛤で持続可能な栄養食品生産の新しいセクターを開く)」です。フナクイムシ(またはテレドニドワームとも呼ばれる)は、海に浸かった木材を通じてトンネルを掘り、それを彼らの家と食料にします。歴史的には無数の木製船を破壊し、今日でも毎年数十億ドル相当の沿岸インフラストラクチャー、例えば桟橋や防波堤を食い尽くしています。
彼らの名前に反して、彼らはワームではなく、フィルターを通して餌をとる蛤やムール貝の親戚で、彼らの貝殻は小さなものに減少し、木材に穴を開けるドリルビットとして使用され、削り取った削りカスを、鰓にいる細菌性の共生微生物の助けを借りて消化します。
テレドニドワームは、オーストラリアのアボリジニによって養殖されていましたし、東南アジアでは生で食べられたり、カレーにされたりしています。それらは蛤のような味がし、栄養価が高く、成長が早く、養殖が容易です。
低入力でタンパク質豊富な食料源としての潜在的価値を認識して、ケンブリッジ大学のデイビッド・ウ
妊娠中毒症の予測と重症度評価にmiRNAバイオマーカーが光を当てる
 カリフォルニア大学サンディエゴ校(UCSD)が主導する研究により、マイクロRNA(miRNA)バイオマーカーのパネルは、妊娠中毒症を予測するだけでなく、その状態の重症度を示せることが明らかになりました。研究者らは当初、妊娠中毒症に関連する110種類の細胞外miRNAを特定しました。これらのmiRNAは細胞間で移動することができます。その後、機械学習の助けを借りて、マーカーを3対の関連するmiRNAのパネルに絞り込みました。このmiRNAバイオマーカーのパネルは、妊娠中毒症の軽度と重度の症例を区別することができ、既存のバイオマーカーである胎盤成長因子(PlGF)と可溶性FMS様チロシンキナーゼ1(sFlt1)比と組み合わせた場合、さらに優れた性能を示しました。
妊娠中毒症は、最大8%の妊娠に影響を及ぼす胎盤機能不全の一種です。症状には、高血圧とタンパク質レベルの上昇が含まれ、母体と赤ちゃんの両方にとって非常に危険な状態です。妊娠中毒症の治療法は現在利用可能ではなく、この状態の進行を停止させる唯一の方法は、早期に赤ちゃんを出産することです。
「現在、妊娠中毒症の早期診断や後の発症リスクの評価は、この疾患に高度に特異的なアッセイが欠如しているため問題となっています。妊娠の監視の強度を計画する際や、出産のタイミングを決定する際には、正確な評価が重要です」と、UCSDの教授であるルイーズ・ローラン博士(Louise Laurent, MD, PhD)と同僚は、Science Advances誌に掲載された論文で述べています。
このオープンアクセス論文は2023年12月20日に公開され、「妊娠中毒症の診断および予後評価のための細胞外マイクロRNAバイオマーカーの発見と検証(Discovery and Verification of Extracellular MicroRNA
カリフォルニア大学サンディエゴ校(UCSD)が主導する研究により、マイクロRNA(miRNA)バイオマーカーのパネルは、妊娠中毒症を予測するだけでなく、その状態の重症度を示せることが明らかになりました。研究者らは当初、妊娠中毒症に関連する110種類の細胞外miRNAを特定しました。これらのmiRNAは細胞間で移動することができます。その後、機械学習の助けを借りて、マーカーを3対の関連するmiRNAのパネルに絞り込みました。このmiRNAバイオマーカーのパネルは、妊娠中毒症の軽度と重度の症例を区別することができ、既存のバイオマーカーである胎盤成長因子(PlGF)と可溶性FMS様チロシンキナーゼ1(sFlt1)比と組み合わせた場合、さらに優れた性能を示しました。
妊娠中毒症は、最大8%の妊娠に影響を及ぼす胎盤機能不全の一種です。症状には、高血圧とタンパク質レベルの上昇が含まれ、母体と赤ちゃんの両方にとって非常に危険な状態です。妊娠中毒症の治療法は現在利用可能ではなく、この状態の進行を停止させる唯一の方法は、早期に赤ちゃんを出産することです。
「現在、妊娠中毒症の早期診断や後の発症リスクの評価は、この疾患に高度に特異的なアッセイが欠如しているため問題となっています。妊娠の監視の強度を計画する際や、出産のタイミングを決定する際には、正確な評価が重要です」と、UCSDの教授であるルイーズ・ローラン博士(Louise Laurent, MD, PhD)と同僚は、Science Advances誌に掲載された論文で述べています。
このオープンアクセス論文は2023年12月20日に公開され、「妊娠中毒症の診断および予後評価のための細胞外マイクロRNAバイオマーカーの発見と検証(Discovery and Verification of Extracellular MicroRNA
UWマディソンで開発された幹細胞技術が自閉症リスクの新たな理解に貢献
 ウィスコンシン大学マディソン校で開発された、脳と脊髄組織の "ロゼット "を成長させる技術は、自閉症に関連する遺伝子変異がヒトの脳発達の初期段階にどのような影響を及ぼすかについての最近の研究を含め、科学者たちに成長するヒトの脳を研究する新しい方法を提供します。この技術は、幹細胞を使用して胚性前脳または脊髄組織構造である「神経ロゼット」を生成するスクリーニングツールであるRosetteArray技術を使用しています。神経ロゼットは、より大きく、より複雑な器官に似た細胞のクラスターであるヒト幹細胞由来の神経オルガノイドを生成するための出発材料であり、異なる遺伝的構成または化学物質への曝露が神経発達障害のリスクを高めるかどうかを評価するために使用できます。
「この技術により、ヒト中枢神経系発達の胚性モデルにアクセスできるようになります。これは有用です。なぜなら、私たちはヒトの発達についてより多くを理解することができるだけでなく、それがいつ間違っているのかを理解することができるからです。」と、ウィスコンシン大学マディソン校のバイオメディカルエンジニアリング教授であり、幹細胞および再生医学センターの副所長であるランドルフ・アシュトン博士(Randolph Ashton, PhD)は言います。
アシュトン博士とウィスコンシン発見研究所の科学者であり、アシュトン博士の研究室で博士号を取得したギャビン・ナイト博士(Gavin Knight, PhD)は、Neurosettaという彼らが共同創立した会社が市場に出しているRosetteArray技術の背後にある技術を開発しました。この会社は、UW-Madison Discovery to Productおよびウィスコンシンアルムニ研究財団(WARF)のアクセラレータープログラムのサポートを受けて設立されました。
RosetteArr
ウィスコンシン大学マディソン校で開発された、脳と脊髄組織の "ロゼット "を成長させる技術は、自閉症に関連する遺伝子変異がヒトの脳発達の初期段階にどのような影響を及ぼすかについての最近の研究を含め、科学者たちに成長するヒトの脳を研究する新しい方法を提供します。この技術は、幹細胞を使用して胚性前脳または脊髄組織構造である「神経ロゼット」を生成するスクリーニングツールであるRosetteArray技術を使用しています。神経ロゼットは、より大きく、より複雑な器官に似た細胞のクラスターであるヒト幹細胞由来の神経オルガノイドを生成するための出発材料であり、異なる遺伝的構成または化学物質への曝露が神経発達障害のリスクを高めるかどうかを評価するために使用できます。
「この技術により、ヒト中枢神経系発達の胚性モデルにアクセスできるようになります。これは有用です。なぜなら、私たちはヒトの発達についてより多くを理解することができるだけでなく、それがいつ間違っているのかを理解することができるからです。」と、ウィスコンシン大学マディソン校のバイオメディカルエンジニアリング教授であり、幹細胞および再生医学センターの副所長であるランドルフ・アシュトン博士(Randolph Ashton, PhD)は言います。
アシュトン博士とウィスコンシン発見研究所の科学者であり、アシュトン博士の研究室で博士号を取得したギャビン・ナイト博士(Gavin Knight, PhD)は、Neurosettaという彼らが共同創立した会社が市場に出しているRosetteArray技術の背後にある技術を開発しました。この会社は、UW-Madison Discovery to Productおよびウィスコンシンアルムニ研究財団(WARF)のアクセラレータープログラムのサポートを受けて設立されました。
RosetteArr
一つの微生物で二重の利益を生む:持続可能なバイオ燃料とカロテノイドの同時生産
 私たちは、大きな問題を解決するために、しばしば最小の生命体に助けを求めます:微生物は食品や飲料の製造、病気の治療、廃棄物の処理、さらには汚染の浄化にも役立ちます。酵母やバクテリアは、化石燃料から伝統的に得られるバイオ燃料や化学製品を植物の糖から変換することもできます。これは、気候変動を遅らせるためのほとんどの計画の重要な構成要素です。今、ウィスコンシン大学マディソン校の研究者らは、利用されにくい植物繊維から同時に2つの化学製品を生産できるバクテリアを開発しました。そして、人間とは異なり、これらの多任務微生物は両方のことを同等にうまく行うことができます。
「私の知る限り、一つの微生物で同時に2つの貴重な製品を作ることができるのは初めてです」と、ウィスコンシン大学マディソン校のバクテリオロジー教授であり、グレートレイクスバイオエネルギー研究センター(GLBRC)のディレクターであるティム・ドノヒュー博士(Tim Donohue, PhD)は言います。
この発見は、2023年12月号の「Applied and Environmental Microbiology」誌に詳述されており、バイオ燃料をより持続可能で商業的に実行可能にするのに役立つ可能性があります。この論文のタイトルは「Production of Carotenoids from Aromatics and Pretreated Lignocellulosic Biomass by Novosphingobium aromaticivorans(アロマティック化合物と前処理されたリグノセルロースバイオマスからのカロテノイドの生産:Novosphingobium aromaticivoransによる研究)」です。
「原則として、この戦略は温室効果ガスの排出量を減らし、経済性を向上させます。一つのポットで2つの製品
私たちは、大きな問題を解決するために、しばしば最小の生命体に助けを求めます:微生物は食品や飲料の製造、病気の治療、廃棄物の処理、さらには汚染の浄化にも役立ちます。酵母やバクテリアは、化石燃料から伝統的に得られるバイオ燃料や化学製品を植物の糖から変換することもできます。これは、気候変動を遅らせるためのほとんどの計画の重要な構成要素です。今、ウィスコンシン大学マディソン校の研究者らは、利用されにくい植物繊維から同時に2つの化学製品を生産できるバクテリアを開発しました。そして、人間とは異なり、これらの多任務微生物は両方のことを同等にうまく行うことができます。
「私の知る限り、一つの微生物で同時に2つの貴重な製品を作ることができるのは初めてです」と、ウィスコンシン大学マディソン校のバクテリオロジー教授であり、グレートレイクスバイオエネルギー研究センター(GLBRC)のディレクターであるティム・ドノヒュー博士(Tim Donohue, PhD)は言います。
この発見は、2023年12月号の「Applied and Environmental Microbiology」誌に詳述されており、バイオ燃料をより持続可能で商業的に実行可能にするのに役立つ可能性があります。この論文のタイトルは「Production of Carotenoids from Aromatics and Pretreated Lignocellulosic Biomass by Novosphingobium aromaticivorans(アロマティック化合物と前処理されたリグノセルロースバイオマスからのカロテノイドの生産:Novosphingobium aromaticivoransによる研究)」です。
「原則として、この戦略は温室効果ガスの排出量を減らし、経済性を向上させます。一つのポットで2つの製品
CRISPRのパイオニアが振り返る初の遺伝子編集療法の承認
 2007年、ルチアーノ・マラフィーニ博士(Luciano Marraffini, PhD)は孤独な科学の道を歩み始めました。それは、その約10年前にバクテリアで発見されたCRISPRを理解することでした。17年後、私たちは皆CRISPRが何であるかを知っています。それは医学における革命、一生に一度の科学的ブレイクスルー、遺伝子治療においてこれまでに発見された最も有望なツールです。しかし当時、CRISPR(clustered regularly interspaced short palindromic repeats)は、目的が不明な単なる好奇心をそそる遺伝子断片に過ぎませんでした。「私が研究を始めたとき、いつか遺伝病を治すのに役立つなどとは誰も言いませんでした」とマラフィーニ博士は振り返ります。
しかし興味深いことに、一つの説はCRISPRがバクテリアの防御システムの一部であり、バクテリアがウイルス(ファージと呼ばれる)や外来の遺伝子断片(プラスミドと呼ばれる)の侵入と戦うために使われるというものでした。ノースウェスタン大学のポスドクだったマラフィーニ博士は、病原性バクテリアの専門家であり、それらがどのように侵入するかを研究していました。CRISPRに目を向けることで、彼はそのスクリプトを反転させ、バクテリアが侵入される側の反応を理解しようとしました。CRISPRが武器であるならば、それがどのように鍛えられ、ふるまうのかを知りたかったのです。
彼の概念的な転換は報われました:2年以内に彼はCRISPRに関する画期的な発見を発表し、そのプロセスでゲノム医学の新興分野を開拓するのに役立ちました。
CRISPRは、侵入者のDNAを驚異的な精度で切り取る遺伝子のメスであることが判明しました。マラフィーニ博士らの研究以来、CRISPR-Cas9(その機能に不可欠なタンパク
2007年、ルチアーノ・マラフィーニ博士(Luciano Marraffini, PhD)は孤独な科学の道を歩み始めました。それは、その約10年前にバクテリアで発見されたCRISPRを理解することでした。17年後、私たちは皆CRISPRが何であるかを知っています。それは医学における革命、一生に一度の科学的ブレイクスルー、遺伝子治療においてこれまでに発見された最も有望なツールです。しかし当時、CRISPR(clustered regularly interspaced short palindromic repeats)は、目的が不明な単なる好奇心をそそる遺伝子断片に過ぎませんでした。「私が研究を始めたとき、いつか遺伝病を治すのに役立つなどとは誰も言いませんでした」とマラフィーニ博士は振り返ります。
しかし興味深いことに、一つの説はCRISPRがバクテリアの防御システムの一部であり、バクテリアがウイルス(ファージと呼ばれる)や外来の遺伝子断片(プラスミドと呼ばれる)の侵入と戦うために使われるというものでした。ノースウェスタン大学のポスドクだったマラフィーニ博士は、病原性バクテリアの専門家であり、それらがどのように侵入するかを研究していました。CRISPRに目を向けることで、彼はそのスクリプトを反転させ、バクテリアが侵入される側の反応を理解しようとしました。CRISPRが武器であるならば、それがどのように鍛えられ、ふるまうのかを知りたかったのです。
彼の概念的な転換は報われました:2年以内に彼はCRISPRに関する画期的な発見を発表し、そのプロセスでゲノム医学の新興分野を開拓するのに役立ちました。
CRISPRは、侵入者のDNAを驚異的な精度で切り取る遺伝子のメスであることが判明しました。マラフィーニ博士らの研究以来、CRISPR-Cas9(その機能に不可欠なタンパク
ミトコンドリアの機能と類似性を持つ巨大細菌Epulopiscium viviparusの全ゲノム解析
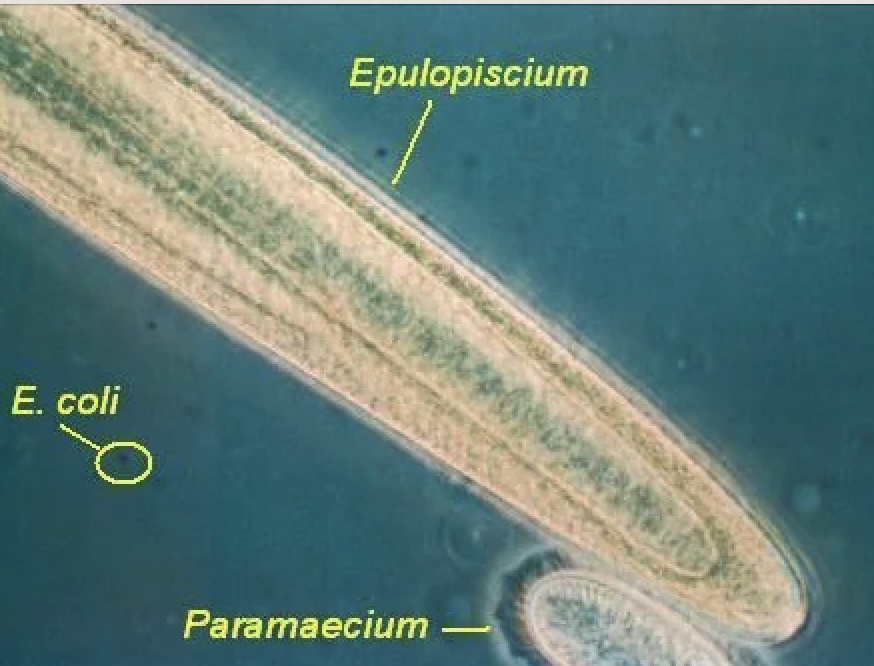 全ての細菌が同じような構造とは限りません。ほとんどの細菌は単細胞で、長さが数万分の数センチメートルです。しかし、Epulopiscium属の細菌は、肉眼で見ることができるほど大きく、よく知られた親戚であるE. coliの100万倍の体積を持っています。コーネル大学とローレンスバークレー国立研究所の研究者らは、この巨大な属の1種の完全なゲノムを初めて論文にしました。その種はEpulopiscium viviparusと名付けられました。2023年12月18日にPNASで公開された論文のタイトルは「ジャイアント細菌Ca. Epulopiscium viviparusの特異な形態と機能は、そのナトリウム動力源を中心に展開されている(The Exceptional Form and Function of the Giant Bacterium Ca. Epulopiscium viviparus Revolves Around Its Sodium Motive Force.)」です。
「この信じられないほどの巨大細菌は、多くの面でユニークで興味深い:その巨大なサイズ、繁殖の仕方、代謝ニーズを満たす方法などがです。この生物のゲノムポテンシャルを明らかにすることは、私たちの理解を大きく広げました。」と、コーネル大学農業生命科学カレッジの微生物学教授であり、研究の対応著者であるエスター・アンガート博士(Esther Angert ,PhD)は述べています。
Epulopiscium属の最初のメンバーは1985年に発見されました。この属の全メンバーは、熱帯海洋のサンゴ礁環境、例えばグレートバリアリーフや紅海に生息する特定のカクレクマノミの腸内に共生しています。
「その巨大なサイズのために、科学者たちは当初、それが何らかの異なるタイプの原生動物だと信じていました。Epulopi
全ての細菌が同じような構造とは限りません。ほとんどの細菌は単細胞で、長さが数万分の数センチメートルです。しかし、Epulopiscium属の細菌は、肉眼で見ることができるほど大きく、よく知られた親戚であるE. coliの100万倍の体積を持っています。コーネル大学とローレンスバークレー国立研究所の研究者らは、この巨大な属の1種の完全なゲノムを初めて論文にしました。その種はEpulopiscium viviparusと名付けられました。2023年12月18日にPNASで公開された論文のタイトルは「ジャイアント細菌Ca. Epulopiscium viviparusの特異な形態と機能は、そのナトリウム動力源を中心に展開されている(The Exceptional Form and Function of the Giant Bacterium Ca. Epulopiscium viviparus Revolves Around Its Sodium Motive Force.)」です。
「この信じられないほどの巨大細菌は、多くの面でユニークで興味深い:その巨大なサイズ、繁殖の仕方、代謝ニーズを満たす方法などがです。この生物のゲノムポテンシャルを明らかにすることは、私たちの理解を大きく広げました。」と、コーネル大学農業生命科学カレッジの微生物学教授であり、研究の対応著者であるエスター・アンガート博士(Esther Angert ,PhD)は述べています。
Epulopiscium属の最初のメンバーは1985年に発見されました。この属の全メンバーは、熱帯海洋のサンゴ礁環境、例えばグレートバリアリーフや紅海に生息する特定のカクレクマノミの腸内に共生しています。
「その巨大なサイズのために、科学者たちは当初、それが何らかの異なるタイプの原生動物だと信じていました。Epulopi
毒矢カエルの生存戦略:体内で毒素を安全に運搬するタンパク質を特定
 スタンフォード大学とその同僚の研究者らは、毒矢カエルが毒素を安全に蓄積できるようにするためのタンパク質を特定しました。この発見は、長年の科学的な謎を解明し、同様の分子で中毒された人を治療するための潜在的な治療戦略を示唆しているかもしれません。カフェインなどのアルカロイド化合物は、コーヒー、紅茶、チョコレートを美味しく、楽しく消費させますが、大量に摂取すると有害になる可能性があります。人間では、肝臓はこれらの化合物の適度な量を安全に代謝することができます。しかし、小さな毒矢カエルは、自分たちの食事ではるかに多くの毒性アルカロイドを消費しますが、これらの毒素を分解する代わりに、捕食者に対する防御機構として皮膚に蓄積します。
「毒矢カエルが自分自身を中毒させることなく体内で高毒性アルカロイドを運搬できる方法は長い間謎でした。私たちはこの質問に答えるために、毒矢カエルの血液中でアルカロイドを結合して安全に運搬する可能性のあるタンパク質を探すことを目指しました。」と、アメリカ、カリフォルニア州にあるスタンフォード大学の生物学部のオーロラ・アルバレス・ブジャ博士(Aurora Alvarez-Buylla, PhD)は述べています。
アルバレス・ブジャ博士と彼女の同僚たちは、ディアブリト毒矢カエルから採取した血液サンプル中のタンパク質を引き付けて結合させるための一種の「分子釣り針」として、毒矢カエルのアルカロイドに似た化合物を使用しました。アルカロイド様化合物は、蛍光光の下で発光するように生物工学的に改変され、チームがこのおとりに結合するタンパク質を見ることができるようになりました。
次に、彼らは各タンパク質が溶液中のアルカロイドとどのように相互作用するかを見るために、タンパク質を分離しました。彼らは、アルカロイド結合グロブリン(ABG)と呼ばれるタンパク質がアルカロイドを集
スタンフォード大学とその同僚の研究者らは、毒矢カエルが毒素を安全に蓄積できるようにするためのタンパク質を特定しました。この発見は、長年の科学的な謎を解明し、同様の分子で中毒された人を治療するための潜在的な治療戦略を示唆しているかもしれません。カフェインなどのアルカロイド化合物は、コーヒー、紅茶、チョコレートを美味しく、楽しく消費させますが、大量に摂取すると有害になる可能性があります。人間では、肝臓はこれらの化合物の適度な量を安全に代謝することができます。しかし、小さな毒矢カエルは、自分たちの食事ではるかに多くの毒性アルカロイドを消費しますが、これらの毒素を分解する代わりに、捕食者に対する防御機構として皮膚に蓄積します。
「毒矢カエルが自分自身を中毒させることなく体内で高毒性アルカロイドを運搬できる方法は長い間謎でした。私たちはこの質問に答えるために、毒矢カエルの血液中でアルカロイドを結合して安全に運搬する可能性のあるタンパク質を探すことを目指しました。」と、アメリカ、カリフォルニア州にあるスタンフォード大学の生物学部のオーロラ・アルバレス・ブジャ博士(Aurora Alvarez-Buylla, PhD)は述べています。
アルバレス・ブジャ博士と彼女の同僚たちは、ディアブリト毒矢カエルから採取した血液サンプル中のタンパク質を引き付けて結合させるための一種の「分子釣り針」として、毒矢カエルのアルカロイドに似た化合物を使用しました。アルカロイド様化合物は、蛍光光の下で発光するように生物工学的に改変され、チームがこのおとりに結合するタンパク質を見ることができるようになりました。
次に、彼らは各タンパク質が溶液中のアルカロイドとどのように相互作用するかを見るために、タンパク質を分離しました。彼らは、アルカロイド結合グロブリン(ABG)と呼ばれるタンパク質がアルカロイドを集
がん治療の新たな希望:デス・スター(KRAS)の秘密の弱点を解明
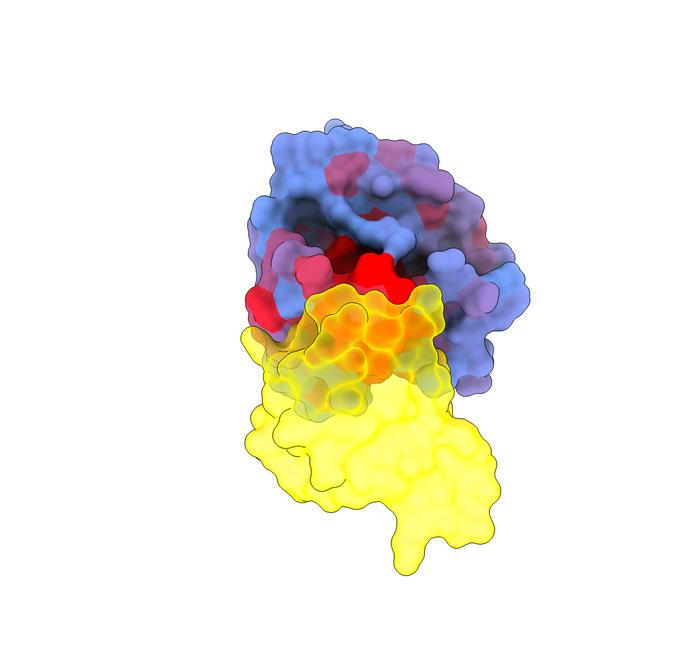 スペイン・バルセロナにある遺伝子規制センターと、イギリス・ケンブリッジ近郊のウェルカム・サンガー研究所の研究者らは、KRASタンパク質に存在するアロステリック制御部位を包括的に同定しました。これらは薬剤開発のために非常に求められているターゲットであり、がんの最も重要な原因の一つの効果を制御するために利用できる秘密の弱点を代表しています。KRASは、多くのタイプのがんで最も頻繁に変異する遺伝子の一つです。人間のがんの10人に1人に見られ、膵臓がんや肺がんなどの致命的なタイプでの発生率が高いとされます。その球形の形状と薬剤で標的にするのに適した部位がないため、このタンパク質は「デス・スター」と呼ばれています。この理由から、KRASは1982年に最初に発見されて以来、「創薬は不可能」と考えられてきました。
KRASを制御する唯一の効果的な戦略は、そのアロステリック通信システムを標的とすることでした。これらは、遠隔制御のロックとキーのメカニズムを通じて機能する分子シグナルです。タンパク質を制御するには、ロック(活性部位)を開くことができるキー(化学化合物または薬剤)が必要です。タンパク質は、その表面の別の場所にある二次ロック(アロステリック部位)によっても影響を受けることがあります。分子がアロステリック部位に結合すると、タンパク質の形状が変化し、たとえばその主要なロックの内部構造を変えることによって、タンパク質の活性や他の分子と結合する能力を変えることができます。
アロステリック部位は、より高い特異性を提供するため、薬剤開発においてしばしば好まれます。これにより、副作用の可能性が低くなります。また、タンパク質の活性をより微妙に変えることができ、その機能を微調整する可能性を提供します。アロステリック部位を標的とする薬剤は、一般に活性部位を標的とする薬剤に比べて、安全で効果的で
スペイン・バルセロナにある遺伝子規制センターと、イギリス・ケンブリッジ近郊のウェルカム・サンガー研究所の研究者らは、KRASタンパク質に存在するアロステリック制御部位を包括的に同定しました。これらは薬剤開発のために非常に求められているターゲットであり、がんの最も重要な原因の一つの効果を制御するために利用できる秘密の弱点を代表しています。KRASは、多くのタイプのがんで最も頻繁に変異する遺伝子の一つです。人間のがんの10人に1人に見られ、膵臓がんや肺がんなどの致命的なタイプでの発生率が高いとされます。その球形の形状と薬剤で標的にするのに適した部位がないため、このタンパク質は「デス・スター」と呼ばれています。この理由から、KRASは1982年に最初に発見されて以来、「創薬は不可能」と考えられてきました。
KRASを制御する唯一の効果的な戦略は、そのアロステリック通信システムを標的とすることでした。これらは、遠隔制御のロックとキーのメカニズムを通じて機能する分子シグナルです。タンパク質を制御するには、ロック(活性部位)を開くことができるキー(化学化合物または薬剤)が必要です。タンパク質は、その表面の別の場所にある二次ロック(アロステリック部位)によっても影響を受けることがあります。分子がアロステリック部位に結合すると、タンパク質の形状が変化し、たとえばその主要なロックの内部構造を変えることによって、タンパク質の活性や他の分子と結合する能力を変えることができます。
アロステリック部位は、より高い特異性を提供するため、薬剤開発においてしばしば好まれます。これにより、副作用の可能性が低くなります。また、タンパク質の活性をより微妙に変えることができ、その機能を微調整する可能性を提供します。アロステリック部位を標的とする薬剤は、一般に活性部位を標的とする薬剤に比べて、安全で効果的で
ゲノム解析によるセンザンコウ密猟ホットスポットの特定
 UCLAの科学者たちとその同僚は、世界で最も密輸されている哺乳類であるセンザンコウの遺伝的な「生息地から目的地までのマップ」を作成しました。これは、生きているシロハラセンザンコウのサンプルと、不法市場で押収された動物の鱗片からサンプルを使用しています。違法なセンザンコウ取引を妨害することは困難です:8種類の異なる種が23カ国で見つかり、その集合範囲は230万平方マイルに及び、その鱗片は伝統医学として販売するために世界中に輸送されます。シロハラアフリカ種は通常、中国や他のアジア諸国に送られます。
現在、研究者らは、密猟および密輸のホットスポットを特定するためにゲノミクスを使用する新しい強力なアプローチを開発しました。これらの発見と「Science」に公開された研究で概説された研究方法を使用して、法執行機関は現在、アフリカで動物が密猟された場所から国際サプライチェーンのシロハラセンザンコウ製品を追跡することができます。
「遺伝子スクリーニングには数日かかりますが、動物の起源を約125マイル以内で正確に特定できます。香港の船から鱗片の袋を降ろすことができれば、たとえば、それが赤道ギニアのバタ市近くの動物から来たものであると特定することができます。」と、進化生物学者でありUCLAの熱帯研究センターの創設ディレクターであるトーマス・スミス博士(Thomas Smith, PhD)は述べました。
市場から生息地へのセンザンコウ取引を追跡するために、著者らはシロハラセンザンコウのゲノムをマッピングし、中央アフリカ全体の既知の地域からこの種の111サンプルを収集して、地理的に異なる集団を遺伝的にマッピングしました。
次に、研究者らは香港市場への移送中に押収されたセンザンコウの鱗片から「スライス」された遺伝物質を取りました。これは、約100万個の個体動物からサンプリングされました
UCLAの科学者たちとその同僚は、世界で最も密輸されている哺乳類であるセンザンコウの遺伝的な「生息地から目的地までのマップ」を作成しました。これは、生きているシロハラセンザンコウのサンプルと、不法市場で押収された動物の鱗片からサンプルを使用しています。違法なセンザンコウ取引を妨害することは困難です:8種類の異なる種が23カ国で見つかり、その集合範囲は230万平方マイルに及び、その鱗片は伝統医学として販売するために世界中に輸送されます。シロハラアフリカ種は通常、中国や他のアジア諸国に送られます。
現在、研究者らは、密猟および密輸のホットスポットを特定するためにゲノミクスを使用する新しい強力なアプローチを開発しました。これらの発見と「Science」に公開された研究で概説された研究方法を使用して、法執行機関は現在、アフリカで動物が密猟された場所から国際サプライチェーンのシロハラセンザンコウ製品を追跡することができます。
「遺伝子スクリーニングには数日かかりますが、動物の起源を約125マイル以内で正確に特定できます。香港の船から鱗片の袋を降ろすことができれば、たとえば、それが赤道ギニアのバタ市近くの動物から来たものであると特定することができます。」と、進化生物学者でありUCLAの熱帯研究センターの創設ディレクターであるトーマス・スミス博士(Thomas Smith, PhD)は述べました。
市場から生息地へのセンザンコウ取引を追跡するために、著者らはシロハラセンザンコウのゲノムをマッピングし、中央アフリカ全体の既知の地域からこの種の111サンプルを収集して、地理的に異なる集団を遺伝的にマッピングしました。
次に、研究者らは香港市場への移送中に押収されたセンザンコウの鱗片から「スライス」された遺伝物質を取りました。これは、約100万個の個体動物からサンプリングされました
マウス脳全体の細胞アトラス完成:未来の神経科学研究への道
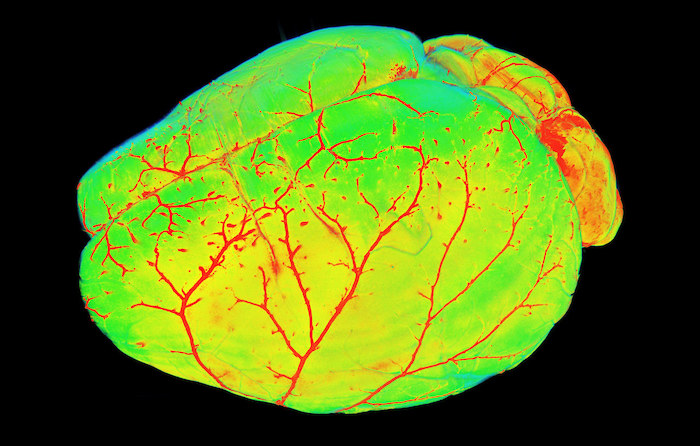 国際的な研究チームが初めて哺乳類の脳全体の完全な細胞アトラスを作成しました。このアトラスはマウス脳の地図として機能し、3200万以上の細胞のタイプ、位置、分子情報を記述し、これらの細胞間の接続情報を提供しています。マウスは神経科学研究で最も一般的に使用される脊椎動物の実験モデルであり、この細胞マップはヒトの脳(おそらく世界で最も強力なコンピューター)のより大きな理解への道を開くと期待されます。細胞アトラスはまた、精神的および神経学的障害を持つ人々のための新世代の精密治療法の開発の基盤を築きます。
この研究成果は、国立衛生研究所(NIH)の脳研究を通じた革新的な神経技術®イニシアチブ、またはBRAINイニシアチブ®によって資金提供され、2023年12月14日号のNatureに掲載された10の論文のコレクションに掲載されました。
「マウスアトラスは、哺乳類の脳細胞の複雑なネットワークを前例のない焦点に持ってきました。これにより、研究者はヒトの脳機能と疾患を理解するために必要な詳細を得ることができます」と、国立精神衛生研究所のディレクターであるジョシュア・A・ゴードン博士(Joshua A. Gordon, MD, PhD)は述べています。
細胞アトラスは、マウス脳の各領域の細胞のタイプとそれらの領域内での組織を記述します。この構造情報に加えて、細胞アトラスは細胞のトランスクリプトーム(細胞での遺伝子の読み出しの完全なセットで、タンパク質や他の細胞製品を作るための指示を含む)の信じられないほど詳細なカタログを提供します。アトラスに含まれるトランスクリプトーム情報は階層的に整理され、細胞クラス、サブクラス、そして脳内の数千の個々の細胞クラスターを詳細に説明します。
細胞アトラスはまた、細胞のエピゲノム(細胞のDNAおよび染色体への化学的変更が細胞の遺伝情報の表現方法を変
国際的な研究チームが初めて哺乳類の脳全体の完全な細胞アトラスを作成しました。このアトラスはマウス脳の地図として機能し、3200万以上の細胞のタイプ、位置、分子情報を記述し、これらの細胞間の接続情報を提供しています。マウスは神経科学研究で最も一般的に使用される脊椎動物の実験モデルであり、この細胞マップはヒトの脳(おそらく世界で最も強力なコンピューター)のより大きな理解への道を開くと期待されます。細胞アトラスはまた、精神的および神経学的障害を持つ人々のための新世代の精密治療法の開発の基盤を築きます。
この研究成果は、国立衛生研究所(NIH)の脳研究を通じた革新的な神経技術®イニシアチブ、またはBRAINイニシアチブ®によって資金提供され、2023年12月14日号のNatureに掲載された10の論文のコレクションに掲載されました。
「マウスアトラスは、哺乳類の脳細胞の複雑なネットワークを前例のない焦点に持ってきました。これにより、研究者はヒトの脳機能と疾患を理解するために必要な詳細を得ることができます」と、国立精神衛生研究所のディレクターであるジョシュア・A・ゴードン博士(Joshua A. Gordon, MD, PhD)は述べています。
細胞アトラスは、マウス脳の各領域の細胞のタイプとそれらの領域内での組織を記述します。この構造情報に加えて、細胞アトラスは細胞のトランスクリプトーム(細胞での遺伝子の読み出しの完全なセットで、タンパク質や他の細胞製品を作るための指示を含む)の信じられないほど詳細なカタログを提供します。アトラスに含まれるトランスクリプトーム情報は階層的に整理され、細胞クラス、サブクラス、そして脳内の数千の個々の細胞クラスターを詳細に説明します。
細胞アトラスはまた、細胞のエピゲノム(細胞のDNAおよび染色体への化学的変更が細胞の遺伝情報の表現方法を変
ホジキンリンパ腫の遺伝子プロファイル分析が開く新たな治療の可能性
 スタンフォード大学医学部が主導する国際研究で、ホジキンリンパ腫の患者数百人のサンプルを調査した結果、血中に循環する腫瘍DNAのレベルが治療によく反応している患者と、病気の再発が起こりやすいとされる他の患者を識別できることが示されました。これにより、予後が良好であると予測される一部の患者は、長期間にわたる治療を避けることが可能になるかもしれません。驚くべきことに、この研究はまた、リンパ節のがんであるホジキンリンパ腫を、それぞれが異なる遺伝的変化を持ち、やや異なる予後を持つ2つのグループに分けることができることを明らかにしました。これらの変化は、がんの成長メカニズムにおける弱点を示唆しており、新しい、より毒性の低い治療法の標的となる可能性があります。腫瘍の分子プロファイルを確立する考え方は新しいものではありません。しかし、他のがんとは異なり、ホジキンリンパ腫はこれらの種類の分析に抵抗してきました。それは、ホジキンリンパ腫の細胞が、大きな腫瘍内でも比較的稀であるためです。
「このアプローチは、古典的ホジキンリンパ腫の遺伝学に関する私たちの最初の重要な洞察を提供します。他のがんと比較して、ホジキンリンパ腫のがん細胞またはがんDNAを見つけることは、針の山から針を探すようなものです。患者の胸にサッカーボールサイズの腫瘍があっても、その塊の中の細胞の約1%しかがん細胞ではなく、残りは腫瘍に対する炎症反応を代表しています。これは、病気を推進する決定的な要因を見つけることを非常に困難にしています。」と、アシュ・アリザデ博士(Ash Alizadeh, MD, PhD)は述べています。
この研究は2023年12月11日に「Nature」に掲載され、「非侵襲的ゲノムプロファイリングによって定義される異なるホジキンリンパ腫サブタイプ(Distinct Hodgkin Lymphoma S
スタンフォード大学医学部が主導する国際研究で、ホジキンリンパ腫の患者数百人のサンプルを調査した結果、血中に循環する腫瘍DNAのレベルが治療によく反応している患者と、病気の再発が起こりやすいとされる他の患者を識別できることが示されました。これにより、予後が良好であると予測される一部の患者は、長期間にわたる治療を避けることが可能になるかもしれません。驚くべきことに、この研究はまた、リンパ節のがんであるホジキンリンパ腫を、それぞれが異なる遺伝的変化を持ち、やや異なる予後を持つ2つのグループに分けることができることを明らかにしました。これらの変化は、がんの成長メカニズムにおける弱点を示唆しており、新しい、より毒性の低い治療法の標的となる可能性があります。腫瘍の分子プロファイルを確立する考え方は新しいものではありません。しかし、他のがんとは異なり、ホジキンリンパ腫はこれらの種類の分析に抵抗してきました。それは、ホジキンリンパ腫の細胞が、大きな腫瘍内でも比較的稀であるためです。
「このアプローチは、古典的ホジキンリンパ腫の遺伝学に関する私たちの最初の重要な洞察を提供します。他のがんと比較して、ホジキンリンパ腫のがん細胞またはがんDNAを見つけることは、針の山から針を探すようなものです。患者の胸にサッカーボールサイズの腫瘍があっても、その塊の中の細胞の約1%しかがん細胞ではなく、残りは腫瘍に対する炎症反応を代表しています。これは、病気を推進する決定的な要因を見つけることを非常に困難にしています。」と、アシュ・アリザデ博士(Ash Alizadeh, MD, PhD)は述べています。
この研究は2023年12月11日に「Nature」に掲載され、「非侵襲的ゲノムプロファイリングによって定義される異なるホジキンリンパ腫サブタイプ(Distinct Hodgkin Lymphoma S
前立腺がん診断の未来:血液ベースの液体生検の臨床的意義
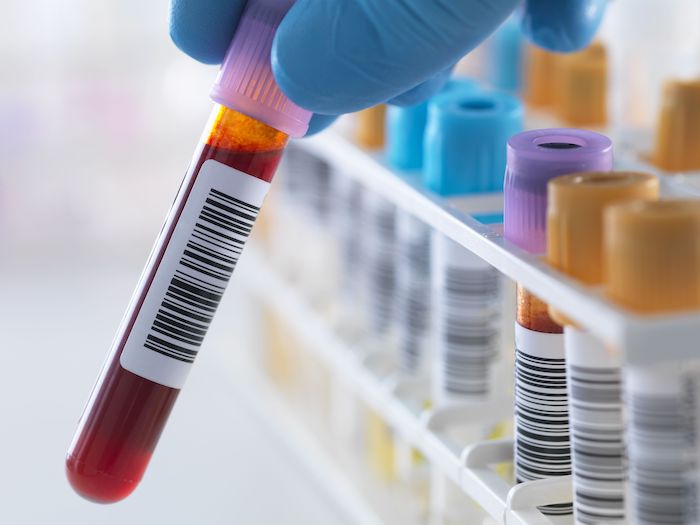 過去10年間で、がん患者の血液サンプルを採取し、原発腫瘍や転移性増殖から放出される細胞、膜結合性小胞または分子を分析することは、従来の組織生検に代わる選択肢として注目されるようになりました。この最小限の侵襲性アプローチは血液ベースの液体生検として知られるようになり、多様ながんの管理において重要な役割を果たすようになり、精密医療の重要な構成要素となりました。Oncoscience(第10巻)で2023年11月30日に公開された論文では、ノバサウスイースタン大学のR. ダニエル・ボンフィル博士(R. Daniel Bonfil, PhD)とガイス・アルエイド博士(Ghaith Al-Eyd, MD, PhD)が、前立腺がん(PCa)管理に関連する3つの血液ベースの液体生検、すなわち循環腫瘍細胞(CTCs)、循環腫瘍DNA(ctDNA)および腫瘍由来エクソソームについて議論しています。この論文は「前立腺がんの問診における血液ベースの液体生検の進化する洞察(Evolving Insights in Blood-Based Liquid Biopsies for Prostate Cancer Interrogation.)」と題されています。
「この研究の視点では、前立腺がんにおける血液ベースの液体生検の臨床的意義に関連する最近の進歩についての包括的な概観を提供します。主な焦点は、循環腫瘍細胞(CTCs)、循環腫瘍DNA(ctDNA)、およびエクソソームといった主要なバイオマーカーに置かれています」と著者は述べています。
これらのタイプの液体生検の分子特性評価における進歩と、前立腺がん患者における再発の予測、特定の治療への反応の改善、および予後の評価へのその潜在的な能力が、論文では強調されています。
現在、転移性去勢抵抗性前立腺がん患者に対する1つのCTCベースおよび1つ
過去10年間で、がん患者の血液サンプルを採取し、原発腫瘍や転移性増殖から放出される細胞、膜結合性小胞または分子を分析することは、従来の組織生検に代わる選択肢として注目されるようになりました。この最小限の侵襲性アプローチは血液ベースの液体生検として知られるようになり、多様ながんの管理において重要な役割を果たすようになり、精密医療の重要な構成要素となりました。Oncoscience(第10巻)で2023年11月30日に公開された論文では、ノバサウスイースタン大学のR. ダニエル・ボンフィル博士(R. Daniel Bonfil, PhD)とガイス・アルエイド博士(Ghaith Al-Eyd, MD, PhD)が、前立腺がん(PCa)管理に関連する3つの血液ベースの液体生検、すなわち循環腫瘍細胞(CTCs)、循環腫瘍DNA(ctDNA)および腫瘍由来エクソソームについて議論しています。この論文は「前立腺がんの問診における血液ベースの液体生検の進化する洞察(Evolving Insights in Blood-Based Liquid Biopsies for Prostate Cancer Interrogation.)」と題されています。
「この研究の視点では、前立腺がんにおける血液ベースの液体生検の臨床的意義に関連する最近の進歩についての包括的な概観を提供します。主な焦点は、循環腫瘍細胞(CTCs)、循環腫瘍DNA(ctDNA)、およびエクソソームといった主要なバイオマーカーに置かれています」と著者は述べています。
これらのタイプの液体生検の分子特性評価における進歩と、前立腺がん患者における再発の予測、特定の治療への反応の改善、および予後の評価へのその潜在的な能力が、論文では強調されています。
現在、転移性去勢抵抗性前立腺がん患者に対する1つのCTCベースおよび1つ
臓器ごとの老化速度を知ることで健康リスクを予測
 私たちの体のパーツが壊れる速度は、部位によって異なります。スタンフォード医学の研究者らが主導した5,678人の研究によると、私たちの臓器は異なる速度で老化していることが示されました。ある臓器の老化が、同年齢の他の人々の同じ臓器と比較して特に進んでいる場合、その臓器を持つ人は、その臓器に関連した病気や死亡のリスクが高まるとされています。研究によると、50歳以上の健康な大人の約5人に1人が、少なくとも1つの臓器が顕著に加速して老化している状態で生活していることがわかりました。しかし、希望の光は、簡単な血液検査で、人の体内のどの臓器が急速に老化しているかを知ることができ、臨床症状が現れる前に治療介入をできるかもしれないということです。「健康であるように見える人の臓器の生物学的な年齢を推定することができます。それは、その人のその臓器に関連した病気のリスクを予測します。」と、研究の主要著者であるスタンフォード大学のトニー・ワイスコレイ博士(Tony Wyss-Coray, PhD)は述べています。ハミルトン・オー氏(Hamilton Oh)とジャロッド・ラトリッジ氏(Jarod Rutledge)は、ワイスコレイ博士の研究室の大学院生であり、この研究の主要著者です。この研究は2023年12月6日にNature誌オンラインで発表されました。オープンアクセスの論文は「(プラズマプロテオームの臓器老化シグネチャが健康と病気を追跡する」Organ Aging Signatures in the Plasma Proteome Track Health and Disease)と題されています。
生物学的年齢対年齢
「多くの研究が、個々の生物学的年齢を表す単一の数字を提供してきました。これは、洗練されたバイオマーカーの配列によって示される年齢であり、実際に生まれてから経過した年数である
私たちの体のパーツが壊れる速度は、部位によって異なります。スタンフォード医学の研究者らが主導した5,678人の研究によると、私たちの臓器は異なる速度で老化していることが示されました。ある臓器の老化が、同年齢の他の人々の同じ臓器と比較して特に進んでいる場合、その臓器を持つ人は、その臓器に関連した病気や死亡のリスクが高まるとされています。研究によると、50歳以上の健康な大人の約5人に1人が、少なくとも1つの臓器が顕著に加速して老化している状態で生活していることがわかりました。しかし、希望の光は、簡単な血液検査で、人の体内のどの臓器が急速に老化しているかを知ることができ、臨床症状が現れる前に治療介入をできるかもしれないということです。「健康であるように見える人の臓器の生物学的な年齢を推定することができます。それは、その人のその臓器に関連した病気のリスクを予測します。」と、研究の主要著者であるスタンフォード大学のトニー・ワイスコレイ博士(Tony Wyss-Coray, PhD)は述べています。ハミルトン・オー氏(Hamilton Oh)とジャロッド・ラトリッジ氏(Jarod Rutledge)は、ワイスコレイ博士の研究室の大学院生であり、この研究の主要著者です。この研究は2023年12月6日にNature誌オンラインで発表されました。オープンアクセスの論文は「(プラズマプロテオームの臓器老化シグネチャが健康と病気を追跡する」Organ Aging Signatures in the Plasma Proteome Track Health and Disease)と題されています。
生物学的年齢対年齢
「多くの研究が、個々の生物学的年齢を表す単一の数字を提供してきました。これは、洗練されたバイオマーカーの配列によって示される年齢であり、実際に生まれてから経過した年数である
アシナガバチの行動研究が示す、社会性と認知能力の進化的関連
 アシナガバチの社会的相互作用は動物を賢くする可能性があることが新研究で明らかになりました。この研究は、個体を識別する能力と社会的協力との間に進化的な関連があるという行動的証拠を提供しています。さらに、互いを認識し、より多く協力するハチの集団は、学習、記憶、視覚といった認知能力に関連する脳の領域で、最近の適応(正の選択)があったことをゲノムシーケンシングが明らかにしました。この研究は、アシナガバチ(Polistes fuscatus)の2つの異なる集団に焦点を当てています。一つは、個体が外見上より均一なルイジアナ州の南部の集団、もう一つは、個体が顔に多様な色のパターンを持つニューヨーク州イサカの北部の集団です。一連の実験により、南部の集団とは異なり、北部の集団は個体を認識し、一部のメンバーと社会的に協力していることが示されました。「北部の集団における認知、学習、記憶に対する強い最近の正の選択の証拠は、南部の集団と比較してはるかに強い」と、コーネル大学の神経生物学と行動の准教授であるマイケル・シーハン博士(Michael Sheehan, PhD)は述べています。北部と南部の集団は同じ種であるにもかかわらず、外見は大きく異なります。南部のアシナガバチは、顔に非常に類似した赤い色のパターンを持ちます。一方、北部のものは黒と黄色のパターンを持ちます。
「北に行くほど、個体の色のパターンが多様になります。カロライナ辺りから大きく変わり始め、北に行くほどさらに多様になります」とシーハン博士は言います。イサカの集団では、各個体はかなり特徴的です。イサカの集団に対する行動研究は実験室で行われ、その後ルイジアナの他の集団にも行われました。4日間にわたり、ハチは見知らぬハチに編入され、その攻撃性のレベルが記録されました。アシナガバチが初めて出会うとき、彼らはしばしば噛みついたり平手打ちで
アシナガバチの社会的相互作用は動物を賢くする可能性があることが新研究で明らかになりました。この研究は、個体を識別する能力と社会的協力との間に進化的な関連があるという行動的証拠を提供しています。さらに、互いを認識し、より多く協力するハチの集団は、学習、記憶、視覚といった認知能力に関連する脳の領域で、最近の適応(正の選択)があったことをゲノムシーケンシングが明らかにしました。この研究は、アシナガバチ(Polistes fuscatus)の2つの異なる集団に焦点を当てています。一つは、個体が外見上より均一なルイジアナ州の南部の集団、もう一つは、個体が顔に多様な色のパターンを持つニューヨーク州イサカの北部の集団です。一連の実験により、南部の集団とは異なり、北部の集団は個体を認識し、一部のメンバーと社会的に協力していることが示されました。「北部の集団における認知、学習、記憶に対する強い最近の正の選択の証拠は、南部の集団と比較してはるかに強い」と、コーネル大学の神経生物学と行動の准教授であるマイケル・シーハン博士(Michael Sheehan, PhD)は述べています。北部と南部の集団は同じ種であるにもかかわらず、外見は大きく異なります。南部のアシナガバチは、顔に非常に類似した赤い色のパターンを持ちます。一方、北部のものは黒と黄色のパターンを持ちます。
「北に行くほど、個体の色のパターンが多様になります。カロライナ辺りから大きく変わり始め、北に行くほどさらに多様になります」とシーハン博士は言います。イサカの集団では、各個体はかなり特徴的です。イサカの集団に対する行動研究は実験室で行われ、その後ルイジアナの他の集団にも行われました。4日間にわたり、ハチは見知らぬハチに編入され、その攻撃性のレベルが記録されました。アシナガバチが初めて出会うとき、彼らはしばしば噛みついたり平手打ちで
空間細胞アトラスによる人間の手足の指の発達に関する新たな発見
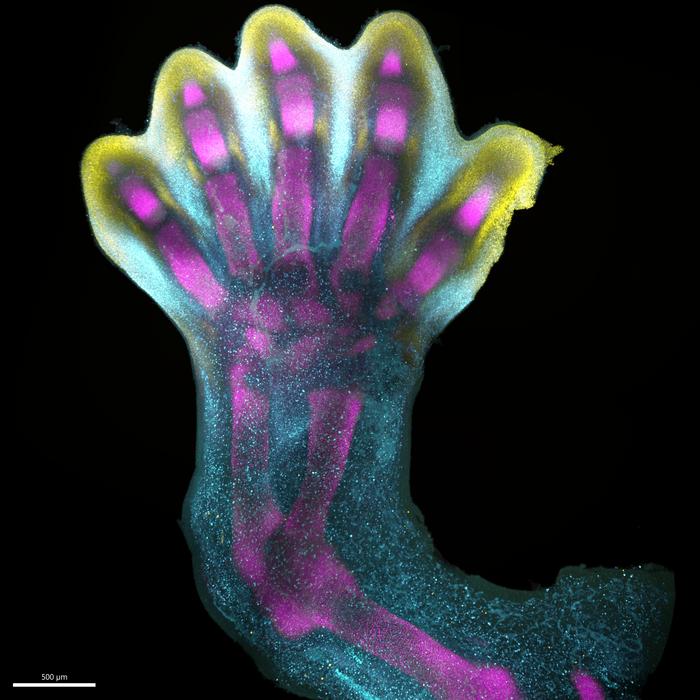 ヒトの四肢発達に関する前例のない洞察が報告されました。これには、四肢の形成を制御する多くの複雑なプロセスが含まれています。ヒトの手足の指は外側に成長するのではなく、より大きな基礎的な芽から内側に形成されます。この過程では、間にある細胞が後退し、その下にある指を明らかにします。これは、研究者らが時間と空間で解決されたヒトの四肢の発達全体の空間細胞アトラスを初めて公開する中で捉えられた多くのプロセスの中の一つです。ウェルカム・サンガー研究所(Wellcome Sanger Institute)、中山大学(Sun Yat-sen University)、欧州バイオインフォマティクス研究所(EMBL's European Bioinformatics Institute)の研究者らとその共同研究者らは、最先端のシングルセル(Single-cell)および空間テクノロジーを使用して、初期のヒトの四肢の細胞ランドスケープを特徴づけるアトラスを作成し、細胞の正確な位置を特定しました。この研究は、ヒトの体のすべての細胞タイプをマッピングすることを目的とした国際的な「ヒューマン・セル・アトラス(Human Cell Atlas)」イニシアチブの一環です。このアトラスは、2023年12月6日に「Nature」誌に掲載され、「空間と時間で解決されたヒト胚四肢細胞アトラス(A Human Embryonic Limb Cell Atlas Resolved in Space and Time)」と題された論文で提供される公開リソースで、四肢の急速な発達を制御する複雑なプロセスを捉えています。このオープンアクセスの論文では、発達中の細胞と一部の先天性四肢症候群(例えば、短い指や余分な指)との新たな関連も明らかにされています。
四肢は、当初は体の側面に特定の形や機能を持たない未分化の細
ヒトの四肢発達に関する前例のない洞察が報告されました。これには、四肢の形成を制御する多くの複雑なプロセスが含まれています。ヒトの手足の指は外側に成長するのではなく、より大きな基礎的な芽から内側に形成されます。この過程では、間にある細胞が後退し、その下にある指を明らかにします。これは、研究者らが時間と空間で解決されたヒトの四肢の発達全体の空間細胞アトラスを初めて公開する中で捉えられた多くのプロセスの中の一つです。ウェルカム・サンガー研究所(Wellcome Sanger Institute)、中山大学(Sun Yat-sen University)、欧州バイオインフォマティクス研究所(EMBL's European Bioinformatics Institute)の研究者らとその共同研究者らは、最先端のシングルセル(Single-cell)および空間テクノロジーを使用して、初期のヒトの四肢の細胞ランドスケープを特徴づけるアトラスを作成し、細胞の正確な位置を特定しました。この研究は、ヒトの体のすべての細胞タイプをマッピングすることを目的とした国際的な「ヒューマン・セル・アトラス(Human Cell Atlas)」イニシアチブの一環です。このアトラスは、2023年12月6日に「Nature」誌に掲載され、「空間と時間で解決されたヒト胚四肢細胞アトラス(A Human Embryonic Limb Cell Atlas Resolved in Space and Time)」と題された論文で提供される公開リソースで、四肢の急速な発達を制御する複雑なプロセスを捉えています。このオープンアクセスの論文では、発達中の細胞と一部の先天性四肢症候群(例えば、短い指や余分な指)との新たな関連も明らかにされています。
四肢は、当初は体の側面に特定の形や機能を持たない未分化の細
欧州研究評議会が神経変性疾患研究を支援:TDP-43タンパク質の画期的研究
 私たちの体のすべての細胞に存在し、生化学的プロセスに重要な役割を果たすタンパク質TDP-43。しかし、このタンパク質は脳内で大きな塊になることがあり、アルツハイマー病やその他の認知症などの変性疾患を引き起こす可能性があります。これがどのようにして起こるのか、そしてこれらのタンパク質の塊が病気にどのように関連しているのかは、注目の研究対象です。ドロテーエ・ドルマン博士(Dorothee Dormann, PhD)は、ヨハネス・グーテンベルク大学マインツ(JGU)の分子細胞生物学の教授であり、マインツ分子生物学研究所(IMB)の非常勤ディレクターでもあります。彼女は、健康な細胞内でもこれらのタンパク質が組み立てられる可能性があり、そのような小規模な組み立てがTDP-43タンパク質の正常な機能に重要であると疑っています。彼女の研究グループは、TDPアセンブリプロジェクトにおいて、これらの組み立てがなぜ起こるのかを調査しています。このプロジェクトに対して、欧州研究評議会(ERC)からERCコンソリデーターグラントとして約200万ユーロ(約2.157百万ドル)が授与されました。これはEUの最も権威ある賞の一つで、画期的な研究に取り組む優れた個々の科学者に授与されます。
細胞内の調節過程において小規模なTDPタンパク質の集合体が重要
ドルマン博士の予備研究は、TDP-43タンパク質の小さな集合体が、遺伝子情報の読み取りやRNAの生成など、細胞の調節過程で重要な役割を果たす可能性を示しています。彼女は合成生物学の方法を用いて、様々なTDP-43の集合体を人工的に引き起こし、それによって細胞内で起こる変化を調査することを目指しています。「健康な細胞での正常な集合体形成プロセスと、集合体が大きすぎたり固すぎたりすることで変性疾患につながる変化を理解することが目標です」とドルマン博士は
私たちの体のすべての細胞に存在し、生化学的プロセスに重要な役割を果たすタンパク質TDP-43。しかし、このタンパク質は脳内で大きな塊になることがあり、アルツハイマー病やその他の認知症などの変性疾患を引き起こす可能性があります。これがどのようにして起こるのか、そしてこれらのタンパク質の塊が病気にどのように関連しているのかは、注目の研究対象です。ドロテーエ・ドルマン博士(Dorothee Dormann, PhD)は、ヨハネス・グーテンベルク大学マインツ(JGU)の分子細胞生物学の教授であり、マインツ分子生物学研究所(IMB)の非常勤ディレクターでもあります。彼女は、健康な細胞内でもこれらのタンパク質が組み立てられる可能性があり、そのような小規模な組み立てがTDP-43タンパク質の正常な機能に重要であると疑っています。彼女の研究グループは、TDPアセンブリプロジェクトにおいて、これらの組み立てがなぜ起こるのかを調査しています。このプロジェクトに対して、欧州研究評議会(ERC)からERCコンソリデーターグラントとして約200万ユーロ(約2.157百万ドル)が授与されました。これはEUの最も権威ある賞の一つで、画期的な研究に取り組む優れた個々の科学者に授与されます。
細胞内の調節過程において小規模なTDPタンパク質の集合体が重要
ドルマン博士の予備研究は、TDP-43タンパク質の小さな集合体が、遺伝子情報の読み取りやRNAの生成など、細胞の調節過程で重要な役割を果たす可能性を示しています。彼女は合成生物学の方法を用いて、様々なTDP-43の集合体を人工的に引き起こし、それによって細胞内で起こる変化を調査することを目指しています。「健康な細胞での正常な集合体形成プロセスと、集合体が大きすぎたり固すぎたりすることで変性疾患につながる変化を理解することが目標です」とドルマン博士は
細胞外小胞を通じた胎盤と胎児脳のコミュニケーションの秘密
 ミズーリ大学獣医学部のバイオメディカルサイエンス教授であるシェリル・ローゼンフェルド博士(Cheryl Rosenfeld, DVM, PhD)は、30年にわたり、妊娠中に母親から赤ちゃんに生物学的情報がどのように伝達されるかについて研究してきました。この研究はローゼンフェルド博士にとって個人的な理由によるものです。彼女の姪であるサラ(Sara)は健康に生まれた様に見えましたが、胎児期に鎮静剤を投与されたことが原因で、サラは10代になると呼吸器系、神経系などの健康問題を抱えてしまいました。「私の姪、サラに起こったことを元に戻すことはできませんが、妊娠中に生物学的情報がどのように運ばれるかをもっと知ることで、他の子どもたちに同じようなことが起こるのを防ぐことができるかもしれません。胎児の脳の発達異常を早期に特定できれば、赤ちゃんの生活で後に現れる可能性のある障害の診断も早くなります。」と、ローゼンフェルド博士は言います。
胎盤は、妊娠中に子宮内で発達する器官で、重要な役割を担っています。胎盤は、妊娠中にタンパク質、脂質、マイクロRNA、神経伝達物質を胎児の脳に転送することで、胎児が母親とコミュニケーションを取ることを可能にします。ローゼンフェルド博士の最近の研究により、研究者らは、この生物学的情報が発達する脳にどのように送られるかを正確に学ぶことができるようになりました。
ローゼンフェルド博士は、胎盤細胞によって生成される細胞外小胞(EV)が、重要な生物学的情報を胎盤から新生中のニューロンに輸送する「発送・取扱」の保護メカニズムとして機能することを発見しました。
この発見は、自閉症スペクトラム障害(ASD)や統合失調症などの神経学的障害の早期診断につながる可能性があります。
「私たちは長い間、胎盤と胎児の脳の間でどのような情報がやり取りされるかを知っていましたが、
ミズーリ大学獣医学部のバイオメディカルサイエンス教授であるシェリル・ローゼンフェルド博士(Cheryl Rosenfeld, DVM, PhD)は、30年にわたり、妊娠中に母親から赤ちゃんに生物学的情報がどのように伝達されるかについて研究してきました。この研究はローゼンフェルド博士にとって個人的な理由によるものです。彼女の姪であるサラ(Sara)は健康に生まれた様に見えましたが、胎児期に鎮静剤を投与されたことが原因で、サラは10代になると呼吸器系、神経系などの健康問題を抱えてしまいました。「私の姪、サラに起こったことを元に戻すことはできませんが、妊娠中に生物学的情報がどのように運ばれるかをもっと知ることで、他の子どもたちに同じようなことが起こるのを防ぐことができるかもしれません。胎児の脳の発達異常を早期に特定できれば、赤ちゃんの生活で後に現れる可能性のある障害の診断も早くなります。」と、ローゼンフェルド博士は言います。
胎盤は、妊娠中に子宮内で発達する器官で、重要な役割を担っています。胎盤は、妊娠中にタンパク質、脂質、マイクロRNA、神経伝達物質を胎児の脳に転送することで、胎児が母親とコミュニケーションを取ることを可能にします。ローゼンフェルド博士の最近の研究により、研究者らは、この生物学的情報が発達する脳にどのように送られるかを正確に学ぶことができるようになりました。
ローゼンフェルド博士は、胎盤細胞によって生成される細胞外小胞(EV)が、重要な生物学的情報を胎盤から新生中のニューロンに輸送する「発送・取扱」の保護メカニズムとして機能することを発見しました。
この発見は、自閉症スペクトラム障害(ASD)や統合失調症などの神経学的障害の早期診断につながる可能性があります。
「私たちは長い間、胎盤と胎児の脳の間でどのような情報がやり取りされるかを知っていましたが、
皮膚自己免疫疾患治療に革命をもたらす特定免疫細胞の除去法を開発
 皮膚自己免疫疾患を引き起こす免疫細胞を取り除き、感染症やがんと戦う保護細胞には影響を与えない新しい方法について画期的な研究が発表されました。メルボルン大学ドハーティ研究所 研究室主任兼免疫学テーマリーダーのローラ・マッケイ教授(Laura Mackay)が率いる研究チームは、異なるタイプの免疫細胞を制御する異なるメカニズムを発見し、これらのメカニズムを正確にターゲットにすることで、「問題の細胞」を選択的に排除し、皮膚の免疫環境を再構築できることを見出しました。私たちの皮膚には、感染症やがんに対抗し、治癒を促進する特殊な免疫細胞が詰まっています。これらの細胞は、組織に留まるメモリーT細胞と呼ばれ、感染症や皮膚のがん細胞と戦うためにその場に留まります。しかし、これらの皮膚メモリーT細胞の一部が適切に制御されない場合、乾癬や白斑病などの自己免疫疾患に寄与してしまうことがあります。メルボルン大学 ドハーティ研究所・マッケイ研究室の名誉研究員および元博士研究員のシモーネ・パーク博士(Simone Park, PhD)は、この研究の主要著者であり、動物モデルにおける皮膚メモリーT細胞のさまざまなタイプを制御するユニークな要素を初めて解明ました。これにより、潜在的な治療戦略のための正確なターゲットが提供されることになります。
「私たちの皮膚に存在する特殊な免疫細胞は多様です。多くは感染症やがんの予防に不可欠ですが、他の細胞は自己免疫疾患の媒介に大きな役割を果たしています。私たちは、皮膚T細胞の異なるタイプがどのように制御されているかの重要な違いを発見し、皮膚の免疫環境をターゲットにした方法で正確に編集することができました。」とパーク博士は述べています。
メルボルン大学 ドハーティ研究所のマッケイ研究室のシニアリサーチオフィサーおよび共同第一著者のスーザン・クリスト博士(Susan
皮膚自己免疫疾患を引き起こす免疫細胞を取り除き、感染症やがんと戦う保護細胞には影響を与えない新しい方法について画期的な研究が発表されました。メルボルン大学ドハーティ研究所 研究室主任兼免疫学テーマリーダーのローラ・マッケイ教授(Laura Mackay)が率いる研究チームは、異なるタイプの免疫細胞を制御する異なるメカニズムを発見し、これらのメカニズムを正確にターゲットにすることで、「問題の細胞」を選択的に排除し、皮膚の免疫環境を再構築できることを見出しました。私たちの皮膚には、感染症やがんに対抗し、治癒を促進する特殊な免疫細胞が詰まっています。これらの細胞は、組織に留まるメモリーT細胞と呼ばれ、感染症や皮膚のがん細胞と戦うためにその場に留まります。しかし、これらの皮膚メモリーT細胞の一部が適切に制御されない場合、乾癬や白斑病などの自己免疫疾患に寄与してしまうことがあります。メルボルン大学 ドハーティ研究所・マッケイ研究室の名誉研究員および元博士研究員のシモーネ・パーク博士(Simone Park, PhD)は、この研究の主要著者であり、動物モデルにおける皮膚メモリーT細胞のさまざまなタイプを制御するユニークな要素を初めて解明ました。これにより、潜在的な治療戦略のための正確なターゲットが提供されることになります。
「私たちの皮膚に存在する特殊な免疫細胞は多様です。多くは感染症やがんの予防に不可欠ですが、他の細胞は自己免疫疾患の媒介に大きな役割を果たしています。私たちは、皮膚T細胞の異なるタイプがどのように制御されているかの重要な違いを発見し、皮膚の免疫環境をターゲットにした方法で正確に編集することができました。」とパーク博士は述べています。
メルボルン大学 ドハーティ研究所のマッケイ研究室のシニアリサーチオフィサーおよび共同第一著者のスーザン・クリスト博士(Susan
バンドウイルカの秘められた感覚:電場を感知する驚異の能力
 尾先から生まれたバンドウイルカの子どもは、そのクジラのような鼻に沿って2列の細いひげを備えています。これはアザラシの触覚に敏感なひげとよく似ています。しかし、これらのひげは出生後まもなく抜け落ち、若いイルカには「振動孔」として知られる一連のくぼみが残ります。最近、ドイツのロストック大学のティム・ヒュットナー氏(Tim Hüttner)とギド・デーンハルト氏(Guido Dehnhardt)は、これらのくぼみが単なる遺物以上のものかもしれないと疑い始めました。成体のバンドウイルカは弱い電場を感知できるのでしょうか?最初に詳しく見てみると、残っているくぼみはサメが電場を検出するのに役立つ構造に似ていることに気づきました。そして、彼らが飼育下のバンドウイルカが水中の電場を感知できるかどうかを調べたところ、すべての動物が電場を感じ取りました。「それは非常に印象的だった」とデーンハルト氏は言います。バンドウイルカが水中の生物が生成する電場にどれほど敏感であるかを知るために、デーンハルト氏とヒュットナー氏は、ニュルンベルク動物園のロレンツォ・フォン・フェルセン氏(Lorenzo von Fersen)と、ロストック大学のラース・ミールシュ氏(Lars Miersch)と協力しました。まず、彼らは2頭のバンドウイルカ、ドナとドリーに異なる電場への感度を試験しました。これは、イルカが砂の海底に埋まった魚を検出できるかどうかを知るためです。まず、各動物に水中の金属棒に顎を休めるように訓練し、イルカに5秒以内に電場を感じたら泳ぎ去るように教えました。この電場は、イルカの鼻先のすぐ上に配置された電極によって生成されました。チームは500μV/cmから2μV/cmまで電場を徐々に減少させ、イルカが指示に従って出発した回数を記録しました。
彼らは感銘を受けました。ドナとドリーは、最も強い電場に
尾先から生まれたバンドウイルカの子どもは、そのクジラのような鼻に沿って2列の細いひげを備えています。これはアザラシの触覚に敏感なひげとよく似ています。しかし、これらのひげは出生後まもなく抜け落ち、若いイルカには「振動孔」として知られる一連のくぼみが残ります。最近、ドイツのロストック大学のティム・ヒュットナー氏(Tim Hüttner)とギド・デーンハルト氏(Guido Dehnhardt)は、これらのくぼみが単なる遺物以上のものかもしれないと疑い始めました。成体のバンドウイルカは弱い電場を感知できるのでしょうか?最初に詳しく見てみると、残っているくぼみはサメが電場を検出するのに役立つ構造に似ていることに気づきました。そして、彼らが飼育下のバンドウイルカが水中の電場を感知できるかどうかを調べたところ、すべての動物が電場を感じ取りました。「それは非常に印象的だった」とデーンハルト氏は言います。バンドウイルカが水中の生物が生成する電場にどれほど敏感であるかを知るために、デーンハルト氏とヒュットナー氏は、ニュルンベルク動物園のロレンツォ・フォン・フェルセン氏(Lorenzo von Fersen)と、ロストック大学のラース・ミールシュ氏(Lars Miersch)と協力しました。まず、彼らは2頭のバンドウイルカ、ドナとドリーに異なる電場への感度を試験しました。これは、イルカが砂の海底に埋まった魚を検出できるかどうかを知るためです。まず、各動物に水中の金属棒に顎を休めるように訓練し、イルカに5秒以内に電場を感じたら泳ぎ去るように教えました。この電場は、イルカの鼻先のすぐ上に配置された電極によって生成されました。チームは500μV/cmから2μV/cmまで電場を徐々に減少させ、イルカが指示に従って出発した回数を記録しました。
彼らは感銘を受けました。ドナとドリーは、最も強い電場に
免疫システムを出し抜く:病原体が細胞に侵入する驚異的な方法
 インディアナ大学の研究者らは、窃盗犯が家に入るために窓を割るのに似た方法で、細胞に物理的な力を使って侵入する病原体のこれまで知られていなかったプロセスを発見しました。これは、感染を防ぐための体の免疫防御を突破するものです。これは、結核、マラリア、クラミジアなど、壊滅的な感染症を引き起こす細胞内病原体に対する戦いにおいて、潜在的なゲームチェンジャーを紹介しています。これらの病気は、病原体が宿主細胞内に保護されているため、治療が非常に困難です。「私たちの研究は、代表的な病原体であるトキソプラズマを使用し、一部の細胞内病原体が宿主細胞への侵入時に物理的な力を適用し、その結果、病原体が分解を回避し、細胞内で生存することを示しています。この研究は、病原体の運動性を標的とすることが、細胞内の感染と戦うための新しい方法である可能性を示唆しています。」と、インディアナ大学ブルーミントン校のアーツアンドサイエンスカレッジの化学科の教授、ヤン・ユウ博士(Yan Yu, PhD)は述べています。通常、侵入する病原体が貪食細胞(細菌、ウイルス、その他の異物を破壊する責任のある白血球の一種)に遭遇すると、貪食細胞に捕らえられて摂取されます。このプロセスから逃れる病原体については、それらの病原体が細胞内の分解機構を「麻痺」させる「秘密の武器庫」を放出しなければならないと一般的に考えられています。しかしながら、ユウ博士の研究は、この一般的な信念は真実ではないことを示しています。
彼女と共同研究者は、病原体が免疫細胞内で摂取されることを避けるために「推進力」を発揮することができることを発見しました。この力強い侵入により、病原体はこれらの浸潤者を分解する能力を欠いた液胞へと転移されます。液胞とは、細胞内での貯蔵や消化のために予約された構造です。この研究を行うために、ユウ博士と同僚らは、マウス由来の細胞
インディアナ大学の研究者らは、窃盗犯が家に入るために窓を割るのに似た方法で、細胞に物理的な力を使って侵入する病原体のこれまで知られていなかったプロセスを発見しました。これは、感染を防ぐための体の免疫防御を突破するものです。これは、結核、マラリア、クラミジアなど、壊滅的な感染症を引き起こす細胞内病原体に対する戦いにおいて、潜在的なゲームチェンジャーを紹介しています。これらの病気は、病原体が宿主細胞内に保護されているため、治療が非常に困難です。「私たちの研究は、代表的な病原体であるトキソプラズマを使用し、一部の細胞内病原体が宿主細胞への侵入時に物理的な力を適用し、その結果、病原体が分解を回避し、細胞内で生存することを示しています。この研究は、病原体の運動性を標的とすることが、細胞内の感染と戦うための新しい方法である可能性を示唆しています。」と、インディアナ大学ブルーミントン校のアーツアンドサイエンスカレッジの化学科の教授、ヤン・ユウ博士(Yan Yu, PhD)は述べています。通常、侵入する病原体が貪食細胞(細菌、ウイルス、その他の異物を破壊する責任のある白血球の一種)に遭遇すると、貪食細胞に捕らえられて摂取されます。このプロセスから逃れる病原体については、それらの病原体が細胞内の分解機構を「麻痺」させる「秘密の武器庫」を放出しなければならないと一般的に考えられています。しかしながら、ユウ博士の研究は、この一般的な信念は真実ではないことを示しています。
彼女と共同研究者は、病原体が免疫細胞内で摂取されることを避けるために「推進力」を発揮することができることを発見しました。この力強い侵入により、病原体はこれらの浸潤者を分解する能力を欠いた液胞へと転移されます。液胞とは、細胞内での貯蔵や消化のために予約された構造です。この研究を行うために、ユウ博士と同僚らは、マウス由来の細胞
なぜリーシュマニア症は痛みを伴わないのか?寄生虫疾患の痛みの知覚に関する新発見
 初めて、研究者らはリーシュマニア症による変形性の皮膚病変がなぜ痛みを伴わないのかを解明し始めました。感染していないマウスと比較して、リーシュマニア症の病変を持つマウスの皮膚を分析し、異なる代謝シグナル経路を検出しました。結果として、この病気を引き起こす寄生虫が痛みの知覚を変化させることが示唆されています。これは、治療の遅延と自らの生存を促進するための方法と考えられています。「なぜこれらの病変が無痛なのか誰も知らないが、寄生虫が何らかの方法で宿主の生理系を操作していると考えられています。私たちのデータに基づくと、寄生虫が何かをして痛みを抑制する経路を引き起こしています。それがどのように行われているかは、まだ調査中です。」と、研究の主要著者でありオハイオ州立大学医学部の病理学教授であるアバイ・サトスカル博士(Abhay Satoskar, MD, PhD)は述べています。この寄生虫性疾患の理解を深めることは、毎年新たに100万人の患者に影響を与えているだけでなく、新しい非麻薬性の疼痛薬の開発につながる可能性があります。「寄生虫の存在によって生産されている可能性のある分子は、他の健康問題に対する鎮痛剤の可能性があると私たちは仮説を立てています」とサトスカル博士は述べています。
この研究は2023年11月21日にiScienceに掲載されました。オープンアクセスの論文は「リーシュマニア・メキシカーナによる皮膚病変における痛みを軽減するメタボロミクスの再プログラミングを促進する(Leishmania mexicana Promotes Pain-Reducing Metabolomic Reprogramming in Cutaneous Lesions)」と題されています。リーシュマニア症の病変が痛みを伴わない理由についての疑問は、長年科学者たちを悩ませてきました。特に、水痘
初めて、研究者らはリーシュマニア症による変形性の皮膚病変がなぜ痛みを伴わないのかを解明し始めました。感染していないマウスと比較して、リーシュマニア症の病変を持つマウスの皮膚を分析し、異なる代謝シグナル経路を検出しました。結果として、この病気を引き起こす寄生虫が痛みの知覚を変化させることが示唆されています。これは、治療の遅延と自らの生存を促進するための方法と考えられています。「なぜこれらの病変が無痛なのか誰も知らないが、寄生虫が何らかの方法で宿主の生理系を操作していると考えられています。私たちのデータに基づくと、寄生虫が何かをして痛みを抑制する経路を引き起こしています。それがどのように行われているかは、まだ調査中です。」と、研究の主要著者でありオハイオ州立大学医学部の病理学教授であるアバイ・サトスカル博士(Abhay Satoskar, MD, PhD)は述べています。この寄生虫性疾患の理解を深めることは、毎年新たに100万人の患者に影響を与えているだけでなく、新しい非麻薬性の疼痛薬の開発につながる可能性があります。「寄生虫の存在によって生産されている可能性のある分子は、他の健康問題に対する鎮痛剤の可能性があると私たちは仮説を立てています」とサトスカル博士は述べています。
この研究は2023年11月21日にiScienceに掲載されました。オープンアクセスの論文は「リーシュマニア・メキシカーナによる皮膚病変における痛みを軽減するメタボロミクスの再プログラミングを促進する(Leishmania mexicana Promotes Pain-Reducing Metabolomic Reprogramming in Cutaneous Lesions)」と題されています。リーシュマニア症の病変が痛みを伴わない理由についての疑問は、長年科学者たちを悩ませてきました。特に、水痘
加齢は表皮角化細胞の細胞外小胞内マイクロRNAを変化させることが判明
 人間の肌は年を重ねるごとに様々な変化を迎えますが、これらの変化の背景には細胞間コミュニケーションの乱れがあります。特に影響を受けるのが、肌の最外層を形成する表皮角化細胞です。細胞同士が情報を交換する際に重要な役割を果たすのが細胞外小胞(EV)で、老化と共にこれらのコミュニケーション手段に変化が生じ、肌の保護機能や修復能力への影響が懸念されます。リヨン大学、東洋大学、ガトフォッセ社の研究チームが行った最新の研究では、加齢が表皮角化細胞から放出される細胞外小胞の性質にどう影響するかが明らかにされました。この研究では、細胞外小胞内のマイクロRNAの変化に特に焦点を当て、この発見が老化プロセスのより深い理解につながり、将来的には老化に伴う肌の問題に対する新たな治療法の開発へと繋がる可能性があります。
細胞外小胞に含まれるマイクロRNAは、細胞の行動を調節する上で重要な役割を果たします。研究チームは特に、miR-30aというマイクロRNAが加齢に伴い豊富になることを発見しました。miR-30aは肌のバリア機能の維持に不可欠な調節因子であり、その増加が加齢に伴う肌の機能的変化に寄与する可能性があります。細胞間コミュニケーションの健全性は、表皮の健康維持において極めて重要です。細胞外小胞を通じた正確な情報伝達は、細胞の成長、分化、修復プロセスを調節します。老化によるこのコミュニケーションプロセスの変化を理解することは、肌の老化を遅らせ、健康を保つための新しい戦略を開発するための鍵となります。この研究は、老化と細胞間コミュニケーションの複雑な関係を解明する一歩として、大きな意義を持ちます。
細胞外小胞(EV)は、細胞が情報を伝達するために放出する微小な粒子です。これらは、細胞内のさまざまな成分を含み、近隣の細胞や遠く離れた細胞に送信され、受け取った細胞の機能を調節します。EVは、健
人間の肌は年を重ねるごとに様々な変化を迎えますが、これらの変化の背景には細胞間コミュニケーションの乱れがあります。特に影響を受けるのが、肌の最外層を形成する表皮角化細胞です。細胞同士が情報を交換する際に重要な役割を果たすのが細胞外小胞(EV)で、老化と共にこれらのコミュニケーション手段に変化が生じ、肌の保護機能や修復能力への影響が懸念されます。リヨン大学、東洋大学、ガトフォッセ社の研究チームが行った最新の研究では、加齢が表皮角化細胞から放出される細胞外小胞の性質にどう影響するかが明らかにされました。この研究では、細胞外小胞内のマイクロRNAの変化に特に焦点を当て、この発見が老化プロセスのより深い理解につながり、将来的には老化に伴う肌の問題に対する新たな治療法の開発へと繋がる可能性があります。
細胞外小胞に含まれるマイクロRNAは、細胞の行動を調節する上で重要な役割を果たします。研究チームは特に、miR-30aというマイクロRNAが加齢に伴い豊富になることを発見しました。miR-30aは肌のバリア機能の維持に不可欠な調節因子であり、その増加が加齢に伴う肌の機能的変化に寄与する可能性があります。細胞間コミュニケーションの健全性は、表皮の健康維持において極めて重要です。細胞外小胞を通じた正確な情報伝達は、細胞の成長、分化、修復プロセスを調節します。老化によるこのコミュニケーションプロセスの変化を理解することは、肌の老化を遅らせ、健康を保つための新しい戦略を開発するための鍵となります。この研究は、老化と細胞間コミュニケーションの複雑な関係を解明する一歩として、大きな意義を持ちます。
細胞外小胞(EV)は、細胞が情報を伝達するために放出する微小な粒子です。これらは、細胞内のさまざまな成分を含み、近隣の細胞や遠く離れた細胞に送信され、受け取った細胞の機能を調節します。EVは、健
MITシンポジウムが示す、グライコバイオロジーの未来
 狭義において、グライコバイオロジーは、すべての生物に存在する糖質と糖コートされた分子、すなわち炭水化物の構造、生物学、および進化の研究です。マサチューセッツ工科大学(MIT)で最近開催されたシンポジウムが明らかにしたように、この分野は生命の基礎を形成する要素に対する科学者たちの理解を再形成する可能性のあるルネッサンスの真っ只中にあります。グライコバイオロジーという用語は元々、1980年代に炭水化物化学と生化学の伝統的な研究の融合を記述するために造られましたが、現在でははるかに広範で多分野にわたるアイデアを包含するようになっています。「グライコサイエンス」という言葉は、生物学や化学だけでなく、バイオエンジニアリング、医学、材料科学などに対するその広範な適用を反映し、急速に成長しているこの分野にとってより適切な名前かもしれません。「これらの糖鎖が健康と疾患において非常に重要な役割を果たしていることがますます明らかになってきています。当初は困難に思えるかもしれませんが、新しいツールの考案や新しい種類の相互作用の特定は、MITの人々が持つ創造的な問題解決能力を正に要求するものです。」とMITのノバルティス化学教授であるローラ・キースリング博士(Laura Kiessling, PhD)は述べています。
身体の糖コート
糖鎖は、基本的な生物学的機能に不可欠な、線形および分岐構造を持つ多様な分子群を含みます。知られている限り、自然界のすべての細胞はこれらの糖分子でコーティングされています。細胞表面の複雑な糖鎖の連鎖から、糖がリピッドやタンパク質に足場のように結合して形成される共役分子に至るまで、それらは生命にとって絶対に基本的です。例えば、キースリング博士は、地球上で最も豊富な有機分子は炭水化物のセルロースであると指摘しています。「精子と卵子の結合は、タンパク質と炭水化物の間の
狭義において、グライコバイオロジーは、すべての生物に存在する糖質と糖コートされた分子、すなわち炭水化物の構造、生物学、および進化の研究です。マサチューセッツ工科大学(MIT)で最近開催されたシンポジウムが明らかにしたように、この分野は生命の基礎を形成する要素に対する科学者たちの理解を再形成する可能性のあるルネッサンスの真っ只中にあります。グライコバイオロジーという用語は元々、1980年代に炭水化物化学と生化学の伝統的な研究の融合を記述するために造られましたが、現在でははるかに広範で多分野にわたるアイデアを包含するようになっています。「グライコサイエンス」という言葉は、生物学や化学だけでなく、バイオエンジニアリング、医学、材料科学などに対するその広範な適用を反映し、急速に成長しているこの分野にとってより適切な名前かもしれません。「これらの糖鎖が健康と疾患において非常に重要な役割を果たしていることがますます明らかになってきています。当初は困難に思えるかもしれませんが、新しいツールの考案や新しい種類の相互作用の特定は、MITの人々が持つ創造的な問題解決能力を正に要求するものです。」とMITのノバルティス化学教授であるローラ・キースリング博士(Laura Kiessling, PhD)は述べています。
身体の糖コート
糖鎖は、基本的な生物学的機能に不可欠な、線形および分岐構造を持つ多様な分子群を含みます。知られている限り、自然界のすべての細胞はこれらの糖分子でコーティングされています。細胞表面の複雑な糖鎖の連鎖から、糖がリピッドやタンパク質に足場のように結合して形成される共役分子に至るまで、それらは生命にとって絶対に基本的です。例えば、キースリング博士は、地球上で最も豊富な有機分子は炭水化物のセルロースであると指摘しています。「精子と卵子の結合は、タンパク質と炭水化物の間の
合成メラニンが有害な活性酸素を消去し、炎症を抑えることで、皮膚の傷の治癒を早める。
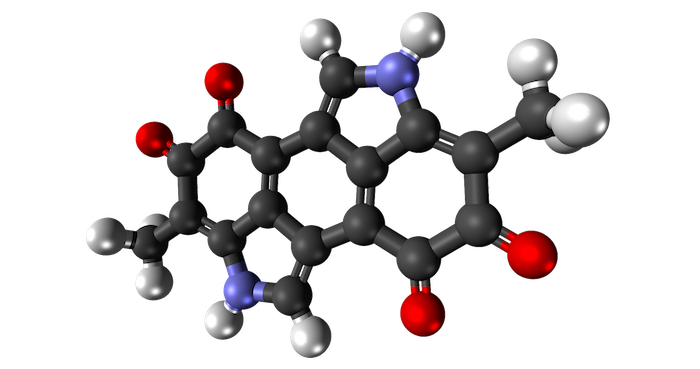 重度の皮膚損傷では、治癒が遅れることがあります。これは、反応性酸素種(ROS)の過剰産生により組織が損傷し、炎症が引き起こされるためです。人工的な抗酸化剤の創傷治療薬が試されていますが、生体適合性や投与方法に問題があります。現在、研究者らは合成メラニンを用いた皮膚損傷の治療効果を試験しています。メラニンは、髪の毛、肌、目に見られる色素として知られていますが、強力な抗酸化剤であり、フリーラジカルの捕捉剤でもあります。これにより、皮膚における自然な防御機能を提供します。研究者らは、合成メラニンが創傷治癒を促進する優れた自然な選択肢となる可能性があると仮説を立てました。2023年11月2日に公開された論文「局所的な合成メラニンの適用が組織修復を促進するメラノサイト(Topical Application of Synthetic Melanin Promotes Tissue Repair Melanocytes)」では、ノースウェスタン大学ファインバーグ医学部皮膚科のダーレン・ビヤシェフ博士(Dauren Biyashev)らは、合成メラニンを用いた治療により、皮膚損傷が著しく迅速に治癒することを報告しています。
メラニンはメラノサイトによって生産され、多くの異なる形態が存在します。皮膚では、メラニンは紫外線から保護します。また、フリーラジカルの強力な捕捉剤でもあります。活性酸素種ROSは、1つ以上の非対称電子を含むため、非常に反応性が高くなります。これらは代謝の自然な産物ですが、過剰になると細胞や組織に損傷を与えます。メラニンは電子豊富な機能基を含んでおり、ROSを無力化することで組織を有害な影響から守ります。研究者らは、皮膚自身の修復化合物の合成版を適用することで、創傷治癒を促進できると仮説を立てました。科学者たちは、ドーパミンを重合させることによって合成メラニン粒子
重度の皮膚損傷では、治癒が遅れることがあります。これは、反応性酸素種(ROS)の過剰産生により組織が損傷し、炎症が引き起こされるためです。人工的な抗酸化剤の創傷治療薬が試されていますが、生体適合性や投与方法に問題があります。現在、研究者らは合成メラニンを用いた皮膚損傷の治療効果を試験しています。メラニンは、髪の毛、肌、目に見られる色素として知られていますが、強力な抗酸化剤であり、フリーラジカルの捕捉剤でもあります。これにより、皮膚における自然な防御機能を提供します。研究者らは、合成メラニンが創傷治癒を促進する優れた自然な選択肢となる可能性があると仮説を立てました。2023年11月2日に公開された論文「局所的な合成メラニンの適用が組織修復を促進するメラノサイト(Topical Application of Synthetic Melanin Promotes Tissue Repair Melanocytes)」では、ノースウェスタン大学ファインバーグ医学部皮膚科のダーレン・ビヤシェフ博士(Dauren Biyashev)らは、合成メラニンを用いた治療により、皮膚損傷が著しく迅速に治癒することを報告しています。
メラニンはメラノサイトによって生産され、多くの異なる形態が存在します。皮膚では、メラニンは紫外線から保護します。また、フリーラジカルの強力な捕捉剤でもあります。活性酸素種ROSは、1つ以上の非対称電子を含むため、非常に反応性が高くなります。これらは代謝の自然な産物ですが、過剰になると細胞や組織に損傷を与えます。メラニンは電子豊富な機能基を含んでおり、ROSを無力化することで組織を有害な影響から守ります。研究者らは、皮膚自身の修復化合物の合成版を適用することで、創傷治癒を促進できると仮説を立てました。科学者たちは、ドーパミンを重合させることによって合成メラニン粒子
第一次世界大戦中にアイオワで孵化し、鉄道車両でアリゾナへ送られた魚はまだ生きている。
 100年以上生きる動物種は約35種しか知られておらず、そのほとんどは互いに関連していません。長寿種を3種以上含むのはセバステス属(海洋の岩魚)だけです。しかし、市民科学のコラボレーションにより、アリゾナ州に生息する淡水魚の3種が100歳以上生きることが特定されました。「バッファローフィッシュの驚異的な長寿を明らかにするアリゾナの3種の淡水魚の百年寿命」(Centenarian Lifespans of Three Freshwater Fish Species in Arizona Reveal the Exceptional Longevity of the Buffalofishes)という論文は、ミネソタ大学ダルース校のアレック・ラックマン博士(Alec R. Lackmann,PhD)らによって2023年10月20日にScientific Reports誌で公開されました。
バッファローフィッシュは北米原産で、3種(ビッグマウス・バッファローI. cyprinellus、スモールマウス・バッファローI. bubalus、ブラック・バッファローI. niger)はミシシッピ川やハドソン湾近辺に固有です。フレッシュリップ・バッファローI. labiosusはメキシコ原産、ウスマシンタ・バッファローI. meridionalisはメキシコとグアテマラ原産です。バッファローフィッシュは大きく(最大36キログラム)、19世紀後半から20世紀初頭にかけて食用として重宝されました。20世紀初頭、漁業局はバッファローフィッシュの孵化プログラムを開始し、1911年のルーズベルトダム完成後、アイオワ州のフェアポート生物学ステーションで孵化したバッファローフィッシュ(稚魚、1歳魚、成魚)420匹を鉄道でアリゾナ州のルーズベルト湖に送り、30年間商業的に漁獲されました。
次の10年
100年以上生きる動物種は約35種しか知られておらず、そのほとんどは互いに関連していません。長寿種を3種以上含むのはセバステス属(海洋の岩魚)だけです。しかし、市民科学のコラボレーションにより、アリゾナ州に生息する淡水魚の3種が100歳以上生きることが特定されました。「バッファローフィッシュの驚異的な長寿を明らかにするアリゾナの3種の淡水魚の百年寿命」(Centenarian Lifespans of Three Freshwater Fish Species in Arizona Reveal the Exceptional Longevity of the Buffalofishes)という論文は、ミネソタ大学ダルース校のアレック・ラックマン博士(Alec R. Lackmann,PhD)らによって2023年10月20日にScientific Reports誌で公開されました。
バッファローフィッシュは北米原産で、3種(ビッグマウス・バッファローI. cyprinellus、スモールマウス・バッファローI. bubalus、ブラック・バッファローI. niger)はミシシッピ川やハドソン湾近辺に固有です。フレッシュリップ・バッファローI. labiosusはメキシコ原産、ウスマシンタ・バッファローI. meridionalisはメキシコとグアテマラ原産です。バッファローフィッシュは大きく(最大36キログラム)、19世紀後半から20世紀初頭にかけて食用として重宝されました。20世紀初頭、漁業局はバッファローフィッシュの孵化プログラムを開始し、1911年のルーズベルトダム完成後、アイオワ州のフェアポート生物学ステーションで孵化したバッファローフィッシュ(稚魚、1歳魚、成魚)420匹を鉄道でアリゾナ州のルーズベルト湖に送り、30年間商業的に漁獲されました。
次の10年
新たな免疫療法戦略で自己免疫性皮膚疾患患者に希望の光
 ピーター・ドハーティ感染・免疫研究所の研究室長兼免疫学テーマリーダーであるメルボルン大学のローラ・マッケイ教授(Laura Mackay, PhD)率いる研究者らは、さまざまなタイプの免疫細胞を制御する明確なメカニズムを発見し、これらのメカニズムを正確に標的とすることで、「問題のある細胞」を選択的に排除し、皮膚の免疫景観を再構築できることを発見しました。私たちの皮膚は、感染症やがんから守り、治癒を促進する特殊な免疫細胞で満たされています。これらの細胞は組織留保記憶(tissue-resident memory)T細胞、またはTRM細胞と呼ばれ、皮膚での感染症やがん細胞と戦うためにその場に留まります。しかし、適切に制御されない場合、これらの皮膚TRM細胞の一部は、乾癬や白斑病などの自己免疫疾患に寄与する可能性があります。
メルボルン大学のシモーヌ・パーク博士(Simone Park, PhD)は、ドハーティ研究所のマッケイ研究室で名誉研究員および元博士研究員であり、この研究の主要な第一著者です。パーク博士は、この研究が動物モデルでの皮膚TRM細胞のさまざまなタイプを制御する独自の要素を記述する最初のものであり、潜在的な治療戦略のための正確な標的を提供していると述べました。
「私たちの皮膚の特殊な免疫細胞は多様です:多くは感染症とがんの予防に不可欠ですが、その他のものは自己免疫症を媒介する大きな役割を果たしています。私たちは、異なるタイプの皮膚T細胞がどのように制御されるかについての重要な違いを発見し、これにより皮膚の免疫風景を標的的に正確に編集することが可能になりました。」とパーク博士は述べています。
ドハーティ研究所のマッケイ研究室のシニアリサーチオフィサーであり、この研究の共同第一著者であるメルボルン大学のスーザン・クリスト博士(Susan Christo, P
ピーター・ドハーティ感染・免疫研究所の研究室長兼免疫学テーマリーダーであるメルボルン大学のローラ・マッケイ教授(Laura Mackay, PhD)率いる研究者らは、さまざまなタイプの免疫細胞を制御する明確なメカニズムを発見し、これらのメカニズムを正確に標的とすることで、「問題のある細胞」を選択的に排除し、皮膚の免疫景観を再構築できることを発見しました。私たちの皮膚は、感染症やがんから守り、治癒を促進する特殊な免疫細胞で満たされています。これらの細胞は組織留保記憶(tissue-resident memory)T細胞、またはTRM細胞と呼ばれ、皮膚での感染症やがん細胞と戦うためにその場に留まります。しかし、適切に制御されない場合、これらの皮膚TRM細胞の一部は、乾癬や白斑病などの自己免疫疾患に寄与する可能性があります。
メルボルン大学のシモーヌ・パーク博士(Simone Park, PhD)は、ドハーティ研究所のマッケイ研究室で名誉研究員および元博士研究員であり、この研究の主要な第一著者です。パーク博士は、この研究が動物モデルでの皮膚TRM細胞のさまざまなタイプを制御する独自の要素を記述する最初のものであり、潜在的な治療戦略のための正確な標的を提供していると述べました。
「私たちの皮膚の特殊な免疫細胞は多様です:多くは感染症とがんの予防に不可欠ですが、その他のものは自己免疫症を媒介する大きな役割を果たしています。私たちは、異なるタイプの皮膚T細胞がどのように制御されるかについての重要な違いを発見し、これにより皮膚の免疫風景を標的的に正確に編集することが可能になりました。」とパーク博士は述べています。
ドハーティ研究所のマッケイ研究室のシニアリサーチオフィサーであり、この研究の共同第一著者であるメルボルン大学のスーザン・クリスト博士(Susan Christo, P
細胞運命の解読:幹細胞スイッチの鍵となるメカニズムが判明
 幹細胞は、死んだり損傷した細胞を置き換えるために分化することができます。しかし、幹細胞はどのようにして、与えられた状況でどのタイプの細胞になるかを決定するのでしょうか?韓国の国際分子生物工学(IMBA)および基礎科学研究所のボン・キョン・クー博士(Bon-Kyoung Koo, PhD)のグループは、腸のオルガノイドを使用して、腸内の分泌細胞の発達を開始する重要な役割を果たす遺伝子、Daam1を同定しました。この発見は、2023年11月24日にScience Advancesに掲載され、がん研究に新たな展望を開きました。
このオープンアクセスの論文のタイトルは「腸のパネス細胞の分化はDaam1/2によるWntシグナリングの非対称調節に依存する」(Intestinal Paneth Cell Differentiation Relies on Asymmetric Regulation of Wnt Signaling by Daam1/2)です。
私たちの体は、ある意味で自動車のようなものです - 機能を維持するためには、定期的にチェックと修理が必要です。私たちの体の場合、損傷したり死んだ細胞は、臓器の機能を維持するために置き換える必要があります。この置き換えは、組織に住む成体幹細胞のおかげで行われます。全ての細胞タイプを形成することができる胚性幹細胞とは異なり、成体幹細胞はそれらが属する組織に見られる細胞タイプのみを形成します。しかし、組織特異的な幹細胞はどのようにしてどの細胞タイプを生じるかを知るのでしょうか?ガブリエレ・コロッツァ博士(Gabriele Colozza, PhD)は、韓国の基礎科学研究所、ゲノムエンジニアリングセンターのディレクターであるボン・キョン・クーのIMBA研究室の博士研究員として、この問題を調査するために腸の幹細胞を使用することを決めまし
幹細胞は、死んだり損傷した細胞を置き換えるために分化することができます。しかし、幹細胞はどのようにして、与えられた状況でどのタイプの細胞になるかを決定するのでしょうか?韓国の国際分子生物工学(IMBA)および基礎科学研究所のボン・キョン・クー博士(Bon-Kyoung Koo, PhD)のグループは、腸のオルガノイドを使用して、腸内の分泌細胞の発達を開始する重要な役割を果たす遺伝子、Daam1を同定しました。この発見は、2023年11月24日にScience Advancesに掲載され、がん研究に新たな展望を開きました。
このオープンアクセスの論文のタイトルは「腸のパネス細胞の分化はDaam1/2によるWntシグナリングの非対称調節に依存する」(Intestinal Paneth Cell Differentiation Relies on Asymmetric Regulation of Wnt Signaling by Daam1/2)です。
私たちの体は、ある意味で自動車のようなものです - 機能を維持するためには、定期的にチェックと修理が必要です。私たちの体の場合、損傷したり死んだ細胞は、臓器の機能を維持するために置き換える必要があります。この置き換えは、組織に住む成体幹細胞のおかげで行われます。全ての細胞タイプを形成することができる胚性幹細胞とは異なり、成体幹細胞はそれらが属する組織に見られる細胞タイプのみを形成します。しかし、組織特異的な幹細胞はどのようにしてどの細胞タイプを生じるかを知るのでしょうか?ガブリエレ・コロッツァ博士(Gabriele Colozza, PhD)は、韓国の基礎科学研究所、ゲノムエンジニアリングセンターのディレクターであるボン・キョン・クーのIMBA研究室の博士研究員として、この問題を調査するために腸の幹細胞を使用することを決めまし
蝶の目からヒントを得た新型UVセンサー:がん細胞の検出に革命
 紫外線(UV)光は可視光線(約400~700nm)よりも波長が短く(<400nm)、検出が困難です。人間の目には見えず、現在のUVセンサー技術にも限界があります。しかし、蝶の目はUVを見ることができるだけでなく、二つの補完的なUV検出メカニズムのおかげで、UVスペクトル上の異なる波長(UVA、UVB、UVC)を区別することができます。研究者らは、蝶の目を模倣した高感度UVセンサーアレイを構築しました。このセンサーには、医療用途を含む多くの潜在的な応用があります。UV光の下では、がん細胞は健康な細胞よりも強く蛍光を発しますが、このセンサーは99%の確信を持ってそれらを区別することができます。そのため、このセンサーは、手術中に腫瘍を取り除く際に、明確な縁を確保する助けになる可能性があります。
2023年11月3日に『Science Advances』に掲載された「Bioinspired, Vertically Stacked, and Perovskite Nanocrystal–Enhanced CMOS Imaging Sensors For Resolving UV Spectral Signatures(バイオインスパイアード、垂直積層、ペロブスカイトナノクリスタル強化CMOSイメージングセンサーによるUVスペクトル署名の解決)」と題されたオープンアクセスの論文で、チェン・チェン博士(Cheng Chen)らはこの研究成果を報告しました。
目
人間は三色型視覚を持っており、三種類の光受容体(赤、青、緑)があり、これらの波長の色を見ることができます。これを可視スペクトルと呼びます。ミツバチもまた三色型視覚を持っています(青、緑、UV)。しかし、蝶はもっと多くの受容体を持っており、一般的なルリツバメ(Graphium sarpedon)では最大15種類
紫外線(UV)光は可視光線(約400~700nm)よりも波長が短く(<400nm)、検出が困難です。人間の目には見えず、現在のUVセンサー技術にも限界があります。しかし、蝶の目はUVを見ることができるだけでなく、二つの補完的なUV検出メカニズムのおかげで、UVスペクトル上の異なる波長(UVA、UVB、UVC)を区別することができます。研究者らは、蝶の目を模倣した高感度UVセンサーアレイを構築しました。このセンサーには、医療用途を含む多くの潜在的な応用があります。UV光の下では、がん細胞は健康な細胞よりも強く蛍光を発しますが、このセンサーは99%の確信を持ってそれらを区別することができます。そのため、このセンサーは、手術中に腫瘍を取り除く際に、明確な縁を確保する助けになる可能性があります。
2023年11月3日に『Science Advances』に掲載された「Bioinspired, Vertically Stacked, and Perovskite Nanocrystal–Enhanced CMOS Imaging Sensors For Resolving UV Spectral Signatures(バイオインスパイアード、垂直積層、ペロブスカイトナノクリスタル強化CMOSイメージングセンサーによるUVスペクトル署名の解決)」と題されたオープンアクセスの論文で、チェン・チェン博士(Cheng Chen)らはこの研究成果を報告しました。
目
人間は三色型視覚を持っており、三種類の光受容体(赤、青、緑)があり、これらの波長の色を見ることができます。これを可視スペクトルと呼びます。ミツバチもまた三色型視覚を持っています(青、緑、UV)。しかし、蝶はもっと多くの受容体を持っており、一般的なルリツバメ(Graphium sarpedon)では最大15種類
毒は針に先行していた: ゲノム研究がハチの毒の起源に光を当てる
 多くの動物群では、毒素がそれぞれ独立して発展してきました。多くの毒性種を含む動物群の一つがハチ目(Hymenoptera)で、この昆虫目にはミツバチ、スズメバチ、アリなどの針を持つ昆虫(刺胞動物)も含まれます。ハチ目は非常に種が豊富で、ミツバチだけでも6,000種以上が存在します。しかし、ハチ目の昆虫は大きな生態学的および経済的重要性を持ちながら、その毒素の進化的発展についてはほとんど知られていません。
ゲーテ大学フランクフルトの細胞生物学&神経科学研究所の応用バイオインフォマティクスワーキンググループで現在客員研究員を務めるビョルン・フォン・ロイモント博士(Dr. Björn von Reumont)が率いる研究者らは、比較ゲノミクスを用いて、進化の過程でミツバチやその他のハチ目の重要な毒素成分がどのように発展したかを初めて体系的に調査しました。毒素は、小さなタンパク質(ペプチド)やいくつかの大きなタンパク質や酵素から構成される複雑な混合物です。刺胞動物は、特別な刺し器具を用いてこの毒性カクテルを獲物や攻撃者に積極的に注入します。
研究の第一段階で、研究者らはハチ目の毒素に最も多く含まれるペプチドやタンパク質を特定しました。これには、プロテインデータベースからの情報を参照しましたが、この情報は限られていました。さらに、彼らは野生のハナバチ2種、ムラサキヤドリバチ(Xylocopa violacea)とオオスジハリバチ(Halictus scabiosae)、そしてミツバチ(Apis mellifera)の毒素に含まれるタンパク質を分析しました。そして、分析した全てのハチ目の毒素に共通する12の「ペプチドおよびタンパク質のファミリー」が存在することを発見しました。これらは明らかにこれらの毒カクテルの「共通の成分」として存在します。
ライプニッツ生物多様性変化分析研究所
多くの動物群では、毒素がそれぞれ独立して発展してきました。多くの毒性種を含む動物群の一つがハチ目(Hymenoptera)で、この昆虫目にはミツバチ、スズメバチ、アリなどの針を持つ昆虫(刺胞動物)も含まれます。ハチ目は非常に種が豊富で、ミツバチだけでも6,000種以上が存在します。しかし、ハチ目の昆虫は大きな生態学的および経済的重要性を持ちながら、その毒素の進化的発展についてはほとんど知られていません。
ゲーテ大学フランクフルトの細胞生物学&神経科学研究所の応用バイオインフォマティクスワーキンググループで現在客員研究員を務めるビョルン・フォン・ロイモント博士(Dr. Björn von Reumont)が率いる研究者らは、比較ゲノミクスを用いて、進化の過程でミツバチやその他のハチ目の重要な毒素成分がどのように発展したかを初めて体系的に調査しました。毒素は、小さなタンパク質(ペプチド)やいくつかの大きなタンパク質や酵素から構成される複雑な混合物です。刺胞動物は、特別な刺し器具を用いてこの毒性カクテルを獲物や攻撃者に積極的に注入します。
研究の第一段階で、研究者らはハチ目の毒素に最も多く含まれるペプチドやタンパク質を特定しました。これには、プロテインデータベースからの情報を参照しましたが、この情報は限られていました。さらに、彼らは野生のハナバチ2種、ムラサキヤドリバチ(Xylocopa violacea)とオオスジハリバチ(Halictus scabiosae)、そしてミツバチ(Apis mellifera)の毒素に含まれるタンパク質を分析しました。そして、分析した全てのハチ目の毒素に共通する12の「ペプチドおよびタンパク質のファミリー」が存在することを発見しました。これらは明らかにこれらの毒カクテルの「共通の成分」として存在します。
ライプニッツ生物多様性変化分析研究所
検索アルゴリズムにより、希少なCRISPR系が新たに200種類近く発見される
 微生物の配列データベースには、バイオテクノロジーに適応可能な酵素や他の分子に関する豊富な情報が含まれています。しかし、これらのデータベースは近年非常に大きくなり、興味のある酵素を効率的に検索することが難しくなっています。現在、マサチューセッツ工科大学(MIT)のマクガバン脳研究所、MITとハーバード大学のブロード研究所、および国立衛生研究所(NIH)の国立生物工学情報センター(NCBI)の研究者らは、細菌のゲノムにおける188種類の新しい希少CRISPRシステムを特定した新しい検索アルゴリズムを開発しました。これは、数千に及ぶ個々のシステムを含んでいます。
この研究は、2023年11月23日に「Science」誌に「希少CRISPR-Casシステムの機能的多様性の深層テラスケールクラスタリングによる解明」(Uncovering the Functional Diversity of Rare CRISPR-Cas Systems with Deep Terascale Clustering)というタイトルで発表されました。
このアルゴリズムは、CRISPR研究の先駆者であるフォン・ジャン教授(Feng Zhang)の研究室から来ており、大規模なゲノムデータを迅速に検索するためのビッグデータクラスタリング手法を使用しています。チームは、石炭鉱山、醸造所、南極の湖、犬の唾液で見つかるような珍しい細菌からのデータを含む、3つの主要な公開データベースを採掘するために、Fast Locality-Sensitive Hashing-Based Clustering(FLSHclust)と呼ばれるアルゴリズムを使用しました。研究者らは、DNAに編集を加えることができるCRISPRシステムや、RNAを標的とするもの、その他さまざまな機能を持つものを含む、驚くべき数と多様性のCRISP
微生物の配列データベースには、バイオテクノロジーに適応可能な酵素や他の分子に関する豊富な情報が含まれています。しかし、これらのデータベースは近年非常に大きくなり、興味のある酵素を効率的に検索することが難しくなっています。現在、マサチューセッツ工科大学(MIT)のマクガバン脳研究所、MITとハーバード大学のブロード研究所、および国立衛生研究所(NIH)の国立生物工学情報センター(NCBI)の研究者らは、細菌のゲノムにおける188種類の新しい希少CRISPRシステムを特定した新しい検索アルゴリズムを開発しました。これは、数千に及ぶ個々のシステムを含んでいます。
この研究は、2023年11月23日に「Science」誌に「希少CRISPR-Casシステムの機能的多様性の深層テラスケールクラスタリングによる解明」(Uncovering the Functional Diversity of Rare CRISPR-Cas Systems with Deep Terascale Clustering)というタイトルで発表されました。
このアルゴリズムは、CRISPR研究の先駆者であるフォン・ジャン教授(Feng Zhang)の研究室から来ており、大規模なゲノムデータを迅速に検索するためのビッグデータクラスタリング手法を使用しています。チームは、石炭鉱山、醸造所、南極の湖、犬の唾液で見つかるような珍しい細菌からのデータを含む、3つの主要な公開データベースを採掘するために、Fast Locality-Sensitive Hashing-Based Clustering(FLSHclust)と呼ばれるアルゴリズムを使用しました。研究者らは、DNAに編集を加えることができるCRISPRシステムや、RNAを標的とするもの、その他さまざまな機能を持つものを含む、驚くべき数と多様性のCRISP
植物はどうやって光の方向を決めるのか?
 植物には視覚器官がないのに、どうやって光の来る方向を知るのでしょうか?生物学と工学の専門知識を組み合わせた画期的な研究で、ローザンヌ大学(UNIL)のクリスチャン・ファンクハウザー教授(Christian Fankhauser)が率いるチームは、ローザンヌ連邦工科大学(EPFL)の同僚と共に、光感受性植物組織が空気と水の境界の光学的特性を利用して、植物に「見える」光の勾配を生成することを明らかにしました。
この結果は、2023年11月23日にScience誌に掲載されました。論文のタイトルは「空気チャンネルが定向性光信号を生成して子葉下部の向光性を調節する」(Air Channels Create a Directional Light Signal to Regulate Hypocotyl Phototropism)です。
生物の大多数(微生物、植物、動物)は、目に相当する視覚器官がなくても、光源の発生地を特定する能力を持っています。この情報は、自分自身を方向付けたり、環境内での最適な位置を決定するために非常に価値があります。特に植物にとって、光がどこから来ているかを知ることは重要で、この情報を使って、光合成の過程で化学エネルギーに変換する太陽光をより多く捕獲するために、自分たちの器官を位置付けます。これは、私たちが食べるほぼ全ての食料の生産に必要な、不可欠な過程です。
向光性を開始する光受容体は以前から知られていましたが、光感受性植物組織の光学的特性は、これまで謎でした。Science誌に掲載された多分野にわたる研究では、UNILの統合ゲノミクスセンターのディレクターで生物医学部教授でもあるクリスチャン・ファンクハウザー博士(Christian Fankhauser ,PhD)、EPFLのソーラーエネルギーおよび建築物理研究所の太陽光エネルギー変換ナノテクノ
植物には視覚器官がないのに、どうやって光の来る方向を知るのでしょうか?生物学と工学の専門知識を組み合わせた画期的な研究で、ローザンヌ大学(UNIL)のクリスチャン・ファンクハウザー教授(Christian Fankhauser)が率いるチームは、ローザンヌ連邦工科大学(EPFL)の同僚と共に、光感受性植物組織が空気と水の境界の光学的特性を利用して、植物に「見える」光の勾配を生成することを明らかにしました。
この結果は、2023年11月23日にScience誌に掲載されました。論文のタイトルは「空気チャンネルが定向性光信号を生成して子葉下部の向光性を調節する」(Air Channels Create a Directional Light Signal to Regulate Hypocotyl Phototropism)です。
生物の大多数(微生物、植物、動物)は、目に相当する視覚器官がなくても、光源の発生地を特定する能力を持っています。この情報は、自分自身を方向付けたり、環境内での最適な位置を決定するために非常に価値があります。特に植物にとって、光がどこから来ているかを知ることは重要で、この情報を使って、光合成の過程で化学エネルギーに変換する太陽光をより多く捕獲するために、自分たちの器官を位置付けます。これは、私たちが食べるほぼ全ての食料の生産に必要な、不可欠な過程です。
向光性を開始する光受容体は以前から知られていましたが、光感受性植物組織の光学的特性は、これまで謎でした。Science誌に掲載された多分野にわたる研究では、UNILの統合ゲノミクスセンターのディレクターで生物医学部教授でもあるクリスチャン・ファンクハウザー博士(Christian Fankhauser ,PhD)、EPFLのソーラーエネルギーおよび建築物理研究所の太陽光エネルギー変換ナノテクノ
ヒトY染色体の完全配列:新たな医学的可能性を開く
 国際研究チームは、完全にシークエンスされた最初のヒトY染色体の配列を生成しました。これは、完全にシークエンスされた最後のヒト染色体です。新しい配列は、Y染色体の長さの50%以上にわたるギャップを埋め、精子の生産に関連する要因など、生殖に関連する重要なゲノムの特徴を明らかにしています。
この研究は、国立ヒトゲノム研究所(National Human Genome Research Institute、NHGRI)が資金提供する研究チーム、テロメアからテロメアまでのコンソーシアム(Telomere-to-Telomere、T2T Consortium)によって主導され、2023年8月23日に「Nature」誌に掲載されました。この論文のタイトルは「ヒトY染色体の完全な配列」(The Complete Sequence of a Human Y Chromosome)です。
Y染色体は、X染色体と共に、性的発達における役割でよく議論されます。これらの染色体は中心的な役割を果たしますが、人間の性的発達に関与する要因はゲノム全体に広がっており、非常に複雑で、男性、女性、インターセックス個体の間で見られる多様な性的特徴を生み出しています。これらのカテゴリーは、社会的なカテゴリーであるジェンダーとは異なります。さらに、最近の研究では、Y染色体上の遺伝子が、がんのリスクや重症度など、人間の生物学の他の側面にも寄与していることが示されています。
研究者らは20年前に最初のヒトゲノム配列を完成させたとき、24本の染色体のすべての配列にギャップが残されました。しかし、残りのゲノム配列に散らばる小さなギャップとは異なり、Y染色体の配列の半分以上が謎のままでした。
すべての染色体には繰り返し領域があるものの、Y染色体は特に繰り返しが多く、その配列を完成させることは特に困難でした。配列データを
国際研究チームは、完全にシークエンスされた最初のヒトY染色体の配列を生成しました。これは、完全にシークエンスされた最後のヒト染色体です。新しい配列は、Y染色体の長さの50%以上にわたるギャップを埋め、精子の生産に関連する要因など、生殖に関連する重要なゲノムの特徴を明らかにしています。
この研究は、国立ヒトゲノム研究所(National Human Genome Research Institute、NHGRI)が資金提供する研究チーム、テロメアからテロメアまでのコンソーシアム(Telomere-to-Telomere、T2T Consortium)によって主導され、2023年8月23日に「Nature」誌に掲載されました。この論文のタイトルは「ヒトY染色体の完全な配列」(The Complete Sequence of a Human Y Chromosome)です。
Y染色体は、X染色体と共に、性的発達における役割でよく議論されます。これらの染色体は中心的な役割を果たしますが、人間の性的発達に関与する要因はゲノム全体に広がっており、非常に複雑で、男性、女性、インターセックス個体の間で見られる多様な性的特徴を生み出しています。これらのカテゴリーは、社会的なカテゴリーであるジェンダーとは異なります。さらに、最近の研究では、Y染色体上の遺伝子が、がんのリスクや重症度など、人間の生物学の他の側面にも寄与していることが示されています。
研究者らは20年前に最初のヒトゲノム配列を完成させたとき、24本の染色体のすべての配列にギャップが残されました。しかし、残りのゲノム配列に散らばる小さなギャップとは異なり、Y染色体の配列の半分以上が謎のままでした。
すべての染色体には繰り返し領域があるものの、Y染色体は特に繰り返しが多く、その配列を完成させることは特に困難でした。配列データを
第三世代シークエンシング技術とY染色体の解読が開く消化器疾患の新展望
 人類遺伝学の分野において大きな突破口が開かれました。最近、人間のY染色体の完全な解読が達成され、消化器疾患を含む多くの分野での研究に新たな道を開きました。このシークエンシングのマイルストーンは、第三世代シークエンシング技術の進歩とともに、消化器疾患の遺伝的根底にある理解を一新させ、より個人化され効果的な治療戦略への道を開くことが期待されています。この件は、2023年11月23日にeGastroenterologyで公開された「消化器疾患における人類遺伝学の新しい地平」(New Horizons of Human Genetics in Digestive Diseases)というタイトルの展望記事で強調されています。
Y染色体は、人間の染色体の中で最も小さく、その複雑な繰り返し構造のため長らく謎に包まれていました。しかし、最近のシークエンシング技術の進歩により、研究者たちはこの遺伝領域の複雑な詳細を解き明かし、性決定におけるその役割や消化系を含む様々な疾患への潜在的な影響に光を当てました。
Y染色体のシーケンスを完了することにより、消化器疾患に寄与する可能性のある遺伝的変異を特定するための包括的な参照が提供されます。この情報は、遺伝的要因によって説明される疾患リスクの割合が、遺伝率の推定に基づいて期待されるものに達していない「欠落した遺伝率」の問題を理解するために不可欠です。
第三世代シークエンシング技術は、長く連続したDNAリードを生成する能力を持ち、消化器疾患の複雑なゲノム風景を解読する上で重要な役割を果たします。これらの技術により、以前のシークエンシング方法ではアクセスできなかった構造変異(コピー数変異や反転など)の検出が可能になります。これらの構造変異は、疾患の感受性や進行において重要な役割を果たす可能性があります。
完全なY染色体のシークエンシングと第
人類遺伝学の分野において大きな突破口が開かれました。最近、人間のY染色体の完全な解読が達成され、消化器疾患を含む多くの分野での研究に新たな道を開きました。このシークエンシングのマイルストーンは、第三世代シークエンシング技術の進歩とともに、消化器疾患の遺伝的根底にある理解を一新させ、より個人化され効果的な治療戦略への道を開くことが期待されています。この件は、2023年11月23日にeGastroenterologyで公開された「消化器疾患における人類遺伝学の新しい地平」(New Horizons of Human Genetics in Digestive Diseases)というタイトルの展望記事で強調されています。
Y染色体は、人間の染色体の中で最も小さく、その複雑な繰り返し構造のため長らく謎に包まれていました。しかし、最近のシークエンシング技術の進歩により、研究者たちはこの遺伝領域の複雑な詳細を解き明かし、性決定におけるその役割や消化系を含む様々な疾患への潜在的な影響に光を当てました。
Y染色体のシーケンスを完了することにより、消化器疾患に寄与する可能性のある遺伝的変異を特定するための包括的な参照が提供されます。この情報は、遺伝的要因によって説明される疾患リスクの割合が、遺伝率の推定に基づいて期待されるものに達していない「欠落した遺伝率」の問題を理解するために不可欠です。
第三世代シークエンシング技術は、長く連続したDNAリードを生成する能力を持ち、消化器疾患の複雑なゲノム風景を解読する上で重要な役割を果たします。これらの技術により、以前のシークエンシング方法ではアクセスできなかった構造変異(コピー数変異や反転など)の検出が可能になります。これらの構造変異は、疾患の感受性や進行において重要な役割を果たす可能性があります。
完全なY染色体のシークエンシングと第
バクテリア防御システムCBASSの新発見:ファージRNAに対する反応
 地球上には脅威から完全に自由な生物は存在せず、その中でもバクテリアにとって最も深刻な敵の一つが、細胞に侵入して増殖し、支配する捕食性ウイルスであるファージです。バクテリアはこれらの感染に対抗するために様々な戦略を進化させてきましたが、どのようにして侵入者を最初に感知するかは長年の謎でした。しかし、今、ロックフェラー大学の細菌学研究室の研究者らは、バクテリアがCBASS(cyclic-oligonucleotide-based anti-phage signaling system)と呼ばれる防御反応を通じてファージを感知していることを発見しました。
これはウイルスRNAを検出するもので、将来的には抗生物質耐性の脅威に対抗するのに役立つかもしれません。彼らは2023年11月15日に「Nature」誌に「Bacterial cGAS Senses a Viral RNA to Initiate Immunity.」(「細菌cGASがウイルスRNAを感知して免疫を開始」)という論文を発表しました。「ファージ感染によってCBASSがどのように活性化されるかは、長年私たちの分野で大きな未知でした。これまで、バクテリアがCBASS免疫応答を開始するトリガーが何であるかは誰も理解していませんでした。」と、研究室の責任者であるルチアーノ・マラフィーニ博士(Luciano Marraffini, PhD)は言います。
遠く離れた領域の親類
核を持つ真核生物(哺乳類、植物、菌類など)から核を持たない原核生物(バクテリアや古細菌など)に至るまで、生命の遠く離れた領域間で共有されるいくつかの基本的な免疫機能があります。これらの免疫応答は、生命の存在の初期に進化していたに違いありません。
一つの保存された特徴は、特殊な酵素であるサイクラーゼに依存するウイルス感知機構です。動物では、これは
地球上には脅威から完全に自由な生物は存在せず、その中でもバクテリアにとって最も深刻な敵の一つが、細胞に侵入して増殖し、支配する捕食性ウイルスであるファージです。バクテリアはこれらの感染に対抗するために様々な戦略を進化させてきましたが、どのようにして侵入者を最初に感知するかは長年の謎でした。しかし、今、ロックフェラー大学の細菌学研究室の研究者らは、バクテリアがCBASS(cyclic-oligonucleotide-based anti-phage signaling system)と呼ばれる防御反応を通じてファージを感知していることを発見しました。
これはウイルスRNAを検出するもので、将来的には抗生物質耐性の脅威に対抗するのに役立つかもしれません。彼らは2023年11月15日に「Nature」誌に「Bacterial cGAS Senses a Viral RNA to Initiate Immunity.」(「細菌cGASがウイルスRNAを感知して免疫を開始」)という論文を発表しました。「ファージ感染によってCBASSがどのように活性化されるかは、長年私たちの分野で大きな未知でした。これまで、バクテリアがCBASS免疫応答を開始するトリガーが何であるかは誰も理解していませんでした。」と、研究室の責任者であるルチアーノ・マラフィーニ博士(Luciano Marraffini, PhD)は言います。
遠く離れた領域の親類
核を持つ真核生物(哺乳類、植物、菌類など)から核を持たない原核生物(バクテリアや古細菌など)に至るまで、生命の遠く離れた領域間で共有されるいくつかの基本的な免疫機能があります。これらの免疫応答は、生命の存在の初期に進化していたに違いありません。
一つの保存された特徴は、特殊な酵素であるサイクラーゼに依存するウイルス感知機構です。動物では、これは
音でエンコードされた顔は盲目の人々の脳でどのように処理されるか?
 ジョージタウン大学医療センターの神経科学者とその同僚たちは、画像を音に変換する特殊な装置を使用して、視覚障害者が「脳の中の紡錘状回顔領域」と呼ばれる部分を使って基本的な顔を認識できることを明らかにしました。この領域は視覚を持つ人々が顔を見た際の処理に不可欠です。
この発見は2023年11月22日にPLOS ONEに掲載されました。オープンアクセスの論文のタイトルは「音でエンコードされた顔は早期盲目の人々の左脳の紡錘状回顔領域を活性化する」(Sound-Encoded Faces Activate the Left Fusiform Face Area in the Early Blind)です。
「視覚障害者が他の感覚を使って視覚の喪失をある程度補うことが長い間知られています。私たちの研究は、視覚と聴覚の間のこの可塑性、または補償がどの程度存在するかをテストしました。基本的な視覚パターンを音声パターンに変換する技術的な装置を使用し、機能的磁気共鳴画像法(fMRI)によって、この補償的な可塑性が脳のどこで起こっているかを決定することができます。」とジョージタウン大学神経科学部門の教授であり、この研究の主要著者であるヨセフ・ラウシェッカー博士(Josef Rauschecker, PhD, DSc)は言います。
人間と非ヒト霊長類の顔認識は、専門的な皮質領域のパッチワークによって達成されます。これらの領域がどのように発達するかは、議論の的となってきました。社会的行動にとって重要であるため、多くの研究者は霊長類の顔認識のための神経メカニズムが先天的であるか、または顔との早期の視覚的経験に依存すると考えています。
「視覚障害者の結果から、紡錘状回顔領域の発達は実際の視覚的な顔の経験には依存せず、顔の構成の幾何学に対する露出に依存することを示唆しています。これは他の感覚モ
ジョージタウン大学医療センターの神経科学者とその同僚たちは、画像を音に変換する特殊な装置を使用して、視覚障害者が「脳の中の紡錘状回顔領域」と呼ばれる部分を使って基本的な顔を認識できることを明らかにしました。この領域は視覚を持つ人々が顔を見た際の処理に不可欠です。
この発見は2023年11月22日にPLOS ONEに掲載されました。オープンアクセスの論文のタイトルは「音でエンコードされた顔は早期盲目の人々の左脳の紡錘状回顔領域を活性化する」(Sound-Encoded Faces Activate the Left Fusiform Face Area in the Early Blind)です。
「視覚障害者が他の感覚を使って視覚の喪失をある程度補うことが長い間知られています。私たちの研究は、視覚と聴覚の間のこの可塑性、または補償がどの程度存在するかをテストしました。基本的な視覚パターンを音声パターンに変換する技術的な装置を使用し、機能的磁気共鳴画像法(fMRI)によって、この補償的な可塑性が脳のどこで起こっているかを決定することができます。」とジョージタウン大学神経科学部門の教授であり、この研究の主要著者であるヨセフ・ラウシェッカー博士(Josef Rauschecker, PhD, DSc)は言います。
人間と非ヒト霊長類の顔認識は、専門的な皮質領域のパッチワークによって達成されます。これらの領域がどのように発達するかは、議論の的となってきました。社会的行動にとって重要であるため、多くの研究者は霊長類の顔認識のための神経メカニズムが先天的であるか、または顔との早期の視覚的経験に依存すると考えています。
「視覚障害者の結果から、紡錘状回顔領域の発達は実際の視覚的な顔の経験には依存せず、顔の構成の幾何学に対する露出に依存することを示唆しています。これは他の感覚モ
免疫システム活用:結核治療に革新をもたらすがん治療法
 新しいがん治療法が、世界で最も壊滅的な感染症の一つである結核に対しても極めて有効であることが明らかになりました。テキサス生物医学研究所(Texas Biomed)の科学者たちは、この治療法が、耐薬性のある細菌でさえも結核の増殖を劇的に減少させることを発見しました。
2023年10月19日に「バイオメディシン&ファーマコセラピー(Biomedicine & Pharmacotherapy)」誌に報告されたこの発見は、結核に感染したヒト細胞を特徴とする新しい細胞モデルにおいて行われました。これにより、潜在的な結核薬や治療法のスクリーニングを加速することが可能になります。
オープンアクセスの論文のタイトルは「MCL-1およびBCL-2阻害剤の組み合わせは結核に対するホスト指向療法として有望なアプローチである」というものです。この研究で評価された治療法は、二つの分子を組み合わせたもので、そのうちの一つはすでにFDAによってがん患者への使用が承認されており、もう一つはがんに対する臨床試験のフェーズ1/2で評価されています。これらの化合物は、がん細胞であれ、この場合は結核菌(M. tb)に感染した細胞であれ、標的とされた領域での正常な細胞死のプロセスを体が開始するのを助けます。
結核は、毎年世界中で160万人以上の死亡を引き起こしています。この細菌は主に肺に感染します。患者は、活動性感染をコントロールするために数ヶ月間抗生物質を服用する必要があります。耐薬性が増加しているため、治療はさらに困難になっています。
テキサス生物医学研究所のラリー・シュレジンガー博士(Larry Schlesinger, MD)の研究室は、空気感染性細菌とヒトとの間の基本的な生物学的相互作用を理解し、それらの洞察を用いて潜在的な治療ターゲットを特定することに焦点を当てています。
結核菌は
新しいがん治療法が、世界で最も壊滅的な感染症の一つである結核に対しても極めて有効であることが明らかになりました。テキサス生物医学研究所(Texas Biomed)の科学者たちは、この治療法が、耐薬性のある細菌でさえも結核の増殖を劇的に減少させることを発見しました。
2023年10月19日に「バイオメディシン&ファーマコセラピー(Biomedicine & Pharmacotherapy)」誌に報告されたこの発見は、結核に感染したヒト細胞を特徴とする新しい細胞モデルにおいて行われました。これにより、潜在的な結核薬や治療法のスクリーニングを加速することが可能になります。
オープンアクセスの論文のタイトルは「MCL-1およびBCL-2阻害剤の組み合わせは結核に対するホスト指向療法として有望なアプローチである」というものです。この研究で評価された治療法は、二つの分子を組み合わせたもので、そのうちの一つはすでにFDAによってがん患者への使用が承認されており、もう一つはがんに対する臨床試験のフェーズ1/2で評価されています。これらの化合物は、がん細胞であれ、この場合は結核菌(M. tb)に感染した細胞であれ、標的とされた領域での正常な細胞死のプロセスを体が開始するのを助けます。
結核は、毎年世界中で160万人以上の死亡を引き起こしています。この細菌は主に肺に感染します。患者は、活動性感染をコントロールするために数ヶ月間抗生物質を服用する必要があります。耐薬性が増加しているため、治療はさらに困難になっています。
テキサス生物医学研究所のラリー・シュレジンガー博士(Larry Schlesinger, MD)の研究室は、空気感染性細菌とヒトとの間の基本的な生物学的相互作用を理解し、それらの洞察を用いて潜在的な治療ターゲットを特定することに焦点を当てています。
結核菌は
量子生物学とAIを用いたCRISPR/Cas9の新しい進歩
 テネシー州にあるオーク・リッジ国立研究所(ORNL)の科学者らは、量子生物学、人工知能、バイオエンジニアリングの専門知識を活用して、再生可能燃料や化学品を生産するために改変可能な微生物などの生物に対するCRISPR/Cas9ゲノム編集ツールの改良に取り組んでいます。CRISPRはバイオエンジニアリングにおいて強力なツールであり、生物の性能を向上させたり、突然変異を修正するために遺伝コードを変更するために使用されます。CRISPR/Cas9ツールは、Cas9酵素がゲノム内の対象となるサイトと結合し、切断するための唯一のユニークなガイドRNAに依存しています。CRISPRツール用の効果的なガイドRNAを計算上予測するための既存のモデルは、わずかなモデル種からのデータに基づいて構築されており、微生物に適用した場合の効率は弱く、一貫性がありません。
「多くのCRISPRツールは、哺乳類細胞やショウジョウバエなどのモデル種向けに開発されています。微生物に特化したものは少なく、染色体の構造やサイズが大きく異なります」と、ORNLの合成生物学グループのリーダーであるキャリー・エッカート博士(Carrie Eckert, PhD)は述べています。「微生物で作業する際にCRISPR/Cas9機構の設計モデルが異なる振る舞いをすることに気づいており、この研究は私たちが経験的に知っていたことを検証するものです。」
ガイドRNAのモデリングと設計を改善するために、ORNLの科学者らは、細胞核内で起こる最も基本的なレベルの現象をよりよく理解することを目指しました。細胞核は遺伝物質が保存されている場所です。彼らは、分子生物学と量子化学を架橋する量子生物学という分野に目を向けました。この分野は、電子構造が核酸(DNAやRNAを構成する分子)の化学的特性や相互作用に与える影響を調査します。
分子
テネシー州にあるオーク・リッジ国立研究所(ORNL)の科学者らは、量子生物学、人工知能、バイオエンジニアリングの専門知識を活用して、再生可能燃料や化学品を生産するために改変可能な微生物などの生物に対するCRISPR/Cas9ゲノム編集ツールの改良に取り組んでいます。CRISPRはバイオエンジニアリングにおいて強力なツールであり、生物の性能を向上させたり、突然変異を修正するために遺伝コードを変更するために使用されます。CRISPR/Cas9ツールは、Cas9酵素がゲノム内の対象となるサイトと結合し、切断するための唯一のユニークなガイドRNAに依存しています。CRISPRツール用の効果的なガイドRNAを計算上予測するための既存のモデルは、わずかなモデル種からのデータに基づいて構築されており、微生物に適用した場合の効率は弱く、一貫性がありません。
「多くのCRISPRツールは、哺乳類細胞やショウジョウバエなどのモデル種向けに開発されています。微生物に特化したものは少なく、染色体の構造やサイズが大きく異なります」と、ORNLの合成生物学グループのリーダーであるキャリー・エッカート博士(Carrie Eckert, PhD)は述べています。「微生物で作業する際にCRISPR/Cas9機構の設計モデルが異なる振る舞いをすることに気づいており、この研究は私たちが経験的に知っていたことを検証するものです。」
ガイドRNAのモデリングと設計を改善するために、ORNLの科学者らは、細胞核内で起こる最も基本的なレベルの現象をよりよく理解することを目指しました。細胞核は遺伝物質が保存されている場所です。彼らは、分子生物学と量子化学を架橋する量子生物学という分野に目を向けました。この分野は、電子構造が核酸(DNAやRNAを構成する分子)の化学的特性や相互作用に与える影響を調査します。
分子
遺伝子発現の記憶を保つ:MITの最新研究
 すべての人間の細胞は、性細胞を除き、DNAにコードされた同じ遺伝情報を含んでいます。しかし、約30,000の遺伝子の中で、各細胞は神経細胞、免疫細胞、または体内の他の数百種類の細胞タイプになるために必要な遺伝子のみを発現します。各細胞の運命は、主にDNAを飾るタンパク質に対する化学的修飾によって決定され、これらの修飾はどの遺伝子がオンまたはオフになるかを制御します。しかし、細胞が分裂してDNAを複製するとき、これらの修飾の半分を失い、問題が生じます:細胞はどのようにして自身が何の細胞であるべきかの記憶を維持するのでしょうか?
MITの新しい研究では、細胞が分裂する際にこれらの記憶を世代から世代へと伝える方法を説明する理論モデルを提案しています。研究チームは、各細胞の核内でゲノムの3D折りたたみパターンが、どの部分のゲノムがこれらの化学的修飾によってマークされるかを決定すると示唆しています。細胞がDNAを複製した後、これらのマークは部分的に失われますが、3D折りたたみによって、各娘細胞は自身のアイデンティティを維持するために必要な化学マークを容易に復元することができます。そして、細胞が分裂するたびに、化学マークによってゲノムの3D折りたたみを復元することができます。この方法で、3D折りたたみとマークの間で記憶をやり取りすることにより、数百回の細胞分裂にわたって記憶を保存することができます。
「細胞タイプが異なる主要な側面は、異なる遺伝子がオンまたはオフになることです。これらの状態は非常に確固たるもので、一つの細胞タイプを別のものに変えることは非常に困難です」と、研究の主著者であるジェレミー・オーウェン博士(Jeremy Owen, PhD)は言います。「私たちがこの研究で行ったことは、細胞内の化学システムの質的な特徴を強調し、遺伝子発現の記憶が安定するためにどのように
すべての人間の細胞は、性細胞を除き、DNAにコードされた同じ遺伝情報を含んでいます。しかし、約30,000の遺伝子の中で、各細胞は神経細胞、免疫細胞、または体内の他の数百種類の細胞タイプになるために必要な遺伝子のみを発現します。各細胞の運命は、主にDNAを飾るタンパク質に対する化学的修飾によって決定され、これらの修飾はどの遺伝子がオンまたはオフになるかを制御します。しかし、細胞が分裂してDNAを複製するとき、これらの修飾の半分を失い、問題が生じます:細胞はどのようにして自身が何の細胞であるべきかの記憶を維持するのでしょうか?
MITの新しい研究では、細胞が分裂する際にこれらの記憶を世代から世代へと伝える方法を説明する理論モデルを提案しています。研究チームは、各細胞の核内でゲノムの3D折りたたみパターンが、どの部分のゲノムがこれらの化学的修飾によってマークされるかを決定すると示唆しています。細胞がDNAを複製した後、これらのマークは部分的に失われますが、3D折りたたみによって、各娘細胞は自身のアイデンティティを維持するために必要な化学マークを容易に復元することができます。そして、細胞が分裂するたびに、化学マークによってゲノムの3D折りたたみを復元することができます。この方法で、3D折りたたみとマークの間で記憶をやり取りすることにより、数百回の細胞分裂にわたって記憶を保存することができます。
「細胞タイプが異なる主要な側面は、異なる遺伝子がオンまたはオフになることです。これらの状態は非常に確固たるもので、一つの細胞タイプを別のものに変えることは非常に困難です」と、研究の主著者であるジェレミー・オーウェン博士(Jeremy Owen, PhD)は言います。「私たちがこの研究で行ったことは、細胞内の化学システムの質的な特徴を強調し、遺伝子発現の記憶が安定するためにどのように
真菌が秘める氷形成の謎:最新の生命科学研究が明らかにする自然の力
 氷の形成は、皆さんが考えるよりもはるかに興味深いものです。自然界で最も一般的な基本的な物理プロセスの1つであるこの現象は、何十年にもわたる科学的な精査にもかかわらず、未だにある程度の謎を残しています。現在、ユタ大学、ドイツのマックス・プランク高分子研究所、アイダホ州立大学の新しい研究が、氷形成における生物学的エージェントの役割に新たな光を当てています。これらのエージェントは、驚くべきことに、すべての真菌によって生成されています。学校で教えられていることとは対照的に、水は必ずしも0度で凍結するわけではありません。これは、相転移に固有のエネルギー障壁が存在するためです。完全に純粋な水は、マイナス46度まで冷却されない限り凍結しません。これは、水分子が氷に至る結晶を形成するために粒子を必要とするためです。このプロセスは核形成と呼ばれます。
生物は、寒冷な環境で生き残るための適応として、氷形成を制御するさまざまな方法を進化させてきました。したがって、最も効率的な氷核形成粒子は、バクテリアや真菌、さらには昆虫によって生成される生物学的起源のものですが、これらの「生物学的氷核」の分子基盤や正確なメカニズムはまだ十分に理解されていません。
ユタ大学の科学部の理論化学者であるヴァレリア・モリネロ博士(Valeria Molinero, PhD)は、この謎を解明する先頭に立っています。この研究は、生命が降水や気候にどのように影響するかという我々の理解を深める可能性を秘めています。
彼女が共同主導した新しい研究では、国際的な研究チームが真菌の氷核形成体の特徴と性質を探求し、それらが小さなタンパク質のサブユニットで構成されており、氷の成長を促進するとともに抑制する役割を果たしていることを明らかにしました。
「これらは環境に分泌されるタンパク質で、氷核形成に非常に効果的な粒子です
氷の形成は、皆さんが考えるよりもはるかに興味深いものです。自然界で最も一般的な基本的な物理プロセスの1つであるこの現象は、何十年にもわたる科学的な精査にもかかわらず、未だにある程度の謎を残しています。現在、ユタ大学、ドイツのマックス・プランク高分子研究所、アイダホ州立大学の新しい研究が、氷形成における生物学的エージェントの役割に新たな光を当てています。これらのエージェントは、驚くべきことに、すべての真菌によって生成されています。学校で教えられていることとは対照的に、水は必ずしも0度で凍結するわけではありません。これは、相転移に固有のエネルギー障壁が存在するためです。完全に純粋な水は、マイナス46度まで冷却されない限り凍結しません。これは、水分子が氷に至る結晶を形成するために粒子を必要とするためです。このプロセスは核形成と呼ばれます。
生物は、寒冷な環境で生き残るための適応として、氷形成を制御するさまざまな方法を進化させてきました。したがって、最も効率的な氷核形成粒子は、バクテリアや真菌、さらには昆虫によって生成される生物学的起源のものですが、これらの「生物学的氷核」の分子基盤や正確なメカニズムはまだ十分に理解されていません。
ユタ大学の科学部の理論化学者であるヴァレリア・モリネロ博士(Valeria Molinero, PhD)は、この謎を解明する先頭に立っています。この研究は、生命が降水や気候にどのように影響するかという我々の理解を深める可能性を秘めています。
彼女が共同主導した新しい研究では、国際的な研究チームが真菌の氷核形成体の特徴と性質を探求し、それらが小さなタンパク質のサブユニットで構成されており、氷の成長を促進するとともに抑制する役割を果たしていることを明らかにしました。
「これらは環境に分泌されるタンパク質で、氷核形成に非常に効果的な粒子です
海ミミズが特殊なタンパク質で太陽光と月光を区別する仕組みを解明
 ヨハネス・グーテンベルク大学マインツ(JGU)、ケルン大学、オルデンブルク大学の研究者チームが共同で行った研究の成果が2023年10月30日、Nature Communicationsに掲載されました。この研究では、非定型クリプトクロムタンパク質(Cry)の機能に関する発見が発表されました。これらのタンパク質は様々な生物に存在し、多くの場合、光によって制御される生物学的プロセスに関与しています。例えば、海ミミズのPlatynereis dumeriliiは、特殊なCryタンパク質であるL-Cryを使用して、日光と月光、さらには異なる月の位相を区別します。これは、これらの生物が、内部の月周期、いわゆる周月時計を介して、繁殖を満月の位相に同期させるために不可欠です。ケルン大学の研究者たちは、同大学のクライオ電子顕微鏡プラットフォームを使用して、L-Cryタンパク質の3次元構造を異なる光条件下で可視化しました。
これらの構造解析の結果と、主にマインツ大学で行われた生化学的研究の結果は、暗闇の中でL-Cryは、安定した接続によって結合された2つのサブユニットからなるいわゆる二量体の配置を採用していること、そして強い日光に似た照明下ではそのサブユニット、または単量体に分解することを明らかにしました。このオープンアクセス記事は「逆光オリゴマー化機構を持つ海洋クリプトクロム」(A Marine Cryptochrome with an Inverse Photo-Oligomerization Mechanism)と題されています。
暗闇での2つのサブユニットの空間配置は、他のCryタンパク質で観察されていない特異なものであり、通常とは異なる配置に対応しています。また、光によって引き起こされる変化の方向も珍しく、他のCryタンパク質では逆のプロセス、すなわち暗闇での単量
ヨハネス・グーテンベルク大学マインツ(JGU)、ケルン大学、オルデンブルク大学の研究者チームが共同で行った研究の成果が2023年10月30日、Nature Communicationsに掲載されました。この研究では、非定型クリプトクロムタンパク質(Cry)の機能に関する発見が発表されました。これらのタンパク質は様々な生物に存在し、多くの場合、光によって制御される生物学的プロセスに関与しています。例えば、海ミミズのPlatynereis dumeriliiは、特殊なCryタンパク質であるL-Cryを使用して、日光と月光、さらには異なる月の位相を区別します。これは、これらの生物が、内部の月周期、いわゆる周月時計を介して、繁殖を満月の位相に同期させるために不可欠です。ケルン大学の研究者たちは、同大学のクライオ電子顕微鏡プラットフォームを使用して、L-Cryタンパク質の3次元構造を異なる光条件下で可視化しました。
これらの構造解析の結果と、主にマインツ大学で行われた生化学的研究の結果は、暗闇の中でL-Cryは、安定した接続によって結合された2つのサブユニットからなるいわゆる二量体の配置を採用していること、そして強い日光に似た照明下ではそのサブユニット、または単量体に分解することを明らかにしました。このオープンアクセス記事は「逆光オリゴマー化機構を持つ海洋クリプトクロム」(A Marine Cryptochrome with an Inverse Photo-Oligomerization Mechanism)と題されています。
暗闇での2つのサブユニットの空間配置は、他のCryタンパク質で観察されていない特異なものであり、通常とは異なる配置に対応しています。また、光によって引き起こされる変化の方向も珍しく、他のCryタンパク質では逆のプロセス、すなわち暗闇での単量
遺伝子組み換え酵母を用いた植物アルカロイドの新たな生物合成法
 遺伝子組み換え酵母細胞を使用した医薬品用生物物質の生産が、国際研究チームによる基礎研究で新たな有望な結果を示しています。2022年、研究者らは、微生物セルファクトリーにこれまでで最も長い生物合成経路、すなわち"組立ライン"をプログラミングし、抗がん剤用の生物物質を生産するために設計したことで国際的な注目を集めました。2023年11月6日に『ネイチャー・ケミカルバイオロジー(Nature Chemical Biology)』に掲載された論文「酵母における自然及びハロゲン化植物モノテルペン・インドール・アルカロイドの生物合成(Biosynthesis of Natural and Halogenated Plant Monoterpene Indole Alkaloids in Yeast)」にて、研究者らは、精神障害治療において有望な結果を示す天然物質アルストニンの人工生産に関する結果を発表しています。この論文はオープンアクセスで公開されています。
「天然植物物質からの医薬品開発は広く利用されています。しかし、植物は人間の病気と戦うためにこれらの物質を生産しているわけではないため、効果的で安全なものにするために修正する必要がしばしばあります」と、DTU Biosustainの上級研究者であり、バイオテック会社Biomiaの共同創設者であるマイケル・クローグ・イェンセン博士(Michael Krogh Jensen, PhD)は述べています。
研究者らは、酵母プラットフォームが植物ベースの医薬品の発見と開発において重要な役割を果たすことを期待しています。
患者の副作用減少
新しい研究結果は、エンジニアリングされた酵母細胞が、研究者が2022年に結果を発表した物質ビンブラスチン以外のアルカロイド群の物質を作り出せることを証明しています。研究者らは、2つの新しい天然植物
遺伝子組み換え酵母細胞を使用した医薬品用生物物質の生産が、国際研究チームによる基礎研究で新たな有望な結果を示しています。2022年、研究者らは、微生物セルファクトリーにこれまでで最も長い生物合成経路、すなわち"組立ライン"をプログラミングし、抗がん剤用の生物物質を生産するために設計したことで国際的な注目を集めました。2023年11月6日に『ネイチャー・ケミカルバイオロジー(Nature Chemical Biology)』に掲載された論文「酵母における自然及びハロゲン化植物モノテルペン・インドール・アルカロイドの生物合成(Biosynthesis of Natural and Halogenated Plant Monoterpene Indole Alkaloids in Yeast)」にて、研究者らは、精神障害治療において有望な結果を示す天然物質アルストニンの人工生産に関する結果を発表しています。この論文はオープンアクセスで公開されています。
「天然植物物質からの医薬品開発は広く利用されています。しかし、植物は人間の病気と戦うためにこれらの物質を生産しているわけではないため、効果的で安全なものにするために修正する必要がしばしばあります」と、DTU Biosustainの上級研究者であり、バイオテック会社Biomiaの共同創設者であるマイケル・クローグ・イェンセン博士(Michael Krogh Jensen, PhD)は述べています。
研究者らは、酵母プラットフォームが植物ベースの医薬品の発見と開発において重要な役割を果たすことを期待しています。
患者の副作用減少
新しい研究結果は、エンジニアリングされた酵母細胞が、研究者が2022年に結果を発表した物質ビンブラスチン以外のアルカロイド群の物質を作り出せることを証明しています。研究者らは、2つの新しい天然植物
フォスファイトの謎:25億年前のエネルギー源が現代の研究で明らかに
 物語は1980年代の終わり、ある1枚の紙から始まります。この紙には、科学者が化学化合物のフォスファイトをリン酸に変換すると、細胞のエネルギー運搬体であるATP分子を生産するのに十分なエネルギーが放出される計算式が書かれていました。このように、微生物は自らをエネルギーで支えることができるはずです。地球上のほとんどの生物とは異なり、微生物は光や有機物の分解によるエネルギー供給に依存していません。科学者は実際に、そのような微生物を環境から分離することに成功しました。そのエネルギー代謝は、計算通りにフォスファイトの酸化からリン酸に変わるものでした。しかし、生化学的メカニズムは具体的にはどのように機能するのでしょうか?残念ながら、このプロセスの背後にある生化学を理解するために必要な鍵となる酵素は隠されたままであり、そのため多くの年月を経ても謎は解明されませんでした。
この間に、その紙は引き出しの中に残り、研究アプローチは後回しにされました。しかし、その考えは科学者の頭から離れることはありませんでした。その科学者は、ドイツのコンスタンツ大学のリムノロジー研究所のベルンハルト・シンク教授(Bernhard Schink)です。彼が紙に計算を行ってから約30年後、思いがけない発見が再び事態を動かし始めました。
下水処理場での予想外の発見と新種の微生物
長年頭の中で温めていたものが、最終的に見つかりました。なんと、コンスタンツの下水処理場で、ベルンハルト・シンク教授(Bernhard Schink)の研究室から数キロメートルの場所でした。コンスタンツ大学の生物学博士研究者である朱慶茂(Zhuqing Mao)が下水汚泥のサンプルを調べ、フォスファイトからエネルギーを得る第二の微生物を発見しました。コンスタンツ大学の生物学者らを率いるシンク教授は、このバクテリアを、唯一の食物源として
物語は1980年代の終わり、ある1枚の紙から始まります。この紙には、科学者が化学化合物のフォスファイトをリン酸に変換すると、細胞のエネルギー運搬体であるATP分子を生産するのに十分なエネルギーが放出される計算式が書かれていました。このように、微生物は自らをエネルギーで支えることができるはずです。地球上のほとんどの生物とは異なり、微生物は光や有機物の分解によるエネルギー供給に依存していません。科学者は実際に、そのような微生物を環境から分離することに成功しました。そのエネルギー代謝は、計算通りにフォスファイトの酸化からリン酸に変わるものでした。しかし、生化学的メカニズムは具体的にはどのように機能するのでしょうか?残念ながら、このプロセスの背後にある生化学を理解するために必要な鍵となる酵素は隠されたままであり、そのため多くの年月を経ても謎は解明されませんでした。
この間に、その紙は引き出しの中に残り、研究アプローチは後回しにされました。しかし、その考えは科学者の頭から離れることはありませんでした。その科学者は、ドイツのコンスタンツ大学のリムノロジー研究所のベルンハルト・シンク教授(Bernhard Schink)です。彼が紙に計算を行ってから約30年後、思いがけない発見が再び事態を動かし始めました。
下水処理場での予想外の発見と新種の微生物
長年頭の中で温めていたものが、最終的に見つかりました。なんと、コンスタンツの下水処理場で、ベルンハルト・シンク教授(Bernhard Schink)の研究室から数キロメートルの場所でした。コンスタンツ大学の生物学博士研究者である朱慶茂(Zhuqing Mao)が下水汚泥のサンプルを調べ、フォスファイトからエネルギーを得る第二の微生物を発見しました。コンスタンツ大学の生物学者らを率いるシンク教授は、このバクテリアを、唯一の食物源として
UCLAの研究により、これまで知られていなかった腸管でのコレステロール吸収経路が明らかになった
 UCLAの研究者たちとその同僚たちは、食事由来のコレステロールが血液に放出される前に腸で処理される複雑なプロセスにおいて、これまで知られていなかった段階を記述しました。これはコレステロール治療の新たな標的経路を明らかにする可能性があります。既存の薬やスタチンはプロセスの一部に影響を与えますが、UCLAの研究室で研究されている実験的な薬は、新たに発見された経路を特に標的とするようです。これにより、コレステロール管理ツールボックスに新しいアプローチが加わる可能性があります。
「私たちの結果は、Asterファミリーの特定のタンパク質が、コレステロールの吸収と取り込みプロセスを進める上で重要な役割を果たしていることを示しています」と、病理学および臨床化学のUCLA教授であり研究者であるピーター・トントノズ博士(Peter Tontonoz ,PhD)は述べています。彼は2023年11月10日にScience誌に掲載された論文の主要な著者です。「Aster経路は、腸のコレステロール吸収を制限し、血漿コレステロールのレベルを減少させるための魅力的な標的である可能性があります。」と述べています。
Science誌の論文のタイトルは「Aster依存性非小胞輸送による食事性コレステロール摂取の促進」(Aster-Dependent Nonvesicular Transport Facilitates Dietary Cholesterol Uptake)です。
食物からのコレステロールは、腸の内面を覆う細胞 – エンテロサイト – によって吸収され、最終的に血液に達する小滴に処理されます。しかし、この旅は多段階のプロセスを経ます。
自由コレステロールは、細胞のプラズマ膜 – 細胞の外部境界 – にあるNPC1L1というタンパク質によって引き込まれます。その後、細胞内の別の膜状ネッ
UCLAの研究者たちとその同僚たちは、食事由来のコレステロールが血液に放出される前に腸で処理される複雑なプロセスにおいて、これまで知られていなかった段階を記述しました。これはコレステロール治療の新たな標的経路を明らかにする可能性があります。既存の薬やスタチンはプロセスの一部に影響を与えますが、UCLAの研究室で研究されている実験的な薬は、新たに発見された経路を特に標的とするようです。これにより、コレステロール管理ツールボックスに新しいアプローチが加わる可能性があります。
「私たちの結果は、Asterファミリーの特定のタンパク質が、コレステロールの吸収と取り込みプロセスを進める上で重要な役割を果たしていることを示しています」と、病理学および臨床化学のUCLA教授であり研究者であるピーター・トントノズ博士(Peter Tontonoz ,PhD)は述べています。彼は2023年11月10日にScience誌に掲載された論文の主要な著者です。「Aster経路は、腸のコレステロール吸収を制限し、血漿コレステロールのレベルを減少させるための魅力的な標的である可能性があります。」と述べています。
Science誌の論文のタイトルは「Aster依存性非小胞輸送による食事性コレステロール摂取の促進」(Aster-Dependent Nonvesicular Transport Facilitates Dietary Cholesterol Uptake)です。
食物からのコレステロールは、腸の内面を覆う細胞 – エンテロサイト – によって吸収され、最終的に血液に達する小滴に処理されます。しかし、この旅は多段階のプロセスを経ます。
自由コレステロールは、細胞のプラズマ膜 – 細胞の外部境界 – にあるNPC1L1というタンパク質によって引き込まれます。その後、細胞内の別の膜状ネッ
細菌とウィルスの腕の競い合いが、急速で複雑な進化への希少なチャンスを提供
 19世紀にチャールズ・ダーウィンによって考案された進化論は、種の適応が世代を経て徐々に受け継がれる遅い、段階的なプロセスとされています。しかし、今日の生物学者たちは、はるかに加速された時間スケールで進化の変化が展開する様子を目の当たりにしています。ダーウィンが進化論を形成するために研究したガラパゴス諸島の魅力的な植物や動物とは異なり、カリフォルニア大学サンディエゴ校・生物科学部のジョシュア・ボーリン博士(Joshua Borin, PhD)とジャスティン・メイヤー准教授(Justin Meyer, PhD)は、単純な実験室のフラスコで急速な進化プロセスを記録しています。ボーリン博士とメイヤー准教授は、共進化を実際に研究するため、細菌とウイルスを閉じた実験室のフラスコ内に設置しました。このフラスコはわずか2ティースプーンの大きさです。細菌がウイルスに感染すると、細菌は攻撃を退けるための新しい防御策を進化させます。それに対して、ウイルスはこれらの適応に対抗するために、新しい防御策を回避する自身の進化変化を行います。
わずか3週間で、細菌(大腸菌)とウイルス(バクテリオファージ、または「ファージ」とも呼ばれます)の間で、いくつかの進化的適応が生じます。2023年11月10日にScience誌に発表された新しい発見は、異なる進化的パターンの出現を明らかにしています。この論文のタイトルは「Rapid Bacteria-Phage Coevolution Drives the Emergence of Multiscale Networks.(急速な細菌-ファージ共進化が多スケールネットワークの出現を引き起こす)」です。
「この研究では、進化の力を示しています」とメイヤー准教授は述べています。彼は、「細菌とファージ間の共進化が、非常に複雑な生態学的ネットワークの出現を促進するこ
19世紀にチャールズ・ダーウィンによって考案された進化論は、種の適応が世代を経て徐々に受け継がれる遅い、段階的なプロセスとされています。しかし、今日の生物学者たちは、はるかに加速された時間スケールで進化の変化が展開する様子を目の当たりにしています。ダーウィンが進化論を形成するために研究したガラパゴス諸島の魅力的な植物や動物とは異なり、カリフォルニア大学サンディエゴ校・生物科学部のジョシュア・ボーリン博士(Joshua Borin, PhD)とジャスティン・メイヤー准教授(Justin Meyer, PhD)は、単純な実験室のフラスコで急速な進化プロセスを記録しています。ボーリン博士とメイヤー准教授は、共進化を実際に研究するため、細菌とウイルスを閉じた実験室のフラスコ内に設置しました。このフラスコはわずか2ティースプーンの大きさです。細菌がウイルスに感染すると、細菌は攻撃を退けるための新しい防御策を進化させます。それに対して、ウイルスはこれらの適応に対抗するために、新しい防御策を回避する自身の進化変化を行います。
わずか3週間で、細菌(大腸菌)とウイルス(バクテリオファージ、または「ファージ」とも呼ばれます)の間で、いくつかの進化的適応が生じます。2023年11月10日にScience誌に発表された新しい発見は、異なる進化的パターンの出現を明らかにしています。この論文のタイトルは「Rapid Bacteria-Phage Coevolution Drives the Emergence of Multiscale Networks.(急速な細菌-ファージ共進化が多スケールネットワークの出現を引き起こす)」です。
「この研究では、進化の力を示しています」とメイヤー准教授は述べています。彼は、「細菌とファージ間の共進化が、非常に複雑な生態学的ネットワークの出現を促進するこ
抗酸化物質グルタチオンがミトコンドリアを健康に保つ仕組み
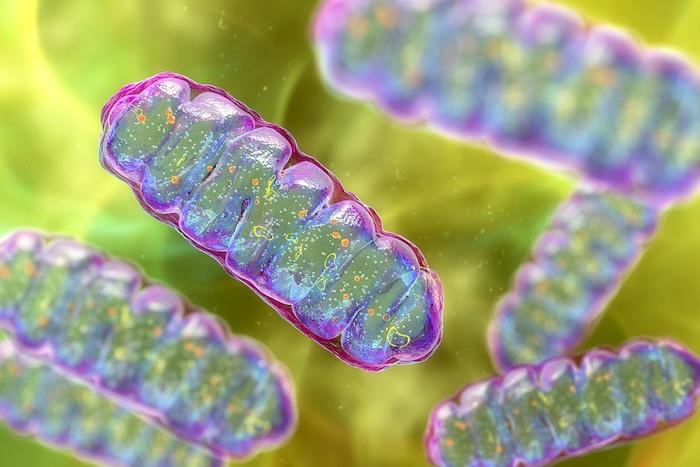 宅配便を受け取る際、配達員があなたに知らせずに玄関先に置いて行った場合、その存在に気づかないことがあります。細胞が栄養を補給する際も同様の状況にあります。細胞壁の外にある栄養素の存在を感知するメカニズムによって、トランスポーター蛋白質が栄養を細胞内に運ぶ必要があります。これまでに特定された数少ない栄養素センシングメカニズムは、人間の健康に大きな影響を与えてきました。特にコレステロールの栄養素センシングメカニズムの発見は、命を救うスタチン薬の開発(およびノーベル賞の受賞)につながりました。これらの発見は、細胞全体が栄養素をどのように検出するかに焦点を当ててきました。しかし、人間の細胞内には自己完結型の、膜によって囲まれたオルガネラが存在し、それらは重要な機能を遂行するために燃料を必要としています。それでは、これらのオルガネラも独自の栄養素センサーを持っている可能性があるのでしょうか?
2023年11月2日にScience誌に掲載された新しい論文で、ロックフェラー大学の代謝調節および遺伝学研究所のキヴァンチ・ビルソイ博士(Kıvanç Birsoy, PhD)と彼の同僚たちは、オルガネラに対する最初のセンサーを発見しました。具体的には、細胞のエネルギー中心であるミトコンドリアのセンサーです。このセンサーは、酸化還元反応を抑制し、適切な鉄レベルを維持する上で重要な役割を果たす、抗酸化物質グルタチオンをミトコンドリア内に運び込む蛋白質の一部です。
「これは非常に実りある発見になると信じています。栄養素センシングについて研究されるたびに、我々は生物学について多くを学び、多くの薬がその結果として開発されてきました。」とビルソイ博士は述べています。
このScience誌の論文は、「ミトコンドリアグルタチオン恒常性の自己調節制御」(Autoregulatory Control o
宅配便を受け取る際、配達員があなたに知らせずに玄関先に置いて行った場合、その存在に気づかないことがあります。細胞が栄養を補給する際も同様の状況にあります。細胞壁の外にある栄養素の存在を感知するメカニズムによって、トランスポーター蛋白質が栄養を細胞内に運ぶ必要があります。これまでに特定された数少ない栄養素センシングメカニズムは、人間の健康に大きな影響を与えてきました。特にコレステロールの栄養素センシングメカニズムの発見は、命を救うスタチン薬の開発(およびノーベル賞の受賞)につながりました。これらの発見は、細胞全体が栄養素をどのように検出するかに焦点を当ててきました。しかし、人間の細胞内には自己完結型の、膜によって囲まれたオルガネラが存在し、それらは重要な機能を遂行するために燃料を必要としています。それでは、これらのオルガネラも独自の栄養素センサーを持っている可能性があるのでしょうか?
2023年11月2日にScience誌に掲載された新しい論文で、ロックフェラー大学の代謝調節および遺伝学研究所のキヴァンチ・ビルソイ博士(Kıvanç Birsoy, PhD)と彼の同僚たちは、オルガネラに対する最初のセンサーを発見しました。具体的には、細胞のエネルギー中心であるミトコンドリアのセンサーです。このセンサーは、酸化還元反応を抑制し、適切な鉄レベルを維持する上で重要な役割を果たす、抗酸化物質グルタチオンをミトコンドリア内に運び込む蛋白質の一部です。
「これは非常に実りある発見になると信じています。栄養素センシングについて研究されるたびに、我々は生物学について多くを学び、多くの薬がその結果として開発されてきました。」とビルソイ博士は述べています。
このScience誌の論文は、「ミトコンドリアグルタチオン恒常性の自己調節制御」(Autoregulatory Control o
ゲノム塩基配列の解読により、より寒冷な気候に生息するウタスズメが大型化する理由が明らかになった
 北米で最も親しまれている鳥の一つであるウタスズメの、驚くべき体サイズの多様性に関する遺伝的基盤が科学者によって解明されました。この発見は、気候変動の課題に適応する能力についても洞察を与えます。2023年11月7日にNature Communications誌に掲載された研究では、メキシコからアラスカにかけてのウタスズメの範囲で観察される体サイズのほぼ3倍の差に大きく貢献している8つの遺伝子変異、すなわちDNA変異を正確に特定するためにゲノムシークエンスが使用されました。例えば、アリューシャン列島に年間を通じて生息するウタスズメは、カリフォルニアの沿岸の湿地に生息する同種の鳥に比べて最大3倍大きくなることがあります。このオープンアクセスの論文は「Candidate Genes Under Selection in Song Sparrows Co-Vary with Climate and Body Mass in Support of Bergmann’s Rule(ウタスズメの選択候補遺伝子は気候や体格と共変化し、ベルクマンの法則を支持する。)」と題されています。
研究の第一著者であり、ブリティッシュコロンビア大学(UBC)の林業学部の博士課程学生であるキャサリン・カーベック氏(Katherine Carbeck)は、多くの種で体サイズが大きく異なる気候条件の下で予測可能に変化すると説明しています。これは「ベルクマンの法則」と呼ばれ、寒冷な気候での生物は体温を調節するためにより大きくなる傾向があるとされています。「局所適応」した個体群の存在は、自然選択がウタスズメの個体群の遺伝的構成を形成し、様々な気候条件下での生存と繁殖を可能にしたことを示唆しています」とカーベック氏は述べています。しかし、ベルクマンの法則の下での遺伝的メカニズムはこれまで不明でした。
全ゲノム
北米で最も親しまれている鳥の一つであるウタスズメの、驚くべき体サイズの多様性に関する遺伝的基盤が科学者によって解明されました。この発見は、気候変動の課題に適応する能力についても洞察を与えます。2023年11月7日にNature Communications誌に掲載された研究では、メキシコからアラスカにかけてのウタスズメの範囲で観察される体サイズのほぼ3倍の差に大きく貢献している8つの遺伝子変異、すなわちDNA変異を正確に特定するためにゲノムシークエンスが使用されました。例えば、アリューシャン列島に年間を通じて生息するウタスズメは、カリフォルニアの沿岸の湿地に生息する同種の鳥に比べて最大3倍大きくなることがあります。このオープンアクセスの論文は「Candidate Genes Under Selection in Song Sparrows Co-Vary with Climate and Body Mass in Support of Bergmann’s Rule(ウタスズメの選択候補遺伝子は気候や体格と共変化し、ベルクマンの法則を支持する。)」と題されています。
研究の第一著者であり、ブリティッシュコロンビア大学(UBC)の林業学部の博士課程学生であるキャサリン・カーベック氏(Katherine Carbeck)は、多くの種で体サイズが大きく異なる気候条件の下で予測可能に変化すると説明しています。これは「ベルクマンの法則」と呼ばれ、寒冷な気候での生物は体温を調節するためにより大きくなる傾向があるとされています。「局所適応」した個体群の存在は、自然選択がウタスズメの個体群の遺伝的構成を形成し、様々な気候条件下での生存と繁殖を可能にしたことを示唆しています」とカーベック氏は述べています。しかし、ベルクマンの法則の下での遺伝的メカニズムはこれまで不明でした。
全ゲノム
インフルエンザAウイルス検出用の金属増強蛍光プローブを開発。プローブを組み込んだセンサーにより、迅速、正確、費用対効果が高く、高感度な分子診断が可能に。
 第一次世界大戦中のインフルエンザの流行、2010年代の中東呼吸器症候群コロナウイルス(MERS-CoV)の流行、そして近年のCOVID-19パンデミックは、伝染性のあるウイルス性呼吸器疾患が人類の歴史の中で頻繁に出現することを明らかにしました。人口密度の増加、交通機関での密接な接触、およびコネクティビティの向上により、このようなウイルス感染の拡散率が著しく増加しています。ウイルスの伝播と大規模な感染を最小限に抑えるためには、ウイルスを検出し、特定することができる迅速な診断テストが感染した患者の効果的な隔離と治療に不可欠です。
近年、ウイルス検出の診断ツールとして蛍光ラテラルフローイムノアッセイ(fluorescence-based lateral flow immunoassay : LFI)が人気を集めています。これは、ウイルス量が存在する特殊な照明条件下で発光する分子を使用する迅速なウイルス検出プラットフォームです。しかし、検出感度に関連するいくつかの問題により、この検出プラットフォームの性能は限定されています。最近の研究では、韓国の光州科学技術院(GIST)の化学科のミンゴン・キム教授(Min-Gon Kim)が率いる研究チームが、複雑な診断用ラボ機器を必要とせずに、インフルエンザウイルスタンパク質を正確かつ迅速に検出できる金ナノロッド(GNR)ベースのプローブで強化されたこれらの蛍光ベースのLFIsを実証しました。
この研究は、2023年9月12日にACS Nano誌に掲載されました。この論文のタイトルは「金ナノロッドでコーティングされた中孔性シリカの蛍光増強プラズモニックアプローチによるインフルエンザAウイルス検出のための高感度側流免疫センサー(Plasmonic Approach to Fluorescence Enhancement of Mesopo
第一次世界大戦中のインフルエンザの流行、2010年代の中東呼吸器症候群コロナウイルス(MERS-CoV)の流行、そして近年のCOVID-19パンデミックは、伝染性のあるウイルス性呼吸器疾患が人類の歴史の中で頻繁に出現することを明らかにしました。人口密度の増加、交通機関での密接な接触、およびコネクティビティの向上により、このようなウイルス感染の拡散率が著しく増加しています。ウイルスの伝播と大規模な感染を最小限に抑えるためには、ウイルスを検出し、特定することができる迅速な診断テストが感染した患者の効果的な隔離と治療に不可欠です。
近年、ウイルス検出の診断ツールとして蛍光ラテラルフローイムノアッセイ(fluorescence-based lateral flow immunoassay : LFI)が人気を集めています。これは、ウイルス量が存在する特殊な照明条件下で発光する分子を使用する迅速なウイルス検出プラットフォームです。しかし、検出感度に関連するいくつかの問題により、この検出プラットフォームの性能は限定されています。最近の研究では、韓国の光州科学技術院(GIST)の化学科のミンゴン・キム教授(Min-Gon Kim)が率いる研究チームが、複雑な診断用ラボ機器を必要とせずに、インフルエンザウイルスタンパク質を正確かつ迅速に検出できる金ナノロッド(GNR)ベースのプローブで強化されたこれらの蛍光ベースのLFIsを実証しました。
この研究は、2023年9月12日にACS Nano誌に掲載されました。この論文のタイトルは「金ナノロッドでコーティングされた中孔性シリカの蛍光増強プラズモニックアプローチによるインフルエンザAウイルス検出のための高感度側流免疫センサー(Plasmonic Approach to Fluorescence Enhancement of Mesopo
長い間、ヒトデ には頭がないと考えられてきたが、実はそうではないかもしれない。
 何世紀にもわたり、自然科学者たちは ヒトデ の体のどの部分が「頭」にあたるのかについて謎に包まれていました。ミミズや魚のように、どちらが頭でどちらが尾か明らかな生物とは異なり、ヒトデは5つの同じ形をした腕を持ち、どの腕も海底を移動する際に先頭になることができます。この特異な体型から、多くの研究者はヒトデには頭が存在しないのではないかと結論付けていました。しかし、スタンフォード大学とカリフォルニア大学バークレー校の研究者が率いる2つのラボが、実際はまったく逆であることを示す研究結果を発表しました。
ヒトデの「頭」に関する新発見:進化により体を失ったか
彼らの研究によると、ヒトデの幼生では頭の発達に関連する遺伝子のシグネチャーがほぼ全体に存在している一方で、動物の胴体や尾部をコードする遺伝子の発現はほとんど見られませんでした。
さらに驚くべき発見として、通常は頭部の最も前方に関連する分子シグネチャーが、ヒトデの各腕の中央に位置し、腕の端に向かうにつれて後方に進行する傾向がありました。
この研究はNature誌に掲載され、「Molecular Evidence of Anteroposterior Patterning in Adult Echinoderms(成体棘皮動物における前後軸パターニングの分子的証拠)」と題されています。この論文の主著者であるローラン・フォルメリー博士(Laurent Formery, PhD)は、「ヒトデは胴体を完全に失い、海底を這う頭部だけとして最もよく説明される」と述べています。「これは科学者たちがこれまで想定していたこととは全く異なります。」
この研究の共同シニア著者である、スタンフォード大学の海洋生物学者クリストファー・ロウ博士(Christopher Lowe, PhD)と、カリフォルニア大学バークレー校の動物種の分子進化の専
何世紀にもわたり、自然科学者たちは ヒトデ の体のどの部分が「頭」にあたるのかについて謎に包まれていました。ミミズや魚のように、どちらが頭でどちらが尾か明らかな生物とは異なり、ヒトデは5つの同じ形をした腕を持ち、どの腕も海底を移動する際に先頭になることができます。この特異な体型から、多くの研究者はヒトデには頭が存在しないのではないかと結論付けていました。しかし、スタンフォード大学とカリフォルニア大学バークレー校の研究者が率いる2つのラボが、実際はまったく逆であることを示す研究結果を発表しました。
ヒトデの「頭」に関する新発見:進化により体を失ったか
彼らの研究によると、ヒトデの幼生では頭の発達に関連する遺伝子のシグネチャーがほぼ全体に存在している一方で、動物の胴体や尾部をコードする遺伝子の発現はほとんど見られませんでした。
さらに驚くべき発見として、通常は頭部の最も前方に関連する分子シグネチャーが、ヒトデの各腕の中央に位置し、腕の端に向かうにつれて後方に進行する傾向がありました。
この研究はNature誌に掲載され、「Molecular Evidence of Anteroposterior Patterning in Adult Echinoderms(成体棘皮動物における前後軸パターニングの分子的証拠)」と題されています。この論文の主著者であるローラン・フォルメリー博士(Laurent Formery, PhD)は、「ヒトデは胴体を完全に失い、海底を這う頭部だけとして最もよく説明される」と述べています。「これは科学者たちがこれまで想定していたこととは全く異なります。」
この研究の共同シニア著者である、スタンフォード大学の海洋生物学者クリストファー・ロウ博士(Christopher Lowe, PhD)と、カリフォルニア大学バークレー校の動物種の分子進化の専
新研究により、ヒマワリが太陽を追跡する能力は複数の光反応に依存していることが明らかに。
 新たな研究によれば、ヒマワリが日中に太陽の東から西へと向きを変え、次の日の出前に再び東を向く能力は、複数の光反応に依存していることが明らかになりました。この研究は、カリフォルニア大学デービス校(University of California Davis)のステイシー・ハーマー博士(Stacey Harmer, PhD)と同僚により行われたもので、このよく知られた植物行動の理解を深め、従来の定型的な光依存応答経路への依存に関する仮説を覆しました。
オープンアクセスジャーナル「PLOS Biology」で発表されたこの論文のタイトルは「Multiple Light Signaling Pathways Control Solar Tracking in Sunflowers(複数の光シグナリング経路がヒマワリの太陽追跡を制御する)」です。
植物は移動することができないため、隣の植物に光を遮られたり、日陰で発芽したりした場合、光に向かって成長することで対処します。このような反応を促進するために、いくつかの分子システムが存在し、その中で最もよく知られているのは光屈性反応です。このシステムでは、青色光が幼苗に不均等に当たると、フォトトロピンと呼ばれるタンパク質によって植物ホルモンの再分布が起こり、成長している先端が光に向かって曲がるようになります。
ヒマワリの太陽追跡能力である日照追跡(heliotropism)が、同じ受容体とホルモンを使用する光屈性反応の一形態であるかどうかは、明らかではありませんでした。この問題を探求するため、著者たちは、実験室で青色光に向かって曲がるヒマワリと、野外で太陽を追跡するヒマワリの遺伝子活動パターンを比較しました。
驚くべきことに、実験室での光屈性曲がりに責任を持つ遺伝子の急速な上昇が、太陽の動きに反応して顕著な活動差を示すものはわずか
新たな研究によれば、ヒマワリが日中に太陽の東から西へと向きを変え、次の日の出前に再び東を向く能力は、複数の光反応に依存していることが明らかになりました。この研究は、カリフォルニア大学デービス校(University of California Davis)のステイシー・ハーマー博士(Stacey Harmer, PhD)と同僚により行われたもので、このよく知られた植物行動の理解を深め、従来の定型的な光依存応答経路への依存に関する仮説を覆しました。
オープンアクセスジャーナル「PLOS Biology」で発表されたこの論文のタイトルは「Multiple Light Signaling Pathways Control Solar Tracking in Sunflowers(複数の光シグナリング経路がヒマワリの太陽追跡を制御する)」です。
植物は移動することができないため、隣の植物に光を遮られたり、日陰で発芽したりした場合、光に向かって成長することで対処します。このような反応を促進するために、いくつかの分子システムが存在し、その中で最もよく知られているのは光屈性反応です。このシステムでは、青色光が幼苗に不均等に当たると、フォトトロピンと呼ばれるタンパク質によって植物ホルモンの再分布が起こり、成長している先端が光に向かって曲がるようになります。
ヒマワリの太陽追跡能力である日照追跡(heliotropism)が、同じ受容体とホルモンを使用する光屈性反応の一形態であるかどうかは、明らかではありませんでした。この問題を探求するため、著者たちは、実験室で青色光に向かって曲がるヒマワリと、野外で太陽を追跡するヒマワリの遺伝子活動パターンを比較しました。
驚くべきことに、実験室での光屈性曲がりに責任を持つ遺伝子の急速な上昇が、太陽の動きに反応して顕著な活動差を示すものはわずか
系統学的研究がオレンジの起源と酸味の遺伝を解明
 柑橘類は世界中で栽培されていますが、その起源については長らく謎が多く、ヒマラヤの麓やオーストラリア北東部のジャングルなど様々な地域が起源地と推測されてきました。しかし、最近行われた広範囲にわたる系統学的分析により、柑橘類の祖先が約2,500万年前に古代インドプレートで発生したことが明らかになりました。
この研究結果は、「Pangenome Analysis Provides Insight into the Evolution of the Orange Subfamily and of Key Gene for Citric Acid Accumulation in Citrus Fruits」(パンゲノム分析がオレンジ亜科の進化と柑橘類の果実におけるクエン酸蓄積の鍵遺伝子に関する洞察を提供する)と題された論文にてNature Genetics誌に掲載されました。
柑橘類の分類は複雑で、オレンジ亜科(Aurantioideae)は33の属、210種以上の種、品種や栽培品種を含みます。これには、野生種から派生したもの、2つ以上の野生種間の交配によって生じたもの、交配種とその親種の交配によって生じたものなどがあります。実際の柑橘類には、小さなクマクワットから大きなポメロ、そしてタコのような形をしたブッダの手まで多様なものが含まれます。柑橘類の親戚には、カレーの木(Bergera koenigii)やオレンジジャスミン(Murraya paniculata)などがあります。
この起源の謎を解き明かすため、華中農業大学のショウ キョウ博士(Qiang Xu)らは314種のゲノム配列を分析し、オレンジ亜科の系統樹を作成しました。この系統樹から、最も古い種が分岐したのは約2,500万年前であり、インドプレートがアジアプレートと衝突し、ヒマラヤ山脈が形成される前のことであるこ
柑橘類は世界中で栽培されていますが、その起源については長らく謎が多く、ヒマラヤの麓やオーストラリア北東部のジャングルなど様々な地域が起源地と推測されてきました。しかし、最近行われた広範囲にわたる系統学的分析により、柑橘類の祖先が約2,500万年前に古代インドプレートで発生したことが明らかになりました。
この研究結果は、「Pangenome Analysis Provides Insight into the Evolution of the Orange Subfamily and of Key Gene for Citric Acid Accumulation in Citrus Fruits」(パンゲノム分析がオレンジ亜科の進化と柑橘類の果実におけるクエン酸蓄積の鍵遺伝子に関する洞察を提供する)と題された論文にてNature Genetics誌に掲載されました。
柑橘類の分類は複雑で、オレンジ亜科(Aurantioideae)は33の属、210種以上の種、品種や栽培品種を含みます。これには、野生種から派生したもの、2つ以上の野生種間の交配によって生じたもの、交配種とその親種の交配によって生じたものなどがあります。実際の柑橘類には、小さなクマクワットから大きなポメロ、そしてタコのような形をしたブッダの手まで多様なものが含まれます。柑橘類の親戚には、カレーの木(Bergera koenigii)やオレンジジャスミン(Murraya paniculata)などがあります。
この起源の謎を解き明かすため、華中農業大学のショウ キョウ博士(Qiang Xu)らは314種のゲノム配列を分析し、オレンジ亜科の系統樹を作成しました。この系統樹から、最も古い種が分岐したのは約2,500万年前であり、インドプレートがアジアプレートと衝突し、ヒマラヤ山脈が形成される前のことであるこ
ナノスケールのDNA格子をシリカにコーティングし、史上最高の重量比強度を持つ材料を開発
 エネルギー効率の高い電気自動車や優れた医療機器など、多岐にわたる用途に役立つ軽量で丈夫な材料の開発が進んでいます。米エネルギー省ブルックヘブン国立研究所、コロンビア大学、コネチカット大学の研究者らは、DNAナノ格子にシリカを薄くコーティングすることで、鋼鉄よりも4倍強く、5倍軽い材料を作り出しました。この材料の強さは、格子要素の完璧な配置と超薄いシリカ膜の強度に起因しています。DNAテンプレート法は、さまざまな形状の格子を、さまざまな材料でコーティングするために適応可能です。
この研究結果はCell Reports Physical Scienceで公開され「高強度・軽量ナノアーキテクチャードシリカ(High-Strength, Lightweight Nano-Architected Silica)」と題されています。
反復する順序立てられた単位、すなわち格子で構成された構造は、軽量でありながら強靭です。フレームが強度をもたらし、開いた空間が軽さを与えます。興味深いことに、格子要素のサイズを小さくすると強度が増し、ナノスケールの格子は、同じ材料で構成された固体よりもさらに強くなることがあります。超強力であるためには、格子は完璧でなければならず、亀裂や空洞などの欠陥があってはなりません。もちろん、非常に小さい(50nm未満)完璧な格子を設計することは非常に困難です。
コロンビア大学とブルックヘブンの機能性ナノ材料センター(CFN)のナノ材料科学者、オレグ・ガング博士(Oleg Gang)とアーロン・ミケルソン博士(Aaron Michelson)は、驚くべき材料を使って、微小で完璧な格子を作成しています:それはDNAです。
DNAの鎖は、塩基対間の相互作用により自動的に3Dの形状に折りたたまれるため、DNA鎖の3D形状を設計することは、その配列を設計することと同
エネルギー効率の高い電気自動車や優れた医療機器など、多岐にわたる用途に役立つ軽量で丈夫な材料の開発が進んでいます。米エネルギー省ブルックヘブン国立研究所、コロンビア大学、コネチカット大学の研究者らは、DNAナノ格子にシリカを薄くコーティングすることで、鋼鉄よりも4倍強く、5倍軽い材料を作り出しました。この材料の強さは、格子要素の完璧な配置と超薄いシリカ膜の強度に起因しています。DNAテンプレート法は、さまざまな形状の格子を、さまざまな材料でコーティングするために適応可能です。
この研究結果はCell Reports Physical Scienceで公開され「高強度・軽量ナノアーキテクチャードシリカ(High-Strength, Lightweight Nano-Architected Silica)」と題されています。
反復する順序立てられた単位、すなわち格子で構成された構造は、軽量でありながら強靭です。フレームが強度をもたらし、開いた空間が軽さを与えます。興味深いことに、格子要素のサイズを小さくすると強度が増し、ナノスケールの格子は、同じ材料で構成された固体よりもさらに強くなることがあります。超強力であるためには、格子は完璧でなければならず、亀裂や空洞などの欠陥があってはなりません。もちろん、非常に小さい(50nm未満)完璧な格子を設計することは非常に困難です。
コロンビア大学とブルックヘブンの機能性ナノ材料センター(CFN)のナノ材料科学者、オレグ・ガング博士(Oleg Gang)とアーロン・ミケルソン博士(Aaron Michelson)は、驚くべき材料を使って、微小で完璧な格子を作成しています:それはDNAです。
DNAの鎖は、塩基対間の相互作用により自動的に3Dの形状に折りたたまれるため、DNA鎖の3D形状を設計することは、その配列を設計することと同
赤痢菌の毒性発現の重要なトリガーを特定
 病原体における毒性を活性化する「スイッチ」を研究している多分野のチームが、赤痢の主な原因である赤痢菌における毒性を制御するタンパク質VirBの働きを特定しました。赤痢菌は世界的に赤痢関連死の主な原因となっており、新しい治療標的が求められています。
ネバダ大学ラスベガス校のヘレン・ウィング博士(Helen Wing)が率いる研究チームによると、VirBは赤痢菌の50以上の毒性遺伝子を活性化する前に、ヌクレオシド三リン酸CTP(ATPのアデニンの代わりにシチジンが結合している)に結合する必要があることが明らかになりました。この研究は、重要なグローバル病原体の毒性メカニズムを解明し、これと類似の毒性メカニズムを持つ他の病原体の新たな治療法の道を開く可能性があります。
この研究は「VirB, a Key Transcriptional Regulator of Shigella Virulence, Requires a CTP Ligand for Its Regulatory Activities(赤痢菌毒性の重要な転写調節因子VirBは、その調節活動にCTPリガンドを必要とする」)」というタイトルでmBio誌に掲載されました。
VirBタンパク質は赤痢菌の大規模な毒性プラスミドによってコードされており、virBが欠けている細胞は非毒性です。VirBは毒性遺伝子を活性化するものの、従来の転写因子のようには働きません。代わりに、ヒストン様核小体構造タンパク質H-NSを取り除くことで遺伝子の無音化を解除します。H-NSはDNAをコーティングし凝縮することで転写を防ぎます。VirBが結合すると、H-NS-DNA複合体を再編成し、DNAを転写のために露出させます。VirBは、H-NSを取り除くことで本質的に遺伝子を解錠します。
VirBは、細胞分裂前の染色体とプラスミドの分
病原体における毒性を活性化する「スイッチ」を研究している多分野のチームが、赤痢の主な原因である赤痢菌における毒性を制御するタンパク質VirBの働きを特定しました。赤痢菌は世界的に赤痢関連死の主な原因となっており、新しい治療標的が求められています。
ネバダ大学ラスベガス校のヘレン・ウィング博士(Helen Wing)が率いる研究チームによると、VirBは赤痢菌の50以上の毒性遺伝子を活性化する前に、ヌクレオシド三リン酸CTP(ATPのアデニンの代わりにシチジンが結合している)に結合する必要があることが明らかになりました。この研究は、重要なグローバル病原体の毒性メカニズムを解明し、これと類似の毒性メカニズムを持つ他の病原体の新たな治療法の道を開く可能性があります。
この研究は「VirB, a Key Transcriptional Regulator of Shigella Virulence, Requires a CTP Ligand for Its Regulatory Activities(赤痢菌毒性の重要な転写調節因子VirBは、その調節活動にCTPリガンドを必要とする」)」というタイトルでmBio誌に掲載されました。
VirBタンパク質は赤痢菌の大規模な毒性プラスミドによってコードされており、virBが欠けている細胞は非毒性です。VirBは毒性遺伝子を活性化するものの、従来の転写因子のようには働きません。代わりに、ヒストン様核小体構造タンパク質H-NSを取り除くことで遺伝子の無音化を解除します。H-NSはDNAをコーティングし凝縮することで転写を防ぎます。VirBが結合すると、H-NS-DNA複合体を再編成し、DNAを転写のために露出させます。VirBは、H-NSを取り除くことで本質的に遺伝子を解錠します。
VirBは、細胞分裂前の染色体とプラスミドの分
脳内ノルアドレナリンシステムの解明に先駆的な新手法を用いる-「ヒトの脳回路の機能解明へのマイルストーン」となる研究成果 専門家コメント
 国際的な研究チームが、注意欠如・多動性障害、うつ病、不安症を治療する薬の標的となってきた脳のノルアドレナリン(NA)系に関して貴重な洞察を提供しました。この研究の重要性は、その発見だけでなく、てんかんのモニタリング用に定期的に埋め込まれる標準的な臨床電極から、実時間の化学活動を記録する革新的な方法論を開発した点にもあります。この研究は「Current Biology」誌のオンライン版に10月23日(月)に掲載され、脳の化学に新たな洞察を与えるだけでなく、生きた人間の脳からデータを取得するという顕著な新しい能力を浮き彫りにしました。オープンアクセスの論文のタイトルは「Noradrenaline Tracks Emotional Modulation of Attention in Human Amygdala(ヒト扁桃体における注意の感情的変調を追跡するノルアドレナリン)」です。
「私たちのグループは、意識的な人間からボルタンメトリーによって記録された最初の『高速』神経化学を記述しています」と、バージニア工科大学のVTC Vernon Mountcastle研究教授であり、Fralin Biomedical Research Institute at VTCの人間神経科学研究センターおよび人間神経画像化研究所の所長であるリード・モンタギュ博士(Read Montague PhD)は述べています。「これは大きな一歩であり、方法論的アプローチは完全に人間で実施されました - 11年以上の徹底的な開発を経て。」
方法について
ボルタンメトリー技術は、約30年前から、ネズミや他の実験モデルで脳機能に関する深い洞察をもたらすために使用されてきましたが、脳に電極を挿入する必要があるため、人間での使用は明確な方法がありませんでした。
「その代わりに、医療手続きで患者に既に使用さ
国際的な研究チームが、注意欠如・多動性障害、うつ病、不安症を治療する薬の標的となってきた脳のノルアドレナリン(NA)系に関して貴重な洞察を提供しました。この研究の重要性は、その発見だけでなく、てんかんのモニタリング用に定期的に埋め込まれる標準的な臨床電極から、実時間の化学活動を記録する革新的な方法論を開発した点にもあります。この研究は「Current Biology」誌のオンライン版に10月23日(月)に掲載され、脳の化学に新たな洞察を与えるだけでなく、生きた人間の脳からデータを取得するという顕著な新しい能力を浮き彫りにしました。オープンアクセスの論文のタイトルは「Noradrenaline Tracks Emotional Modulation of Attention in Human Amygdala(ヒト扁桃体における注意の感情的変調を追跡するノルアドレナリン)」です。
「私たちのグループは、意識的な人間からボルタンメトリーによって記録された最初の『高速』神経化学を記述しています」と、バージニア工科大学のVTC Vernon Mountcastle研究教授であり、Fralin Biomedical Research Institute at VTCの人間神経科学研究センターおよび人間神経画像化研究所の所長であるリード・モンタギュ博士(Read Montague PhD)は述べています。「これは大きな一歩であり、方法論的アプローチは完全に人間で実施されました - 11年以上の徹底的な開発を経て。」
方法について
ボルタンメトリー技術は、約30年前から、ネズミや他の実験モデルで脳機能に関する深い洞察をもたらすために使用されてきましたが、脳に電極を挿入する必要があるため、人間での使用は明確な方法がありませんでした。
「その代わりに、医療手続きで患者に既に使用さ
乗り物酔いの原因となるニューロンが特定された
 運動から得られる情報は、内耳から脳の「前庭核」と呼ばれる部分へ伝わり、この部分は乗り物酔いにおいて重要な役割を果たします。UAB Institut de Neurociències (INc-UAB) とワシントン大学の研究者らは、マウスでこの不快感を引き起こす特定のニューロンを同定しました。研究グループは、短時間かつ繰り返し回転させられたマウスの前庭核の細胞を分析し、VGLUT2タンパク質を発現するニューロンが乗り物酔いの症状において重要であることを実証しました。著者らによると、これらのニューロンは回転による乗り物酔いの影響、例えば食欲減少、体温低下、運動量の低下、条件付け味覚回避(回転の時間に近い時に導入された味への嫌悪)などに必要です。
この研究は PNAS に掲載され、オープンアクセスの論文は「Vestibular CCK Signaling Drives Motion Sickness–Like Behavior in Mice(前庭CCKシグナリングがマウスの乗り物酔い様行動を引き起こす)」と題されています。
研究者らは、これらのニューロンをケモジェネティクス(これらの特定細胞と相互作用するために特別に設計された分子)によってブロックすることで、回転させられたマウスの乗り物酔いを防ぐことができることを発見しました。また、光(オプトジェネティクス)によるこれらの活性化は、回転させられた時と同じめまいの症状を静止しているマウスで再現します。
特に、研究者らはVGLUT2ニューロンのサブグループでコレシストキニン遺伝子(CCKニューロン)を発現するものが乗り物酔いに責任があることを特定し、これらは不快な感覚を生成する脳の領域である側脳室核にシグナルを送ることがわかりました。
「CCK-A受容体をブロックする薬を投与されたマウスは側脳室核の活性化が少なく、乗
運動から得られる情報は、内耳から脳の「前庭核」と呼ばれる部分へ伝わり、この部分は乗り物酔いにおいて重要な役割を果たします。UAB Institut de Neurociències (INc-UAB) とワシントン大学の研究者らは、マウスでこの不快感を引き起こす特定のニューロンを同定しました。研究グループは、短時間かつ繰り返し回転させられたマウスの前庭核の細胞を分析し、VGLUT2タンパク質を発現するニューロンが乗り物酔いの症状において重要であることを実証しました。著者らによると、これらのニューロンは回転による乗り物酔いの影響、例えば食欲減少、体温低下、運動量の低下、条件付け味覚回避(回転の時間に近い時に導入された味への嫌悪)などに必要です。
この研究は PNAS に掲載され、オープンアクセスの論文は「Vestibular CCK Signaling Drives Motion Sickness–Like Behavior in Mice(前庭CCKシグナリングがマウスの乗り物酔い様行動を引き起こす)」と題されています。
研究者らは、これらのニューロンをケモジェネティクス(これらの特定細胞と相互作用するために特別に設計された分子)によってブロックすることで、回転させられたマウスの乗り物酔いを防ぐことができることを発見しました。また、光(オプトジェネティクス)によるこれらの活性化は、回転させられた時と同じめまいの症状を静止しているマウスで再現します。
特に、研究者らはVGLUT2ニューロンのサブグループでコレシストキニン遺伝子(CCKニューロン)を発現するものが乗り物酔いに責任があることを特定し、これらは不快な感覚を生成する脳の領域である側脳室核にシグナルを送ることがわかりました。
「CCK-A受容体をブロックする薬を投与されたマウスは側脳室核の活性化が少なく、乗
サメの極低突然変異率が新研究で明らかに
 約4億から5億年前から海を埋め尽くしているサメは、その間に地球や多くの生物が大きく変化してきたにも関わらず、基本的な脊椎動物のグループとしてあまり変わっていません。その体形や生物学的特徴はほとんど変化していません。この理由を明らかにしたのは、ドイツ、オーストラリア、スウェーデン、アメリカから成る国際研究チームです。彼らは、サメが脊椎動物の中で最も低い世代間の突然変異率を持っていることを発見しました。
この研究は、ドイツのヴュルツブルク大学 (Julius-Maximilians-Universität Würzburg, JMU) の発生生化学部門のマンフレッド・シャルトル博士(Manfred Schartl, PhD)の研究グループが主導し、2023年10月19日に「Nature Communications」誌に発表されました。公開された論文のタイトルは「Low Mutation Rate in Epaulette Sharks Is Consistent with a Slow Rate of Evolution in Sharks(マモンツキテンジクザメの低い突然変異率はサメの遅い進化速度と一致する)」です。
マモンツキテンジクザメに関する研究では、オーストラリア北東沖でサメが捕獲され、その後モナシュ大学のオーストラリア再生医療研究所 (Australian Regenerative Medicine Institute, ARMI) で繁殖ステーションが設置されました。これにより、初めてサメの家族ツリー内の突然変異率を遺伝学的に評価することが可能になりました。
まず研究チームは高品質のリファレンスゲノムを作成し、親サメの全ゲノムをシーケンスした後、9匹の子供の新たな突然変異を発見しました。
その結果、1塩基対あたりの世代ごとの突然変異率が7×10-10
約4億から5億年前から海を埋め尽くしているサメは、その間に地球や多くの生物が大きく変化してきたにも関わらず、基本的な脊椎動物のグループとしてあまり変わっていません。その体形や生物学的特徴はほとんど変化していません。この理由を明らかにしたのは、ドイツ、オーストラリア、スウェーデン、アメリカから成る国際研究チームです。彼らは、サメが脊椎動物の中で最も低い世代間の突然変異率を持っていることを発見しました。
この研究は、ドイツのヴュルツブルク大学 (Julius-Maximilians-Universität Würzburg, JMU) の発生生化学部門のマンフレッド・シャルトル博士(Manfred Schartl, PhD)の研究グループが主導し、2023年10月19日に「Nature Communications」誌に発表されました。公開された論文のタイトルは「Low Mutation Rate in Epaulette Sharks Is Consistent with a Slow Rate of Evolution in Sharks(マモンツキテンジクザメの低い突然変異率はサメの遅い進化速度と一致する)」です。
マモンツキテンジクザメに関する研究では、オーストラリア北東沖でサメが捕獲され、その後モナシュ大学のオーストラリア再生医療研究所 (Australian Regenerative Medicine Institute, ARMI) で繁殖ステーションが設置されました。これにより、初めてサメの家族ツリー内の突然変異率を遺伝学的に評価することが可能になりました。
まず研究チームは高品質のリファレンスゲノムを作成し、親サメの全ゲノムをシーケンスした後、9匹の子供の新たな突然変異を発見しました。
その結果、1塩基対あたりの世代ごとの突然変異率が7×10-10
がん細胞死を活性化する「スイッチ」を発見
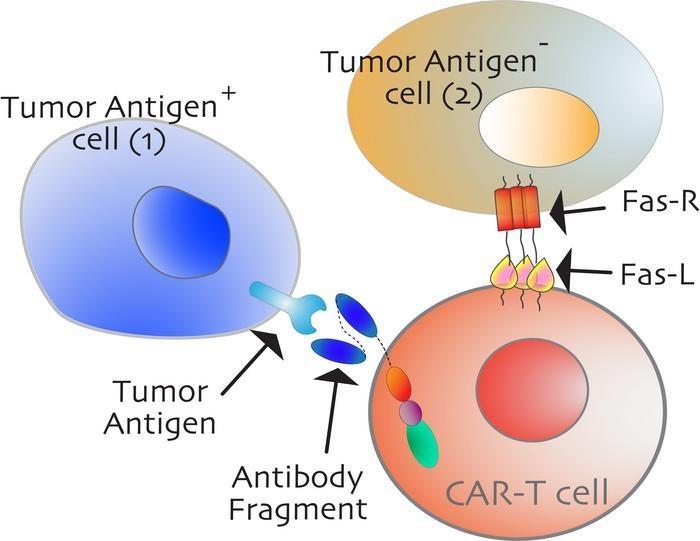 カリフォルニア大学デービス総合がんセンターの研究チームが、CD95受容体(Fasとも呼ばれる)上の重要なエピトープ(大きなタンパク質を活性化させるタンパク質の一部)を特定し、細胞の自滅を引き起こすことができることを発見しました。この新たな細胞死の誘導能力は、がん治療の向上への道を開くかもしれません。この研究結果は、2023年10月14日にNature誌の「Cell Death & Differentiation」に掲載されました。
CD95受容体は細胞膜に存在するタンパク質受容体で、活性化すると細胞が自己破壊する信号を放出します。Fasを調節することで、固形腫瘍、特に卵巣がんにおいて、キメラ抗原受容体(CAR)T細胞療法の恩恵を拡大することも可能です。
ジョギンダー・トゥシル-シン博士(Jogender Tushir-Singh, PhD)は、「我々は、細胞毒性FasシグナルおよびCAR T細胞による抗腫瘍作用に最も重要なエピトープを発見した」と述べています。トゥシル-シン博士は、UCデービスの医学微生物学および免疫学部の准教授で、この研究の主執筆者です。「以前の取り組みではこの受容体をターゲットにすることは成功しなかった。しかし、今回このエピトープを特定したことで、腫瘍内のFasを標的にする治療法への道が開かれるかもしれない」とトゥシル-シン博士は言います。
オープンアクセスの論文のタイトルは「Characterizing the Regulatory Fas (CD95) Epitope Critical for Agonist Antibody Targeting and CAR-T Bystander Function in Ovarian Cancer(卵巣がんにおけるアゴニスト抗体標的とCAR-Tバイスタンダー機能のための調節的Fas(CD95
カリフォルニア大学デービス総合がんセンターの研究チームが、CD95受容体(Fasとも呼ばれる)上の重要なエピトープ(大きなタンパク質を活性化させるタンパク質の一部)を特定し、細胞の自滅を引き起こすことができることを発見しました。この新たな細胞死の誘導能力は、がん治療の向上への道を開くかもしれません。この研究結果は、2023年10月14日にNature誌の「Cell Death & Differentiation」に掲載されました。
CD95受容体は細胞膜に存在するタンパク質受容体で、活性化すると細胞が自己破壊する信号を放出します。Fasを調節することで、固形腫瘍、特に卵巣がんにおいて、キメラ抗原受容体(CAR)T細胞療法の恩恵を拡大することも可能です。
ジョギンダー・トゥシル-シン博士(Jogender Tushir-Singh, PhD)は、「我々は、細胞毒性FasシグナルおよびCAR T細胞による抗腫瘍作用に最も重要なエピトープを発見した」と述べています。トゥシル-シン博士は、UCデービスの医学微生物学および免疫学部の准教授で、この研究の主執筆者です。「以前の取り組みではこの受容体をターゲットにすることは成功しなかった。しかし、今回このエピトープを特定したことで、腫瘍内のFasを標的にする治療法への道が開かれるかもしれない」とトゥシル-シン博士は言います。
オープンアクセスの論文のタイトルは「Characterizing the Regulatory Fas (CD95) Epitope Critical for Agonist Antibody Targeting and CAR-T Bystander Function in Ovarian Cancer(卵巣がんにおけるアゴニスト抗体標的とCAR-Tバイスタンダー機能のための調節的Fas(CD95
脳のモザイク染色体と局所性てんかんの新たな原因が特定された
 「Nature Genetics」誌にて、研究者らが脳の染色体モザイク症の新たな起源メカニズムを報告し、脳モザイク染色体1qの増加が特定の臨床的表現型と関連していることを発見しました。通常、人々の体内の各細胞は同じ遺伝情報を持っています。しかし、時には2つ以上の遺伝的に異なる細胞群を持つことがあります。これは主に胎児期に起こり、「モザイク症」と呼ばれています。これらの細胞群の一部には、疾患や障害を引き起こす遺伝的変化が存在することがあります。神経学者、神経外科医、ゲノム学専門家は、てんかん手術中に切除された脳組織でモザイク症を検査するために協力しました。研究によると、脳のモザイク症はてんかんに大きく関与していることが示されています。
2023年10月23日に「Nature Genetics」誌に発表された新しい研究において、オハイオ州コロンバスのネーションワイド・チルドレンズ病院の研究者らは、焦点性てんかんを持つ一部の子供たちの脳モザイク症の別の起源を記述しています。この論文のタイトルは「Post-Zygotic Rescue of Meiotic Errors Causes Brain Mosaicism and Focal Epilepsy(有糸分裂誤りの後期救済が脳モザイク症と焦点性てんかんを引き起こす)」です。
アダム・オステンドルフ博士(Adam Ostendorf, PhD)によると、「約26人に1人が生涯にわたっててんかんを経験することになります。その原因は非常に多様で、てんかん患者の半数以上では謎のままです」とのこと。
てんかんのある子供の約3分の1は、薬剤に抵抗性の発作を持ち、これが彼らの生活の質、安全性、発達の成果に大きな影響を及ぼしています。「私たちは、薬剤耐性てんかんの遺伝的原因を研究することに動機づけられました。そうすることで、将来的によ
「Nature Genetics」誌にて、研究者らが脳の染色体モザイク症の新たな起源メカニズムを報告し、脳モザイク染色体1qの増加が特定の臨床的表現型と関連していることを発見しました。通常、人々の体内の各細胞は同じ遺伝情報を持っています。しかし、時には2つ以上の遺伝的に異なる細胞群を持つことがあります。これは主に胎児期に起こり、「モザイク症」と呼ばれています。これらの細胞群の一部には、疾患や障害を引き起こす遺伝的変化が存在することがあります。神経学者、神経外科医、ゲノム学専門家は、てんかん手術中に切除された脳組織でモザイク症を検査するために協力しました。研究によると、脳のモザイク症はてんかんに大きく関与していることが示されています。
2023年10月23日に「Nature Genetics」誌に発表された新しい研究において、オハイオ州コロンバスのネーションワイド・チルドレンズ病院の研究者らは、焦点性てんかんを持つ一部の子供たちの脳モザイク症の別の起源を記述しています。この論文のタイトルは「Post-Zygotic Rescue of Meiotic Errors Causes Brain Mosaicism and Focal Epilepsy(有糸分裂誤りの後期救済が脳モザイク症と焦点性てんかんを引き起こす)」です。
アダム・オステンドルフ博士(Adam Ostendorf, PhD)によると、「約26人に1人が生涯にわたっててんかんを経験することになります。その原因は非常に多様で、てんかん患者の半数以上では謎のままです」とのこと。
てんかんのある子供の約3分の1は、薬剤に抵抗性の発作を持ち、これが彼らの生活の質、安全性、発達の成果に大きな影響を及ぼしています。「私たちは、薬剤耐性てんかんの遺伝的原因を研究することに動機づけられました。そうすることで、将来的によ
アルツハイマー病の最大の遺伝的危険因子(APOE4変異体)に関する研究:新たな標的に向けて
 サンフランシスコのグラッドストーン研究所(Gladstone Institutes)の研究者らが、アルツハイマー病の発症リスクが平均よりも高いとされるAPOE4遺伝子変異を持つ人々に朗報をもたらす発見をしました。APOE4が認知症を引き起こす脳の変化につながることは以前から知られていましたが、その具体的なメカニズムは不明でした。
しかし、最近の研究で、APOE4を生成するニューロンが、他のAPOE変異体を生成するニューロンと比べて、免疫シグナル分子であるHMGB1を大量に放出することが明らかになりました。このHMGB1が放出されると、脳の免疫細胞であるミクログリアが活性化し、炎症を引き起こし、ニューロンが退化するというプロセスが始まります。
この研究は「APOE4-Promoted Gliosis and Degeneration in Tauopathy Are Ameliorated by Pharmacological Inhibition of HMGB1 Release」(「APOE4によるグリオーシスおよびタウオパチーにおける退化は、HMGB1放出の薬理学的阻害により改善される」)と題され、2023年10月19日にCell Reports誌に掲載されました。
「この経路を標的にすることで、APOE4による神経退化に対してこれほど強力な保護効果が得られるとは、私たちも驚きと興奮を覚えました」と、グラッドストーン研究所の研究員であり、カリフォルニア大学サンフランシスコ校(UCSF)の神経学および病理学の教授であるヤドン・ファン博士(Yadong Huang, PhD)は述べています。「これは、APOE4が誘発する神経炎症がアルツハイマー病においてどのような役割を果たしているのかという、長年の疑問に答えるものであり、病気の新しい治療法への道を示しています。」
サンフランシスコのグラッドストーン研究所(Gladstone Institutes)の研究者らが、アルツハイマー病の発症リスクが平均よりも高いとされるAPOE4遺伝子変異を持つ人々に朗報をもたらす発見をしました。APOE4が認知症を引き起こす脳の変化につながることは以前から知られていましたが、その具体的なメカニズムは不明でした。
しかし、最近の研究で、APOE4を生成するニューロンが、他のAPOE変異体を生成するニューロンと比べて、免疫シグナル分子であるHMGB1を大量に放出することが明らかになりました。このHMGB1が放出されると、脳の免疫細胞であるミクログリアが活性化し、炎症を引き起こし、ニューロンが退化するというプロセスが始まります。
この研究は「APOE4-Promoted Gliosis and Degeneration in Tauopathy Are Ameliorated by Pharmacological Inhibition of HMGB1 Release」(「APOE4によるグリオーシスおよびタウオパチーにおける退化は、HMGB1放出の薬理学的阻害により改善される」)と題され、2023年10月19日にCell Reports誌に掲載されました。
「この経路を標的にすることで、APOE4による神経退化に対してこれほど強力な保護効果が得られるとは、私たちも驚きと興奮を覚えました」と、グラッドストーン研究所の研究員であり、カリフォルニア大学サンフランシスコ校(UCSF)の神経学および病理学の教授であるヤドン・ファン博士(Yadong Huang, PhD)は述べています。「これは、APOE4が誘発する神経炎症がアルツハイマー病においてどのような役割を果たしているのかという、長年の疑問に答えるものであり、病気の新しい治療法への道を示しています。」
サメのユニークな治癒力を解明:スウェーデンの研究チームが新たな道を開く
 サメは多くの点で他の魚類と異なり、野生での傷からの回復が報告されていることから、傷の治癒能力が驚くほど優れていると言われています。この治癒能力はまだ実験室条件下で文書化されていませんが、サメの皮膚に含まれる化学物質のいくつかは、生医学的に大きな可能性を秘めています。この可能性を調査するために、スウェーデンのカロリンスカ研究所の皮膚科研究者2人が、同僚と共に、小型のサメ、スピニードッグフィッシュ(Squalus acanthias)およびその他の軟骨魚種について、ウッズホールの海洋生物学研究所(MBL)で研究を行いました。彼らの目的は、これらの動物の皮膚のユニークな生化学を理解することです。他の研究所でのサメの研究は、新しい抗生物質の開発や、嚢胞性線維症研究に関連する生化学的経路の発見につながっています。
カロリンスカの皮膚科准教授で主任研究員のヤコブ・ウィクストローム博士(Jakob Wikström, PhD)と、上級研究者のエティ・バッハール・ウィクストローム博士(Etty Bachar-Wikström, PhD)は、MBLでサメの2種類と、その近縁種であるリトルスケートの皮膚粘液を調査しました。多くの魚類が比較的滑らかな皮膚を持ち、厚い粘液層で保護されているのに対し、サメは砂紙のように感じる粗い皮膚を持っています。この皮膚が保護的な粘液層を持っているかどうかは明らかではありませんでした。
「魚の生物学についてはサメの生物学よりもはるかに多くのことが知られています。その理由は明白です」とウィクストローム博士は述べました。「魚は扱いやすく、商業的な関心も大きいからです。」もちろん、サメも魚ですが、魚の99%は骨を持つ種(Osteichthyes)であり、軟骨のサメやスケート(Chondrichthyes)とは異なりますと彼は指摘しました。
この研究の初期結果は
サメは多くの点で他の魚類と異なり、野生での傷からの回復が報告されていることから、傷の治癒能力が驚くほど優れていると言われています。この治癒能力はまだ実験室条件下で文書化されていませんが、サメの皮膚に含まれる化学物質のいくつかは、生医学的に大きな可能性を秘めています。この可能性を調査するために、スウェーデンのカロリンスカ研究所の皮膚科研究者2人が、同僚と共に、小型のサメ、スピニードッグフィッシュ(Squalus acanthias)およびその他の軟骨魚種について、ウッズホールの海洋生物学研究所(MBL)で研究を行いました。彼らの目的は、これらの動物の皮膚のユニークな生化学を理解することです。他の研究所でのサメの研究は、新しい抗生物質の開発や、嚢胞性線維症研究に関連する生化学的経路の発見につながっています。
カロリンスカの皮膚科准教授で主任研究員のヤコブ・ウィクストローム博士(Jakob Wikström, PhD)と、上級研究者のエティ・バッハール・ウィクストローム博士(Etty Bachar-Wikström, PhD)は、MBLでサメの2種類と、その近縁種であるリトルスケートの皮膚粘液を調査しました。多くの魚類が比較的滑らかな皮膚を持ち、厚い粘液層で保護されているのに対し、サメは砂紙のように感じる粗い皮膚を持っています。この皮膚が保護的な粘液層を持っているかどうかは明らかではありませんでした。
「魚の生物学についてはサメの生物学よりもはるかに多くのことが知られています。その理由は明白です」とウィクストローム博士は述べました。「魚は扱いやすく、商業的な関心も大きいからです。」もちろん、サメも魚ですが、魚の99%は骨を持つ種(Osteichthyes)であり、軟骨のサメやスケート(Chondrichthyes)とは異なりますと彼は指摘しました。
この研究の初期結果は
マウントサイナイ研究チーム主導の試験で、転移性膀胱癌患者に免疫療法と化学療法を組み合わせることで生存率が向上することが明らかに
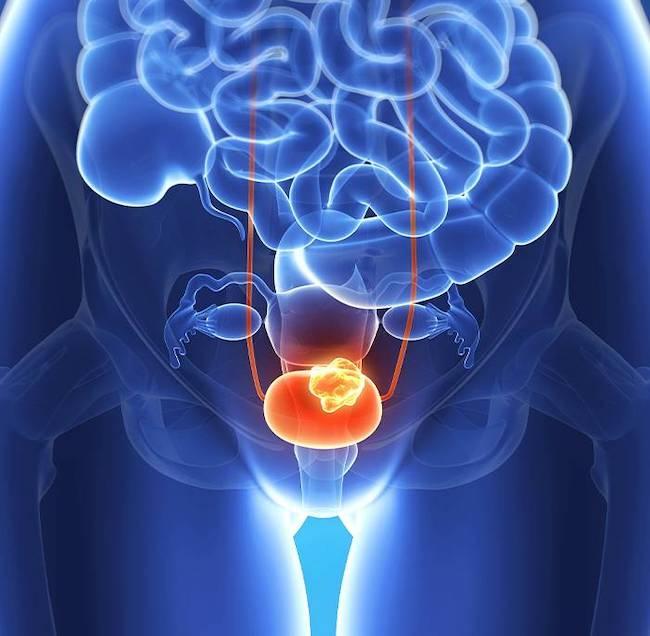 マウントサイナイ研究者らが共同主導する臨床試験が、進行性の膀胱がん患者において、免疫療法を化学療法レジメンに追加することで生存率が向上することを初めて示しました。この結果は、2023年10月22日に『ニューイングランド・ジャーナル・オブ・メディシン』と欧州医学腫瘍学会(European Society for Medical Oncology)の年次総会で同時に報告されました。ランダム化フェーズ3試験「CheckMate 901」は、化学療法のジェムシタビンとシスプラチンに免疫療法薬ニボルマブを組み合わせた患者群が、化学療法のみを受けた患者群と比較して、顕著な改善を見せました。治療後に病気の徴候がない患者の数は、ニボルマブを含む治療を受けた群でほぼ2倍になりました。ニボルマブは、がんと戦うために免疫システムを活用するモノクローナル抗体の免疫チェックポイント阻害剤です。
マシュー・ガルスキー博士(Matthew Galsky, PhD)は、「これまで一次標準治療のシスプラチンベースの化学療法に何らかの新薬を加えても、転移性尿路上皮癌の全体的生存率が改善されたことはありませんでした」と述べています。ガルスキー博士は、ティッシュがんセンター(The Tisch Cancer Institute)のティッシュがん研究所内膀胱がんセンターの共同ディレクターで、この論文の主執筆者です。「これらの結果は、転移性尿路上皮癌治療のための新たな標準的アプローチとして、ニボルマブを含むシスプラチンベースの化学療法を支持しています」。
試験には合計608人の患者が参加し、免疫療法と化学療法の組み合わせを受けた患者の全体的生存率と無進行生存率は、約3年後に高まっていました。これらの患者の完全奏効の中央持続期間は37.1ヶ月で、化学療法のみを受けた患者では13.2ヶ月でした。
この試験は、ブ
マウントサイナイ研究者らが共同主導する臨床試験が、進行性の膀胱がん患者において、免疫療法を化学療法レジメンに追加することで生存率が向上することを初めて示しました。この結果は、2023年10月22日に『ニューイングランド・ジャーナル・オブ・メディシン』と欧州医学腫瘍学会(European Society for Medical Oncology)の年次総会で同時に報告されました。ランダム化フェーズ3試験「CheckMate 901」は、化学療法のジェムシタビンとシスプラチンに免疫療法薬ニボルマブを組み合わせた患者群が、化学療法のみを受けた患者群と比較して、顕著な改善を見せました。治療後に病気の徴候がない患者の数は、ニボルマブを含む治療を受けた群でほぼ2倍になりました。ニボルマブは、がんと戦うために免疫システムを活用するモノクローナル抗体の免疫チェックポイント阻害剤です。
マシュー・ガルスキー博士(Matthew Galsky, PhD)は、「これまで一次標準治療のシスプラチンベースの化学療法に何らかの新薬を加えても、転移性尿路上皮癌の全体的生存率が改善されたことはありませんでした」と述べています。ガルスキー博士は、ティッシュがんセンター(The Tisch Cancer Institute)のティッシュがん研究所内膀胱がんセンターの共同ディレクターで、この論文の主執筆者です。「これらの結果は、転移性尿路上皮癌治療のための新たな標準的アプローチとして、ニボルマブを含むシスプラチンベースの化学療法を支持しています」。
試験には合計608人の患者が参加し、免疫療法と化学療法の組み合わせを受けた患者の全体的生存率と無進行生存率は、約3年後に高まっていました。これらの患者の完全奏効の中央持続期間は37.1ヶ月で、化学療法のみを受けた患者では13.2ヶ月でした。
この試験は、ブ
AIが抗マラリア薬DHAを骨粗しょう症治療薬と特定
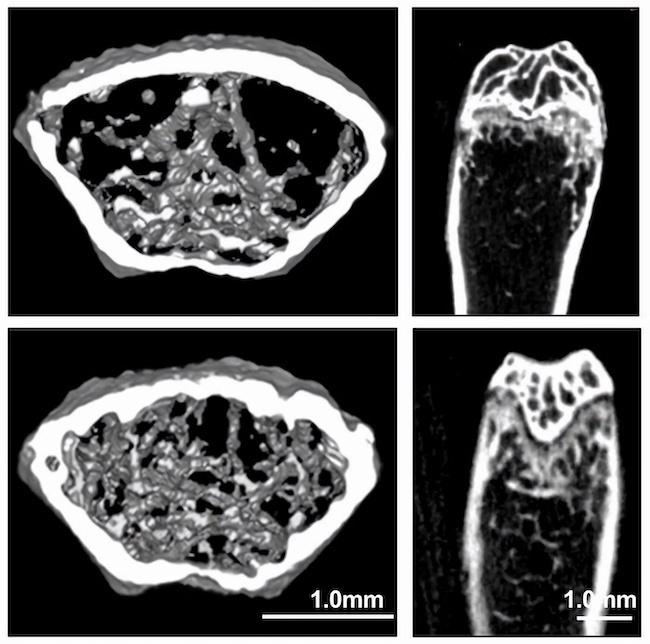 最近の研究で、AI(人工知能)が抗マラリア薬の一つ、ジヒドロアルテミシニン(DHA)を骨粗しょう症の治療薬として有効であることを特定しました。この研究結果は、アメリカ化学会(ACS)が発行する「ACS Central Science」誌に掲載され、研究論文のタイトルは「Deep Learning-Predicted Dihydroartemisinin Rescues Osteoporosis by Maintaining Mesenchymal Stem Cell Stemness Through Activating Histone 3 Lys 9 Acetylation(ディープラーニングによるジヒドロアルテミシニンの骨粗しょう症治療効果:メセンキマル幹細胞の幹細胞性維持によるヒストン3リジン9のアセチル化活性化)」です。
骨粗しょう症は通常、高齢者に多く見られる病気で、骨の再生を担う「オステオブラスト」と骨を分解する「オステオクラスト」とのバランスが崩れることで発生します。現在の治療法は主にオステオクラストの活動を抑制することに焦点を当てていますが、今回の研究では、骨髄メセンキマル幹細胞(BMMSCs)と呼ばれるオステオブラストの前駆細胞を活用した新たな治療法が提案されています。
ジェン・ウェイ・シー博士(Zhengwei Xie, PhD)らの研究チームは、病気に関連する遺伝子発現の変化を逆転させる薬剤を予測できるディープラーニングアルゴリズムを開発しました。今回、ヤン・リュウ博士(Yan Liu, PhD)、ウェイラン・リー博士(Weiran Li, PhD)らと共に、このアルゴリズムを用いてBMMSCsに焦点を当てた新しい骨粗しょう症治療戦略を模索しました。
研究チームは、新生マウスと成熟マウスで異なる遺伝子発現プロファイルに基づいてプログラムを実行
最近の研究で、AI(人工知能)が抗マラリア薬の一つ、ジヒドロアルテミシニン(DHA)を骨粗しょう症の治療薬として有効であることを特定しました。この研究結果は、アメリカ化学会(ACS)が発行する「ACS Central Science」誌に掲載され、研究論文のタイトルは「Deep Learning-Predicted Dihydroartemisinin Rescues Osteoporosis by Maintaining Mesenchymal Stem Cell Stemness Through Activating Histone 3 Lys 9 Acetylation(ディープラーニングによるジヒドロアルテミシニンの骨粗しょう症治療効果:メセンキマル幹細胞の幹細胞性維持によるヒストン3リジン9のアセチル化活性化)」です。
骨粗しょう症は通常、高齢者に多く見られる病気で、骨の再生を担う「オステオブラスト」と骨を分解する「オステオクラスト」とのバランスが崩れることで発生します。現在の治療法は主にオステオクラストの活動を抑制することに焦点を当てていますが、今回の研究では、骨髄メセンキマル幹細胞(BMMSCs)と呼ばれるオステオブラストの前駆細胞を活用した新たな治療法が提案されています。
ジェン・ウェイ・シー博士(Zhengwei Xie, PhD)らの研究チームは、病気に関連する遺伝子発現の変化を逆転させる薬剤を予測できるディープラーニングアルゴリズムを開発しました。今回、ヤン・リュウ博士(Yan Liu, PhD)、ウェイラン・リー博士(Weiran Li, PhD)らと共に、このアルゴリズムを用いてBMMSCsに焦点を当てた新しい骨粗しょう症治療戦略を模索しました。
研究チームは、新生マウスと成熟マウスで異なる遺伝子発現プロファイルに基づいてプログラムを実行
遺伝子治療が膠芽腫に有効:再発グリオブラストーマ患者の生存延長を示す
 HSV1ウイルスを使用したこの人類初の第1相試験では、41人の再発性グリオブラストーマ患者を対象に、ブリガム・アンド・ウィメンズ・ホスピタル(BWH)の研究者が設計したオンコリティックウイルス治療が生存期間を延長し、特に以前にウイルス抗体を持つ患者において顕著でした。グリオブラストーマ(GBM)は、攻撃性の高い脳腫瘍で、再発GBMは10ヶ月未満の生存と関連しています。がんに対して体の免疫防御を動員する免疫療法は、GBMには効果的ではなかった理由は、腫瘍を取り囲む環境が体の免疫系の攻撃をほとんど受け入れないためです。
マスジェネラルブリガムヘルスケアシステムの創設メンバーであるBWH の研究者らは、この免疫抑制環境を免疫応答に適した環境に変換するために、オンコリティックウイルスを開発しました。その結果、「Nature」誌に掲載された研究では、この新しい遺伝子療法アプローチの安全性と初期の有効性が示され、ウイルスに「免疫学的に慣れている」とされる再発GBM患者のサブグループにおいて生存期間が延長されました。
このオープンアクセスの論文のタイトルは「Clinical Trial Links Oncolytic Immunoactivation to Survival In Glioblastoma(臨床試験がオンコリティック免疫活性化とグリオブラストーマの生存との関連を示す)」で、Nature News & Viewsの記事「An Engineered Virus Shows Potential As an Immune Therapy In Glioblastoma(設計されたウイルスがグリオブラストーマの免疫療法としての可能性を示す)」と共に掲載されました。
「GBMは、腫瘍を取り囲む免疫抑制因子の環境のために攻撃性を持っています。これにより、免疫システムが
HSV1ウイルスを使用したこの人類初の第1相試験では、41人の再発性グリオブラストーマ患者を対象に、ブリガム・アンド・ウィメンズ・ホスピタル(BWH)の研究者が設計したオンコリティックウイルス治療が生存期間を延長し、特に以前にウイルス抗体を持つ患者において顕著でした。グリオブラストーマ(GBM)は、攻撃性の高い脳腫瘍で、再発GBMは10ヶ月未満の生存と関連しています。がんに対して体の免疫防御を動員する免疫療法は、GBMには効果的ではなかった理由は、腫瘍を取り囲む環境が体の免疫系の攻撃をほとんど受け入れないためです。
マスジェネラルブリガムヘルスケアシステムの創設メンバーであるBWH の研究者らは、この免疫抑制環境を免疫応答に適した環境に変換するために、オンコリティックウイルスを開発しました。その結果、「Nature」誌に掲載された研究では、この新しい遺伝子療法アプローチの安全性と初期の有効性が示され、ウイルスに「免疫学的に慣れている」とされる再発GBM患者のサブグループにおいて生存期間が延長されました。
このオープンアクセスの論文のタイトルは「Clinical Trial Links Oncolytic Immunoactivation to Survival In Glioblastoma(臨床試験がオンコリティック免疫活性化とグリオブラストーマの生存との関連を示す)」で、Nature News & Viewsの記事「An Engineered Virus Shows Potential As an Immune Therapy In Glioblastoma(設計されたウイルスがグリオブラストーマの免疫療法としての可能性を示す)」と共に掲載されました。
「GBMは、腫瘍を取り囲む免疫抑制因子の環境のために攻撃性を持っています。これにより、免疫システムが
ライム病の新たな治療標的を見つける”地下鉄マップ”
 タフツ大学医学部の科学者たちは、ライム病の原因となる細菌の主要な代謝活動を示すゲノムスケールの代謝モデル、別名「地下鉄マップ」を開発しました。このマップを使用して、彼らは宿主への感染にのみ使用される経路を選択的に標的とする2つの化合物を特定することに成功しました。彼らの研究は2023年10月19日にmSystems誌に掲載されました。オープンアクセスの記事のタイトルは「Metabolic Modeling Predicts Unique Drug Targets in Borrelia burgdorferi(代謝モデリングがボレリア・ブルグドルフェリにおけるユニークな薬物標的を予測する)」です。
どちらの薬も多くの副作用があるためライム病の治療には適していませんが、計算上の「地下鉄マップ」を使用して薬物標的と可能性のある既存の治療法を予測することに成功したことは、他の有益な細菌に影響を与えることなく、ライム病のみをブロックする微小物質を開発することが可能であることを示しています。
ゲノムスケールの代謝モデル(GEM)は、遺伝子、酵素、代謝物質、その他の情報を含む生物システムに関するすべての既知の代謝情報を収集します。これらのモデルは、大規模なデータと機械学習を使用して、科学者が分子メカニズムを理解し、予測を立て、以前は未知であり、既知の生物学的プロセスに反するかもしれない新しいプロセスを特定するのに役立ちます。
現在、ライム病は幅広いスペクトルの抗生物質で治療されており、ライム病菌ボレリア・ブルグドルフェリを殺すと同時に、宿主の微生物群に居住し、多くの有益な機能を果たす他の多くの細菌も殺します。慢性ライム症状または反復するライム病のある人々は、医学的ガイドラインに反して何年もの間抗生物質を服用していますが、それが効果があるという証拠はありません。
「私たちがま
タフツ大学医学部の科学者たちは、ライム病の原因となる細菌の主要な代謝活動を示すゲノムスケールの代謝モデル、別名「地下鉄マップ」を開発しました。このマップを使用して、彼らは宿主への感染にのみ使用される経路を選択的に標的とする2つの化合物を特定することに成功しました。彼らの研究は2023年10月19日にmSystems誌に掲載されました。オープンアクセスの記事のタイトルは「Metabolic Modeling Predicts Unique Drug Targets in Borrelia burgdorferi(代謝モデリングがボレリア・ブルグドルフェリにおけるユニークな薬物標的を予測する)」です。
どちらの薬も多くの副作用があるためライム病の治療には適していませんが、計算上の「地下鉄マップ」を使用して薬物標的と可能性のある既存の治療法を予測することに成功したことは、他の有益な細菌に影響を与えることなく、ライム病のみをブロックする微小物質を開発することが可能であることを示しています。
ゲノムスケールの代謝モデル(GEM)は、遺伝子、酵素、代謝物質、その他の情報を含む生物システムに関するすべての既知の代謝情報を収集します。これらのモデルは、大規模なデータと機械学習を使用して、科学者が分子メカニズムを理解し、予測を立て、以前は未知であり、既知の生物学的プロセスに反するかもしれない新しいプロセスを特定するのに役立ちます。
現在、ライム病は幅広いスペクトルの抗生物質で治療されており、ライム病菌ボレリア・ブルグドルフェリを殺すと同時に、宿主の微生物群に居住し、多くの有益な機能を果たす他の多くの細菌も殺します。慢性ライム症状または反復するライム病のある人々は、医学的ガイドラインに反して何年もの間抗生物質を服用していますが、それが効果があるという証拠はありません。
「私たちがま
UCLA主導のチーム、心臓損傷の再生治療につながる幹細胞由来のメカニズムを発見
 CLA主導の研究チームは、ヒトの幹細胞由来心筋細胞の成熟を促進する重要な内部制御メカニズムを特定しました。この発見により、心筋細胞が未熟な胎児段階から成熟した大人の形態に発達する方法に関する理解が深まります。この研究成果は、2023年10月16日に「Circulation」誌に「Regulation of Postnatal Cardiomyocyte Maturation by an RNA Splicing Regulator RBFox1(後天的心筋細胞の成熟を制御するRNAスプライシング調節因子RBFox1)」として発表されました。シンガポールのDuke-NUS医学校および他の機関との共同研究により、RNAスプライシング調節因子として知られるRBFox1が、新生児の心細胞よりも成人の心細胞で著しく多く存在することが判明しました。この事実は、心細胞の成熟プロセス中のRBFox1の急激な増加を、既存の単一細胞データの分析を通じても確認しています。
「これは、RNAスプライシング制御が新生後の心細胞の成熟に重要な役割を果たすという最初の証拠です」と、UCLAの麻酔学部門で博士研究員としてこの研究を行ったジジュン・ホアン博士(Jijun Huang PhD)は述べています。「RBFox1だけでは、未成熟な胎児心筋細胞を完全に成熟した大人の細胞まで進展させるには不十分かもしれませんが、他のアプローチを超えてこの成熟プロセスを大幅に促進できる新しいRNAベースの内部ネットワークを明らかにしました。」
心筋細胞が生まれてから完全に成熟するまでには、その構造、機能、および生理的特性に大きな変化があります。これまで、この包括的な成熟を監視するメカニズムは十分に理解されていませんでした。
RBFox1によるRNAスプライシングとその後の成熟手順および特性の関連する正確なメカニ
CLA主導の研究チームは、ヒトの幹細胞由来心筋細胞の成熟を促進する重要な内部制御メカニズムを特定しました。この発見により、心筋細胞が未熟な胎児段階から成熟した大人の形態に発達する方法に関する理解が深まります。この研究成果は、2023年10月16日に「Circulation」誌に「Regulation of Postnatal Cardiomyocyte Maturation by an RNA Splicing Regulator RBFox1(後天的心筋細胞の成熟を制御するRNAスプライシング調節因子RBFox1)」として発表されました。シンガポールのDuke-NUS医学校および他の機関との共同研究により、RNAスプライシング調節因子として知られるRBFox1が、新生児の心細胞よりも成人の心細胞で著しく多く存在することが判明しました。この事実は、心細胞の成熟プロセス中のRBFox1の急激な増加を、既存の単一細胞データの分析を通じても確認しています。
「これは、RNAスプライシング制御が新生後の心細胞の成熟に重要な役割を果たすという最初の証拠です」と、UCLAの麻酔学部門で博士研究員としてこの研究を行ったジジュン・ホアン博士(Jijun Huang PhD)は述べています。「RBFox1だけでは、未成熟な胎児心筋細胞を完全に成熟した大人の細胞まで進展させるには不十分かもしれませんが、他のアプローチを超えてこの成熟プロセスを大幅に促進できる新しいRNAベースの内部ネットワークを明らかにしました。」
心筋細胞が生まれてから完全に成熟するまでには、その構造、機能、および生理的特性に大きな変化があります。これまで、この包括的な成熟を監視するメカニズムは十分に理解されていませんでした。
RBFox1によるRNAスプライシングとその後の成熟手順および特性の関連する正確なメカニ
NIHから1.9億ドルの資金を獲得し、がん・心疾患治療のためのエクソソームの流れを電子的に制御する新しい細胞コミュニケーション制御法を研究
 人間の体は、細胞レベルに至るまで複雑な内部コミュニケーションシステムを有している。しかしながら、これらのシステムは健康な人間の機能に関するメッセージだけでなく、病気にも影響を与えることがある。たとえばがん。「不健康な細胞はどのようにして自らのがん情報を近くの細胞に運び、腫瘍を成長させ、最終的にがんになるのか?」より重要なのは、この流れを制御して病気を止めることができるかどうかである。
マサチューセッツ大学アマースト校(UMass Amherst)の機械工学・産業工学助教授であり、生物医学工学の兼任教員、応用生命科学研究所の所属を持つジングレイ・ピン博士(Jinglei Ping)は、この問いに答えるために、5年間で1.9億ドルのNIHからの研究助成金を使用する予定である。NIHからのマキシマイジング・インベスティゲーターズ・リサーチ・アワードは、ピン博士の細胞間コミュニケーションを操作する新しい方法に関する調査を支援する。
細胞が隣の細胞と「話す」一つの方法は、エクソソームと呼ばれる小さな粒子を介して行われる。「エクソソームは、細胞によって生成される非常に小さな『泡』であり、この泡は重要な分子、例えばRNAや小さなDNA片を一つの細胞から別の細胞へと運ぶ」とピン博士は説明する。
しかし、このメカニズムは体内の病気の拡散を説明することもできる。「エクソソームの放出は、腫瘍細胞の成長と腫瘍ががんになる方法と関連している」と彼は言う。同様に、心拍を制御する細胞である心筋細胞もエクソソームの流れの影響を受け、心疾患に関連している。
エクソソームを制御することにより、新しい治療法が可能になるかもしれず、ピン博士はpHを使ってこの点をつなげたいと考えている。
「エクソソームの流れは細胞のシグナルを制御し、細胞の伝令役である」と彼は言う。「そして、流れはpHによって制御され
人間の体は、細胞レベルに至るまで複雑な内部コミュニケーションシステムを有している。しかしながら、これらのシステムは健康な人間の機能に関するメッセージだけでなく、病気にも影響を与えることがある。たとえばがん。「不健康な細胞はどのようにして自らのがん情報を近くの細胞に運び、腫瘍を成長させ、最終的にがんになるのか?」より重要なのは、この流れを制御して病気を止めることができるかどうかである。
マサチューセッツ大学アマースト校(UMass Amherst)の機械工学・産業工学助教授であり、生物医学工学の兼任教員、応用生命科学研究所の所属を持つジングレイ・ピン博士(Jinglei Ping)は、この問いに答えるために、5年間で1.9億ドルのNIHからの研究助成金を使用する予定である。NIHからのマキシマイジング・インベスティゲーターズ・リサーチ・アワードは、ピン博士の細胞間コミュニケーションを操作する新しい方法に関する調査を支援する。
細胞が隣の細胞と「話す」一つの方法は、エクソソームと呼ばれる小さな粒子を介して行われる。「エクソソームは、細胞によって生成される非常に小さな『泡』であり、この泡は重要な分子、例えばRNAや小さなDNA片を一つの細胞から別の細胞へと運ぶ」とピン博士は説明する。
しかし、このメカニズムは体内の病気の拡散を説明することもできる。「エクソソームの放出は、腫瘍細胞の成長と腫瘍ががんになる方法と関連している」と彼は言う。同様に、心拍を制御する細胞である心筋細胞もエクソソームの流れの影響を受け、心疾患に関連している。
エクソソームを制御することにより、新しい治療法が可能になるかもしれず、ピン博士はpHを使ってこの点をつなげたいと考えている。
「エクソソームの流れは細胞のシグナルを制御し、細胞の伝令役である」と彼は言う。「そして、流れはpHによって制御され
乳がん研究における重大な発見:コラーゲンXVIIIの機能を抑制することで乳がん細胞を弱体化
 フィンランドのオウル大学の研究者たちは、乳がん研究において画期的な発見をしました。彼らは、細胞外マトリックスタンパク質であるコラーゲンXVIIIが、乳がんの進行と転移を著しく促進することを実証しました。さらに、このコラーゲンの機能を抑制することで、乳がん治療に一般的に使用される特定の標的療法の効果を向上させることができることを示しました。これらの発見は、より効果的な、そして全く新しいがん薬の開発につながる可能性があります。
この研究は、2023年9月15日号の「The Journal of Clinical Investigation」に掲載されました。オープンアクセスの論文のタイトルは「Targeting Collagen XVIII Improves the Efficiency of ErbB Inhibitors in Breast Cancer Models(コラーゲンXVIIIを標的とすることで、乳がんモデルにおけるErbB阻害剤の効率を改善する)」です。
細胞外マトリックスは、細胞によって産生されるタンパク質と炭水化物から構成され、細胞の振る舞いや機能を調節します。がん組織においては、細胞外マトリックスががんの成長と転移、治療反応、薬剤耐性を制御することが知られています。
コラーゲンは、人間において知られている28種類の細胞外マトリックスタンパク質の中で最も一般的です。コラーゲンXVIIIは、特殊な形態の細胞外マトリックスである基底膜に存在します。基底膜は、細胞が付着し、細胞分裂、運動、分化を調節する薄いシート状のマトリックスです。
がん薬の効果を高めるコラーゲン機能の抑制
乳がんのマウスモデルと細胞モデルでのコラーゲンの研究を通じて、研究者たちはコラーゲンXVIIIががん細胞における特定の成長因子受容体のシグナリングを調節することを発見しました
フィンランドのオウル大学の研究者たちは、乳がん研究において画期的な発見をしました。彼らは、細胞外マトリックスタンパク質であるコラーゲンXVIIIが、乳がんの進行と転移を著しく促進することを実証しました。さらに、このコラーゲンの機能を抑制することで、乳がん治療に一般的に使用される特定の標的療法の効果を向上させることができることを示しました。これらの発見は、より効果的な、そして全く新しいがん薬の開発につながる可能性があります。
この研究は、2023年9月15日号の「The Journal of Clinical Investigation」に掲載されました。オープンアクセスの論文のタイトルは「Targeting Collagen XVIII Improves the Efficiency of ErbB Inhibitors in Breast Cancer Models(コラーゲンXVIIIを標的とすることで、乳がんモデルにおけるErbB阻害剤の効率を改善する)」です。
細胞外マトリックスは、細胞によって産生されるタンパク質と炭水化物から構成され、細胞の振る舞いや機能を調節します。がん組織においては、細胞外マトリックスががんの成長と転移、治療反応、薬剤耐性を制御することが知られています。
コラーゲンは、人間において知られている28種類の細胞外マトリックスタンパク質の中で最も一般的です。コラーゲンXVIIIは、特殊な形態の細胞外マトリックスである基底膜に存在します。基底膜は、細胞が付着し、細胞分裂、運動、分化を調節する薄いシート状のマトリックスです。
がん薬の効果を高めるコラーゲン機能の抑制
乳がんのマウスモデルと細胞モデルでのコラーゲンの研究を通じて、研究者たちはコラーゲンXVIIIががん細胞における特定の成長因子受容体のシグナリングを調節することを発見しました
前立腺がんの骨転移治療に画期的なアプローチが見出される:前立腺がん細胞から放出されるエクソソームが重要な役割を担う
 中国の陸軍医科大学と深セン大学の研究者らが、2023年7月号の「Genes & Diseases」誌に掲載された研究で、前立腺がん(PCa)の骨転移に伴う骨芽細胞病変の発展と進行においてmiR-18a-5pというマイクロRNAが果たす重要な役割を調査しました。特に注目すべきは、骨転移を持つPCa患者の骨微小環境におけるmiR-18a-5pの発現が著しく高まっていたことで、この病気の発症においてmiR-18a-5pが関与している可能性が示唆されています。
この論文のタイトルは「Antagonizing Exosomal miR-18a-5p Derived from Prostate Cancer Cells Ameliorates Metastasis-Induced Osteoblastic Lesions by Targeting Hist1h2bc and Activating Wnt/β-Catenin Pathway(前立腺がん細胞由来のエクソソームmiR-18a-5pを拮抗することで、転移による骨芽細胞病変を軽減:Hist1h2bcの標的化とWnt/β-カテニン経路の活性化)」です。
miR-18a-5pが骨芽細胞病変に与える影響についての深い洞察を得るため、研究者らは一連の包括的な実験を実施しました。PCa細胞と前骨芽細胞の両方でmiR-18a-5pを抑制することにより、骨芽細胞の分化と活動の大幅な減少を実証しました。特に注目すべきは、miR-18a-5pが抑制されたPCa細胞をマウスモデルに導入した際、骨の生物力学的特性と骨ミネラル量が顕著に改善されたことで、この特定のマイクロRNAを標的とする治療法の可能性が強調されました。
続く調査では、miR-18a-5pによって引き起こされる骨芽細胞病変の複雑な分子メカニズムが明らかにされました。研
中国の陸軍医科大学と深セン大学の研究者らが、2023年7月号の「Genes & Diseases」誌に掲載された研究で、前立腺がん(PCa)の骨転移に伴う骨芽細胞病変の発展と進行においてmiR-18a-5pというマイクロRNAが果たす重要な役割を調査しました。特に注目すべきは、骨転移を持つPCa患者の骨微小環境におけるmiR-18a-5pの発現が著しく高まっていたことで、この病気の発症においてmiR-18a-5pが関与している可能性が示唆されています。
この論文のタイトルは「Antagonizing Exosomal miR-18a-5p Derived from Prostate Cancer Cells Ameliorates Metastasis-Induced Osteoblastic Lesions by Targeting Hist1h2bc and Activating Wnt/β-Catenin Pathway(前立腺がん細胞由来のエクソソームmiR-18a-5pを拮抗することで、転移による骨芽細胞病変を軽減:Hist1h2bcの標的化とWnt/β-カテニン経路の活性化)」です。
miR-18a-5pが骨芽細胞病変に与える影響についての深い洞察を得るため、研究者らは一連の包括的な実験を実施しました。PCa細胞と前骨芽細胞の両方でmiR-18a-5pを抑制することにより、骨芽細胞の分化と活動の大幅な減少を実証しました。特に注目すべきは、miR-18a-5pが抑制されたPCa細胞をマウスモデルに導入した際、骨の生物力学的特性と骨ミネラル量が顕著に改善されたことで、この特定のマイクロRNAを標的とする治療法の可能性が強調されました。
続く調査では、miR-18a-5pによって引き起こされる骨芽細胞病変の複雑な分子メカニズムが明らかにされました。研
妊娠中の脳は”再配線”され、母親としての役割に備えることが判明
 フランシス・クリック研究所(UK)の研究者らは、妊娠ホルモンがマウスの脳を「再配線」して母親としての準備をすることを示しました。彼らの発見によれば、エストロゲンとプロゲステロンの両方が、子供が生まれる前に親としての行動を引き起こすために脳の一部のニューロンに作用することが示されました。これらの適応により、生まれた子たちへの反応が強く、選択的になったとしています。
この研究は、Science誌に「Hormone-Mediated Neural Remodeling Orchestrates Parenting Onset During Pregnancy(ホルモンによる神経の再構築が妊娠中の親としての行動の開始を調整する)」として掲載されました。
処女の雌のロデントは子供たちとの相互作用をあまり示さないのに対し、母親はほとんどの時間を子供の世話に費やすことがよく知られています。出産時に放出されるホルモンがこのような母親としての行動の開始に最も重要であると考えられていました。
しかし、以前の研究では、帝王切開で出産したラットや、妊娠ホルモンにさらされた処女のマウスも、この母親としての行動を示すことが示されており、妊娠中のホルモンの変化がより重要である可能性が示唆されていました。
現在の研究では、雌のマウスが妊娠後期に親としての行動を増加させ、子供たちとの接触がこの行動の変化に必要ではないことが確認されました。
研究者らは、親としての行動に関連する脳の領域である視床下部のMPOAにある神経細胞の集団(ガラニン発現ニューロン)がエストロゲンとプロゲステロンに影響を受けることを発見しました。
脳の記録によれば、エストロゲンはこれらのニューロンの基本的な活動を同時に減少させ、より興奮しやすくしました。一方、プロゲステロンは、ニューロン間のコミュニケー
フランシス・クリック研究所(UK)の研究者らは、妊娠ホルモンがマウスの脳を「再配線」して母親としての準備をすることを示しました。彼らの発見によれば、エストロゲンとプロゲステロンの両方が、子供が生まれる前に親としての行動を引き起こすために脳の一部のニューロンに作用することが示されました。これらの適応により、生まれた子たちへの反応が強く、選択的になったとしています。
この研究は、Science誌に「Hormone-Mediated Neural Remodeling Orchestrates Parenting Onset During Pregnancy(ホルモンによる神経の再構築が妊娠中の親としての行動の開始を調整する)」として掲載されました。
処女の雌のロデントは子供たちとの相互作用をあまり示さないのに対し、母親はほとんどの時間を子供の世話に費やすことがよく知られています。出産時に放出されるホルモンがこのような母親としての行動の開始に最も重要であると考えられていました。
しかし、以前の研究では、帝王切開で出産したラットや、妊娠ホルモンにさらされた処女のマウスも、この母親としての行動を示すことが示されており、妊娠中のホルモンの変化がより重要である可能性が示唆されていました。
現在の研究では、雌のマウスが妊娠後期に親としての行動を増加させ、子供たちとの接触がこの行動の変化に必要ではないことが確認されました。
研究者らは、親としての行動に関連する脳の領域である視床下部のMPOAにある神経細胞の集団(ガラニン発現ニューロン)がエストロゲンとプロゲステロンに影響を受けることを発見しました。
脳の記録によれば、エストロゲンはこれらのニューロンの基本的な活動を同時に減少させ、より興奮しやすくしました。一方、プロゲステロンは、ニューロン間のコミュニケー
Life Science News from Around the Globe
Edited by Michael D. O'Neill

バイオクイックニュースは、サイエンスライターとして30年以上の豊富な経験があるマイケルD. オニールによって発行されている独立系科学ニュースメディアです。世界中のバイオニュース(生命科学・医学研究の動向)をタイムリーにお届けします。バイオクイックニュースは、現在160カ国以上に読者がおり、2010年から6年連続で米国APEX Award for Publication Excellenceを受賞しました。
BioQuick is a trademark of Michael D. O'Neill