スペイン・バルセロナにある遺伝子規制センターと、イギリス・ケンブリッジ近郊のウェルカム・サンガー研究所の研究者らは、KRASタンパク質に存在するアロステリック制御部位を包括的に同定しました。これらは薬剤開発のために非常に求められているターゲットであり、がんの最も重要な原因の一つの効果を制御するために利用できる秘密の弱点を代表しています。KRASは、多くのタイプのがんで最も頻繁に変異する遺伝子の一つです。人間のがんの10人に1人に見られ、膵臓がんや肺がんなどの致命的なタイプでの発生率が高いとされます。その球形の形状と薬剤で標的にするのに適した部位がないため、このタンパク質は「デス・スター」と呼ばれています。この理由から、KRASは1982年に最初に発見されて以来、「創薬は不可能」と考えられてきました。
KRASを制御する唯一の効果的な戦略は、そのアロステリック通信システムを標的とすることでした。これらは、遠隔制御のロックとキーのメカニズムを通じて機能する分子シグナルです。タンパク質を制御するには、ロック(活性部位)を開くことができるキー(化学化合物または薬剤)が必要です。タンパク質は、その表面の別の場所にある二次ロック(アロステリック部位)によっても影響を受けることがあります。分子がアロステリック部位に結合すると、タンパク質の形状が変化し、たとえばその主要なロックの内部構造を変えることによって、タンパク質の活性や他の分子と結合する能力を変えることができます。
アロステリック部位は、より高い特異性を提供するため、薬剤開発においてしばしば好まれます。これにより、副作用の可能性が低くなります。また、タンパク質の活性をより微妙に変えることができ、その機能を微調整する可能性を提供します。アロステリック部位を標的とする薬剤は、一般に活性部位を標的とする薬剤に比べて、安全で効果的です。
しかし、アロステリック部位は非常に捉えどころがありません。40年にわたる研究、数万件の科学論文、KRASの300以上の公表された構造にもかかわらず、臨床使用に承認された薬はたったの2つです。これらの薬剤は、活性部位に隣接するポケットに結合し、タンパク質が活性化されるのを防ぐアロステリックな立体構造変化を誘導することによって機能します。
「KRASに対する実用的な薬剤を生み出すのに数十年がかかったのは、アロステリック部位を大規模に同定するツールが欠けていたためであり、治療的なターゲット部位を暗闇の中で探しているようなものでした。この研究では、タンパク質全体のアロステリック部位を体系的にマッピングできる新しいアプローチを示します。薬剤発見の目的において、それはまるで明かりをつけ、タンパク質を制御する多くの方法を明らかにするようなものです」と、遺伝子規制センターのスタッフサイエンティストであり、研究の共著者であるアンドレ・フォーレ博士は説明しています。
より安全で効果的な薬剤のための4つの有望なターゲット
この研究論文の著者らは、ディープミューテーショナルスキャニングと呼ばれる技術を使用してアロステリック部位をマッピングしました。これは、KRASタンパク質の26,000以上のバリエーションを作成し、一度に1つまたは2つのビルディングブロック(アミノ酸)のみを変更することを含みます。チームは、これらの異なるKRASバリエーションががんを引き起こすためにKRASが重要な6つの他のタンパク質にどのように結合するかをチェックしました。研究者らはAIソフトウェアを使用してデータを分析し、アロステリズムを検出し、既知および新しい治療標的部位の位置を特定しました。
「私たちの方法のユニークなセールスポイントはそのスケーラビリティです。この作業だけで、私たちは22,000を超える生物物理学的測定を行いました。これは、私たちがDNAシーケンシングと合成方法論の顕著な進歩を活用し始める前に、すべてのタンパク質に対してこれまでに行われた総数と同じ数です。これは莫大な加速であり、アプローチの力と可能性を示しています」と、遺伝子規制センターのポスドク研究員であり、研究の第一著者であるチェンチュン・ウェン博士は説明しています。
この技術は、期待よりもはるかに多くの強力なアロステリック部位がKRASに存在することを明らかにしました。これらの部位の変異は、KRASがその3つの主要なパートナーのすべてに結合する能力を抑制し、KRASの活動を広範囲に抑制することが可能であることを示唆しています。これらの部位の一部は特に興味深く、これらの部位はタンパク質の表面に容易にアクセス可能な4つの異なるポケットに位置しており、将来の薬剤のための有望なターゲットを代表しています。
研究の著者たちは、特に「ポケット3」を非常に興味深い部位として強調しています。このポケットはKRASの活性部位から遠く離れた場所に位置しているため、以前は製薬会社からほとんど注目されていませんでした。
研究者らはまた、KRASの小さな変更がそのパートナーとの振る舞いを劇的に変え、タンパク質が一方を他方よりも好むようにすることができることを発見しました。これは重要な意味を持ちます。なぜなら、がん以外の組織でのKRASの正常な機能を妨げることなく、KRASの異常な活動を制御する新しい戦略につながる可能性があるからです。正常なKRASバージョンを温存することは、副作用が少なく、より安全で効果的な治療法を意味します。研究者はまた、この知識を使用してKRASの生物学をさらに掘り下げ、さまざまなシナリオでのタンパク質の振る舞いを説明し、異なるがんタイプでのその役割を決定するのに重要な鍵となる可能性があります。
「創薬は不可能」とされてきた新たな設計図
この研究は、任意の種における任意の完全なタンパク質に対して、アロステリック部位の完全なマップを提供する初めてのものです。研究は、KRASをマッピングするために科学者たちが使用したような適切なツールと技術があれば、歴史的に「創薬は不可能」と考えられてきた多くの異なる医学的に重要なタンパク質に対して新たな脆弱性を明らかにすることができることを示しています。
「医学における大きな挑戦は、どのタンパク質が病気の原因となっているかを知ることではなく、それらをどのように制御するかを知らないことです。私たちの研究は、これらのタンパク質を標的とし、その活動を制御する薬剤の開発を加速する新しい戦略を代表しています。アロステリック部位を標的とすることの性質は、結果として得られる薬剤が現在持っているものよりも安全で効果的な治療法になる可能性が高いことを意味します」と、研究の上級著者であり、遺伝子規制センターとウェルカム・サンガー研究所のICREA(カタルーニャ研究・高等研究機構)研究教授であるベン・レーナー博士(Dr. Ben Lehner)は結論づけています。
この研究は、2023年12月18日にNature誌に発表されました。論文のタイトルは「KRAS抑制のためのエネルギーおよびアロステリックなランドスケープ(The Energetic and Allosteric Landscape for KRAS Inhibition.)」です。
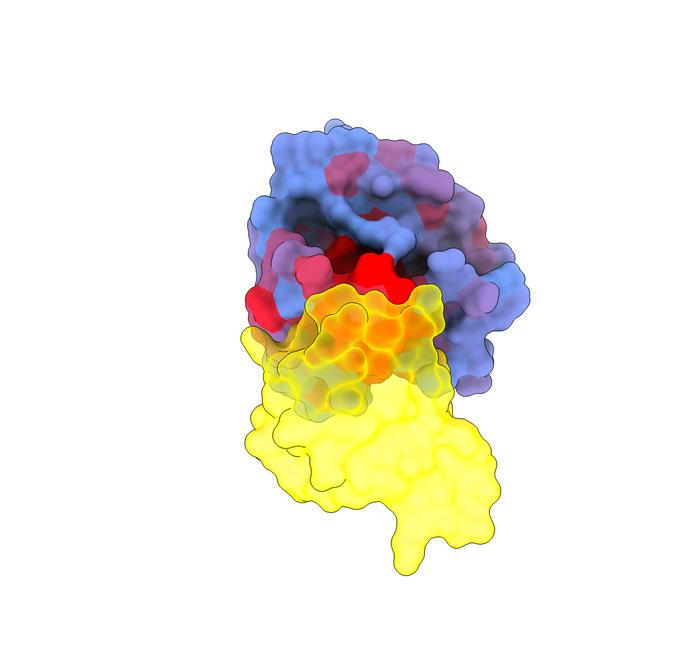
画像:ヒトタンパク質KRAS(青)と、その主要なパートナーの1つであるRAF1(黄)との相互作用を示す3次元画像。青から赤へのグラデーションは、アロステリック効果の可能性が高まっていることを示している。
(Credit:Weng, Faure, and Escobedo/Centro de Regulación Genómica)