2021年6月10日発行のCell誌に掲載された研究論文によると、体内の免疫系が宿主の細胞を傷つけることなく、癌細胞を排除することができるという驚くべき新しいメカニズムが明らかになった。この発見は、癌細胞に選択的に作用し、正常な細胞や組織には無害であるように設計されたファースト・イン・クラスの医薬品を開発する可能性を秘めている。この発見が成功すれば、適切な薬剤を適切な量、適切なタイミングで投与することができるようになり、精密医療の実践を向上させることができるだろう。この論文は「好中球エラスターゼが癌細胞を選択的に死滅させ、腫瘍形成を抑制する(Neutrophil Elastase Selectively Kills Cancer Cells and Attenuates Tumorigenesis)」と題されている。(画像は好中球)
私たちの免疫系は、健康を維持しながら病気を退治するために重要な役割を果たしている。例えば、免疫系は、細菌、真菌、原虫など、さまざまな感染性病原体を認識して攻撃する能力を持っている。シカゴ大学医学部総合癌センターの研究者たちは、免疫系が癌に対して同様の反応を起こすことができるかどうか、またどのようにして反応を起こすのかについて興味を持っていた。
このような発見は、癌の弱点(アキレス腱)を明らかにし、望ましくない副作用の少ない、より効果的な新しい治療法の開発を可能にする。
その有力な手がかりとなるのが、白血球の一種である多形核好中球(PMN)である。PMNは、免疫系が発する化学的シグナルに反応して、体内の必要な部位に移動する。しかし、PMNが癌細胞を死滅させる正確なメカニズムは完全には解明されていない。
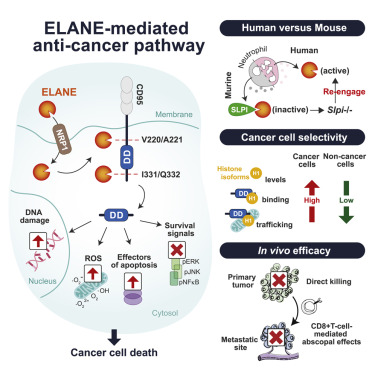
今回の新たな研究により、シカゴ大学の研究チームは、好中球エラスターゼ(ELANE)が、ヒトの好中球から放出され、癌細胞に特異的に細胞死経路を活性化する主要な抗癌タンパク質であることを突き止めた。ELANEは、癌細胞を、腫瘍と、癌細胞が転移した遠隔地の両方で死滅させ、近くの健康な細胞は温存する。
本論文の筆頭著者であり、シカゴ大学のBen May Department for Cancer Researchの准教授であるLev Becker博士は、「一歩下がって考えてみると、我々が発見したのは、変異した細胞に対する体の最初の反応だと思う」と述べた。「細胞は常に変化しており、突然変異は蓄積していく。癌になる人もいれば、ならない人もいる。我々が発見した経路は、変異した細胞を排除するための免疫系の原初的なメカニズムを説明するのに役立つかもしれない」と述べている。
Becker博士らは、ヒトとマウスのモデルを用いて、ELANEが複雑な癌殺傷プログラムを開始することを確認した。このプログラムは、細胞生存経路を抑制し、DNA損傷を誘発し、ミトコンドリアの活性酸素種産生を上昇させ、最終的にアポトーシスとして知られるプログラムされた細胞死を活性化する。
この一連の流れは、PMNがエラスターゼという酵素を分泌することによって引き起こされる。エラスターゼは、タンパク質をより小さな分子に分解する。その結果、どの細胞がアポトーシスを起こすかを制御することで、免疫系のバランスを保つ役割を担うCD95デスドメインが解放されるのである。次に、活性化されたCD95デスドメインは、癌細胞でゲノムの安定性を維持するために上昇しているヒストンH1と相互作用する。
ELANEは、多くの種類の癌細胞株で一貫してこのプログラムを活性化したが、試験した非癌細胞では活性化しなかった。研究者らによると、ELANEが癌細胞と非癌細胞のどちらにも特異的に作用することで、潜在的な毒性が抑えられている可能性があると言う。この可能性は、ELANEを注射した腫瘍のないマウスで副作用が観察されなかったことからもうかがえる。また、この選択的な殺傷によって免疫細胞が維持されるため、免疫細胞は解放された抗原を利用して、癌が転移した部位にまで及ぶ増強された免疫反応を起こすことができる。
ELANEは幅広い種類の癌細胞を殺傷することができるため、癌の遺伝子構成にかかわらず、この治療法を用いることができる可能性がある。研究者らは、トリプルネガティブ乳癌、メラノーマ、肺癌などの治療が困難な癌を含む、遺伝的に多様な9種類の癌でELANEの有効性を実証した。
上記の発見に加えて、研究者らは、ヒトとマウスの好中球による活性型ELANEの放出の違いを明らかにし、また、ELANEに類似したタンパク質で腫瘍阻害剤に対する感受性が低いブタ膵臓エラスターゼ(PPE)が、さらに優れた治療反応を誘導することを示したと報告している。
研究者らは、ELANE/PPEの治療効果を最大化する方法を、単独療法および他の癌治療との併用療法の両方で解明するために、今後の研究が必要であると述べている。
Becker博士は、「今回の発見は、マウスから始めるという従来の方法をとっていたら、決して見つからなかったであろう発見の一つだ。今回は、患者の観察から始まり、研究室に持ち帰ってマウスでさらに研究し、新しい癌治療法として人に還元できると期待している」と述べている。
癌治療へのユニークなアプローチは、実社会への応用が期待されている。 Becker博士がサイエンティフィック・ファウンダー兼ディレクターを務めるOnchilles Pharma社は、最近、投資家からシリーズAの資金援助を受け、前臨床の概念実証試験におけるBecker博士の研究成果に基づく最初の医薬品候補を進めている。
その他の著者には、シカゴ大学のChang Cui、Kasturi Chakraborty、Xu Anna Tang、Guolin Zhou、Kelly Q. Schoenfelt、Kristen M. Becker、Alexandria Hoffman、Ya-Fang Chang、Ariane Blank、Catherine A. Reardon、Hilary A. Kenny、Ernst Lengyel、Geoffrey Greene、ワシントン大学シアトル校のTomas Vaisarが含まれている。
画像の概要
Cell誌の記事に掲載されたELANEを介した抗癌剤の経路を示す画像。(出典:Cell)