なぜ核酸医薬にDrug Delivery System(DDS)が重要なのか
 核酸医薬品はアンチセンスのヴィトラミューンが1998年に承認されて、その後2004年にRNAアプタマーのマキュジェンが承認されましたが、その後ヴィトラミューンが発売中止になり、それ以降核酸医薬はあまり開発が進んできませんでした。このことは、前から話しているように核酸医薬の安定性に問題があったからです。そして、このころから急速に開発が進んだ競合品の抗体医薬の市場導入により、核酸医薬は医薬市場で厳しい状態になり、更に核酸医薬の多くが臨床試験で有効性を証明できませんでした。そこで、siRNAに関してAlnylam社と資本提携をしていたRoche社が核酸医薬から完全撤退し、Novartis社もAlnylam社との提携を終了し、Merck社のsiRNA医薬からmiRNA医薬開発へのシフト、更にPfizer社は核酸医薬開発ユニットの解散など、メガファーマの核酸医薬からの撤退が相次ぎました。
しかし、最近は2013年に世界初の全身投与型のアンチセンス核酸医薬のホモ結合型家族性高コレステロール血症を対象としたmipomersenがアメリカで承認され、2016年にはDDS技術を利用せずに化学修飾により血中安定性を実現した、デュシャンヌ型筋ジストロフィーに対するeteplirsenなどが承認されてきました。更に2018年にAlnylam社より、DDS技術を導入したsiDNA医薬patisiranがアミロイドーシスの核酸原因遺伝子の標的治療薬としてアメリカで承認されました。このように、最近では合成アミノ酸や化学修飾などを用いて核酸医薬品の安定性が高められ、更にDrug Delivery System(DDS)により体内安定性とターゲットへの薬剤の輸送が可能となりました。これからは核酸医薬の分野でDDSが必要不可欠な技術になっていくと考えられます。それでは、標的細胞へのDDSを用いた核酸輸送
核酸医薬品はアンチセンスのヴィトラミューンが1998年に承認されて、その後2004年にRNAアプタマーのマキュジェンが承認されましたが、その後ヴィトラミューンが発売中止になり、それ以降核酸医薬はあまり開発が進んできませんでした。このことは、前から話しているように核酸医薬の安定性に問題があったからです。そして、このころから急速に開発が進んだ競合品の抗体医薬の市場導入により、核酸医薬は医薬市場で厳しい状態になり、更に核酸医薬の多くが臨床試験で有効性を証明できませんでした。そこで、siRNAに関してAlnylam社と資本提携をしていたRoche社が核酸医薬から完全撤退し、Novartis社もAlnylam社との提携を終了し、Merck社のsiRNA医薬からmiRNA医薬開発へのシフト、更にPfizer社は核酸医薬開発ユニットの解散など、メガファーマの核酸医薬からの撤退が相次ぎました。
しかし、最近は2013年に世界初の全身投与型のアンチセンス核酸医薬のホモ結合型家族性高コレステロール血症を対象としたmipomersenがアメリカで承認され、2016年にはDDS技術を利用せずに化学修飾により血中安定性を実現した、デュシャンヌ型筋ジストロフィーに対するeteplirsenなどが承認されてきました。更に2018年にAlnylam社より、DDS技術を導入したsiDNA医薬patisiranがアミロイドーシスの核酸原因遺伝子の標的治療薬としてアメリカで承認されました。このように、最近では合成アミノ酸や化学修飾などを用いて核酸医薬品の安定性が高められ、更にDrug Delivery System(DDS)により体内安定性とターゲットへの薬剤の輸送が可能となりました。これからは核酸医薬の分野でDDSが必要不可欠な技術になっていくと考えられます。それでは、標的細胞へのDDSを用いた核酸輸送
Drug Delivery System(DDS)の過去と現状
 Drug Delivery System(DDS)についは、核酸医薬との関連を中心に話したいと思いますが、その前にDDSが考えられた経緯について少し話してみたいと考えています。
低分子創薬が盛んな2000年以前は、レセプターとリガンドの創薬のスクリーニングで、天然物などや合成化合物をスクリーニングすることで、生理活性物質を探索してきました。しかし、見つかった生理活性物質が直ぐに薬になるかと言うと、以前にも話したように生体に投与した際の体内動態などの問題で殆どの生理活性物質は薬になりません。そこで、経口投与薬の場合、体内吸収や体内動態を良くするために発展したのが製剤の技術です。生理活性物質にポリエチレンオキシドとポリエチレングリコールなどを加え、混合した徐放性製剤にすることにより体内での放出を制御し、薬物の血中濃度を治療領域に長時間一定に維持することで、体内での薬効作用をコントロールできました。私はこれがDDSの考え方の始まりと考えています。
その後、2000年代に入り、低分子薬の副作用を軽減するために、疾患部位に選択的に薬物を送る薬物ターゲティングの技術が出てきました。一方、このころ創薬の分野にも大きな変革があり、生体高分子、特に抗体が医薬品として利用されるようになってきました。開発段階で、抗体の中には薬効は示さないがターゲットの疾患部位の細胞に取り込まれる抗体があることがわかり、低分子薬に運び屋のこの抗体を付けて疾患部位に薬物を送り込む方法(Antibody-drug conjugate)が考えられました。詳しくは以前に「低分子・中分子創薬の新しい考え方であるAntibody-drug conjugate(ADC)製剤」の項目で紹介したので、そこをお読み頂ければ幸いです。
その後、ペプチドドリーム社が提案した中分子のペプタイドをDDSに利用するPepti
Drug Delivery System(DDS)についは、核酸医薬との関連を中心に話したいと思いますが、その前にDDSが考えられた経緯について少し話してみたいと考えています。
低分子創薬が盛んな2000年以前は、レセプターとリガンドの創薬のスクリーニングで、天然物などや合成化合物をスクリーニングすることで、生理活性物質を探索してきました。しかし、見つかった生理活性物質が直ぐに薬になるかと言うと、以前にも話したように生体に投与した際の体内動態などの問題で殆どの生理活性物質は薬になりません。そこで、経口投与薬の場合、体内吸収や体内動態を良くするために発展したのが製剤の技術です。生理活性物質にポリエチレンオキシドとポリエチレングリコールなどを加え、混合した徐放性製剤にすることにより体内での放出を制御し、薬物の血中濃度を治療領域に長時間一定に維持することで、体内での薬効作用をコントロールできました。私はこれがDDSの考え方の始まりと考えています。
その後、2000年代に入り、低分子薬の副作用を軽減するために、疾患部位に選択的に薬物を送る薬物ターゲティングの技術が出てきました。一方、このころ創薬の分野にも大きな変革があり、生体高分子、特に抗体が医薬品として利用されるようになってきました。開発段階で、抗体の中には薬効は示さないがターゲットの疾患部位の細胞に取り込まれる抗体があることがわかり、低分子薬に運び屋のこの抗体を付けて疾患部位に薬物を送り込む方法(Antibody-drug conjugate)が考えられました。詳しくは以前に「低分子・中分子創薬の新しい考え方であるAntibody-drug conjugate(ADC)製剤」の項目で紹介したので、そこをお読み頂ければ幸いです。
その後、ペプチドドリーム社が提案した中分子のペプタイドをDDSに利用するPepti
抗炎症剤・抗菌剤の応用に期待されるデコイ型核酸とリボスイッチ
 現在、医薬品として承認されている核酸医薬は、AIDS 患者におけるサイトメガロウィルス(CMV)性網膜炎に適用されるアンチセンス、Vitravene(fomivirsen)と、血管新生型(滲出型)加齢性黄斑変性症に用いられるアプタマー、Macugen(pegaptanib)の2つのみである。Macugenは、2008 年7 月に承認された国内初の核酸医薬品で、Vitravene、Macugenいずれも硝子体内への局所投与であり、作用の発現は限局的である。しかし、今後は全身適用可能な核酸医薬品の開発が求められている。大阪大学の森下竜一教授たちはデコイ核酸医薬の開発を行い、Drug Delivery System(DDS)と組み合わせて、全身適用可能な抗炎症薬の開発を考えています。
デコイ型核酸医薬は、転写因子の結合部位を含むオリゴヌクレオチドを合成し、2 本鎖核酸とし、ターゲット細胞の核内に導入することで遺伝子発現を抑制する方法を応用した核酸医薬です。デコイが転写因子と結合することでDNA 上への転写因子の結合を阻害し、プロモーター活性が低下し、本来発現する遺伝子群がコントロールされ、活性化される遺伝子群の発現を調節する方法です。デコイは細胞周期や炎症などターゲットとなる現象に関与する複数の遺伝子を同時に制御することが可能であることから「おとり型核酸医薬」と言われています。デコイ型核酸医薬はアンチセンス法より高い効果を得ることができ、特にデコイオリゴは細胞周期に関与するE2F、炎症に関与するNFκB、そして細胞増殖・分化関与に対する治療効果が期待されます。そのため、炎症反応を担うサイトカインや接着分子の転写発現を抑制することでその作用を発揮し、炎症性疾患の治療薬としての期待が寄せられています。特に森下教授たちは、NFκB デコイオリゴのアトピー性皮膚炎治療薬としての開発
現在、医薬品として承認されている核酸医薬は、AIDS 患者におけるサイトメガロウィルス(CMV)性網膜炎に適用されるアンチセンス、Vitravene(fomivirsen)と、血管新生型(滲出型)加齢性黄斑変性症に用いられるアプタマー、Macugen(pegaptanib)の2つのみである。Macugenは、2008 年7 月に承認された国内初の核酸医薬品で、Vitravene、Macugenいずれも硝子体内への局所投与であり、作用の発現は限局的である。しかし、今後は全身適用可能な核酸医薬品の開発が求められている。大阪大学の森下竜一教授たちはデコイ核酸医薬の開発を行い、Drug Delivery System(DDS)と組み合わせて、全身適用可能な抗炎症薬の開発を考えています。
デコイ型核酸医薬は、転写因子の結合部位を含むオリゴヌクレオチドを合成し、2 本鎖核酸とし、ターゲット細胞の核内に導入することで遺伝子発現を抑制する方法を応用した核酸医薬です。デコイが転写因子と結合することでDNA 上への転写因子の結合を阻害し、プロモーター活性が低下し、本来発現する遺伝子群がコントロールされ、活性化される遺伝子群の発現を調節する方法です。デコイは細胞周期や炎症などターゲットとなる現象に関与する複数の遺伝子を同時に制御することが可能であることから「おとり型核酸医薬」と言われています。デコイ型核酸医薬はアンチセンス法より高い効果を得ることができ、特にデコイオリゴは細胞周期に関与するE2F、炎症に関与するNFκB、そして細胞増殖・分化関与に対する治療効果が期待されます。そのため、炎症反応を担うサイトカインや接着分子の転写発現を抑制することでその作用を発揮し、炎症性疾患の治療薬としての期待が寄せられています。特に森下教授たちは、NFκB デコイオリゴのアトピー性皮膚炎治療薬としての開発
「核酸抗体」とも言われるアプタマー
 核酸アプタマーは一本鎖のDNAやRNAから構成された核酸医薬ですが、細胞内でmRNAやゲノムDNAとのハイブリダイゼーションで薬効を発揮する他の核酸医薬の作用機序と異なり、抗体と同じように標的タンパク質や細胞と結合し、細胞膜上や細胞外で薬効作用を発揮します。すなわち、一本鎖のDNA/RNAが熱的に安定な立体構造の分子内相補鎖を形成することで、標的分子に特異的に結合する物質になります。この原理から、この物質を標的に特異的に結合する分子を指す、ラテン語のaptus(結合)とギリシャ語のmeros(部分)を合わせてアプタマー呼ぶようになりました。更にアプタマーは標的分子に特異的に結合することから「合成抗体」、「化学抗体」や「核酸抗体」と言われ、よく抗体と対比して語られます。
アプタマー作成法は1990年にTuerk(Science 246, 505-510, 1990)とElllington (Nature 346, 818-822,1990)らによって報告された、SELEX(Systematic Evolution of Ligands by Exponential Enrichment)法を利用しています。初めにSELEX法は10~50残基ほどのランダムな配列を持つ一本鎖DNA/RNAを合成し、熱処理して相補配列に基づく三次元構造形成したDNA/RNAのライブラリーができます。天然のDNAは基本的に二重らせん構造ですが、アプタマーのように人工的に作られたDNA/RNAは二次構造を形成し、複雑な立体構造を形成することで、多種多用なライブラリーが構築できます。このライブラリーを用いてアプタマーの探索を行います。ライブラリーに標的タンパク質や細胞を添加して、標的に結合した数種のDNA/RNAを抽出して、PCRでこれらのDNA/RNAを増幅します。更にこの増幅したDNA/RNA
核酸アプタマーは一本鎖のDNAやRNAから構成された核酸医薬ですが、細胞内でmRNAやゲノムDNAとのハイブリダイゼーションで薬効を発揮する他の核酸医薬の作用機序と異なり、抗体と同じように標的タンパク質や細胞と結合し、細胞膜上や細胞外で薬効作用を発揮します。すなわち、一本鎖のDNA/RNAが熱的に安定な立体構造の分子内相補鎖を形成することで、標的分子に特異的に結合する物質になります。この原理から、この物質を標的に特異的に結合する分子を指す、ラテン語のaptus(結合)とギリシャ語のmeros(部分)を合わせてアプタマー呼ぶようになりました。更にアプタマーは標的分子に特異的に結合することから「合成抗体」、「化学抗体」や「核酸抗体」と言われ、よく抗体と対比して語られます。
アプタマー作成法は1990年にTuerk(Science 246, 505-510, 1990)とElllington (Nature 346, 818-822,1990)らによって報告された、SELEX(Systematic Evolution of Ligands by Exponential Enrichment)法を利用しています。初めにSELEX法は10~50残基ほどのランダムな配列を持つ一本鎖DNA/RNAを合成し、熱処理して相補配列に基づく三次元構造形成したDNA/RNAのライブラリーができます。天然のDNAは基本的に二重らせん構造ですが、アプタマーのように人工的に作られたDNA/RNAは二次構造を形成し、複雑な立体構造を形成することで、多種多用なライブラリーが構築できます。このライブラリーを用いてアプタマーの探索を行います。ライブラリーに標的タンパク質や細胞を添加して、標的に結合した数種のDNA/RNAを抽出して、PCRでこれらのDNA/RNAを増幅します。更にこの増幅したDNA/RNA
ノーベル賞の成果を利用した核酸医薬siRNA
 皆様、新年あけましておめでとうございます。今年もよろしくお願いいたします。コロナ禍が一向に終息の兆しが見えませんが、今年はWithコロナの生活が昨年以上に定着していくのではないでしょうか?
それでは、今回は予定どおりsiRNAを紹介しましょう。siRNAは2006年のノーベル賞生理学・医学賞を受賞したスタンフォード大学のProf. Andrew Z. Fireとマサチューセッツ大学のProf. Craig C. Melloが発見した、2本鎖RNAによる遺伝子発現制御現象のRNA interference(RNA干渉)の現象を利用した核酸医薬です。
その方法は、ゲノムはDNAの塩基配列として書き込まれており、これがRNAに転写され(mRNA)、タンパク質に翻訳されます。この遺伝子発現機構を阻害し、機能を制御する手段の一つとして、注目を集めているのがRNA干渉です。RNA干渉とは二本鎖RNAによって塩基配列特異的にmRNAが制御され、タンパク質への翻訳が阻害されて、最終的に遺伝子発現が制御される現象です。
Prof. FireとProf. Melloらは標的mRNAと同じ配列を有する二本鎖RNAを線虫の細胞内に導入したところ、一本鎖RNAの場合と比較して効果的に遺伝子発現を阻害することを明らかにしました[Nature 1998, 391 (6669) : 806-811]。このRNA干渉は哺乳類を含めた殆どの生物に共通で見られる現象であることが明らかになり、RNA干渉は遺伝子発現を制御することから、疾患に関わる遺伝子の機能を制御する治療薬(siRNA)として、またsiRNAは一本鎖RNAのアンチセンスと比較して活性が極めて高いことから期待が高まったのです。 それでは、siRNAがどのように遺伝子発現を制御するのかに関して少し説明します。siRNAは細胞内に入るとAr
皆様、新年あけましておめでとうございます。今年もよろしくお願いいたします。コロナ禍が一向に終息の兆しが見えませんが、今年はWithコロナの生活が昨年以上に定着していくのではないでしょうか?
それでは、今回は予定どおりsiRNAを紹介しましょう。siRNAは2006年のノーベル賞生理学・医学賞を受賞したスタンフォード大学のProf. Andrew Z. Fireとマサチューセッツ大学のProf. Craig C. Melloが発見した、2本鎖RNAによる遺伝子発現制御現象のRNA interference(RNA干渉)の現象を利用した核酸医薬です。
その方法は、ゲノムはDNAの塩基配列として書き込まれており、これがRNAに転写され(mRNA)、タンパク質に翻訳されます。この遺伝子発現機構を阻害し、機能を制御する手段の一つとして、注目を集めているのがRNA干渉です。RNA干渉とは二本鎖RNAによって塩基配列特異的にmRNAが制御され、タンパク質への翻訳が阻害されて、最終的に遺伝子発現が制御される現象です。
Prof. FireとProf. Melloらは標的mRNAと同じ配列を有する二本鎖RNAを線虫の細胞内に導入したところ、一本鎖RNAの場合と比較して効果的に遺伝子発現を阻害することを明らかにしました[Nature 1998, 391 (6669) : 806-811]。このRNA干渉は哺乳類を含めた殆どの生物に共通で見られる現象であることが明らかになり、RNA干渉は遺伝子発現を制御することから、疾患に関わる遺伝子の機能を制御する治療薬(siRNA)として、またsiRNAは一本鎖RNAのアンチセンスと比較して活性が極めて高いことから期待が高まったのです。 それでは、siRNAがどのように遺伝子発現を制御するのかに関して少し説明します。siRNAは細胞内に入るとAr
承認された「核酸医薬」の中で一番多いアンチセンスについて
 ここで核酸医薬のメリットを少し話すことにします。疾病の原因となるタンパク質に作用し、その機能を阻害する低分子医薬品や抗体医薬と異なり、核酸医薬は疾病の原因となる遺伝子発現を制御しており、従来の医薬品と異なり遺伝子選択性が高く、標的に直接作用します。そのため今まで開発が困難とされた難病の治療にも期待されており、更に薬物の副作用も軽減されると考えられます。現在承認されている核酸医薬は、国立医薬品食品衛生研究所遺伝子医薬部のホームページで確認すると2022年8月時点では以下のようになっています。
これを見ると承認された核酸医薬品で一番多いのはアンチセンスで、次にsiRNAになります。そこで、初めにアンチセンスについて詳細を説明することにします。
アンチセンスは日常的に体内で行われている、DNAからmRNAができ、更にタンパク質が出来る遺伝子情報が伝達される流れの中で、途中の遺伝子レベルの機能であるDNAやmRNAに結合することで、疾病に関与するタンパク質の合成プロセスを阻害します。疾病の原因となるmRNAやDNAの塩基配列がわかっているとその部分を標的として、それに相補助な配列を有する短い核酸(アンチセンスRNA)を合成し、体内に投与することで、細胞内の疾病に関与する標的mRNAやDNAの標的位置にアンチセンスRNAがバインドすることで二重鎖を形成し、疾病に関与するタンパク質の生成を制御する方法です。特定の病原ウィルスの遺伝子やガン等の様に異常な遺伝子の働きで疾病を引き起こす場合は、遺伝子レベルで病気の治療にはアンチセンスRNA有効であると考えられます。
しかし、アンチセンス核酸の配列の選択をどのようにするかが問題です。普通mRNAは数百から数千塩基長とアンチセンス核酸に比べて非常に長く、mRNAのどの領域を標的にするかについての検討が必要です。一般にmRNAは一本鎖で
ここで核酸医薬のメリットを少し話すことにします。疾病の原因となるタンパク質に作用し、その機能を阻害する低分子医薬品や抗体医薬と異なり、核酸医薬は疾病の原因となる遺伝子発現を制御しており、従来の医薬品と異なり遺伝子選択性が高く、標的に直接作用します。そのため今まで開発が困難とされた難病の治療にも期待されており、更に薬物の副作用も軽減されると考えられます。現在承認されている核酸医薬は、国立医薬品食品衛生研究所遺伝子医薬部のホームページで確認すると2022年8月時点では以下のようになっています。
これを見ると承認された核酸医薬品で一番多いのはアンチセンスで、次にsiRNAになります。そこで、初めにアンチセンスについて詳細を説明することにします。
アンチセンスは日常的に体内で行われている、DNAからmRNAができ、更にタンパク質が出来る遺伝子情報が伝達される流れの中で、途中の遺伝子レベルの機能であるDNAやmRNAに結合することで、疾病に関与するタンパク質の合成プロセスを阻害します。疾病の原因となるmRNAやDNAの塩基配列がわかっているとその部分を標的として、それに相補助な配列を有する短い核酸(アンチセンスRNA)を合成し、体内に投与することで、細胞内の疾病に関与する標的mRNAやDNAの標的位置にアンチセンスRNAがバインドすることで二重鎖を形成し、疾病に関与するタンパク質の生成を制御する方法です。特定の病原ウィルスの遺伝子やガン等の様に異常な遺伝子の働きで疾病を引き起こす場合は、遺伝子レベルで病気の治療にはアンチセンスRNA有効であると考えられます。
しかし、アンチセンス核酸の配列の選択をどのようにするかが問題です。普通mRNAは数百から数千塩基長とアンチセンス核酸に比べて非常に長く、mRNAのどの領域を標的にするかについての検討が必要です。一般にmRNAは一本鎖で
コロナウイルスのmRNAワクチンで注目を集めた「核酸医薬」
 この3年間のコロナ禍でワクチン接種の話が良く出ています。特に直近ではコロナウイルスオミクロン株亜系統BA5で、今まで以上に高い第7波の感染拡大に見舞われ、4回目のワクチン接種が勧められています。しかし、ウイルスは変異することにより薬に対する耐性も獲得するので、今のワクチンがBA5の感染予防にどれほど効果があるか疑問視されていますが、少なくても重症化を防ぐ効果は高いと考えられています。
ところで、コロナウイルスのmRNAワクチンとはどのようなものなのでしょうか。一般的にRNAはゲノムDNAの一部分を転写したもので、その後翻訳され蛋白質なります。コロナウイルスのmRNAワクチンはこのmRNAから翻訳さら蛋白質が出来ることを利用して、コロナウイルスの表面の蛋白質をコードするmRNAを人工合成してワクチンを作ります。そのため、このワクチンを接種すると体内でコロナウイルス表面の蛋白質が生成され、この蛋白質を免疫細胞が取り込むことで、ウイルスに対する抗体が生成されるので、体内でのウイルスの増殖を抑えることが出来ます。この様にDNAや転写因子のRNAを利用した薬の分野を「核酸医薬」と言います。最近この核酸医薬に分野が進んでおり、低分子医薬から抗体医薬に続く第3の医薬と言われています。
そこで、今回は核酸医薬について話しましょう。人のゲノムDNAは遺伝子数3万個強の遺伝子情報を持っています。このDNAからmRNAに転写され、蛋白質が出来て細胞が増殖されることで人体を維持しています。しかし、DNAの遺伝子の一部が変異していると、そのmRNAは蛋白質に翻訳される際に、蛋白質の欠損、異常蛋白質産生や蛋白質の異常発現などにより、細胞の異常増殖や機能異常を起こしてしまい、これが疾患に繋がるのです。そのためmRNAを利用して薬を作り、体内で疾患を阻害する蛋白質を発現したり、疾患RNAを切断したりト
この3年間のコロナ禍でワクチン接種の話が良く出ています。特に直近ではコロナウイルスオミクロン株亜系統BA5で、今まで以上に高い第7波の感染拡大に見舞われ、4回目のワクチン接種が勧められています。しかし、ウイルスは変異することにより薬に対する耐性も獲得するので、今のワクチンがBA5の感染予防にどれほど効果があるか疑問視されていますが、少なくても重症化を防ぐ効果は高いと考えられています。
ところで、コロナウイルスのmRNAワクチンとはどのようなものなのでしょうか。一般的にRNAはゲノムDNAの一部分を転写したもので、その後翻訳され蛋白質なります。コロナウイルスのmRNAワクチンはこのmRNAから翻訳さら蛋白質が出来ることを利用して、コロナウイルスの表面の蛋白質をコードするmRNAを人工合成してワクチンを作ります。そのため、このワクチンを接種すると体内でコロナウイルス表面の蛋白質が生成され、この蛋白質を免疫細胞が取り込むことで、ウイルスに対する抗体が生成されるので、体内でのウイルスの増殖を抑えることが出来ます。この様にDNAや転写因子のRNAを利用した薬の分野を「核酸医薬」と言います。最近この核酸医薬に分野が進んでおり、低分子医薬から抗体医薬に続く第3の医薬と言われています。
そこで、今回は核酸医薬について話しましょう。人のゲノムDNAは遺伝子数3万個強の遺伝子情報を持っています。このDNAからmRNAに転写され、蛋白質が出来て細胞が増殖されることで人体を維持しています。しかし、DNAの遺伝子の一部が変異していると、そのmRNAは蛋白質に翻訳される際に、蛋白質の欠損、異常蛋白質産生や蛋白質の異常発現などにより、細胞の異常増殖や機能異常を起こしてしまい、これが疾患に繋がるのです。そのためmRNAを利用して薬を作り、体内で疾患を阻害する蛋白質を発現したり、疾患RNAを切断したりト
コロナウイルスなどの感染症と、癌や生活習慣病などの薬の違いと医薬品開発
 人間の病気の殆どは感染症と癌・成人病(生活習慣病)や先天性心疾患などの個別化医療の疾患領域であり、薬の開発の考え方や手段など創薬が異なります。この中で癌の領域の創薬は、2000年以前は癌細胞殺すか細胞増殖を抑える薬の開発が殆どで、感染症と同じような考え方でしたが、2000年以降はバイオマーカーを用いた個別化医療の疾患領域の創薬の考え方に変わっています。
コロナウイルス感染が世界的に猛威を振るう前は、感染症の薬はインフルエンザの治療薬がRocheなどで開発されてから、新しい薬の開発は殆ど必要無いと考えられ、多くの製薬企業は感染症医薬品から手を引いていました。それは、前々回もお話しましたが、感染症の治療薬や予防薬はウイルスや病原菌の増殖を抑えることを目的に開発されるため、全ての人に共通に使用できます。薬に患者さん個人に差があるとすれば、効き方と副作用の出方なので、一つの疾患に対して多種の薬を開発する必要がなく、特効薬が開発されれば解決するからです。また、感染症の治療薬の創薬は低分子創薬が中心で、殆どの製薬企業が低分子創薬のスクリーニングに用いていた低分子創薬用のライブラリーを手放してしまい、今回のコロナウイルスの治療薬開発に迅速に対応できなかったと考えられます。迅速に対応できた製薬企業は、以前から感染症の分野に強く、豊富な低分子創薬のライブラリーを維持してきた、ファイザー製薬や塩野義製薬などでした。
癌の領域の癌細胞殺すか細胞増殖を抑える薬の開発は副作用が強く古いと考えられていましたが、最近はプロドラッグ化やAntibody-drug conjugate(ADC)にし、癌細胞への選択性を高めることで、有効な薬になっています。また、PETのように癌細胞に蓄積する性質を持った化合物に光を吸収するユニットを付けた薬を作り、癌細胞に薬を集積させて、そこにレーザー光線を当てる治療法(
人間の病気の殆どは感染症と癌・成人病(生活習慣病)や先天性心疾患などの個別化医療の疾患領域であり、薬の開発の考え方や手段など創薬が異なります。この中で癌の領域の創薬は、2000年以前は癌細胞殺すか細胞増殖を抑える薬の開発が殆どで、感染症と同じような考え方でしたが、2000年以降はバイオマーカーを用いた個別化医療の疾患領域の創薬の考え方に変わっています。
コロナウイルス感染が世界的に猛威を振るう前は、感染症の薬はインフルエンザの治療薬がRocheなどで開発されてから、新しい薬の開発は殆ど必要無いと考えられ、多くの製薬企業は感染症医薬品から手を引いていました。それは、前々回もお話しましたが、感染症の治療薬や予防薬はウイルスや病原菌の増殖を抑えることを目的に開発されるため、全ての人に共通に使用できます。薬に患者さん個人に差があるとすれば、効き方と副作用の出方なので、一つの疾患に対して多種の薬を開発する必要がなく、特効薬が開発されれば解決するからです。また、感染症の治療薬の創薬は低分子創薬が中心で、殆どの製薬企業が低分子創薬のスクリーニングに用いていた低分子創薬用のライブラリーを手放してしまい、今回のコロナウイルスの治療薬開発に迅速に対応できなかったと考えられます。迅速に対応できた製薬企業は、以前から感染症の分野に強く、豊富な低分子創薬のライブラリーを維持してきた、ファイザー製薬や塩野義製薬などでした。
癌の領域の癌細胞殺すか細胞増殖を抑える薬の開発は副作用が強く古いと考えられていましたが、最近はプロドラッグ化やAntibody-drug conjugate(ADC)にし、癌細胞への選択性を高めることで、有効な薬になっています。また、PETのように癌細胞に蓄積する性質を持った化合物に光を吸収するユニットを付けた薬を作り、癌細胞に薬を集積させて、そこにレーザー光線を当てる治療法(
私たち(Spectro Decypher)が考えている臨床バイオマーカー探索の手法
 前回、私たちのグループ(Spectro Decyphe & CaBNET)の臨床バイオマーカー探索の手法をもう少し詳しくお話ししたいと書きましたが、このグループは臨床医も参加しており、一昨年からのコロナ禍のためグループの具体化が進展していない状態です。早くコロナウイルス感染が収まることを期待しているところです。
そのため今回はグループの具体的な臨床バイオマーカー探索の手法では無く、私たち(Spectro Decypher)が考えている臨床バイオマーカー探索の手法をお話します。
私たちは臨床試料を用いた癌治療の個別化医療を目的とした診断マーカー探索の組織です。皆さんもご存知のように抗がん剤は、例えばオブジーボでも、癌患者さん全体の20~30%しか効果がありません。その中で完治する患者さんはごく一部です。更に抗がん剤は多種類市場されていますが、どの治療薬も万能ではありません。それは、癌細胞が単一でなくヘテロであり、更に癌患者さん個々人によって癌細胞のヘテロな度合いが変わることによります。そのため、臨床のお医者さんは癌細胞の病理学的解析(癌細胞の形状や状態)では、どの治療薬を選べば良いかを正確に判断できない状態です。最近はハーセプチンのように診断マーカーを提供している治療薬が殆どですが、それでも診断マーカーで選ばれた癌患者さんの一部にしか効果が認められません。私は癌のようなヘテロな組織の場合、単一の診断マーカーで癌患者さんの全てに最適の治療薬を提供するのは難しいと考えています。そこで、私たちは癌患者さんの今までの臨床Data(血液や癌細胞の病理学的解析など)に、ゲノム・プロテインとメタボローム解析した最新Dataを用いて、全てMachine leaningの手法で解析し、患者さんを層別し、個々人に合った臨床バイオマーカー探索する事で患者さんに適した治療薬の選択の方法を考えてい
前回、私たちのグループ(Spectro Decyphe & CaBNET)の臨床バイオマーカー探索の手法をもう少し詳しくお話ししたいと書きましたが、このグループは臨床医も参加しており、一昨年からのコロナ禍のためグループの具体化が進展していない状態です。早くコロナウイルス感染が収まることを期待しているところです。
そのため今回はグループの具体的な臨床バイオマーカー探索の手法では無く、私たち(Spectro Decypher)が考えている臨床バイオマーカー探索の手法をお話します。
私たちは臨床試料を用いた癌治療の個別化医療を目的とした診断マーカー探索の組織です。皆さんもご存知のように抗がん剤は、例えばオブジーボでも、癌患者さん全体の20~30%しか効果がありません。その中で完治する患者さんはごく一部です。更に抗がん剤は多種類市場されていますが、どの治療薬も万能ではありません。それは、癌細胞が単一でなくヘテロであり、更に癌患者さん個々人によって癌細胞のヘテロな度合いが変わることによります。そのため、臨床のお医者さんは癌細胞の病理学的解析(癌細胞の形状や状態)では、どの治療薬を選べば良いかを正確に判断できない状態です。最近はハーセプチンのように診断マーカーを提供している治療薬が殆どですが、それでも診断マーカーで選ばれた癌患者さんの一部にしか効果が認められません。私は癌のようなヘテロな組織の場合、単一の診断マーカーで癌患者さんの全てに最適の治療薬を提供するのは難しいと考えています。そこで、私たちは癌患者さんの今までの臨床Data(血液や癌細胞の病理学的解析など)に、ゲノム・プロテインとメタボローム解析した最新Dataを用いて、全てMachine leaningの手法で解析し、患者さんを層別し、個々人に合った臨床バイオマーカー探索する事で患者さんに適した治療薬の選択の方法を考えてい
個別化医療を目的とした臨床試料を用いた臨床バイオマーカー探索のグループ
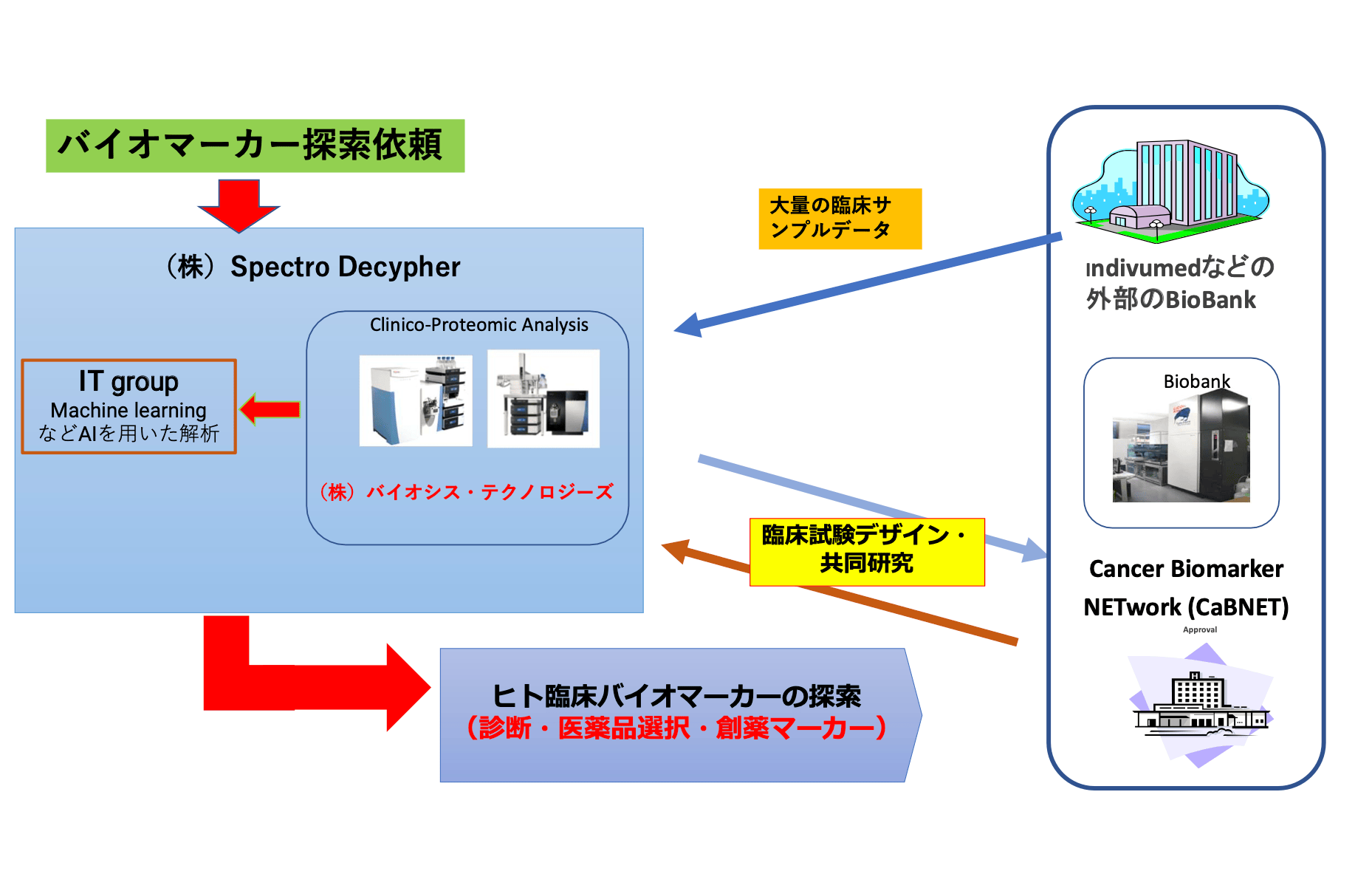 このコラムの初めの頃に個別化医療に関して説明しましたが、個別化医療で重要になるのは科学的に患者さんを層別でき、最適の薬を選べる遺伝子やタンパク質などの診断マーカーです。癌の領域では他病気の領域よりも診断マーカー(腫瘍マーカー)が少し進んでいると思われますが、患者個々人で病気の状況も異なるので、個別化医療には程遠く、また癌以外の病気(感染症を除く)では診断マーカーが殆ど無いのが現状です。
そのため、医療現場では現症診断にまだ多くを頼っており、遺伝子やタンパク質などの分子レベルで、ターゲットを予想して科学的に開発された医薬品の間に、まだまだ大きな谷があります。そのためには何が必要なのか。私は臨床の現場で起きている病気の現症を遺伝子やタンパク質などの分子レベルで解明し、それに合った最適な診断マーカーを病態組織や血液などの臨床資料から探索することが必要になっていると考えています。
アメリカでは2015年の年頭のオバマ大統領のPrecision Medicineの開発に大きな予算を出すと発言してから、癌治療を目的としたCancer Moonshot Projectが数年前から始まっており、臨床試料を用いたゲノムやプロテイン解析を利用した個別化医療に向かっています。
そこで、私たちは日本でも病態組織や血液などの臨床資料から患者さんを層別できる、診断マーカーを探索し、個別化医療に結びつけるシステムに取り組んで、今年の7月に癌治療の個別化医療を目的とした診断マーカー探索の組織を構築しました。
このグループは私たちのベンチャー企業の(株)Spectro Decypherと(株)Biosys Technologiesと、日本医科大学が中心になってできたCancer Biomarker NETwork(CaBNET)が共同で臨床バイオマーカー探索を行う組織です。
私たちの組織の体制
このコラムの初めの頃に個別化医療に関して説明しましたが、個別化医療で重要になるのは科学的に患者さんを層別でき、最適の薬を選べる遺伝子やタンパク質などの診断マーカーです。癌の領域では他病気の領域よりも診断マーカー(腫瘍マーカー)が少し進んでいると思われますが、患者個々人で病気の状況も異なるので、個別化医療には程遠く、また癌以外の病気(感染症を除く)では診断マーカーが殆ど無いのが現状です。
そのため、医療現場では現症診断にまだ多くを頼っており、遺伝子やタンパク質などの分子レベルで、ターゲットを予想して科学的に開発された医薬品の間に、まだまだ大きな谷があります。そのためには何が必要なのか。私は臨床の現場で起きている病気の現症を遺伝子やタンパク質などの分子レベルで解明し、それに合った最適な診断マーカーを病態組織や血液などの臨床資料から探索することが必要になっていると考えています。
アメリカでは2015年の年頭のオバマ大統領のPrecision Medicineの開発に大きな予算を出すと発言してから、癌治療を目的としたCancer Moonshot Projectが数年前から始まっており、臨床試料を用いたゲノムやプロテイン解析を利用した個別化医療に向かっています。
そこで、私たちは日本でも病態組織や血液などの臨床資料から患者さんを層別できる、診断マーカーを探索し、個別化医療に結びつけるシステムに取り組んで、今年の7月に癌治療の個別化医療を目的とした診断マーカー探索の組織を構築しました。
このグループは私たちのベンチャー企業の(株)Spectro Decypherと(株)Biosys Technologiesと、日本医科大学が中心になってできたCancer Biomarker NETwork(CaBNET)が共同で臨床バイオマーカー探索を行う組織です。
私たちの組織の体制
社会全体がコロナ禍で騒いでいる中で個別化医療なの?
 コロナウイルス感染の第4波の中で、医薬品業界はコロナウイルス治療薬や予防薬の研究開発に全力を注ぐ必要があり、この時期に個別化医療で無いでしょうと考える人も多いと思います。そこで、今回は私たちの個別化医療を行うための臨床試料を用いたバイオマーカー探索グループの話をする前に感染症と個別化医療について少し話します。
人間の病気の殆どは感染症と個別化医療の疾患領域です。感染症は、治療薬や予防薬が全ての人に共通に使用できるので、個別化医療の考え方は必要ないと考えられます。個人差があるとすれば、効き方と副作用の出方ですので、一過性で特効薬が開発されれば解決します。一方、個別化医療は癌・成人病(生活習慣病)や先天性心疾患などで、疾患の出方が多様なため個々人にあった薬が必要になります。今のコロナウイルス感染での外出自粛が長引けば、私は生活習慣病が増えるのではないかと危惧しています。
最近、政府はコロナ禍の中で日本のコロナウイルスのワクチンなど予防薬や治療薬の研究開発遅れている、特に抗体医薬の研究開発が遅れているので、そこを推進すると言っています。しかし、最近外国の抗体創薬の探索研究を行っているベンチャー企業から、「日本の製薬各社に抗体医薬の研究開発を共同で行いたいと話しをしても殆どの企業は乗り気ではない。何故でしょう」との相談がありました。これを考えると政府の言っているように日本で抗体医薬の研究開発がこれから進むかどうかは疑問です。
確かに、抗体創薬の探索研究は低分子創薬に比べて、創薬ターゲットに対するリード薬の探索は早いと思います。それなのに何故日本の製薬会社は乗り気にならないのか。それは抗体医薬やRNAワクチンの開発(品質保証などGLP、動物実験)・製品化(GMPなどの工場生産)には多額の費用が掛かるからです。この開発・製品化が出来るのは世界のトップ10に入るような資金力のあ
コロナウイルス感染の第4波の中で、医薬品業界はコロナウイルス治療薬や予防薬の研究開発に全力を注ぐ必要があり、この時期に個別化医療で無いでしょうと考える人も多いと思います。そこで、今回は私たちの個別化医療を行うための臨床試料を用いたバイオマーカー探索グループの話をする前に感染症と個別化医療について少し話します。
人間の病気の殆どは感染症と個別化医療の疾患領域です。感染症は、治療薬や予防薬が全ての人に共通に使用できるので、個別化医療の考え方は必要ないと考えられます。個人差があるとすれば、効き方と副作用の出方ですので、一過性で特効薬が開発されれば解決します。一方、個別化医療は癌・成人病(生活習慣病)や先天性心疾患などで、疾患の出方が多様なため個々人にあった薬が必要になります。今のコロナウイルス感染での外出自粛が長引けば、私は生活習慣病が増えるのではないかと危惧しています。
最近、政府はコロナ禍の中で日本のコロナウイルスのワクチンなど予防薬や治療薬の研究開発遅れている、特に抗体医薬の研究開発が遅れているので、そこを推進すると言っています。しかし、最近外国の抗体創薬の探索研究を行っているベンチャー企業から、「日本の製薬各社に抗体医薬の研究開発を共同で行いたいと話しをしても殆どの企業は乗り気ではない。何故でしょう」との相談がありました。これを考えると政府の言っているように日本で抗体医薬の研究開発がこれから進むかどうかは疑問です。
確かに、抗体創薬の探索研究は低分子創薬に比べて、創薬ターゲットに対するリード薬の探索は早いと思います。それなのに何故日本の製薬会社は乗り気にならないのか。それは抗体医薬やRNAワクチンの開発(品質保証などGLP、動物実験)・製品化(GMPなどの工場生産)には多額の費用が掛かるからです。この開発・製品化が出来るのは世界のトップ10に入るような資金力のあ
中分子有機化合物の創薬への新たな利用法
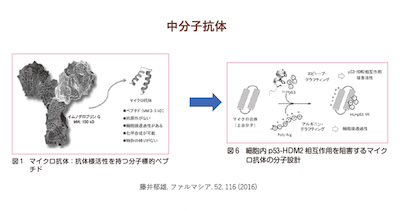 今回は中分子化合物をPPI阻害剤として利用する以外の、新たな利用法に関して少し説明します。以前の「プロテイン相互作用を阻害する中分子創薬が最近話題」のところで、「最近では中分子サイクリックペプタイドがPPI阻害剤の開発への利用だけでなく、低分子創薬への応用や、抗体薬やドラッグデリバリーにも利用できるのではないかとも考えられています。」と書きました。
更に、前回天然物の中分子化合物にサイクリックペプタイドやペプチドミメティック化合物多く含まれていることを説明している際に、動植物はそれらの中分子化合物の多くを生理活性物質として分子の立体構造変えながら利用していることを思い出しました。特にセファロスポリンなどのサイクリックペプタイドの一部分は体内動態の研究で、血液中では水酸基などの水溶性残基を分子の外に出して水溶性になり、目的のプロテインと相互作用する際には水溶性残基を分子の内側に入れて脂溶性を高めることが明らかになっています。この様な体内動態を示す中分子化合物は抗体薬やドラッグデリバリーにも利用できると考えられます。 中分子化合物の抗体薬やドラッグデリバリーの応用は、最近盛んにおこなわれるようになり、20015年から2017年に掛けて既に報告があります。 初めに中分子化合物を用いたドラッグデリバリーですがペプチドドリーム社が2017年の合成誌(K.Masuya, et.al.,J.Synth.Chem.,Jpn.75.1171)に報告しています。それによるとサイクリックペプタイドなどの中分子化合物は抗体と同じ様に目的の疾患細胞に集積する性能を持つ化合物が存在し、このような性能を持つ中分子化合物を利用することでAntibody-Drug Conjugate(ADC)と同様のドラッグデリバリーが可能となると言っています。これをペプチドドリーム社はPeptide-Drug C
今回は中分子化合物をPPI阻害剤として利用する以外の、新たな利用法に関して少し説明します。以前の「プロテイン相互作用を阻害する中分子創薬が最近話題」のところで、「最近では中分子サイクリックペプタイドがPPI阻害剤の開発への利用だけでなく、低分子創薬への応用や、抗体薬やドラッグデリバリーにも利用できるのではないかとも考えられています。」と書きました。
更に、前回天然物の中分子化合物にサイクリックペプタイドやペプチドミメティック化合物多く含まれていることを説明している際に、動植物はそれらの中分子化合物の多くを生理活性物質として分子の立体構造変えながら利用していることを思い出しました。特にセファロスポリンなどのサイクリックペプタイドの一部分は体内動態の研究で、血液中では水酸基などの水溶性残基を分子の外に出して水溶性になり、目的のプロテインと相互作用する際には水溶性残基を分子の内側に入れて脂溶性を高めることが明らかになっています。この様な体内動態を示す中分子化合物は抗体薬やドラッグデリバリーにも利用できると考えられます。 中分子化合物の抗体薬やドラッグデリバリーの応用は、最近盛んにおこなわれるようになり、20015年から2017年に掛けて既に報告があります。 初めに中分子化合物を用いたドラッグデリバリーですがペプチドドリーム社が2017年の合成誌(K.Masuya, et.al.,J.Synth.Chem.,Jpn.75.1171)に報告しています。それによるとサイクリックペプタイドなどの中分子化合物は抗体と同じ様に目的の疾患細胞に集積する性能を持つ化合物が存在し、このような性能を持つ中分子化合物を利用することでAntibody-Drug Conjugate(ADC)と同様のドラッグデリバリーが可能となると言っています。これをペプチドドリーム社はPeptide-Drug C