東京大学生産技術研究所の会原幸一先生らは臨床バイオマーカーで正常(健康)状態と異常(疾病)状態の違いを定量的に示すことができるため、癌、心臓病、糖尿病などの診断において広く使われていますが、従来の静的バイオマーカーは、正常状態と疾病の早期状態や病態悪化の初期状態の違いをはっきり識別することが困難(なため)で、疾病の早期診断や病態悪化の予兆検出をするには有効ではないため、正常状態と病態の臨界状態、病態初期状態あるいは病態悪化の動的状態遷移過程をはっきり識別することが出来る動的ネットワークバイオマーカー(DNB:Dynamical Network Biomarker)を提案しています。
このDNBを複雑疾病の早期診断や病態悪化の予兆検出に広く適用することで、適切なタイミングで適切な個別化医療を行なうことが可能となるものと期待されます。
前回の西村先生らの肺癌の臨床プロテオーム解析から、24 cancer-related KEGG pathways から得られたLPIA、MIAとAISのSTRING gene set enrichments(GSE)の結果でも、動的ネットワークバイオシステムがどのように病気ステージで変わるかを明らかにしました。更に癌細胞近傍の正常細胞も既に癌細胞特有のバイオシステムが高発現していることは、まさに会原先生らに提言している正常状態と病態の臨界状態を実験的に証明していると考えられます。
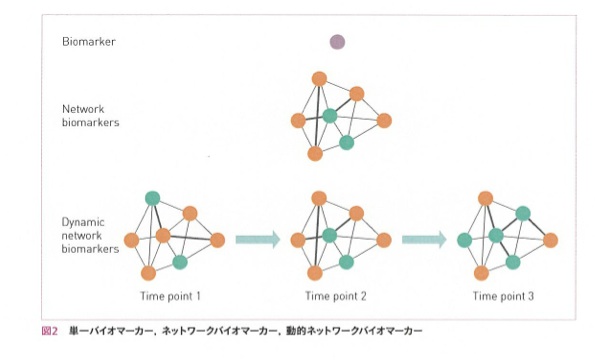
この様にバイオマーカーは上記の図のように、以前には何か単一のバイオマーカーを探索することで創薬に応用可能と考えられていました。更に、ゲノム解析からバイオマーカーシステムが明らかになりネットワークバイオマーカーの考え方が必要と言われるようになってきました。しかし、最近では今までは話してきたように疾病の早期診断や病態悪化などのステージの異なる臨床試料を用いたプロテオーム解析などによって明らかになる、動的ネットワークバイオマーカーの考え方が今後の臨床や創薬に最も重要になってきていると考えられます。
臨床バイオマーカーとしては単一のバイオマーカーで良いのですが、動的ネットワークバイオマーカーを考慮すると臨床バイオマーカーも更に詳細になり、以前に紹介した糖尿病のDDP-4阻害剤を使っている患者さん薬の選択も試行錯誤でなく、科学的選択が可能になるのではないでしょうか。これこそが正に個別化医療に繫がると私は考えています。
更に、創薬もこの動的ネットワークバイオマーカーを考慮して開発を進めることがこれからは必要となっていると思うのです。この様に考えるとこれからの創薬は低分子医薬、中分子医薬、抗体医薬、コンジュゲート医薬や免疫医薬などのどれを選ぶかを議論するのでは無く、動的ネットワークバイオマーカーを考慮した創薬の開発を考えればよいのではないでしょうか。
ここで、動的ネットワークバイオシステムの解析について少しお話します。これには臨床試料を用いたプロテオーム解析やメタボローム解析が必要で、癌細胞や血液などを用いたプロテオーム解析は探索的プロテオーム解析による発現解析で、対象の臨床試料に特異的なタンパク質を見出すことができ、通常この情報はタンパク質の種類とそれらの相対的な発現量を明らかにすることができます。更に、これら臨床プロテオーム解析からサブグループ特異的に同定されたタンパク質群が他のタンパク質群とどのように相互作用しているかを知ることは、バイオマーカーや治療標的タンパク質を評価する上で最も重要な情報であります。
また、臨床試料を用いたもう一つの解析法がメタポローム解析で主に血液や尿などの臨床検査に用いる生体資料を対象として、そこに出てきた脂質、ペプタイド、プロテインなどの生体由来の代謝物を解析し、その結果をゲノム解析から明らかになったバイオシステムの情報を用いコンピューター解析することで、ターゲットのネットワークバイオマーカーを明らかにしようとする方法です。
このように、臨床試料を用いた臨床プロテオミクスやメタボロームは、病気サブグループに関連する分子ネットワークからDrug responder やNon-responder見極めや、薬剤耐性の予測などに有望なプラットホームであると考えられます。更に、創薬開発は前に述べたようにフェーズIIからフェーズIIIへの成功確率をいかに上げるかが大きな課題です。それは種間差(動物と人間)であるだけでなくフェーズIIIで開発に適した患者を用いているかで薬物の有効性に影響するし、また人種間で副作用が影響します。 そこで、臨床サンプルを用いた臨床プロテオミクスやメタボロームのDataの医薬品開発への利用が重要性を増していると考えます。 但し、メタボローム解析は生体代謝物を見ているので、臨床バイオマーカーは探索できても創薬ターゲットバイオマーカーを探索するのは難しいと思われ、一方プロテオーム解析は創薬ターゲットバイオマーカーを探索に適していても臨床バイオマーカー探索には不向きではないかと私は考えています。
しかし、臨床プロテオミクスとメタボロームのどちらの方法の問題点を解決するためには、ネットワークバイオマーカーを実験的に証明する必要があり、それぞれのバイオマーカーの相互作用、言い換えるとプロテインープロテイン相互作用(PPI)を解明することで、必要になっているのが探索的プロテインープロテイン相互作用解析です。次回は探索的プロテインープロテイン相互作用解析する方法を説明することにしましょう。