今回は今年のノーベル化学賞に輝いた、ATを用いタンパク質のアミノ酸配列から、タンパク質の高次構造解析する技術を利用する、創薬研究について話すことにします。2024年のノーベル化学賞は、全く新たなタンパク質をコンピュータで設計し、合成したワシントン大学のデイビッド・ベイカー氏と、タンパク質の立体構造を予測する画期的なAIモデルを開発した(アルファード2)グーグル・ディープマインド社のデミス・ハサビス氏/ジョン・M. ジャンパー氏に贈られました。
これらの研究によって、タンパク質をカスタマイズして新規に合成する可能性が開かれ、医薬品開発などへの応用も期待されています。またタンパク質の立体構造をAIモデルで正確に予測できるようになったことで、多くの研究者がこのプログラムを活用し、タンパク質の精度の高い予測立体構造や機能の情報を短時間で得ら、創薬のタンパク質の立体構造とリード化合物探索などに欠かせない手段になるとと考えられています。
最近ハサビス氏らは、タンパク質と薬物のバインディング部位も正確に予測できるアルファード3を開発しました。そこで、このアルファード3を用いた、医薬品開発の「薬物のリード化合物の探索」と「リード化合物の最適化」について話します。
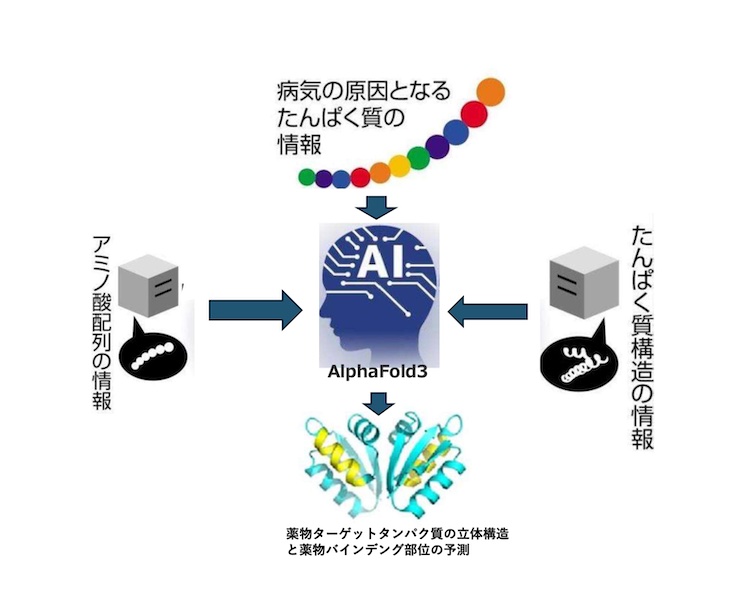
まずは「薬物のリード化合物の探索」について説明します。RNAなどから病気の原因となるタンパク質の構造情報がわかると、アミノ酸配列のデータベースとたんぱく質構造のProtein Data Bank(PDB)を用いて、アルファード3で解析し、薬物のターゲットタンパク質の立体構造と薬物のバインディング部位を予測します。更に、低分子や中分子有機化合物のデータベースを組み合わせることにより、AIでリード化合物の探索が可能になります。その後実験で、この方法で見つかったリード化合物と薬物ターゲットタンパク質とバインデングアッセイを行い、実際にバインディングを確認する必要があります。
次に、「リード化合物の最適化」についてですが、薬物ターゲットタンパク質のバインディング部位の構造とリード化合物を利用して、AIがリード化合物の化学構造を修飾し、バインディングに適した化学構造に最適化することで、生理活性の高い医薬品候補化合物を見つけることができます。
更に、アルファード3はプロテインープロテイン相互作用の立体構造と相互作用部位の予測も可能で、プロテインープロテイン相互作用を阻害する薬物の探索も可能になっています。
以上のことから、今後の低分子・中分子有機化合物の薬物探索と開発はAIを用いた方法が主流になって行くと考えられます。
それでは次回は今後の医薬品開発の方向性に関して、私の考え話したいと思います。




