DDSの具体的な研究例の最後にエクソソームを取り上げます。最近の研究で細胞が分泌するナノサイズの小胞であるエクソソームが、タンパク質や核酸を内封して、細胞間にコミニケションツールとして働いていることが明らかになりました。更に、エクソソームには臓器などの体内組織の特定の細胞に、分子を送達する機能も有している可能性が示されていて、このことはエクソソームが生体に備わっている天然のDDSであり、高分子ミセルやリボソームよりも有効なDDSにつながる可能性があると考えられます。
エクソソームをDDSのキャリアとして利用するには、エクソソームがどのような特性をもっているのかを理解する必要があります。エクソソームは細胞が分泌する100nmほどの脂質二重膜を有する、細胞外小胞の一種です。エクソソームの分泌機構については完全に解明されているわけではありませんが、一般的にエンドソーム由来と考えられています。後期エンドソームは内側にくびれて腔内膜小胞(intraluminal membrane vesicle;ILV)を形成します。このILVを多数含む多胞性エンドソーム(multivesicular body;MVB)が細胞膜と融合して、細胞外へと放出される小胞がエクソソームと考えられています。そのエクソソームの内容物には、細胞に由来するmicroRNA(miRNA)やmRNAなどの核酸やさまざまなタンパク質が内包されています。そして、脂質二重膜にも膜タンパク質が存在しています。
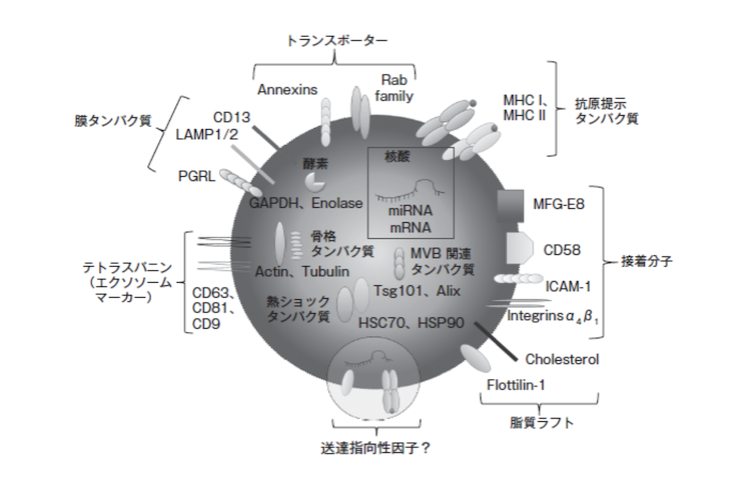
あらゆる細胞がこのような小胞(エクソソーム)を分泌しており、細胞間にコミニケションツールとして働いているのです。(Y.Yosioka & T.Ochiya, Drug Delivery System, 35-1, 35,2020)近年、エクソソームに含まれているmiRNAは、人の全遺伝子の60%以上もの発現を制御し、細胞の分化や増殖、更に発生段階での遺伝子発現の時間的制御の重要なプロセスに関与していることが明らかになっています。そこで、エクソソームに薬物を内包することで有効なDDS医薬品ができると考えられます。
しかし、エクソソームDDSの実用化の課題は、細胞から分泌されるので、大量生産には不向きで、またエクソソーム内に効率的に薬物を内封する技術が確立されていません。更に治療に必要な量のエクソソームを投与した時の安全性が担保されるかわかりません。
これらの課題を解決するために長崎大学の大山将太教授らは(Shota Oyama & Asako Yamayoshi, Drug Delivery System 36-2,108, 2021)、エクソソーム膜表面タンパク質のCD63を標的とするモノクローナル抗体(anti-CD63抗体)と、miRNAに相補的な配列を有する核酸(anti-miR)の2つから構成される抗体複合型核酸(ExomiR-Tracker)を体内に投与することで、癌細胞から分泌されるエクソソームのCD63にExomiR-Trackerが付き、Cal27細胞内に取り込まれてmiRNAの機能が阻害されたことを確認しました。
このように、エクソソームを投与するのではなく、体内に発生しているエクソソームに、エクソソーム膜上に存在するCD63、CD9、CD81などのテトラスパニンを標的としたモノクローナル抗体に、核酸医薬を付けたExomiR-Trackerを体内に投与することで、目的のエクソソーム膜上にExomiR-Trackerが吸着し、疾患細胞に送達することが可能となります。この方法を用いることで、エクソソームに内包された多種の分子を標的とした新規分子標的医薬への発展が期待されると考えられます。
以上、DDSは目的の疾患部位に低分子、生体高分子や核酸など医薬品を送達させる有力な手段であり、薬の副作用の軽減にも繋がると私は考えています。
そこで、医薬品をDDS化して、疾患部位に送達されるためには、疾患の標的分子の探索、疾患部位への送達のメカニズムと患者の層別が必要になります。次回からはこの部分に関して、私の考えを話してみたいと思います。