DDSは標的部位に到達するまで薬物を保持して、標的部位で薬物を放出する必要があります。そこで、前回も話したようにDDSは、温度などの物理的刺激やpH変化などの環境の刺激に応答して薬物を制御する必要があり、更に薬物の作用部位が細胞内の場合は、薬物を細胞内に到達させる必要があります。そこで、DDSナノキャリアとして注目されたのが、A.D.Banghamによって発見されたリボソームです。
リボソームは、リン脂質からなる数10~数100nmの粒径を持つ微小なカプセルで、その内部に様々な分子を封入でき、生体適合性や生分解性にも優れています。そのため、発見されてから、薬物や生理活性物質の理想的な運搬体と考えられてきました。更に、薬の効果を最大限引き出すために、臓器・組織レベルあるいは細胞の内部まで薬物送達させ、正確なコントロールを実現する新しいリポソームテクノロジーが必要とされています。薬物送達システムとしてのリポソームの有用性をより高めるために、高度な機能をもつリポソームとして、温度感受性リポソームおよび、膜融合能をもったリポソームなどの開発と応用についての研究が進められています。
そこで、今回はリボソームを用いたDDS研究の第一人者である河野健司教授の研究例を紹介します(Kenji Kono, Drug Delivery System 31-4, 2016, 331)。 河野教授らは下記の図に示すように、リポソームの機能はポリマーとリポソーム膜との相互作用によって発現するため、リポソームにさまざまな機能の分子鎖構造を持つポリマーを複合させることにより、多様な機能性と鋭敏な応答性を持った高機能・高性能リポソームの作成が可能になると考えました。
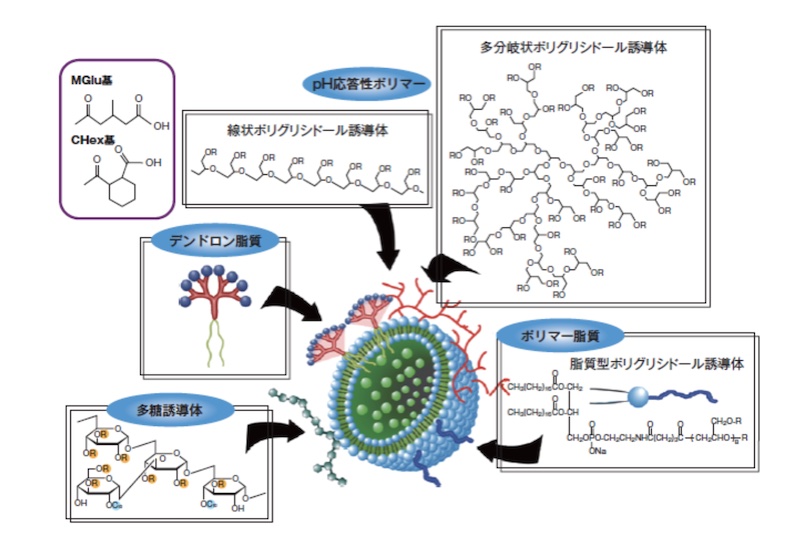
その中で、今回はPH応答性ポリマーの複合化による機能性リポソームについて説明します。
まず、機能性ポリマーにポリグリシドール(PG)をベースポリマーとして用いることを検討しています。このポリマーにコハク酸無水物、3―メチルグルタリル酸無水物、シクロヘキサン―1 ,2―ジカルボン酸無水物を反応させ、スクシニル(Suc)基やMGlu 基、CHex 基(図)をポリグリシドール側鎖に導入することで種々のpH 応答性ポリマーを作製します。更に、これらのポリマーを卵黄ホスファチジルコリン(EYPC)リポソームに複合化すると、中性では安定ですが、弱酸性環境においては不安定で膜融合し、pH 応答性膜融合リポソームが得られることがわかりました。これは、中性ではポリマー側鎖カルボキシ基が解離して荷電するため、高度に水和したポリマー鎖によってリポソーム膜が安定化されますが、pH の低下とともにカルボキシ基がプロトン化され、ポリマー鎖が脂質膜と強く相互作用して不安定化し、膜融合を誘起すると考えられます。中でも、MGlu 基やCHex 基を持つポリグリシドール誘導体は、微弱酸性領域での鋭敏なpH 応答機能をリポソームに与え、優れたpH 応答性膜融合リポソームが生成されました。これらのpH 応答性基は、多分岐状ポリグリシドールや多糖類など、さまざまな分子鎖構造を有するポリマーに対して高いpH 応答機能を与え、多様なpH 応答特性を持つリポソームの作製が可能になりました。
このように、pH 応答性リポソーム―リポプレックス複合体は、アニオン性の表面により細胞膜にダメージを与えず、更に細胞内で膜融合によってスムーズにプラスミドDNA を細胞質に移行させるため、高効率で低毒性な遺伝子導入が実現されたものと考えられます。
この河野教授らの研究はDDSに機能性リポソームを有効活用した例であり、今後のリポソームを用いたDDS研究の道筋を示したと考えられます。それでは、次回はエキソソームを用いたDDSの例を説明します。