前回述べたように現症診断にまだ多くを頼っている臨床の現場と、ゲノムから解析されたバイオメカニズムを用いターゲットを予想して科学的に開発された医薬品の間に、まだまだ大きな谷があって、そこを科学的に結びつけることがまだ十分でないためにその谷を埋めることが出来ないのが現状ではないでしょうか。
そのためには何が必要なのでしょうか?私は臨床の現場で起きている現症を分子レベルで解明することが非常に重要になっていると考えています。そのためには臨床試料を用いた臨床プロテオーム解析やメタポローム解析手法と最新の分析技術、更に最近のIT技術を応用したAIやマシンランニングの手法を総合的に活用して臨床現場で起きている現症を科学的に解明していくことが必要であると思うのです。
そこで、この点をはじめに臨床試料を用いた臨床プロテオーム解析から詳しく説明することにします。
その代表例としてアストラゼネカ社が上皮成長因子受容体(EGFR)チロシンキナーゼ阻害剤イレッサ(非小細胞肺癌治療薬)を合成・開発した際に、現在一緒に仕事をしている聖マリアンナ医科大学特任教授の西村先生たちは、臨床試料を用いるタンパク質発現・定量解析技術としての質量分析に基づく探索的プロテオミックス解析(MS-based discovery proteomics)手法を用いて、EGFRに変異がある人では受容体の形がイレッサと結合しやすい形になっているので、薬の効果が高まることを解明しました。
また、日本人などの東アジア人にEGFRの変異が多く認められる事を報告し、そのことがイレッサの医薬申請に大きく寄与しました。更に、臨床の現場でもEGFR(上皮成長因子受容体)遺伝子変異検査を行い、がん細胞を調べEGFR遺伝子に変異が起きている場合には、イレッサを投与するようになっています。
このように、疾患を起こしている機能分子はタンパク質であり、治療標的もそのタンパク質です。そのため、臨床試料を用いるタンパク質発現・定量解析技術としての質量分析に基づく探索的プロテオミックス解析が益々重要となっています。
ここで探索的プロテオミックス解析において質量分析の手法がなぜ重要かについて少しお話します。質量分析の特徴は他の方法と異なり高感度で分子レベルでの解析が可能な、非常高い分子認識能力にあり、この手法には一般的にLC/MS/MSを用いた「ショットガンプロテオーム解析」が用いられています。今はこの方法により数百~数千種類のタンパク質群が一斉同定されています。更に用いられる臨床試料は多様で、手術切除により凍結組織、ホルマリン固定包埋(FFPE)組織、バイオプシー、血漿、脊髄液などがありこれらの臨床試料をこの方法で解析することが重要で現在は可能になっています。 ここで、肺腺癌の臨床試料を用いた西村先生らが行った探索的プロテオミックス解析の例を示します。
話の初めに一般的に臨床の現場で行われている肺腺癌組織の病理学的な分類について説明します。2011年にIASLC/ATS/ERSで提案される肺腺癌の新しい病理学的分類においては、癌の進行の度合いによって、3つのサブタイプ、lepidicタイプ腺癌はsitu(AIS)、最小限に浸潤性腺癌(MIA)とlepidicな主な浸潤性腺癌(LPIA)に分類され、腺癌はこのサブタイプによって構成されています。
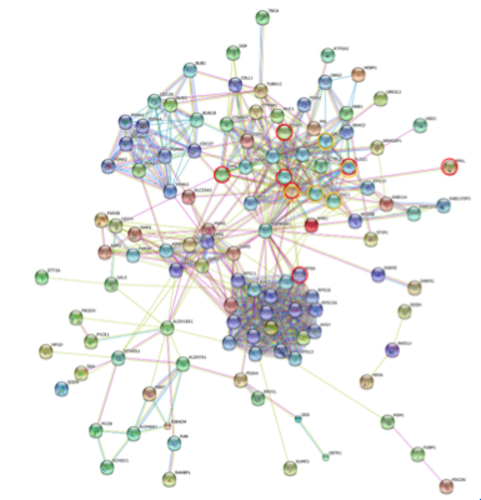
西村先生らが肺がんFFPE-組織標本を用いレーザー-マイクロ解剖した(LMD)ガン細胞の臨床プロテオーム分析研究行った結果の発現プロテインを、LPIAプロテオーム・データベースから決定されたSTRING PPIネットワークに表しました。その結果、ErbB signaling pathwayは多くのcancer pathwayと関係していることがわかり、 そしてErbBファミリーは表皮腫瘍の成長で重要な役割を演ずる成長因子レセプターのEGFRの過剰発現が60%のnon-small cell lung cancer(NSCLC)のまわりで起こり、それは腺癌より高い頻度を持っていることが明らかになりました。
図A
図B
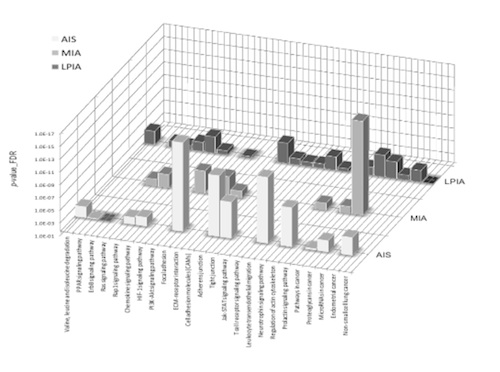
更にHypoxia-inducible factors (HIFs)は低酸素下のHIF-1で起こるMet receptorの活性化が起こります。ここで、ErbB とHIF-1 signaling pathwaysに関与する分子を図Aでオレンジと赤い円によって表示しました。更に、 図Bは24 cancer-related KEGG pathways から得られたLPIA、MIAとAISのSTRING gene set enrichments(GSE)の結果で、この結果は動的ネットワークバイオシステムがどのように病気ステージで変わるかを明らかにしています。
この結果よりこの種の肺癌の創薬を考えた場合AISとMIAでそれぞれ高発現しているプロテインが異なっているので、それぞれのターゲットプロテインも異なってくると考えられます。尚、LPIAに至っては特徴的に高発現しているプロテインがなくこのステージの創薬は難しいと思われます。
更に臨床の先生方は癌の手術の際に転移を防ぐために、癌近傍の正常細胞(病理学的に正常細胞)も切除します。そこでこの正常細胞もプロテオーム解析をすると、すでに癌細胞特有のプロテインが高発現していて癌細胞と動的ネットワークバイオシステムを形成していることが明らかになりました。その中で非常に興味深い結果は、現在抗癌剤のターゲットプロテインとしているプロテインで、すでに幾つかのところでスクリーニングをしているこのプロテインが、AIS、MIAやLPIAで高発現していないで、何と癌近傍の正常細胞で高発現していることが明らかになり、抗癌剤よりも手術後の再発や転移予防薬としての開発の方が良いのではないかと私は思っています。
それで次回は肺腺癌組織の臨床プロテオーム解析の結果より明らかになってきた動的ネットワークバイオシステムについて説明することにします。



