泥棒が銀行の金庫に進入すると、センサーが作動してアラームが鳴る。細胞は、侵入者のために独自の早期警戒システムを有している。フランス・グルノーブルのヨーロッパ分子生物学研究室(EMBL)の科学者達は、特定のタンパク質がウィルスの侵入を検出した際にアラームを鳴らす方法を発見した。2011年10月14日付のCell誌に掲載された今回の研究は、自然免疫反応についての理解を深めるのに重要な役割を果たし、インフルエンザや狂犬病、肝炎など多様なウィルスに対する細胞の迅速な対応方法の解明に寄与するであろう。
細胞は浸潤する物質を探知するために、パターン認識受容体と呼ばれるタンパク質を利用する。このタンパク質は、感染菌だけが持つ分子パターンを認識し、結合するのである。この結合によって受容体の形状が変化し連鎖反応を引き起こし、最終的には周囲の細胞に浸潤の警告を行なう。今までは、このセンシングとシグナル伝達の二つのプロセスの結びつきが解明されていなかった。
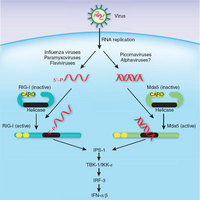
EMBLの研究者達は、これらの受容体の一つであるRIG-Iが形状の変化をシグナルに変換する正確な構造メカニズムを発見した。「リガンド結合はどのようにしてシグナリングを誘発するのか?これは、構造生物学者にとって古典的な問題です。」と、今回の研究の主導者であるステファン・キューサック博士は語る。「我々は特にRIG-Iについての答えを探すのに興味がありました。なぜなら、RIG-Iはインフルエンザ、麻疹、C型肝炎といったほぼ全てのRNAウィルスをターゲットにするからです。」
RIG-Iはウィルス感染への反応として、ウィルス遺伝物質であるウィルスRNAを認識し、抗ウィルス分子インターフェロンを生成するように細胞を刺激する。インターフェロンが分泌され、周囲の細胞に取り込まれ、感染と戦うための数百の遺伝子を活性化する。RIG-Iが細胞自身のRNAではなくウィルスRNAだけを検知し、アラームを鳴らす方法を理解するために、研究者達は欧州シンクロトロン放射光施設(ESRF)が産生する強力なX線ビームを使用した。X線結晶解析と呼ばれる方法で、ウィルスRNAの存在下および非存在下でRIG-Iの三次元分子構造を特定したのである。ウィルス感染のない状況では、受容体が“片目を開けて寝ている”状態であることが分かった。つまり、RIG-IのウィルスRNAを探知する部分が露出している反面、シグナリングを受け持つ領域が、シグナリング機構の手の届かない所に隠されているのだ。RIG-IはウィルスRNAを検出すると形を変え、シグナリング分域が“目覚めた“状態になり、インターフェロンの生産を引き起こすためにアクセス可能になるのである。
EMBLの研究者達は真鴨のRIG-Iを使用したが、この受容体の機能はヒトのそれと同じである。「RIG-IはウィルスRNAに反応して活性化されますが、同様のメカニズムが他の免疫受容体にも使用されている可能性が高いでしょう。その特異性がウィルスであろうと細菌であろうと。」と、今回の研究の大半を実行した博士課程学生のエバ・コワリンスキー氏は言う。従ってこれらの発見は、感染に対する防御の最前線である自然免疫反応の働きのより広範な理解に貢献し、今年の生理学または医学ノーベル賞の対象である。
この研究は、国際ウィルス宿主細胞相互作用団(International Unit of Virus Host-Cell Interactions)のプロジェクトとして実施され、EMBLとグルノーボルのジョセフ・フーリエ大学(UJF)、そしてフランス国立科学研究センター(CNRS)との連携で、さらにフランス・リヨンの国立保健・医療研究所(INSERM)のデニス・ゲルリエール博士も参画している。
[BioQuick News: Innate Immune Response Illuminated by New Study of RIG-I">