自然免疫系は、宿主と微生物の相互作用を制御し、特に粘膜に侵入した病原体に対する防御に重要な役割を担っている。今回、パスツール研究所とInserm (フランス国立衛生医学研究所)の研究者らは、腸管感染モデルを用いて、自然免疫系エフェクター細胞-グループ3自然免疫系リンパ球が感染の初期段階で作用するだけでなく、再感染時に宿主を保護する自然免疫記憶を発達させるよう訓練できることを明らかにした。この研究は、2022年2月24日のScience誌に掲載された。この論文は「訓練されたILC3応答が腸管防御を促進する(Trained ILC3 responses promote intestinal defense)」と題されている。
腸の病気や消化管出血の原因となる大腸菌感染症対策は、公衆衛生上の大きな課題だ。飲料水や食品中に存在するこれらの細菌は、急性腸炎に伴う持続的な下痢を引き起こすことがある。その結果、腸管病原性大腸菌および腸管出血性大腸菌は、世界の小児死亡原因の約9%を占めている。
腸粘膜は、正常な身体機能に不可欠な常在細菌叢に対する耐性を維持しながら、病原体の感染に対抗するための複雑な防御システムを保有している。この常時監視を行うのが自然免疫系であり、感染後数時間のうちに初期防御を行う。次に、適応免疫系は、BおよびTリンパ球の表面に発現する特異的受容体を活性化することにより、遭遇した病原体に対する記憶を形成し、それによって防御抗体および炎症性サイトカインの産生を可能にする。長期的な耐性と防御における適応免疫系の機能が明確に確立されているのとは異なり、免疫記憶における自然免疫系の役割はいまだ解明されていない。
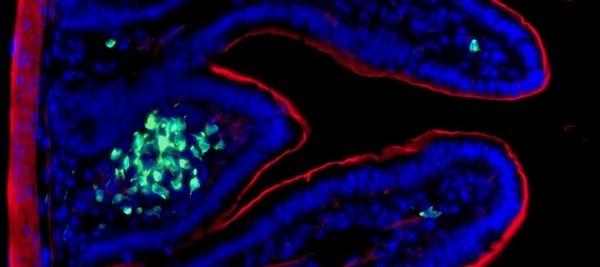
2008年にInsermの科学者ジェームズ・ディ・サント博士率いるチーム(パスツール研究所/Insermの自然免疫ユニット)は、適応型Tリンパ球やBリンパ球とは異なる新しいリンパ球ファミリーとしてグループ3自然免疫系細胞(ILC3)を発表した。ILC3は、インターロイキン22(IL-22)などの炎症性サイトカインを産生し、特に腸管粘膜における自然免疫反応に重要な役割を担っている。このサイトカインの放出は、上皮細胞による抗菌ペプチドの産生を活性化し、それによって腸管バリアの完全性を維持するために細菌の負荷を減少させる。
この度の研究では、自然免疫ユニットの研究者が、Citrobacter rodentium(大腸菌感染モデルマウス)をベースにした時間制限付きの腸内細菌チャレンジに免疫系をさらすという革新的なプロトコルを使用した。その結果、C. rodentiumにさらされた後、ILC3が活性化した状態で数カ月間持続することが観察された。さらに、2回目の感染時には、この『鍛えられた』ILC3が、増殖とIL-22の大量生産を通じて、感染を制御する優れた能力を発揮することも確認された。
本研究の筆頭著者であり、自然免疫ユニットの科学者であるニコラ・セラフィニ博士は、「我々の研究は、腸管ILC3が長期にわたって記憶を獲得し、反復感染に対する腸管粘膜防御を強化していることを示している」と説明している。
またジェームズ・ディ・サント博士は「粘膜の自然免疫系を "鍛える"ことができれば、人間の病気を引き起こすさまざまな病原体に対する身体の防御力を向上させる道が開ける。今回の発見は、新しい抗菌免疫防御機構を示すものであり、長期的には、腸の病気( 炎症性腸疾患や癌)に対する新しい治療法につながる可能性がある」と述べている。
BioQuick News :Discovery of an Innate Immunological Memory in the Intestine