長年、研究者はインシュリン産生膵ベータ細胞を再活性化することで糖尿病を治療する方法を探してきたが、ほとんど成果が得られていない。しかし、類似したアルファ細胞をベータ細胞に「リプログラミング」することで、いつか、2型糖尿病に対して、現在の治療法を補完する方向の新しい治療法が可能になるかも知れない。ヒトとマウスの細胞使って、細胞核内の染色質 (クロマチン) と呼ばれる物質を変化させる化学物質で処理するとアルファ細胞中でベータ細胞遺伝子が発現したという研究論文が、「Journal of Clinical Investigation」の2013年2月22日付オンライン版に掲載されている。
この論文の筆頭著者で、ペンシルバニア大学Institute of Diabetes, Obesity and Metabolism, Perelman School of Medicineのメンバーであり、遺伝学教授を務めるKlaus H. Kaestner, Ph.D.は、「この研究成果から治療法が確立すれば、インシュリン産生ベータ細胞が増え、グルカゴン産生アルファ細胞が減ることになるから、糖尿病患者にとっては一挙両得になるはず」と語っている。
2型糖尿病では、インシュリンが欠けるだけでなく、グルカゴンが過剰になる。糖尿病は1型も2型もインシュリン産生ベータ細胞が不足することによって引き起こされるのであり、理論的には、健康なベータ細胞を移植すれば、病気の進行を止めることができる。ただし、1型糖尿病の場合には自己免疫を抑制するために免疫抑制薬なども併用しなければならない。しかし、まだ誰も、胚性幹細胞を使っても、あるいは成熟細胞のリプログラミングの方法を使っても、実験室レベルでさえ効率的にベータ細胞を産生することができないでいる。
アルファ細胞は、ベータ細胞と同じように膵臓内の内分泌細胞であり、グルカゴンと呼ばれるペプチド・ホルモンを合成し、分泌する。このグルカゴンが血中のグルコース量を引き上げる。Dr. Kaestnerは、「研究では、ヒストンにメチル基を付加するタンパク質の機能を抑制する化学物質でヒトのランゲルハンス島細胞を処理した。こうすると、他にも効果はあるが、まず遺伝子発現に影響を与えるヒストンの修飾を停止することができる。この処理を施すと、ベータ細胞マーカーを発現するアルファ細胞の頻度が上がることを突き止めた。しかも、薬品で処理するとインシュリン産生さえ始めた」と述べている。
細胞核の内部でDNA鎖は、ヒストンというタンパク質に巻きついている。研究チームは、アルファ細胞内の遺伝子の多くがヒストンの修飾でマークされており、それによって活性化されたり、抑制されたりすることを突き止めた。そのような遺伝子の中には、ベータ細胞内の機能に重要とされる遺伝子も多く含まれていた。ある状態でオフになっている遺伝子も、ヒストンを抑制している修飾を取り除くだけで容易に活性化することができる。Dr. Kaestnerは、「ある程度、ヒトのアルファ細胞は柔軟なエピジェネティックな状態にあると言える。私たち研究チームは、そのことを利用し、アルファ細胞をリプログラミングしてベータ細胞表現型に変えることができれば、糖尿病患者が必要とするインシュリン産生細胞を増やすことができるのではないかと考えた」と説明している。
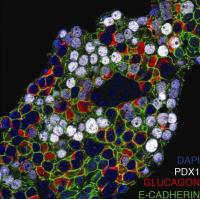
この研究論文の共同著者は、ペンシルバニア大学のNuria C. Bramswig、Logan Everett、Jonathan Schug、Chengyang Liu、Yanping Luo、Ali Naji各氏、および、Oregon Health & Science大学のMarkus Grompe、Craig Dorrell、Philip R. Streeterの各氏。オレゴンのグループは、細胞をより分けるために、ヒト内分泌細胞の各タイプに対応する抗体のパネルを作製した。画像: ヒトのランゲルハンス島をヒストンのメチルトラスフェラーゼ阻害物質であるAdoxで処理すると、グルカゴン陽性細胞がかなりの数を占める中にベータ細胞に対応する転写調節因子 PDX1 (白い部分) が共存することになる。このことは、部分的に内分泌細胞への転換が起きていることを示している。(Credit: Nuria Bramswig, Perelman School of Medicine, University of Pennsylvania).
■原著へのリンクは英語版をご覧ください:Reprogramming Pancreas Cells to Fight Diabetes