Weill Cornell Medicineの研究者とその共同研究者による前臨床研究の成果が、ヒトの胃から採取した幹細胞を血糖値の上昇に反応してインスリンを分泌する細胞に変換することが可能であることを示し、この手法が糖尿病治療の有望なアプローチとなることが明らかになりました。この研究の結果は、2023年4月27日にNature Cell Biologyに掲載され、ヒトの胃組織から得た幹細胞が、インスリン分泌細胞であるβ細胞に驚くほど高い効率で再プログラムされることが報告されました。実験では、これらの細胞が糖尿病モデルマウスに移植され、病気の兆候が回復したことが確認されたとしています。
「この研究は、1型糖尿病や重症の2型糖尿病に対して、患者自身の細胞を用いた治療法を開発するための確かな基礎となる概念実証試験です」と、Weill Cornell Medicineの再生医学教授であり、Hartman Institute for Therapeutic Organ RegenerationのメンバーでもあるJoe Zhou博士は述べました。このNature Cell Biologyの論文のタイトルは、「Stomach-Derived Human Insulin-Secreting Organoids Restore Glucose Homeostasis(胃由来のヒトインスリン分泌オルガノイドが血糖値の調節を回復させる)」です。
インスリンは血糖値を調節する重要なホルモンであり、その不足は糖尿病やその合併症の原因となります。米国では約160万人が1型糖尿病であり、自己免疫攻撃によって膵臓のβ細胞が破壊されることで発症します。また、数百万人以上のアメリカ人が重度の2型糖尿病により、十分なβ細胞が存在しない状態にあります。現在の治療法では、インスリンの手動注射やウェアラブルポンプ注射などが一般的に使用されていますが、これらの方法には痛みやグルコースコントロールの課題、装着の煩雑さなど、いくつかの欠点が存在します。
生物医学の研究者たちは、より自然な方法でβ細胞の機能を代替することを目指しており、血糖値を自動的に感知し、必要に応じてインスリンを分泌するヒト細胞の移植を検討しています。理想的には、移植拒絶反応の問題を回避するために、患者自身の細胞を使用することが望ましいと言えます。
Zhou博士は、この目標に向けて15年以上前から取り組んできました。彼は博士研究員時代の初期の実験で、3つの転写因子(遺伝子発現を制御するタンパク質)を活性化することによって、通常の膵臓細胞をインスリン産生のβ細胞に変化させることができることを発見しました。この実験により、通常のβ細胞の形成に必要な遺伝子が活性化されることが明らかになりました。さらに、2016年の研究では、胃の幹細胞という特定の種類の幹細胞が、この3つの因子の活性化法に非常に感受性を持つことが示されました。
Zhou博士は、「胃は自身のホルモン分泌細胞を作り出し、胃の細胞と膵臓の細胞は胚発生時に隣接して存在しているため、胃の幹細胞がβ細胞に簡単に変化することは驚くことではありません」と述べています。
この研究の成果は、将来的には1型糖尿病や重度の2型糖尿病患者に対して、より効果的な治療法を提供する可能性があります。しかし、実用化にはまだ時間と研究のさらなる進展が必要です。今後の研究に期待が高まるとともに、この成果が糖尿病治療の分野において重要なマイルストーンとなることは間違いありません。この研究は、自己免疫によってβ細胞が破壊される1型糖尿病やβ細胞の数が不十分な2型糖尿病など、深刻な疾患に苦しむ多くの患者にとって希望をもたらすものです。
現在、糖尿病治療においては、患者自身の血糖値を管理することが非常に重要です。インスリンの補充や他の薬物療法は有効ですが、痛みや複雑な手続き、血糖値の正確な制御の難しさなどの課題があります。この新しいアプローチによって、患者自身の細胞を利用してインスリンを分泌する細胞を増やすことが可能となれば、これらの問題に対する解決策となるでしょう。
この研究の成果は、まだ前臨床段階にありますが、将来的には臨床試験を経て実用化される可能性があります。実際に患者に移植された細胞が期待通りの機能を果たし、安全性や有効性が確認される必要があります。しかし、これまでの結果は非常に有望であり、糖尿病治療における新たな展望を開く可能性があることを示しています。
今後の研究では、より詳細なメカニズムの解明や、さらなる効率的な再プログラミング方法の開発が求められるでしょう。また、移植細胞の長期的な安定性や持続性、免疫応答の管理など、さまざまな課題にも取り組む必要があります。
Weill Cornell Medicineの分子生物学講師であるXiaofeng Huang博士を筆頭著者とする研究チームは、ヒトの胃から容易に取り出すことができる幹細胞を利用し、インスリン分泌の能力を持つβ様細胞へと変換する方法を成功させました。これまでにはさまざまな技術的な困難があり、このような成果を得ることは難しい課題でしたが、今回の研究でようやく目標が達成されました。
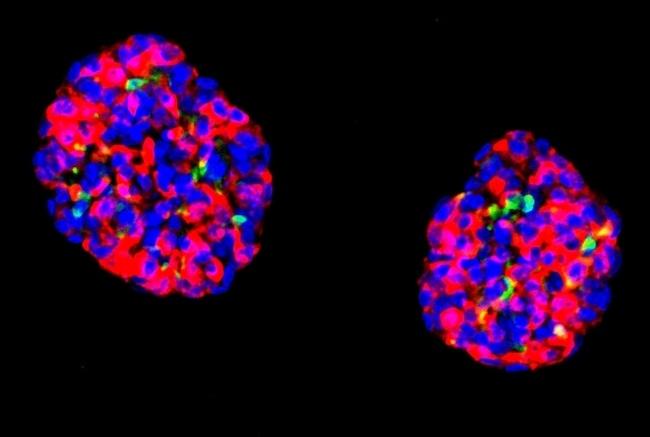
研究チームは、ヒトの胃の幹細胞をβ様細胞へと変化させ、それらをオルガノイドと呼ばれる小さなクラスター状の組織へと成長させました。驚くべきことに、これらのオルガノイドはグルコースに対して敏感であり、インスリンの分泌反応を示すことが明らかになりました。さらに、これらのβ様オルガノイドは糖尿病モデルマウスに移植されると、実際の膵臓のβ細胞とほぼ同等の機能を発揮し、血糖値の上昇に応じてインスリンを分泌して血糖値を安定させることが確認されました。さらに、移植された細胞は長期間にわたって機能し続け、耐久性があることも示唆されました。
Zhou博士は、この手法を臨床応用するためにはまだ改良の余地があると指摘しています。例えば、ヒトへの移植に適したスケールでβ細胞を生産する方法や、1型糖尿病における免疫攻撃に対する耐性を高めるための改良が必要です。
最終的には、患者自身から容易に採取した胃の幹細胞を利用し、数週間後にインスリンを分泌するオルガノイドを移植することで、薬物治療を必要とせずに血糖値を調整できる技術を開発したいという展望があります。これにより、患者の生活の質が向上し、糖尿病治療における有望なアプローチを提供しています。現在の治療法では、インスリンの手動注射やウェアラブルポンプ注射が主流ですが、これらにはいくつかの制約が存在します。痛みや注射による不快感、グルコースコントロールの難しさ、機器の装着が必要なことなどが挙げられます。
この新たな技術が実用化されれば、患者は内視鏡検査などの比較的簡単な手順によって自身の胃から幹細胞を採取し、その細胞をβ様オルガノイドとして再プログラムします。そして数週間後に、これらのオルガノイドを移植することで、血糖値を自動的に調整する能力を持つ細胞を体内に導入することが可能となります。
しかしながら、まだ臨床応用には課題が残されています。例えば、生産規模の拡大や免疫攻撃に対する弱点の改善など、さまざまな技術的な最適化が必要です。研究チームは、これらの課題に取り組むとともに、臨床への実装に向けてさらなる研究を進める予定です。
この成果は、糖尿病治療の領域において画期的な進展となり得るだけでなく、患者の生活の質を改善する可能性を秘めています。Weill Cornell Medicineの研究者と共同研究者の取り組みにより、ヒトの胃から採取した幹細胞をインスリン分泌細胞に変換する新たなアプローチが開拓されました。今後の研究の進展に期待が寄せられるとともに、この成果が患者の健康と福祉に貢献することを願ってやみません。
[Weill Cornell Medicine news release] [Nature Cell Biology abstract]
画像:
ヒト胃のインスリン分泌オルガノイドは、分子的にも機能的にも膵島に類似している。赤:プロインスリンの副産物であるc-ペプチド。緑:グルカゴン(通常、膵臓のα細胞で産生される)、ソマトスタチンおよびグレリン(通常、胃の細胞で産生される)。青色:DAPI、細胞核を標識している。画像提供:Xiaofeng Huang.