細胞の門番は、どうやって持ち場に戻るのか? 最新技術が解き明かすタンパク質リサイクルの仕組み
私たちの体を作る細胞の中では、日々、生命活動に不可欠な物質のやり取りが絶えず行われています。特に細胞の「門番」とも言える表面のタンパク質は、必要なものを取り込み、情報を伝える重要な役割を担っています。しかし、一度細胞内に取り込まれたタンパク質が、どうやって再び表面に戻ってくるのでしょうか? その巧妙な「リサイクル」の仕組みは、長年、細胞生物学の大きな謎の一つでした。今回、UTサウスウェスタンメディカルセンターの研究チームが、その謎を解き明かす鍵となる発見をしました。彼らは最先端の技術を駆使して、タンパク質が細胞表面へ帰還する重要なメカニズムを分子レベルで明らかにしたのです。この発見は、神経疾患やがんなどの治療法開発にも繋がる可能性を秘めています。
UTサウスウェスタンメディカルセンターの研究者を中心とするチームが、細胞内のエンドソームリサイクリングを担う重要なメカニズムを特定しました。このプロセスは人の健康に不可欠なものです。2024年11月25日にNature Communications誌に掲載されたこの研究成果は、細胞生物学における基本的な問いに答え、神経疾患やがんを含む疾患の治療法につながる可能性があります。このオープンアクセスの論文タイトルは「Structural Basis for Retriever-SNX17 Assembly and Endosomal Sorting(リトリーバー-SNX17複合体の形成とエンドソームソーティングの構造基盤)」です。
「私たちの研究は、タンパク質がエンドソームから細胞膜(形質膜)へとどのようにリサイクルされるかを理解する上で、大きな進歩です」と、UTサウスウェスタンの内科学(Internal Medicine)および免疫学の准教授であるエムレ・チューラー博士(Emre Turer, MD, PhD)は述べています。エンドソームは、細胞内でのタンパク質や脂質の仕分けと輸送において、極めて重要な役割を果たしています。
チューラー博士は、内科学教授であり消化器・肝臓病部門(Division of Digestive and Liver Diseases)の部長であるエズラ・バースタイン博士(Ezra Burstein, MD, PhD)、そしてアイオワ州立大学(Iowa State University)の准教授であるバオユー・“ストーン”・チェン博士(Baoyu “Stone” Chen, PhD)と共に、この研究を主導しました。
細胞の表面は多種多様なタンパク質で満ちており、人体に存在する全タンパク質の最大10%が細胞表面に存在すると言われています。これらの大部分は受容体です。受容体は細胞外の分子に結合してそれらを細胞内に取り込み、再び細胞表面に戻ってこのサイクルを繰り返します。エンドサイトーシスリサイクリングとして知られるこのプロセスは、栄養取り込み、細胞間コミュニケーション、接着、遊走といった細胞の基本的な機能に不可欠です。科学者たちは、このプロセスの異常が、頭蓋顔面や心臓の先天異常、特定の種類の免疫不全症などの健康問題に関連していることを突き止めています。
受容体の細胞内への取り込みについてはよく研究されてきましたが、受容体がどのようにして細胞表面に戻るのかについては、あまり解明されていなかったとチューラー博士は言います。これまでの研究で、ソーティングネキシン17(SNX17: sorting nexin 17)と呼ばれるタンパク質と、リトリーバーと呼ばれるタンパク質複合体がこのリサイクルプロセスに極めて重要であることが示唆されていましたが、それらがどのように連携して機能するのかは不明でした。
この疑問に答えるため、研究者たちはまずSNX17の一部を改変し、タンパク質のどの部分がリトリーバー複合体に結合するのかを詳しく調べました。これらの実験から、SNX17の一端、いわゆるC末端テールが、このタンパク質の別の部分に結合していることが示唆されました。しかし、受容体が他の分子(カーゴ)を取り込むと、これらのカーゴがSNX17に結合し、C末端テールを置き換えます。これにより、C末端テールはリトリーバー複合体と結合できるようになります。
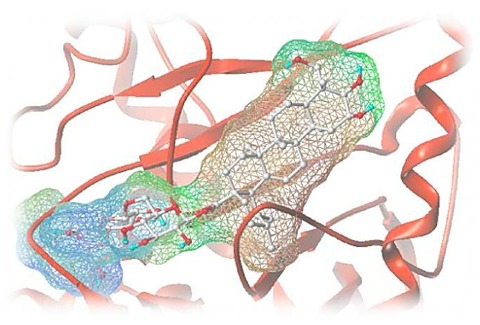
次に研究者たちは、クライオ電子顕微鏡法(cryo-EM: cryogenic electron microscopy)を用いて、SNX17がリトリーバー複合体に結合した状態をほぼ原子レベルで観察しました。その結果は、UTサウスウェスタンの生物物理学教授であり構造生物学ラボの共同ディレクターであるクライオ電子顕微鏡法の専門家、ゼェ・“ジェームズ”・チェン博士(Zhe “James” Chen, PhD)によって解析されました。この構造解析により、SNX17のC末端テールがリトリーバー複合体に結合することが確認され、この相互作用が起こるリトリーバー複合体上の結合ポケットが明らかになりました。
研究者たちがリトリーバー複合体の結合ポケットに変異を導入したところ、SNX17は溶液中でリトリーバー複合体に結合できなくなりました。結合ポケットが改変された変異型リトリーバー複合体を持つ細胞では、40種類の細胞表面タンパク質が著しく減少していることが特定されました。さらなる研究により、リトリーバー複合体の結合ポケットは進化的に古く、ヒト、ショウジョウバエ、アメーバなどの生物で同一の構造が共有されていることが示されました。
興味深いことに、追加の実験により、SNX17のC末端テールに類似した部分を持つため、リトリーバー複合体の同じポケットに結合すると考えられる他の14種類のタンパク質が特定されました。他のタンパク質構造のデータベースを検索した結果、病原体由来のタンパク質を含む、さらにいくつかのタンパク質もリトリーバー複合体と相互作用する可能性が示唆されました。
「リトリーバー複合体のこれら他の結合パートナーの役割を解明することは、今後何年にもわたって私たちを忙しくさせるでしょう」と、バータ・M・アンド・Dr. セシル・O・パターソン消化器病学講座(Berta M. and Dr. Cecil O. Patterson Chair in Gastroenterology)の保持者であるバースタイン博士は述べています。
この研究に貢献した他のUTサウスウェスタンの研究者には、筆頭著者である内科学助教のアミカ・シングラ博士(Amika Singla, PhD)、生物物理学および細胞生物学(Cell Biology)准教授のシャオチェン・バイ博士(Xiaochen Bai, PhD)、生物物理学助教のホー・イー・ジョイス・ファン博士(Ho Yee Joyce Fung, PhD)、生物物理学助教のヤン・ハン博士(Yan Han, PhD)、生化学准教授のアンドリュー・レモフ博士(Andrew Lemoff, PhD)、上級研究員のラン・ソン博士(Ran Song, PhD)、学生インターンのエスター・バナラー(Esther Banarer)が含まれます。
チューラー博士とバースタイン博士は、ハロルド・C・シモンズ総合がんセンター(Harold C. Simmons Comprehensive Cancer Center)のメンバーです。
UTサウスウェスタンメディカルセンターについて
米国有数の学術医療センターの一つであるUTサウスウェスタンは、先駆的な生物医学研究と卓越した臨床ケアおよび教育を統合しています。同機関の教員には6人のノーベル賞受賞者が含まれ、米国科学アカデミーのメンバー25人、米国医学アカデミーのメンバー24人、ハワード・ヒューズ医学研究所の研究者14人が在籍しています。3,200人以上の常勤教員が画期的な医学的進歩を担い、科学主導の研究を迅速に新しい臨床治療へと応用することに尽力しています。UTサウスウェスタンの医師は80以上の専門分野で、年間12万人以上の入院患者、36万人以上の救急外来患者にケアを提供し、約500万件の外来診療を監督しています。
写真;エンドソームリサイクル研究の共同研究者は、(左から右)アイオワ州立大学准教授のバオユー・“ストーン”・チェン博士、UTSW教員のエムレ・チューラー博士、ゼェ・“ジェームズ”・チェン博士。この研究の多くは、バオユー・“ストーン”・チェン博士が2023年6月から2024年8月にかけてUTSWの生物物理学客員教授を務めていた間に行われた。(Credit:バオユー・“ストーン”・チェン博士)