それは分子スケールでは小さなゲームのように見えるかもしれない。 心筋細胞のフィラメント状タンパク質は、心臓を鼓動させるため完全に協調できるように、正確に同じ長さである必要がある。 別のタンパク質は、フィラメントが適切なサイズであるかどうかを判断し、そこに小さなキャップを付ける。 しかし、そのタンパク質が間違いを犯してキャップを早めに装着してしまうと、別のタンパク質であるレイオモジンがやって来て、キャップを邪魔にならないようにノックする。分子スケールでのこの小さなダンスは取るに足らないように聞こえるかもしれないが、健康な心臓や他の筋肉の発達に重要な役割を果たしている。PLOS Biologyのオンラインで2020年9月8日に公開された論文で、ワシントン州立大学(WSU)の研究チームがこのメカニズムがどのように機能するかを初めて証明した。 この論文は「レイオモジンがアクチンの細いフィラメントの先端に漏れのあるキャップを作製する(Leiomodin Creates a Leaky Cap at the Pointed End of Actin-Thin Filaments.)」と題されている。
この発見は将来、タンパク質の遺伝子変異に起因する深刻で時には壊滅的な遺伝性心臓病の診断と治療の改善につながる可能性がある。 これらの状態の1つである心筋症は、世界中の500人に1人が罹患しており、多くの場合、致命的または生涯にわたる健康への影響をもたらす可能性がある。
ネマリンミオパチーと呼ばれる同様の状態は、体全体の骨格筋に影響を及ぼし、しばしば壊滅的な結果をもたらす。 「これらのタンパク質の変異は、ミオパチーの患者に見られる」と、WSUの遺伝子およびリンダボイランド化学工学および生物工学部の准教授であり、プロジェクトのリーダーのAlla Kostyukova博士は述べている。 「我々の仕事は、これらの突然変異がこれらの問題を引き起こすことを証明し、治療のための戦略を提案することだ。」
心筋は、タンパク質の小さな太いフィラメントと細いフィラメントでできている。 電気信号の助けを借りて、ロープのようなフィラメントは、複雑で正確なアーキテクチャで結合および結合解除され、心筋が収縮して鼓動することを可能にしている。細いフィラメントは、人体で最も豊富なタンパク質であるアクチンでできている。 別のタンパク質であるトロポマイシンは、アクチンフィラメントを包み込む。 トロポミオシンは、他の2つのタンパク質、トロポモジュリンとレイオモジンとともに、アクチンフィラメントの末端で一種のキャップとして機能し、フィラメントの長さを決定する。
「それは美しく設計されている」と、タンパク質の構造を理解することに焦点を当てた研究をしているKostyukova博士は語った。
また、システムも厳しく規制されている。
心筋を健康に保つために、約ミクロンの長さのアクチンフィラメントはすべて正確に同じ長さでなければならない。 心筋症の家族では、遺伝的変異により、短すぎるまたは長すぎるフィラメントが形成される。 この影響を受けた人々は、障害、病気、そして死を引き起こす重大な心臓の問題を抱えている可能性がある。
7年間にわたるプロジェクトで、研究者らは、レイオモジンがアクチンフィラメントの端に付着し、他のタンパク質であるトロポモジュリンを移動させて、アクチンフィラメントの適切な長さを保証することを証明した。
「このことが原子レベルの精度で示されたのはこれが初めてだ」と、Voiland Schoolの助教授で論文の筆頭著者であるDmitri Tolkatchev博士は述べている。 「以前は、いくつかの研究所がこの問題の解決を試みたが、ほとんど成功しなかった。我々のデータを使用して、やっと直接的な証拠が得られた。」
研究者らは、最先端のアプローチを使用して主要なタンパク質を作製し、分子レベルおよび細胞レベルで研究した。 この作業では、分子を設計し、プラスミドに遺伝子レベルで構築してから、細菌または心臓の細胞に生成した。 研究者らは、磁気共鳴画像法(MRI)と同じ物理的原理に基づいて機能する核磁気共鳴(NMR)を使用して、タンパク質の原子レベルでの結合を理解した。 彼らはまた、分子動力学シミュレーションを使用してそれらをモデル化した。
「このメカニズムを示すことができる可能性は高くなかったが、発見の影響は高い」とNMRの専門家であるTolkatchev 博士は述べた。 「これは研究するのに非常に重要な問題であり、筋肉力学の分野に大きな影響を与える可能性がある。」
研究者らは、病気であろうと健康であろうと、細いフィラメントの構造を調節する追加の成分と分子メカニズムを特定して、研究を続けることを望んでいる。
学際的なグループには、アリゾナ大学(UA)の研究者が含まれ、UAの細胞分子医学部長であるCarol Gregorio博士が率いている。 WSUのグループは、タンパク質の構造、構造生化学、およびアクチンフィラメントと調節タンパク質の特性に関する専門知識を持っており、UAのグループは、筋肉集合の分子生物学、細胞生物学、および発生生物学の専門知識を持っている。
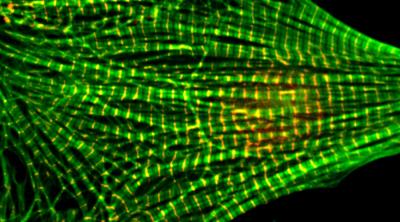
画像:
心筋細胞の顕微鏡写真。 規則的な緑色のパターンは、染色されたアクチンフィラメントを示している。 (クレジット:WSU)
[siteimg width=400 height=222">modules/xelfinder/index.php/view/602/5682-1.jpg[/siteimg">
BioQuick News:Research Shows How Actin-Thin Filaments Are Kept at Exact Same Length in Healthy Heart; Uneven Lengths Lead to Disease; Work Enabled by Atomic-Precision NMR Analysis