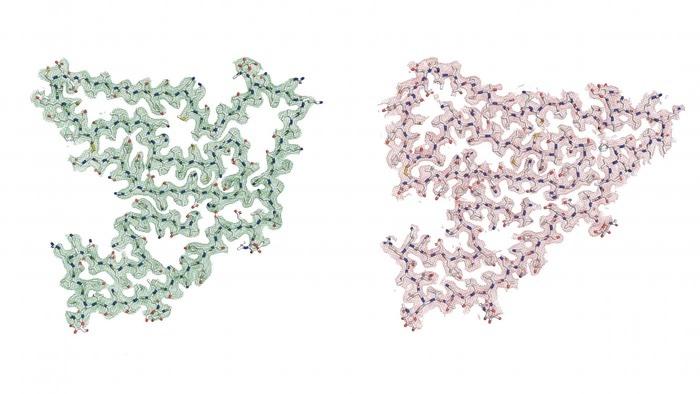アルツハイマー病に罹患した脳を細胞の奥深くまで観察すると、怪しげなタンパク質の塊が見つかるだろう。1980年代に神経科学者がこのタンパク質のもつれを同定し始めて以来、他の脳疾患にも独自のタンパク質のもつれの特徴があることが分かってきた。
コロンビア大学ズッカーマン研究所の主任研究員であるアンソニー・フィッツパトリック博士は、「これらの疾患には、それぞれ固有のタンパク質のもつれ、すなわちフィブリルがある。病気に関連するこれらのタンパク質は、独自の形状と挙動を持っている」と述べている。フィッツパトリック博士は、コロンビア大学アービング・メディカルセンターの生化学と分子生物物理学の助教授でもあり、コロンビア大学のアルツハイマー病と加齢脳に関するタウブ研究所のメンバーでもある。
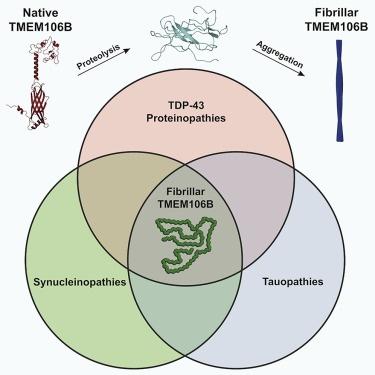
このフィッツパトリック博士と22人の国際共同研究者による研究は、2022年3月4日付のCell誌にオンライン掲載され、病気の脳に新しい線維が存在することを明らかにした。このオープンアクセス論文は、「多様な神経変性疾患におけるTMEM106Bのホモ型線維化( Homotypic Fibrillization of TMEM106B Across Diverse Neurodegenerative Diseases )」と題されている。
この論文の共同筆頭著者であるフィッツパトリック研究室の学部生アンドリュー・チャン氏は、「我々は、神経変性疾患の管理に何らかの影響を与えることが期待できる、驚くべき刺激的な結果を得た」と語っている。薬物研究者らは、長い間、新薬のターゲットとしてこのタンパク質を追求してきたが、これまでのところ、ほとんど期待はずれの結果しか得られていない。
フィブリル関連疾患は、一般的なものと稀なものを合わせて、世界中で何百万人もの人々に影響を与えている。人口の増加や寿命の延長に伴い、その発生率は増加することが予想される。フィッツパトリック博士は、叔父を進行性核上性麻痺(PSP)という病気で亡くしている。
「TMEM106Bというタンパク質が線維を形成することを発見した。この挙動はこれまで知られていなかった」と、ザッカーマン研究所のフィッツパトリック研究室の元メンバーで、現在はスタンフォード大学構造生物学部の大学院生であるシャン・シンユ氏は語っている。「このタンパク質は、リソソームとエンドソームの中心的な構成要素で、我々が年を取るにつれて細胞内に蓄積されるゴミを掃除する小器官だ」。
通常、TMEM106B分子は、それらの廃棄物管理小器官の膜にまたがっている。フィッツパトリック博士の研究チームは、実験室での探索の結果、TMEM106B分子が2つの断片に分かれることを発見した。そして、小器官内の断片は自己集合して、細胞を固定するフィブリル(線維)になることができるのだという。
この発見は、まずタンパク質のミスフォールドを伴う3つの神経変性疾患で亡くなった患者11人から提供された脳組織から、タンパク質を抽出することから始まった。3つの神経変性疾患とは、PSP、レビー小体型認知症(DLB)、前頭側頭葉変性症(FTLD)である。「FTLDは、60歳未満の認知症の中で最も多く見られる疾患だ。この研究を行うことができるのは、脳を惜しみなく提供してくれる人たちがいるからだと思うと、とても意欲が湧く」と、共同筆頭著者であり、このプロジェクトに携わる3人の学部生の一人であるマリア・シムヤノスカ氏は語った。
共著者であるブリティッシュ・コロンビア大学のイアン・マッケンジー医学博士、共著者であるフロリダ州メイヨー・クリニックのデニス・ディクソン医学博士とレナード・ペルトロチェリ博士がこの貴重な研究資源の調達に貢献した。フィッツパトリック博士とマッケンジー博士に加え、コロラド大学ボルダー校のマイケル・ストウエル博士が論文の共同執筆者として参加している。23人のチームには、ベルギーの3人を含む他の研究機関の研究者が参加した。
この研究チームは、世界最高水準の低温電子顕微鏡(クライオ電子顕微鏡)を用いて、個々のタンパク質分子のスナップショットをさまざまな角度から撮影した。そして、その写真をもとに、タンパク質の3次元モデルを原子レベルで詳細に構築した。そして、このモデルから、タンパク質を構成するアミノ酸の正確な配列を推測し、TMEM106Bの同定に役立てたのである。文字が連なって特定の意味を持つ言葉になるのと同じように、アミノ酸分子はそれぞれ独自の形と機能を持つタンパク質を構築する。
研究チームは、アルツハイマー病のタウタンパク質など、古くから知られている線維形成タンパク質のいずれかが、低温電子顕微鏡データから得られたモデルと一致することを十分に予想していた。ところが、膨大なタンパク質配列のデータベースから検索を行ったところ、驚くべき結果が得られた。研究チームは、この謎のタンパク質がTMEM106Bの135アミノ酸の断片と一致することを見出したのだ。このタンパク質は、10年以上前にFTLDと関連する可能性のある遺伝子を幅広く探索した結果、同定されたものであったため、これは驚くべき発見であった。
今のところ、手元にあるデータは、TMEM106B線維が病気の脳組織に存在することを示しているだけで、その線維が病気を引き起こすということを示しているわけではない。しかし、フィッツパトリック博士は、異なる脳疾患の組織にTMEM106B線維が多く存在することと、このタンパク質がリソソームやエンドソームに通常存在することを考え合わせると、病気を引き起こす可能性があることがわかると指摘する。
研究チームはCell誌上で、TMEM106B線維の形成によってリソソームの機能が阻害され、その結果、他の既知の線維形成タンパク質からなる線維の形成が促進されると推測している。これらの機能不全は、脳細胞を死滅させ、認知症や運動障害、言語障害など、アルツハイマー病やPSP、FTLDなど、タンパク質のもつれが特徴的な脳疾患の症状を引き起こす可能性がある。
「我々は今、有望な新しい手がかりを得たのだ。それは、様々な神経変性疾患を繋ぐ共通項を指し示すかもしれないし、新しい介入への道を開くかもしれない。」とフィッツパトリック博士は語っている。
Cell誌のアブストラクトで、著者らは、「TMEM106Bの135アミノ酸C末端フラグメントからなる、これまで未解決だったアミロイド線維が、TDP-43、タウ、αシヌクレイン蛋白の異常凝集を特徴とする症例を含む、異なるヒト神経変性疾患に共通して見られることを明らかにした。TDP-43病変を伴う前頭側頭葉変性症(FTLD-TDP、n=8)、進行性核上性麻痺(PSP、n=2)、レビー小体型認知症(DLB、n=1)の死後ヒト脳組織から、低温電子顕微鏡と質量分析を併用してTMEM106Bフィブリルの構造を2.7 Åで解明することに成功した。ライソゾーム/エンドソームタンパク質であるTMEM106Bからなる豊富なアミロイド線維が、広範なヒトの衰弱性疾患と共通していることは、神経変性を開始または加速する可能性のある線維化経路が共有されていることを示している。」と述べている。
トップ画像
TMEM106Bというタンパク質の重要な断片は、いくつかの原子モデルが示されており、単一または双子型の線維に積み重なることができる。 (Credit: Andrew Chang and Anthony Fitzpatrick / Columbia University's Zuckerman Institute / Cell)