この30年間で、癌の早期発見・早期治療の進歩により、癌全体の死亡率は30%以上減少した。しかし、膵臓癌は依然として治療が困難な癌だ。これは、この癌が治療に抵抗する生物学的要因に守られていることが一因だ。UCLAの研究者たちは、この流れを変えることを期待して、膵臓癌の治療法の一部として承認されている化学療法薬イリノテカンと、免疫活性を高めて腫瘍の抵抗力を克服するのに役立つ治験薬3M-052を装填したナノスケール粒子を、膵臓腫瘍に投与する技術を開発した。
研究チームは、ACS Nano誌に掲載された最近の研究で、膵臓癌のマウスモデルにおいて、同時に投与された組み合わせが、各成分の合計よりも優れた効果を発揮することを明らかにしている。この論文は、「ナノキャリアによるTLR7アゴニストと免疫原性細胞死刺激の同時投与は、膵臓癌化学免疫療法に有効(Nanocarrier Co-formulation for Delivery of a TLR7 Agonist Plus an Immunogenic Cell Death Stimulus Triggers Effective Pancreatic Cancer Chemo-Immunotherapy)」と題されている。
UCLAカリフォルニア・ナノシステム研究所の医学特別教授兼研究ディレクターのアンドレ・ネル医学博士は、「私の考えでは、免疫系を活用することで、膵臓癌の治療成績に大きな違いが生まれると思っている」と語っている。
この研究者らが開発した二重担体ナノキャリアは、ナノキャリアなしのイリノテカンや、2つの薬剤を別々に送達するナノキャリアよりも、マウスの腫瘍を縮小させ、癌の転移を予防する効果が高かった。また、この併用療法は、癌を殺す免疫細胞をより多く腫瘍部位に引き寄せ、血中の薬物濃度をより長く維持することができた。有害な副作用の証拠はなかった。
イリノテカンは、癌細胞が成長するのを阻止するだけでなく、免疫系の樹状細胞に危険信号を送り、樹状細胞がキラーT細胞を動員し、腫瘍部位に移動して癌細胞を破壊する。しかし、膵臓癌患者では樹状細胞の機能が低下していることが多いため、3M-052は、癌部位と近くのリンパ節の両方でキラーT細胞をよりよく動員できるよう、特別な支援を提供するのである。
癌の併用療法は新しいものではないが、同じナノキャリアに薬剤をパッケージングすることは困難であることが分かっている。化学療法用のデュアルデリバリーナノキャリアが食品医薬品局(FDA)に承認されたのは、たった1つだけである。しかし、ネル博士の研究室は過去7年間にわたり、同時デリバリーのためのアプローチを開発してきた。今回の発見は、革新的なナノキャリア設計により、薬物を別々にデリバリーするよりも効果的に連動して作用させることができるという、さらなる証拠となる。
多くのナノキャリアは、細胞膜のように脂肪分で構成された脂質分子の層で構成され、その中に薬物を封入することができる空間がある。今回の装置では、この脂質の二重層が、シリカでできたガラスの泡の芯を取り囲んでおり、その中空内部をイリノテカンで満たすことができる。UCLAのポスドク研究員で筆頭研究者のリジア・ルオ博士は、3M-052分子の脂肪質の尾部を利用して、この外側の脂質層に直接第二の薬物を組み込むことができるという独創的なアイデアを思いついた。
この担体の構造設計は、人間の髪の毛1本分の幅に1000個必要なほど小さく、膵臓癌を守る手強いロープ状のバリアに入り込んで腫瘍部位に移動する間に、薬物の漏れや毒性を防ぐのに役立っている。また、ガラスバブルは薬物の漏出を防ぐため、他の薬剤運搬体に比べ、より多くのイリノテカンを腫瘍部位に運搬することができる。
今後、さらに前臨床試験を行い、大型動物モデルでの治療効果を検証するとともに、シリカナノキャリアの大量生産に向けた品質管理を確認する予定である。
UCLAのナノメディシン部門の創設者兼チーフ、カリフォルニア大学のナノテクノロジー環境影響研究センターのディレクターでもあるネル博士は、「画期的な新技術が市場に出るまでには、通常10~20年かかる。ナノキャリアは、20年近く前から存在していた。脂質ベースのナノキャリアが先導しているが、脂質層で装飾されたシリカベースのキャリアは、発見速度を速め、癌免疫療法を改善する良いチャンスだ。」と述べている。
[News release] [ACS Nano abstract]
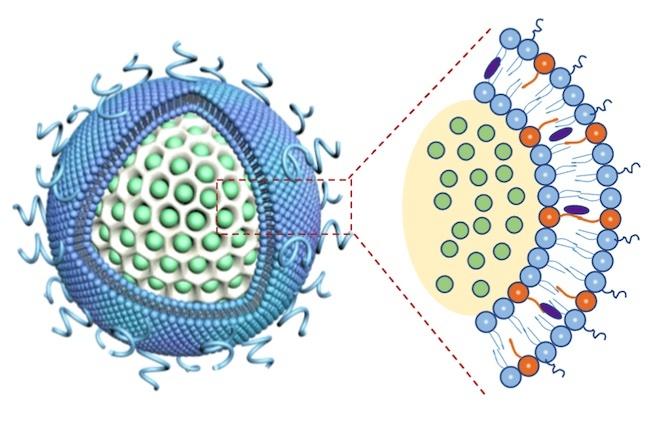
ナノキャリアの中空ガラスバブル(白、左)にはイリノテカン(緑)が充填されており、その上を免疫抑制剤3M-052(右の拡大画像ではオレンジ色の粒子)を含む脂質層(青)が覆っている。(Credit: CNSI/UCLA)




