1. DNAサンプル調製の基本
a. DNA抽出の重要性
DNAサンプル調製の最初のステップは、サンプルからDNAを抽出することです。このプロセスは、細胞や組織からDNAを分離し、純化することを含みます。DNA抽出の方法は、サンプルのタイプ(血液、組織、細菌など)によって異なり、それぞれのサンプルタイプに最適なプロトコルが存在します。正確な抽出は、後続の分析で高品質の結果を得るために不可欠です。
b. DNA純化とその必要性
DNA抽出後、純化プロセスが続きます。純化は、抽出されたDNAから不要な成分(たとえば、タンパク質、リピッド、ポリサッカライドなど)を除去するプロセスです。純化されたDNAは、後続のアプリケーション(PCR、シーケンシングなど)でのパフォーマンスを向上させ、正確な結果を保証します。
c. DNA量の測定と調整
DNAが抽出および純化された後、その濃度と純度を測定することが重要です。これは、スペクトロフォトメーターやフルオロメーターを使用して行われ、サンプルが後続の実験に適しているかを確認します。適切な量と品質のDNAが得られたら、ライブラリ調製やPCRといった次のステップに進みます。
d. ライブラリ調製のプロセス
DNAシーケンシングを行う前に、DNAライブラリを調製する必要があります。これは、シーケンシングプラットフォームに適した形式にDNAを準備するプロセスです。ライブラリ調製には、フラグメンテーション、アダプターライゲーション、およびPCR増幅のステップが含まれます。各ステップは、シーケンシングの成功に寄与し、データの品質を確保します。
2. シーケンスのためのサンプル調製プロトコル
a. DNAフラグメンテーション
DNAシーケンシングのためのサンプル調製では、しばしばDNAを所定のサイズにフラグメンテーション(断片化)する必要があります。このプロセスは、物理的な方法(例:ソノケーション)や酵素的な方法を使用して、DNAを小さなピースに分割します。フラグメンテーションの目的と方法は、使用するシーケンシングプラットフォームとアプリケーションによって異なります。
b. アダプターライゲーション
フラグメンテーション後、シーケンシングアダプターをDNA断片にライゲーション(結合)します。アダプターは、シーケンシングプラットフォームにDNAサンプルをロードし、シーケンスを生成するのに必要な特定の配列を提供します。アダプターの正確なライゲーションは、シーケンシングの効率とデータ品質に直接影響します。
c. PCR増幅とバーコーディング
アダプターがライゲーションされたら、PCR(ポリメラーゼ連鎖反応)を使用してDNAライブラリを増幅します。このステップでは、特定のプライマーを使用して、DNAフラグメントをコピーし、シーケンシングのための十分な量を生成します。また、バーコード(インデックス)タグを使用して、複数のサンプルを同時にシーケンスし、後でデータを分離することも一般的です。
d. ライブラリバリデーションと定量化
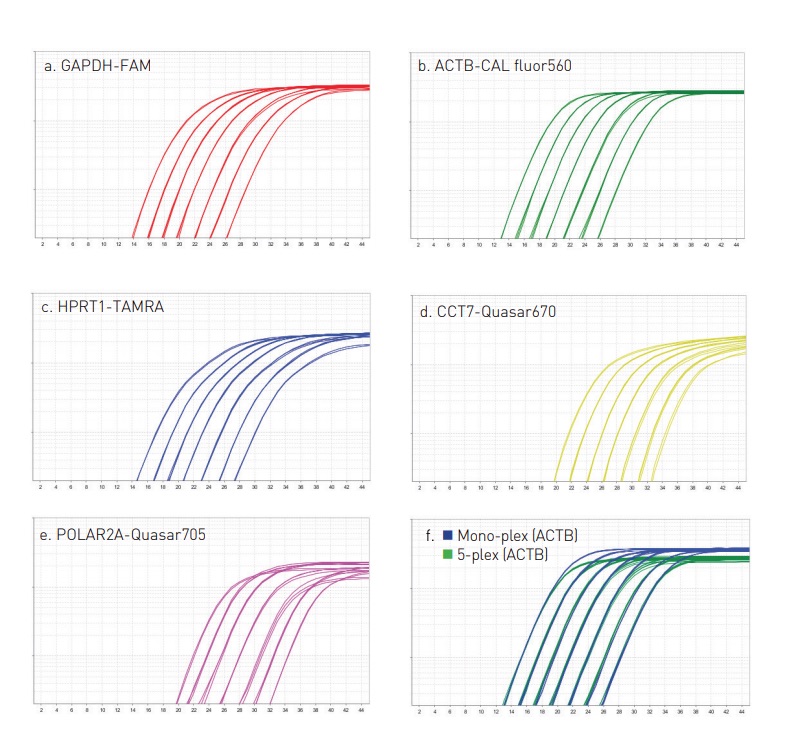
ライブラリ調製が完了したら、その品質と量を確認することが重要です。ライブラリのサイズ分布をチェックし、適切な量のDNAが得られていることを確認します。これは、ゲル電気泳動やバイオアナライザーを使用して行われ、ライブラリがシーケンシングの要件を満たしているかを確認します。
3. DNAシーケンスのためのサンプル調製の実演
a. 実験の設計とサンプルの選定
DNAシーケンスの実演は、適切なサンプル選定と実験設計から始まります。サンプルの種類(例:細胞、組織、微生物)、サンプルの状態(例:新鮮、凍結、FFPE)、および目的(例:全ゲノムシーケンシング、エクソームシーケンシング)に基づいて、最適なサンプル調製プロトコルを選定します。
b. 実験手順の詳細なウォークスルー
サンプル調製の各ステップ(DNA抽出、純化、フラグメンテーション、アダプターライゲーション、PCR増幅など)を実際に実演し、ポイントと注意事項をハイライトします。これには、使用する試薬、機器、および技術の詳細な説明が含まれます。
c. トラブルシューティングとヒント
実験中に遭遇する可能性のある一般的な問題とその解決策について説明します。これには、DNAの不足や劣化、アダプターライゲーションの失敗、PCRの最適化など、多くの一般的な課題が含まれます。また、実験の成功を確保するためのベストプラクティスとヒントも提供します。
d. データの検証と解析
シーケンシングが完了したら、得られたデータを検証し、初期の解析を行います。これには、リードの品質チェック、アライメント、バリアントコールなどの基本的なバイオインフォマティクスのステップが含まれます。また、データが期待通りであるかを確認し、必要に応じて追加の実験や解析を計画します。
4. 高品質なDNAライブラリの構築
a. ライブラリ調製の基本原則
DNAライブラリの構築は、シーケンシングの成功に不可欠なステップです。このセクションでは、ライブラリ調製の基本的なプロセス、使用される主な試薬、および各ステップの目的について説明します。これには、DNAのフラグメンテーション、アダプターのライゲーション、およびPCR増幅が含まれます。
b. ライブラリの品質コントロール
ライブラリ調製後の品質コントロールは、シーケンシングのデータ品質に直接影響します。ライブラリの品質を評価するための主な方法にはゲル電気泳動、バイオアナライザー、qPCRなどがあります。
c. ライブラリの定量化とプーリング
シーケンシング前にライブラリを正確に定量化し、必要に応じて複数のライブラリをプールすることは、シーケンシングランの最適化とコスト効率の向上に寄与します。
d. ライブラリのシーケンシングとデータ品質
ライブラリがシーケンスされると、初期のデータ品質を評価し、ライブラリ調製の成功を確認することが重要です。
5. サンプル調製の課題と解決策
a. DNA抽出の課題
DNA抽出は、多くの場合、サンプルタイプや使用するキットに依存して異なる課題を抱えています。一般的な問題には、DNAの劣化、汚染、または不足などがあります。
b. ライブラリ調製の難しさ
ライブラリ調製の過程で遭遇する可能性のある問題には、アダプターライゲーションの失敗や不均等なサンプル増幅が含まれます。
c. PCRバイアスとその緩和策
PCRバイアスは、特定のフラグメントが他のフラグメントよりも過剰に増幅される現象です。これは、シーケンスデータの解釈を歪める可能性があります。
d. サンプルの汚染とその防止
サンプルの汚染は、誤った結果や再実験の必要性を引き起こす可能性があります。次にサンプル汚染を防ぐためのベストプラクティスと、汚染が疑われる場合のトラブルシューティングのアプローチについて説明します。
6. サンプル調製におけるベストプラクティス
a. サンプルの取り扱いと保存
サンプルの品質は、その取り扱いと保存方法に大きく依存します。サンプルを最適な状態で保存し、DNAの劣化や汚染を防ぐための対策が必要です。また、サンプルのトラッキングと管理に関するプロトコールも必要です。
b. 高品質な試薬とキットの選定
使用する試薬とキットの品質も、サンプル調製の結果に影響を与えます。高品質な試薬を選定し、その品質を確保するための対策が必要です。
c. プロトコルの最適化と検証
プロトコルの最適化は、実験の再現性と効率を向上させる鍵です。プロトコルを特定のサンプルタイプやアプリケーションに合わせて最適化する対策が必要です。また、新しいプロトコルを検証するためのアプローチについても検討が必要です。
d. クオリティコントロールの実施
各ステップの後にクオリティコントロール(QC)を実施することで、問題を早期にキャッチし、失敗した実験のリピートを防ぐことができます。
7. 未来のDNAサンプル調製テクノロジー
a. オートメーションとロボット技術の進化
DNAサンプル調製のオートメーションは、再現性の向上、ヒューマンエラーの削減、およびスループットの増加を可能にします。液体分注ロボットの高機能化は、精度と柔軟性を向上させ、複雑なプロトコルを効率的に実行できるようにします。これには、マルチチャネルピペッティング、温度コントロール、およびサンプル追跡機能の統合が含まれます。
b. マイクロフルイディクスとラボオンアチップテクノロジー
マイクロフルイディクスとラボオンアチップテクノロジーは、微小な液体ボリュームでの実験を可能にし、試薬の使用を最小限に抑えます。これらのテクノロジーは、サンプル調製のプロセスをコンパクトで効率的なフォーマットに統合し、高スループットなアプリケーションをサポートします。
c. 人工知能と機械学習の応用
人工知能(AI)と機械学習(ML)は、サンプル調製プロセスの最適化とトラブルシューティングに革命をもたらす可能性があります。AIとMLを使用して、データからパターンを学習し、プロトコルの最適化や問題の予測を自動化するシステムが開発されています。
d. ネクストジェネレーションシーケンシング(NGS)テクノロジーの進化
NGSテクノロジーの進化は、サンプル調製の要件とプロトコルに新しい動向をもたらします。例えば、シングルセルシーケンシングや長リードシーケンシングテクノロジーは、サンプル調製の新しいアプローチと戦略を必要とします。