株式会社サイトパスファインダーより研究支援ツールのご案内
細胞を播種するだけでプラスミドが導入可能なトランスフェクションプレートを受託作製します。
プラスミドトランスフェクションプレート受託作製サービス

- 特許技術のアクセラレーターにより高効率で導入
- プレートに細胞を播種するだけの簡単操作
- 高い再現性
- 目的別の自由なレイアウトが可能
- -20℃で長期保存可能
製品の詳細
本製品は、お客様がアッセイで使用されるプラスミド、導入試薬、アクセラレーターからなる複合体を固相化したプレフィルドプレート(96/384/1536ウェルプレート)です。
トランスフェクションプレートとは
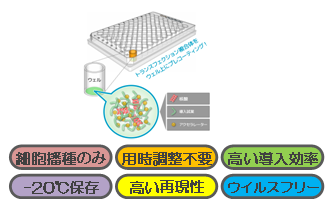
サイトパスファインダーのトランスフェクションプレートは、核酸、トランスフェクション試薬、アクセラレーターからなる複合体をプレートウェル上にプレコーティングしてあり、細胞を播種するだけの簡単な操作で直ぐにトランスフェクションを行うことができます。
特許技術「アクセラレーター」とは
サイトパスファインダーの特許技術であるアクセラレーター(導入促進剤)を添加してあり、従来のトランスフェクション試薬よりも高効率で核酸の導入が期待できます。
遺伝子導入効率を上げるサイトパスファインダーの技術とは
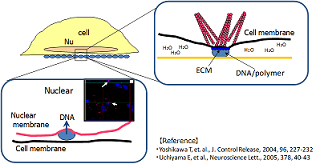
サイトパスファインダーは、細胞外マトリクスタンパク質(*)などの「遺伝子導入促進剤」を用いる独自の固相トランスフェクション技術を開発することにより、遺伝子導入効率を飛躍的に高めることに成功しました。
遺伝子導入促進剤の開発により、適用可能な細胞種が広がり、遺伝子導入効率が低くてお悩みの細胞でのトランスフェクション実験を可能にします。
* 細胞外マトリクスタンパク質による遺伝子導入促進作用につきましては、細胞内ストレスファイバー誘引作用が引き金となって、細胞とDNA(RNA)層間の相互作用が増強されるメカニズムによるものと考えられます。
他の方法との比較

・再現性が高い
・適応可能な細胞が多い
・96~1536ウエルプレートで実施可能
・ダブルノックダウン可能
価格について
価格は、ご使用プレート数、トランスフェクション条件、プレート種類により変動がございますため、都度、ご相談ください。
*プラスミドはお客様からご提供頂きます。
レイアウト例
下図は一般的なプラスミドライブラリスクリーニング時に利用されるレイアウトです。
エッジ効果を回避するための無処置群(blank)がプレートの両サイドに配置され、その内側の列には主に陰性対照(Neg)や陽性対照(Pos1~Pos3)などのコントロールプラスミドが配置されています。残りの領域には実際のプラスミドライブラリがレイアウトされます。ライブラリの規模によってプレートの枚数は増えることになりますが、コントロールプラスミドの配置は基本的には全ライブラリプレートで共通です。

技術開発に関する論文
- Uchimura, E., Yamada, S., Fujita, S., Miyake, M., Miyake, J. (2009) Reverse Transfection Using Gold Nanoparticles; Micro and nano technologies in bioanalysis; Methods and protocols. Method in Mol Biol., Lee, J. W. and Foote, R. S. eds. Humana Press, 544, 609-616
- Highly Efficient Reverse Transfection with siRNA in Multiple Wells of Microtiter Plates. S.Fujita, E. Ohta, C. Sasaki, K. Takano, M. Miyake, J. Miyake. J. Biosci. Bioeng. 104, 329-333 (2007).
- Universal design of reverse transfection using antibodies against cell surface antigen. E. Uchimura, S. Yamada, E. Nomura, K. Matsumoto, S. Fujita, M. Miyake, J. Miyake, J. Biosci. BIoeng, 104, 152-135 (2007).
- A Method for Reverse Transfection Using Gold Colloid as a Nano-Scaffold. Uchimura, E., Yamada, S., Uebersax, L., Fujita, S., Miyake, M.*, Miyake, J. J. Biosci. Bioeng., 103, 101-103 (2007).
- Mechanical immobilization of Hela cell on aligned carbon nanotube array. A Ago, E. Uchimura, A. Saitoh, T. Oshima, N. Ishigami, M. Tsuji, M. Yumura, M. Miyake, Materials Lett. 60, 3851-3854 (2006).
- On-chip transfection of PC12 cell based on the rational understanding of the role of ECM molecules: efficient, non-viral transfection of PC12 cell using collagen IV. Eiichiro Uchimura, Shigeru Yamada, Lorenz Uebersax, Tomohiro Yoshikawa, Kayo Matsumoto, Michiko Kishi, Daniel P.Funeriu, Masato Miyake, Jun Miyake. Neuroscience Letters. 378(1),40-43 (2005).
- Transfection microarray of nonadherent cell on an oleyl poly (ethylene glycol) ether-modified glass slide. Koichi Kato, Kohei Umezawa, Masato Miyake, Jun Miyake, and Teruyuki Nagamune. BioTechniques 37:444-452 (2004)
- Transfection microarray of human mesenchymal stem cell and on-chip siRNA gene knockdown. Tomohiro Yoshikawa, Eiichiro Uchimura, Michiko Kishi, Daniel P. Funeriu, Masato Miyake, Jun Miyake. Journal of Controlled Release 96, 227-232 (2004).
- Immobilized culture of nonadherent cell on an oleyl poly(ethylene glycol) ether-modified surface. Koichi Kato, Kohei Umezawa, Daniel Petru-Funeriu, Masato Miyake, Jun Miyake, Teruyuki Nagamune. BioTechniques 35 (5), 1014-1021 (2003).
- 三宅正人,吉川智啓.“リバーストランスフェクション”,「遺伝子医学MOOK(ムック)」5号株式会社メディカル ドゥ (2006).
技術応用に関する論文
- Yamada, S., Hakamada, K., Munakata, T., Takano, K., Fujita, S., Miyake, M, Miyake, J. (2009) The system for analyzing the event timing profile of each single-cell by using the model of neurite maturation of PC12D cell. Biosens. Bioelectron., 24, 1493-1497.
- Onuki-Nagasaki, R., Nagasaki, A., Hakamada, K., Uyeda, Q., P., T., Fujita, S., Miyake, M., Miyake, J. (2008) On-chip screening method for cell-migration genes based on a transfection microarray. Lab Chip, 8, 1502-1506.
- Yamada, S., Nomura, T., Takano, K., Fujita, S., Miyake, M, Miyake, J. (2008) Expression of a chimeric CSF1R-LTK mediates ligand-dependent neurite outgrowth. Neuroreport., 19, 1733-1738.
- Onuki-Nagasaki, R., Nagasaki, A., Hakamada, K., Uyeda, Q., P., T., Fujita, S., Miyake, M., Miyake, J. (2010) Transfection Microarrays for High-Throuput Phenotypic Screening of Genes Involved in Cell Migration. Method in Mol Biol, 193-203.
- Identification of twinfilin-2 as a factor involved in neurite outgrowth by RNAi-based screen. Yamada, S., Uchimura, E., Ueda, T., Nomura, T., Fujita, S., Matsumoto, K., Funeriu, D. P., Miyake, M*, Miyake, J. Biochem. Biophys. Res. Commun., 363, 926-930 (2007).
- Retinoic acid induces functional c-Ret tyrosine kinase in human neuroblastoma. Yamada, S., Nomura, T., Uebersax, L., Matsumoto, K., Fujita, S., Miyake, M.*, Miyake, J. NeuroReport, 18, 359-363 (2007).
- Advances in Transfection Microarray-based studies of neuronal cell lines , Eiichiro Uchimura, Shigeru Yamada, Kayo Matsumoto, Michiko Kishi, Tomohiro Yoshikawa, Daniel P. Funeriu, Masato Miyake, Jun Miyake, Cytometry Research.14, 39-44 (2004).
- 吉川智啓、三宅正人、藤田芳司 「創薬ターゲットとしてのプロテインキナーゼの網羅的解析」、実験医学増刊号 Vol126、羊土社、2008
- 佐藤孝明、三宅正人 「細胞・組織を用いたセンシング」、バイオセンサ・ケミカルセンサ事典、テクノシステム、2007
技術とその応用に関する総説
- Fujita, S., Takano, K., Ota, E., Yoshikawa, T., Sasaki, C., Sano, T., Miyake, M., Miyake, J. (2010) New Methods for Reverse Transfection with siRNA from a Solid Surface. Method in Mol Biol., Min, W-P. eds. Humana Press, 197-209.
- Miyake, M, Yoshikawa, T., Fujita, S. Miyake J.(2009) Transfection microarray for drug discovery, Molecular Biology, 5, 444-449
- Wheeler, DB., Carpenter AE., Sabatini DM. (2005) Cell microarrays and RNA interference chip away at gene function. Nature Genetics, 37, 525-530.
- 三宅正人,“創薬を変えるトランスフェクションアレイ技術”,「Bioベンチャー2004年7・8月号」, 羊土社(2004.7)
- 三宅正人,“ゲノムチップ”,「化学フロンティア13 ナノバイオエンジニアリング」,杉本直己編著,化学同人(2004.3)
- 三宅正人,吉川智啓,内村英一郎.「トランスフェクションアレイ技術とその応用」放医研シンポジウム報文集「テーラーメード放射線治療を目指して」,実業公報社pp.169-174.
FAQ
-
Q1:手持ちのプラスミドの導入用のカスタムプレートの作製はできますか?またその費用を教えてください。
- お客様のご希望のカスタムプレートの作製をお受けいたします。この際、プラスミドトランスフェクション条件最適化プレートにより条件設定が実施されている必要がございます。費用は、用いる核酸やご希望のレプリカ数によって大きく違いますので別途お見積いたします。
- 以下の核酸をご提供ください。
1)性状:凍結乾燥でも溶解液(5μM以上を推奨)でも可
2)形状:プラスチックチューブでもプレート分注でも可 。後者の場合、レイアウトは別途ご相談させていただきます。
3)収量:0.1nmol以上が望ましい。ただし、レプリカ数により変動しますので、別途確認させていただきます。 ただし、対照群については、ライブラリーよりも多くの収量を必要とします。 - お手持ちの細胞(ウィルス・マイコプラズマ感染がないことが確認されていることが必要です)をお預かりして、プラスミドトランスフェクション条件最適化プレートを用いた条件検討を受託するサービスも別料金で承っておりますので、お問い合わせください。
- プラスミドトランスフェクションの成否を知るためのプラスミド、カチオン性脂質・ポリマーから成るトランスフェクション試薬、当社独自の促進剤、の3つの成分が、様々な混合比(140通り以上の組み合わせ)で各ウェルにプリントされています。
- 本製品は、プラスミド、トランスフェクション試薬、促進剤の3つの成分比がノウハウになっており公開できません。但し、トランスフェクション試薬の種類については、お客様のご要望に従い、お知らせいたします。
- 本製品は、プラスミド導入により引き起こされる細胞死を指標に最適条件を探索します。なお、決定された条件に従って作成したプレートは、トランスフェクション実験で行う通常のアッセイ(細胞死、抗体染色、化学発光・蛍光・発色法など)が可能です。
- 本製品では、予めレポーター遺伝子を導入した細胞を播種していただくことを想定しております。
- 市販のドロッパー、または、ピペットで播種してください。後者をご利用の場合は96ウェルもご用意できますので、96ウェルをご希望の場合はお問い合わせください。また、プレート遠心機を併用いただくことで、操作性、データの再現性などにポジティブな影響を得られます。
- 同じです。ただ、リバーストランスフェクション時には、トランスフェクションミックスボリューム+細胞懸濁液量=培養容量となりますが、本製品では、ミックスボリュームのデッドボリュームを考量しなくてもよいため、培養容量の細胞懸濁液を分注ください。このため、播種密度は、底面積当たりの播種量を基準とし、細胞懸濁液を調製いただく必要がございます。
- 細胞種や実験条件(アッセイ条件)によって異なりますが、96ウェルを基準とした際の培地の量の比較の目安をご参考までにお示しします。384ウェルを用いるとトランスフェクション時のみでなく、アッセイに用いる試薬の量も節約できます。また、スクリーニングには、より高密度な1536ウェルもご用意しております。
ウェル当り 96ウェル 384ウェル 1536ウェル 培地の量 100 μℓ 20-40μℓ 2-5μℓ - 接着系の各種細胞に適しており、ほとんどの接着系細胞でトランスフェクション実験が可能です。また、浮遊系細胞においても、プレートを遠心して細胞を固相表面に濃縮することにより、同様の効果が得られるケースを確認しております(浮遊系細胞についてはご購入前にお問い合わせください)。
- 当社の促進剤は、細胞への取り込みのみを促進するため、プラスミド導入後の効果については、従来法と同じと考えられます。
- エンドサイトーシス・ファゴサイトーシス、マクロピノサイトーシスといった細胞の生理的な食作用・飲作用によるものと考えられております。本製品に含まれる当社の促進剤は、食作用・飲作用を促進するものと推察しております。また、増殖能のない細胞系での実績もありますことから、増殖非連動系への利用も可能です。
- フィブロネクチンなどECM(細胞外マトリクス)を用いた系では一部、分化誘導を惹き起こすことが知られていますが、本製品の促進剤はECMではなく、哺乳動物細胞には存在しないペプチド蛋白を用いており、現在のところ、促進剤が動物細胞においてアーティファクトとなるようなシグナリング等は確認されておりません。
- 毒性は細胞で異なりますが、本製品では、細胞毒性も含め最適条件を探索いたします。本製品中に、固相化を行っていないウェルを設置しておりますため、このウェルと、陰性対照導入ウェルとの差を評価いただくことで、トランスフェクションの細胞障害性を評価することが可能です。これまでの経験では、細胞毒性は従来法と同等または、それよりも低くなるようです。
- プラスミドトランスフェクション効率については、プレート間、プレート内で十分な再現性が確認されております。
- 本製品は、固相トランスフェクション法による効果をベースにしております。そのため、本製品で決定された条件をそのまま従来の液相系で用いることは出来ません。
固相トランスフェクションは、少量の細胞で多数の実験を行う際に有効です。ご希望の実験規模や使用する核酸によっても大きく異なりますので、実験条件によっては、コスト高となってしまうケースもございます。本製品をお試しの際に、お問い合わせください。
- 上記以外の哺乳動物細胞やその他の生物の細胞についてはお問い合わせください。
- 未開封状態で、-20℃で6ヶ月の保管が可能です。室温での保管はおやめください。
- 特に制約条件はございません。培地に含まれる血清濃度や添加因子の影響を受ける場合もございますため、特殊な培地、培養条件をお試しの場合は、購入前にお問い合わせください。
お役立ち資料

アプリケーションデータ

Examined assay variations in CP

プラスミドトランスフェクションプレート取扱説明書