CovalX コンフォメーショナルエピトープマッピング受託解析サービス
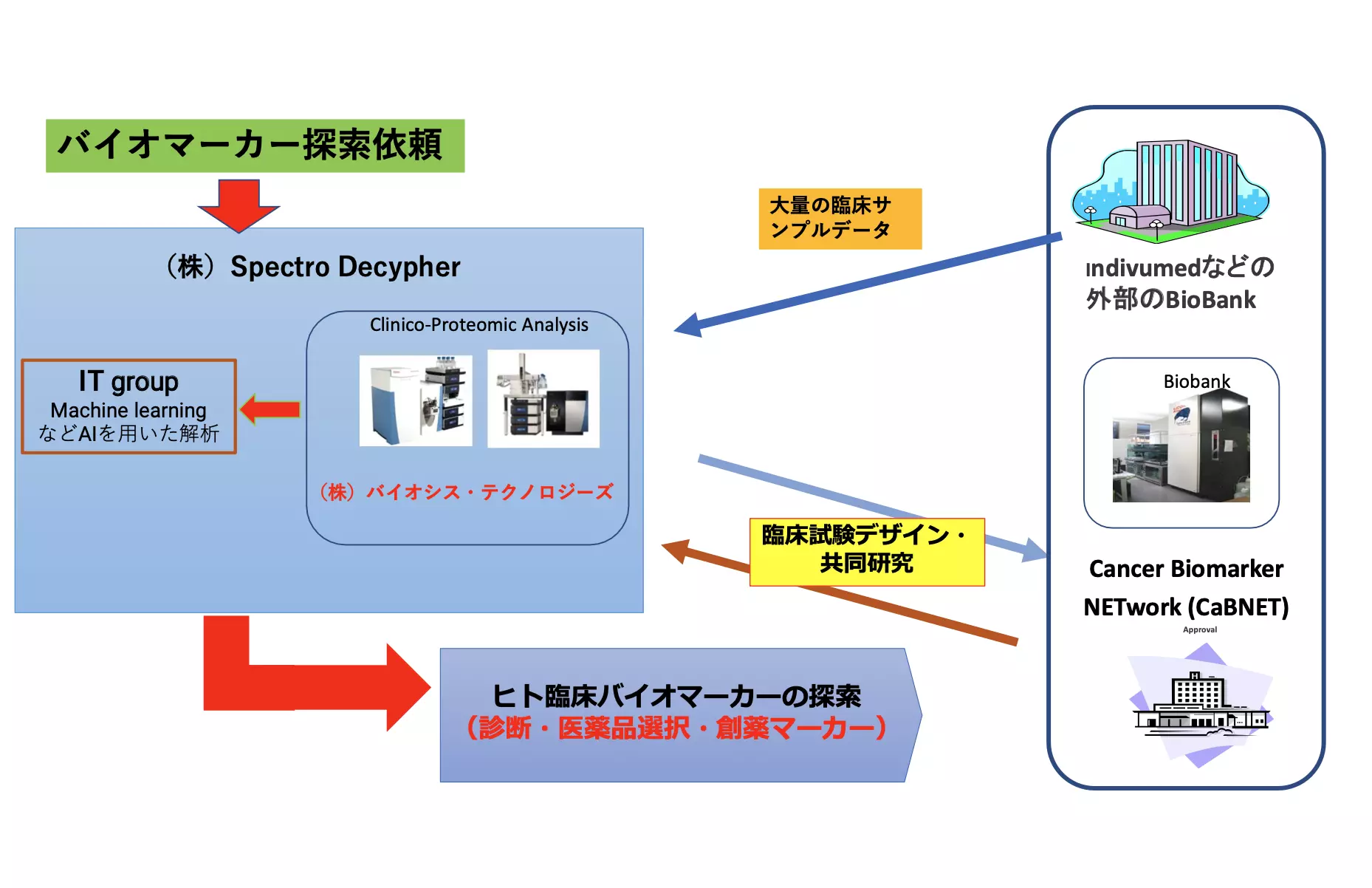
受託解析サービスのご案内 水素重水素交換(HDX)質量分析法 高分解能MSによりタンパク質の立体構造や複合体の相互作用部位(エピトープ)解析を行います。 タンパク質複合体の解析 タンパク質のサブユニット解析 タンパク質の多量体形成解析 PEGylatedタンパク質解析 抗原 / 抗体のキャラクタリゼ-ション、 結合のストイキオメトリ-解析、サンドイッチアッセイ解析 タンパク質のアグリゲーション解析 サンプル中のニ量体、三量体、多量体のストイキオメトリ-及び相対比較定量解析 タンパク質相互作用の阻害アッセイ…